ЧТО ТАКОЕ РАК?

Рак – это аномальный рост клеток. Раковые клетки быстро размножаются, несмотря на ограниченное пространство, питательные вещества, которыми делятся другие клетки, или сигналы организма о прекращении размножения. Раковые клетки часто имеют отличную от здоровых клеток форму, не функционируют должным образом и могут распространяться во многие части тела. Опухоли – это аномальные разрастания тканей, скопления клеток, которые могут бесконтрольно расти и делиться.
Рак, который впервые развивается в ткани или органе, называется первичным. Злокачественная опухоль обычно называется по имени пораженного органа или типа клеток. Злокачественная опухоль, не распространившаяся на другие части тела, называется локализованным раком. Опухоль может проникать в окружающие ткани на большую глубину и прорастать собственными кровеносными сосудами. Этот процесс также известен как ангиогенез. Если раковые клетки разрастаются и образуют другую опухоль на новом месте, это называется вторичным раком или метастазом. Метастаз сохраняет название первоначального рака. Например, рак кишечника, распространившийся на печень, называется метастатическим раком кишечника, даже если человек испытывает симптомы, вызванные проблемами в печени.
Раковые опухоли можно разделить на три группы: доброкачественные, злокачественные и предраковые (предзлокачественные).
Доброкачественные опухоли не являются раковыми и редко представляют угрозу для жизни. Доброкачественные опухоли растут очень медленно, не распространяются на другие части тела и обычно состоят из клеток, очень похожих на нормальные или здоровые клетки. Доброкачественные опухоли могут вызывать проблемы, если они вырастают слишком большими и оказывают давление на другие органы (например, опухоль мозга внутри черепа).
Злокачественные опухоли растут быстрее доброкачественных и способны распространяться и разрушать соседние ткани. Клетки злокачественной опухоли могут отделяться от основной (первичной) опухоли и распространяться в другие части тела, что называется метастазированием. После захвата здоровой ткани в новом месте опухоль продолжает делиться и расти. Эти вторичные участки называются метастазами, а состояние – метастатическим раком.
Предраковое (или предзлокачественное) состояние – это состояние, включающее аномальные клетки, которые могут (или могут) перерасти в рак.
ЧТО ТАКОЕ ОНКОЛОГИЯ?
Онкология – это изучение рака и опухолей. Слово “онко” означает образование или опухоль, а “логия” – изучение в какой-либо области. Онкологи – это врачи, специализирующиеся на диагностике и лечении рака. Существует три основных типа онкологов.
Медицинские онкологи, занимающиеся лечением рака с помощью химиотерапии и других препаратов,
Хирургические онкологи, занимающиеся лечением рака хирургическим путем,
Радиационные онкологи, которые лечат рак с помощью облучения,
Лечение рака – это работа мультидисциплинарной команды. По сути, упомянутые выше медицинские онкологи работают в составе мультидисциплинарной команды, которая может включать таких специалистов, как патологоанатом, молекулярный патолог, психоонколог, радиолог, интервенционный радиолог, врач первичной медицинской помощи, генетик, гематолог, специалист по паллиативной помощи, онкологическая медсестра.
Сфера деятельности онколога во многом определяется стадией злокачественной опухоли (рака). Например, лечение рака на ранних стадиях может включать хирургическое вмешательство или радиотерапию, а лечение рака на поздних стадиях может потребовать проведения химиотерапии.
КАКИЕ СУЩЕСТВУЮТ ВИДЫ РАКА?
Рак можно классифицировать в зависимости от типа клеток, в которых он начинается. К некоторым видам рака, начинающимся в определенных типах клеток, относятся:
Это один из видов рака, возникающий из эпителиальных клеток (клеток, выстилающих органы). Карциномы могут проникать в окружающие ткани и органы и метастазировать в лимфатические узлы и другие части тела. Наиболее распространенными видами рака этой группы являются рак молочной железы, рак предстательной железы, рак легкого и рак толстой кишки.
Это разновидность злокачественной опухоли костей или мягких тканей (жира, мышц, кровеносных сосудов, нервов и других соединительных тканей, поддерживающих и окружающих органы). Наиболее распространенными формами саркомы являются лейомиосаркома, липосаркома и остеосаркома.
Лимфома и миелома - это онкологические заболевания, зарождающиеся в клетках иммунной системы. Лимфома - это рак лимфатической системы, которая циркулирует по всему организму и поэтому может возникнуть в любом месте. Миелома (или множественная миелома) зарождается в плазматических клетках - разновидности белых кровяных клеток, вырабатывающих антитела для борьбы с инфекциями. Этот тип рака может повлиять на способность клеток эффективно вырабатывать антитела.
Лейкоз - это рак белых кровяных телец и костного мозга, ткани, из которой образуются клетки крови. Существует несколько подтипов; распространенными являются лимфоцитарный лейкоз и хронический лимфоцитарный лейкоз.
Раковые заболевания головного и спинного мозга
Раковые заболевания головного и спинного мозга известны как рак центральной нервной системы. Некоторые из них являются доброкачественными, в то время как другие могут расти и распространяться.
Другие типы опухолей
Опухоли половых клеток - это тип опухолей, возникающих в клетках, дающих начало сперматозоидам или яйцеклеткам. Эти опухоли могут возникать практически в любом месте организма и могут быть как доброкачественными, так и злокачественными.
Нейроэндокринные опухоли состоят из клеток, выделяющих в кровь гормоны в ответ на сигнал, поступающий из нервной системы. Эти опухоли, которые могут вырабатывать больше гормонов, чем обычно, могут вызывать множество различных симптомов. Нейроэндокринные опухоли могут быть доброкачественными или злокачественными.
Карциноидные опухоли представляют собой разновидность нейроэндокринных опухолей. Это медленно растущие опухоли, которые обычно располагаются в желудочно-кишечном тракте (в основном в прямой и тонкой кишке). Карциноидные опухоли могут распространяться на печень или другие части тела, выделяя такие вещества, как серотонин или простагландины, и вызывая карциноидный синдром.
КАКОВЫ ФАКТОРЫ РИСКА РАЗВИТИЯ РАКА?
Раковые заболевания могут быть вызваны многими факторами. Фактически большинство раковых заболеваний развивается в результате воздействия многих причинных факторов. Факторами риска при раке являются:
Возраст:
С возрастом многие виды рака становятся более распространенными. Чем дольше человек живет, тем больше он подвергается воздействию канцерогенов и тем больше генетических изменений или мутаций может произойти в его клетках.
Вещества, вызывающие рак (канцерогены)
Канцерогены – это вещества, которые изменяют поведение клетки и повышают вероятность развития рака
Генетика
Некоторые люди рождаются с наследственно обусловленным высоким риском развития рака (“генетическая предрасположенность”). Хотя это не означает, что рак обязательно разовьется, это делает заболевание более вероятным. Например, женщины, являющиеся носителями генов рака молочной железы BRCA 1 и BRCA 2, имеют более высокую предрасположенность к развитию этого вида рака, чем женщины с нормальным риском развития рака молочной железы. Однако известно, что менее 5% всех случаев рака молочной железы обусловлены генами. Таким образом, хотя вероятность развития рака молочной железы у женщин с одним из этих генов индивидуально выше, большинство случаев заболевания не обусловлено наследственной ошибкой гена высокого риска.
Иммунная система
Люди со слабой иммунной системой подвержены риску развития некоторых видов рака. Люди, перенесшие трансплантацию органов и использующие препараты для подавления иммунной системы с целью предотвращения отторжения органов, а также люди, чья иммунная система ослаблена в результате таких заболеваний, как ВИЧ, могут быть подвержены риску развития рака.
Употребление алкоголя
Чрезмерное употребление алкоголя может повысить риск развития шести видов рака, включая рак кишечника (колоректальный), молочной железы, ротовой полости, глотки и гортани (рта и горла), пищевода, печени и желудка.
Избыточный вес или ожирение
Ожирение может повышать риск развития 12 различных видов рака, включая рак мочевого пузыря и рак поджелудочной железы.
Ошибка в диете и питании
Эксперты предполагают, что высокое потребление красного мяса, переработанного мяса, соленых продуктов и диеты, не включающие овощи и фрукты, особенно эффективны при раке толстой кишки, носоглотки и желудка.
Недостаточная физическая активность
Регулярная физическая активность не только способствует снижению избытка жира в организме и связанных с ним рисков развития рака, но и помогает снизить риск развития рака толстой кишки, молочной железы и эндометрия
Курение
Сигаретный дым содержит не менее 80 различных веществ, вызывающих рак (канцерогенов). При вдыхании дыма эти вещества попадают в легкие, переходят в кровь и разносятся по всему организму. Поэтому курение или жевание табака не только вызывает рак легких и полости рта, но и связано со многими другими онкологическими заболеваниями.
Ионизирующее излучение
Радон, рентгеновские лучи, гамма-излучение и другие виды высокоэнергетического излучения могут повышать риск развития рака. Длительное и незащищенное воздействие ультрафиолетового излучения солнца, солнечных лучей и соляриев также может привести к развитию меланомы и злокачественных новообразований кожи. Люди со светлой кожей, большим количеством родинок на теле и семейным анамнезом меланомы или немеланомного рака кожи находятся в группе риска по ионизирующему излучению.
Опасности на некоторых рабочих местах
Некоторые люди подвергаются риску воздействия раковых веществ в результате своей работы. Например, у работников химической лакокрасочной промышленности частота возникновения рака мочевого пузыря превышает норму.
Инфекции
Инфекционные агенты ответственны примерно за 2,2 млн. смертей от рака в год. Например, около 70% случаев рака шейки матки вызывается инфекцией, вызванной вирусом папилломы человека (ВПЧ), рак печени и неходжкинская лимфома могут быть вызваны вирусами гепатита В и С, а лимфомы также связаны с вирусом Эпштейна-Барра. Бактериальные инфекции в прошлом не рассматривались в качестве возбудителей рака, однако последние исследования показали, что у людей с инфекцией helicobacter pylori в желудке развивается воспаление слизистой оболочки желудка, что повышает риск развития рака желудка.
КАК РАСПРОСТРАНЯЕТСЯ РАК?
Рак отличается от доброкачественных опухолей тем, что он может распространяться в другие части тела из места своего возникновения. Тогда раковые клетки начинают расти в этой области. Злокачественная опухоль, распространяющая свои клетки в близлежащие ткани, называется инвазивным раком. Когда рак распространяется из одной части тела в другую, это называется вторичным раком или “метастазированием”. Для того чтобы рак распространился, ему необходимо увеличить собственное кровоснабжение. Это называется ангиогенезом. Без такого кровоснабжения клетки на границе опухоли погибнут от недостатка кислорода.
Раковые клетки вырабатывают вещества, которые позволяют им перемещаться по организму гораздо легче, чем нормальным клеткам. Раковые клетки также не так хорошо склеиваются между собой, как нормальные.
Рак может распространяться следующими путями:
- Локально – в тканях, окружающих первичный рак, и рядом с ними
- Через лимфатическую систему
- Через кровообращение
КАКОВЫ СИМПТОМЫ РАКА?
Симптомы рака сильно различаются в зависимости от типа заболевания. Например, злокачественная опухоль может проникать в структуры, расположенные вблизи места роста раковой опухоли, нарушать их функции или давить на нервы (например, рак яичников может давить на толстую кишку, вызывая запоры; рак легких может давить на нерв, проходящий через грудную клетку, вызывая охриплость). Рак может возникать во многих тканях и органах и проявляться различными симптомами. Рак часто вызывает метаболические изменения, которые приводят к таким общим симптомам, как усталость, потеря веса и общее ощущение дискомфорта.
Знание признаков и симптомов рака имеет большое значение для ранней диагностики и эффективного лечения. Однако для ранней диагностики рака и правильного лечения необходимо также уделять большое внимание скрининговым исследованиям. Даже если у человека нет никаких жалоб, он должен защитить себя с помощью скрининговых тестов на рак в определенном возрасте. Наиболее распространенные симптомы рака можно перечислить следующим образом:
- Необъяснимая потеря веса
- Припухлости, шишки или увеличенные лимфатические узлы
- Ночная потливость
- Кровотечения (аномальные вагинальные кровотечения, кровь в кале или ректальные кровотечения, кровь в моче)
- Изменения в работе кишечника (изменение привычек дефекации или мочеиспускания)
- Постоянный и упорный кашель
- Одышка
- Боль в любой части тела,
- Постоянная сильная усталость
- Изменения кожи
- Ощущение вздутия в брюшной полости
- Затруднения при глотании
Некоторые из этих признаков и симптомов могут быть характерны для определенных видов рака, в то время как другие могут встречаться при нескольких видах рака.
Необъяснимая потеря веса
Первым симптомом многих онкологических заболеваний, особенно рака желудка, поджелудочной железы, пищевода и легких, является необъяснимая потеря веса. Это равносильно тому, что женщина весом 130 кг теряет 6-7 кг или мужчина весом 200 кг теряет около 10 кг. Людям, неожиданно потерявшим вес, важно показаться врачу. Хотя потеря веса более вероятна при поздних стадиях рака, она может происходить и при раке на ранних стадиях.
Синдром кахексии, включающий потерю веса, а также потерю мышечной массы, является не только симптомом онкологического заболевания, но и считается непосредственной причиной смерти примерно у 20% больных раком.
Припухлости, шишки и бугорки на теле
Шишки и уплотнения в различных частях тела могут быть симптомами многих видов рака. Опухоли в молочной железе могут быть одним из симптомов рака, реже встречаются такие симптомы рака молочной железы, как покраснение, уплотнение или появление апельсиновой корки в молочной железе. Опухоли в яичках могут быть признаком рака яичек. Как женщинам рекомендуется ежемесячно проводить самообследование молочных желез, так и мужчинам следует ежемесячно проводить обследование яичек.
Увеличенные лимфатические узлы могут быть первым признаком рака, особенно лимфомы, и могут возникать во многих частях тела. С другой стороны, не следует забывать, что замеченные уплотнения могут быть как признаком первой стадии рака, так и показателем последней стадии.
Ночная потливость
Ночная потливость – частый симптом рака, особенно лейкемии и лимфомы. Ночная потливость, вызванная раком, – это не просто “приливы жара”. В случае ночной потливости, вызванной раком, люди могут быть настолько мокрыми, что им приходится вставать с постели и менять пижаму. Ночная потливость чаще всего возникает во время сна.
Кровоизлияния
Необычные кровотечения могут возникать на ранних или поздних стадиях многих онкологических заболеваний. Кровь в мокроте может указывать на рак легкого, кровь в кале – на рак толстой кишки, кровь в моче – на рак мочевого пузыря, а несвоевременное вагинальное кровотечение – на рак матки или шейки матки. Цвет крови иногда может быть важен для определения ее источника. Кровотечения из нижнего отдела толстой (левой) и прямой кишки обычно ярко-красные. Кровотечения из верхнего отдела толстой (правой) и тонкой кишки обычно темно-красные, коричневые или черные. Кровь из более высоких отделов, например из пищевода или желудка, часто напоминает кофейную гущу. К другим причинам ректального кровотечения относятся геморрой, анальные трещины и колит. С другой стороны, некоторые виды колита являются фактором риска развития рака толстой кишки.
Постоянный и упорный кашель
Постоянный, не проходящий кашель может быть одним из первых признаков рака легких. Упорный кашель может быть также признаком рака, распространившегося на легкие, например, рака молочной железы, толстой кишки, почек или предстательной железы.
Одышка
Одышка является одним из основных ранних симптомов рака легких. Хотя рак легкого может быть связан с хроническим кашлем, наиболее распространенные симптомы рака легкого со временем изменились. Раньше наиболее распространенные виды этого заболевания, как правило, росли вблизи крупных дыхательных путей в легких, что могло приводить к частому (кровавому) кашлю. Сегодня наиболее распространенная форма рака легкого – аденокарцинома легкого – обычно растет во внешних отделах легких. Эти опухоли могут вырасти до того, как их обнаружат, и часто вызывают одышку.
Боль в груди, животе, тазу, спине или головная боль
Боль в любой части тела может быть возможным признаком рака.
Головная боль
Головная боль является наиболее частым симптомом рака мозга или опухолей, распространившихся (метастазировавших) в мозг; однако большинство головных болей не связано с раком.
Классическая головная боль, связанная с опухолью головного мозга, особенно сильна по утрам и со временем прогрессирует. Эти головные боли могут усиливаться при таких действиях, как кашель или опорожнение кишечника, и могут возникать только с одной стороны головы. У людей с головными болями, вызванными опухолью мозга, часто наблюдаются и другие симптомы, такие как тошнота и рвота, слабость в одной стороне тела или новые приступы. Однако опухоли мозга могут вызывать головные боли, неотличимые от головных болей напряжения, которые могут быть единственным признаком наличия опухоли.
Рак, распространившийся на мозг (метастазы в мозг), встречается в семь раз чаще, чем первичные опухоли мозга, и вызывает сходные симптомы. К раковым заболеваниям, наиболее склонным к распространению в мозг, относятся рак молочной железы, рак легкого, рак мочевого пузыря и меланома. Нередко у людей с метастазами в головной мозг, особенно у больных мелкоклеточным раком легкого, симптомы, связанные с опухолью в головном мозге, появляются раньше, чем симптомы, связанные с первичным раком.
Боль в спине
Наиболее частой причиной боли в спине является напряжение в спине, однако постоянная боль в спине без видимых причин может быть и признаком рака. Боль в спине при раке часто (но не всегда) усиливается ночью, боль не проходит, когда вы ложитесь, и может усиливаться при глубоком вдохе. Боль в спине может быть вызвана опухолями в груди, брюшной полости или тазу, а также метастазами других онкологических заболеваний в позвоночник.
Боль в плече
Боль в плечах или лопатке часто может быть вызвана растяжением мышц, но в редких случаях она также может быть важным ранним признаком рака. Боль при раке легких, раке молочной железы и лимфомах, а также метастазы других онкологических заболеваний могут вызывать боль в плечах или лопатке.
Боль в груди
Необъяснимые заболевания сердца или боль в груди также могут быть признаком рака. Хотя легкие не имеют нервных окончаний, у многих людей с диагнозом “рак легкого” боль ощущается как “легочная”.
Боль в животе или тазовая боль
Как и в случае с болью в других частях тела, хотя боли в животе и тазу в большинстве случаев связаны с заболеваниями, отличными от рака, особенно эти два вида болей (рак матки, рак яичников, рак шейки матки, рак труб, рак яичников) не следует игнорировать, поскольку они относятся к симптомам рака, и должны быть проверены врачом.
Чувство усталости
В отличие от обычной усталости, усталость, вызванная раком, часто бывает гораздо более продолжительной. Некоторые люди описывают эту усталость как “усталость всего тела” или истощение. Отличительной чертой этого типа усталости является то, что она значительно снижает качество жизни.
Существует множество причин, по которым рак может вызывать усталость. В целом рост опухоли может быть тяжелым для организма. Другие симптомы рака, такие как одышка, анемия, боль или снижение уровня кислорода в крови (гипоксия), также могут вызывать усталость.
Изменения кожи
Изменения кожи могут наблюдаться как при опухолях внутренних органов, так и при опухолях кожи. Некоторые виды рака могут вызывать желтуху, потемнение или покраснение кожи. Хотя такие виды рака кожи, как базальноклеточная и плоскоклеточная карцинома, встречаются чаще, большинство смертей от рака кожи связано с меланомой. Следует отметить, что меланома обычно впервые обнаруживается кем-то другим. Не следует оставлять без внимания подозрительное пятно на коже, необходимо обратиться в медицинское учреждение.
Вздутие живота (абдоминальная дистензия)
Вздутие живота может быть первым признаком многих онкологических заболеваний, включая рак яичников, рак поджелудочной железы и рак толстой кишки. Симптомы рака яичников часто называют “тихим убийцей”, поскольку они часто проявляются на поздних стадиях заболевания. Вздутие живота является одним из распространенных симптомов рака яичников, однако женщины часто связывают этот симптом с увеличением веса или другими причинами. Аналогичным образом, запоры, боли при половом акте и частое мочеиспускание также могут быть симптомами рака яичников. При появлении любого из этих симптомов необходимо обратиться к врачу. Не следует забывать, что ранняя диагностика рака яичников повышает успешность лечения.
Кровь в моче
Кровь в моче может быть симптомом рака мочевого пузыря.
Затруднения при глотании
Затрудненное глотание, также известное как дисфагия, может быть симптомом рака. Затрудненное глотание обычно является первым симптомом рака пищевода, обусловленного сужением пищевода. С другой стороны, поскольку пищевод проходит через область между легкими, такие опухоли, как рак легкого и лимфомы, расположенные в этой области, часто могут вызывать этот симптом.
КАКОВЫ РЕДКИЕ СИМПТОМЫ РАКА?
К числу редких симптомов рака относятся следующие:
Тромбы
Существует множество факторов риска образования тромбов в ногах, известных как тромбоз глубоких вен (ТГВ). В последние годы было отмечено, что одним из таких факторов может быть ранее не диагностированный рак. 20 Важно знать симптомы ТГВ не только по этой причине, но и потому, что тромбы часто отрываются и попадают в легкие, что называется легочной эмболией.
Изменения в моче
Изменения в мочеиспускании могут быть ранним признаком рака.
Изжога или несварение желудка
Хроническая изжога, обусловленная гастроэзофагеальной рефлюксной болезнью (ГЭРБ), может быть одной из причин развития рака пищевода.
Zona
В редких случаях опоясывающий лишай – заболевание, вызванное реактивацией вируса ветряной оспы, – может быть симптомом рака.
Депрессия
Появившаяся депрессия также может быть ранним симптомом рака.
Минимально травматичные переломы
Когда рак распространяется на кости, он может ослабить их, так что переломы происходят при минимальной травме. Перелом, возникающий в кости, ослабленной раком, называется патологическим переломом.
Легкая гематома
Синяки, не вызванные травмой, также могут быть оценены врачом. Раковые клетки, проникающие в костный мозг, могут снижать количество тромбоцитов в крови. Уменьшение количества тромбоцитов также может вызывать легкое образование синяков. Некоторые лейкемии, опухоли лимфатических узлов или рак костного мозга могут вызывать синяки. Помимо легких синяков на коже, при этих заболеваниях могут возникать кровотечения из десен, носовые кровотечения или кровотечения из других мест. Если у вас без видимых причин идет кровь из носа, сильно кровоточат десны после чистки зубов, очень интенсивное и длительное кровотечение из небольших порезов или ссадин, следует немедленно обратиться к врачу.
Белые пятна в полости рта
Белые пятна на деснах или языке (лейкоплакия) могут быть ранним признаком рака полости рта.
Другие причины
Некоторые виды рака вызывают уникальные симптомы в зависимости от того, какие соединения они вырабатывают и выделяют. Например, некоторые виды рака легкого вырабатывают гормоноподобное вещество, повышающее уровень кальция в крови.
КАК ДИАГНОСТИРУЕТСЯ РАК?
Инструменты, используемые для диагностики рака, весьма обширны и включают лабораторные анализы, визуализационные исследования и другие инвазивные и неинвазивные процедуры
Физические обследования
Он используется для оценки уплотнений, образований, повреждений или изменений цвета кожи, которые указывают на рак.
Полный анализ крови (CBC)
В ходе лечения могут быть выявлены отклонения в биохимическом составе крови, свидетельствующие о лейкозе, при наблюдении за развитием анемии, инфекции или других осложнений.
Тесты на определение опухолевых маркеров
Анализы на опухолевые маркеры – это анализы крови, используемые для измерения содержания в крови веществ, уровень которых повышается при наличии рака. К ним относятся тест на простат-специфический антиген (PSA) для выявления рака предстательной железы, тесты BRCA1 и BRCA2, используемые для выявления рака молочной железы и яичников, и тест CA-125, используемый для выявления опухоли, связанной с рядом онкологических заболеваний.
Проточная цитометрия
Проточная цитометрия оценивает состояние клеток, взвешенных в жидкости, и полезна для диагностики лейкемии или лимфомы по образцу крови или костного мозга.
Биопсия
Биопсия – это взятие образца ткани или жидкости из организма для исследования под микроскопом. Она может быть получена с помощью тонкоигольной аспирации (FNA), биопсии с помощью иглы, конусной биопсии или хирургическим путем.
Визуализационные исследования
Для диагностики рака используются визуализационные исследования. Эти исследования могут включать рентгенографию, компьютерную томографию (КТ) и магнитно-резонансную томографию (МРТ). Визуализация в ядерной медицине с использованием радиоактивных трассеров позволяет диагностировать некоторые виды рака, а с помощью позитронно-эмиссионной томографии можно выявить изменения в обмене веществ.
Геномное тестирование
Геномное тестирование позволяет определить хромосомные характеристики опухоли и помочь онкологу понять, что провоцирует развитие заболевания, и выбрать наиболее подходящее лекарственное лечение.
ЧТО ТАКОЕ СТАДИРОВАНИЕ РАКА?

Классификация рака в зависимости от анатомической протяженности заболевания, т.е. стадии, имеет большое значение для лечения пациентов, проведения исследований и борьбы с раком. Система стадирования UICC TNM – это общий язык, принятый медицинскими работниками в области онкологии для общения о степени распространения рака у каждого конкретного пациента. Когда стадия рака известна и понятна, это часто служит основой для принятия решения о соответствующем лечении и индивидуальном прогнозе. Она также может использоваться для обоснования и оценки рекомендаций по лечению и представляет собой важную информацию для политиков, разрабатывающих или реализующих планы по борьбе с раком, его профилактике и исследованиям.
Классификация TNM ориентирована на анатомический размер опухоли и определяется путем оценки следующих категорий
T определяет размер основной (первичной) опухоли
N характеризует, распространился ли рак на близлежащие лимфатические узлы
M описывает наличие метастазов (распространение рака из первичной опухоли в другую часть тела)
ЧТО ТАКОЕ МЕТАСТАЗИРОВАНИЕ?
Метастазирование – это распространение рака в другую часть тела, отличную от места его возникновения. Это означает, что раковые клетки могут поселиться и размножаться в другой части тела, образуя новые опухоли. Раковые клетки метастазируют в другие части тела через лимфатическую систему и кровоток. Раковые клетки из первоначальной или первичной опухоли могут перемещаться в другие органы, такие как легкие, кости, печень, мозг и другие области. Эти метастатические опухоли являются “вторичными раковыми опухолями”, поскольку они возникают из первичной опухоли. Метастазирование важно, поскольку оно помогает определить стадирование и лечение.
ЧТО ТАКОЕ ЛЕЧЕНИЕ РАКА?

Врачи применяют лечение рака в зависимости от его вида, стадии на момент диагностики и общего состояния здоровья человека.
Подходы к лечению рака следующие:
В химиотерапии используются препараты, направленные на быстро делящиеся клетки. Цель этих препаратов – уничтожить раковые клетки. Препараты также могут способствовать уменьшению размеров опухоли. Некоторые побочные эффекты химиотерапии могут быть тяжелыми.
Гормональная терапия предполагает прием лекарственных препаратов, которые изменяют работу определенных гормонов или препятствуют способности организма вырабатывать их. Гормональная терапия используется для лечения рака молочной железы, рака предстательной железы и рака репродуктивной системы путем изменения количества гормонов в организме.
Иммунотерапия, один из подходов к лечению онкологических заболеваний нового поколения, направлена на то, чтобы организм самостоятельно победил рак путем активации иммунной системы. Иммунотерапия, имеющая гораздо меньше побочных эффектов, чем химиотерапия и таргетная “умная” терапия, создает память в иммунных клетках, что приводит к лучшим, долгосрочным и постоянным ответам.
При радиотерапии используются высокие дозы радиации для уничтожения раковых клеток. Врач может также рекомендовать радиотерапию перед хирургическим вмешательством для уменьшения размеров опухоли или снижения связанных с ней симптомов.
Трансплантация стволовых клеток может быть особенно полезна для людей с раком, связанным с кровью, таким как лейкемия или лимфома.
При лечении рака хирургическое вмешательство является частью плана лечения. Например, хирург может удалить лимфатические узлы, чтобы уменьшить или предотвратить распространение заболевания.
Таргетная терапия направлена на предотвращение размножения раковых клеток. Они также могут укреплять иммунную систему. Двумя примерами таких методов лечения являются препараты на основе малых молекул и моноклональные антитела.
Эти методы лечения применяются как по отдельности, так и вместе. Первое лечение обычно называется лечением первой линии. Лечение, проводимое после первой линии, называется адъювантным. По сути, химиотерапия, применяемая после хирургического вмешательства, является адъювантным лечением. Лечение, проводимое до первой линии, называется неоадъювантным.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ О РАКЕ
Что такое паллиативное лечение в онкологии?
Цель паллиативной помощи – обеспечить пациенту как можно более хорошее самочувствие и улучшить качество жизни, независимо от стадии рака. Паллиативная помощь может быть направлена на удовлетворение физических, психических, психологических и социальных потребностей онкологического больного. Паллиативное лечение может продолжаться одновременно с лечебной терапией. Это означает, что пациенты, получающие паллиативную помощь, могут продолжать активное лечение, направленное на уменьшение или прекращение роста раковой опухоли. Специалисты по паллиативному лечению будут работать с онкологами, чтобы справиться с побочными эффектами лечения и поддержать качество жизни пациента. Такие методы лечения рака, как хирургия, химиотерапия, иммунотерапия, таргетная терапия и радиотерапия, также могут применяться в рамках паллиативного лечения. В этом случае целью является облегчение симптомов, а не борьба с раком.
Каковы цели лечения рака?
Лечение рака преследует разные цели;
Окончательное излечение (Cure): Целью лечения является полное излечение рака, позволяющее вести нормальный образ жизни. В зависимости от конкретной ситуации это может быть возможно, а может и нет.
Первичное лечение Цель первичного лечения – полностью удалить рак из организма или уничтожить раковые клетки. В качестве первичного лечения может быть использован любой метод лечения рака, но наиболее распространенным методом первичного лечения большинства распространенных видов рака является хирургическое вмешательство. Если рак человека особенно чувствителен к лучевой или химиотерапии, то в качестве первичного лечения может быть использован один из этих методов.
Адъювантное лечение: Цель адъювантной терапии – уничтожить раковые клетки, которые могут остаться после первичного лечения, чтобы снизить вероятность рецидива рака. В качестве адъювантной терапии может быть использовано любое противораковое лечение. К распространенным видам адъювантного лечения относятся химиотерапия, лучевая терапия и гормональная терапия.
Паллиативное лечение: Паллиативное лечение может помочь облегчить побочные эффекты лечения или симптомы и признаки, вызванные раком. Хирургия, радиотерапия, химиотерапия и гормональная терапия могут быть использованы для облегчения признаков и симптомов. Лекарственные препараты могут облегчить такие симптомы, как боль и одышка.
Что необходимо делать для профилактики рака?

Онкологические заболевания являются одной из наиболее распространенных причин смерти в нашей стране и в мире. Воздействие химических веществ, курение и употребление алкоголя, стрессы и нерациональное питание приводят к увеличению числа случаев заболевания раком. Можно ли снизить риск возникновения рака, избегая этих внешних факторов? Эксперты утверждают, что изменение образа жизни снижает риск возникновения рака. В частности, изменив привычки питания, отказавшись от таких привычек, как курение и алкоголь, и ведя активный образ жизни, можно снизить заболеваемость раком. Два наиболее важных момента в профилактике рака – это выбор здоровой пищи и отказ от канцерогенов, таких как курение. Последние исследования показывают, что диета, богатая овощами и фруктами, жизнь без курения, регулярная физическая активность и поддержание здоровой массы тела могут снизить развитие рака на 40%. Это означает предотвращение 3-4 млн. новых случаев рака в мире ежегодно. В продуктах питания содержатся витамины, минералы и клетчатка, необходимые для полноценной и здоровой жизни, а также биологически активные молекулы, известные как антиоксиданты, обладающие защитным действием. Они защищают организм от многих серьезных заболеваний, в том числе и от рака.
Согласно статистике, чаще всего диагностируются рак легких, молочной железы и толстой кишки, а наиболее частыми причинами гибели людей являются рак легких, печени и желудка. Чтобы диагностировать рак на ранней стадии и назначить правильное лечение, необходимо уделять большое внимание онкологическим скрининговым исследованиям. Даже если у человека нет никаких жалоб, он должен защитить себя с помощью скрининговых тестов на рак в определенном возрасте.
Для профилактики онкологических заболеваний рекомендуется учитывать следующие рекомендации:
- Человек должен стараться поддерживать свой идеальный вес.
- Следует избегать одностороннего питания. Все группы продуктов, включая мясо, молоко, крупы, фрукты, овощи и жиры, должны потребляться в соответствующих количествах в течение дня.
- Следует обратить внимание на употребление 5 порций фруктов и 2 порций овощей в день.
- Употребление целлюлозы очень важно для профилактики рака. Поэтому вместо белого хлеба следует отдавать предпочтение ржаному, цельнозерновому или цельнозерновому хлебу. Фрукты, которые можно есть с кожурой, следует употреблять без кожуры.
- Для поддержания идеального веса следует избегать избыточного потребления сахара.
- В качестве способа приготовления пищи следует предпочесть запекание или варку. Следует избегать жарки и готовить продукты без сильного обжаривания.
- Важно не курить и не находиться в курящем окружении.
- Необходимо избегать бездействия и увеличивать ежедневную физическую активность. Занятия спортом не менее 2 дней в неделю – важное условие здорового образа жизни.
- Ежедневно необходимо выпивать 2-2,5 л воды.
- Следует сократить потребление чая и кофе. При употреблении кофе вместо сухого молока можно использовать полужирное молоко. Вместо напитков с высоким содержанием сахара, таких как кисели и готовые фруктовые соки, можно пить компоты с низким содержанием сахара, приятности, свежевыжатые фруктовые соки.
- Следует избегать чрезмерного употребления алкоголя.
- Важно употреблять рыбу 2-3 раза в неделю, чтобы получить положительный эффект от содержащихся в ней жирных кислот Омега-3.
- Следует увеличить частоту употребления продуктов с высоким содержанием антиоксидантов, таких как брокколи, цветная и кочанная капуста.
- Необходимо следить за тем, чтобы все виды пищи были хорошо вымыты и очищены, а также использовать чистую воду.
- Жир для жарки не должен использоваться многократно.
- Пищу, приготовленную непосредственно на костре, следует употреблять не чаще одного дня в неделю.
- Суточное потребление соли должно быть менее 5 г. Следует ограничить потребление продуктов с высоким содержанием соли, таких как соленья и маринады.
- Следует по возможности избегать употребления салями, колбас и копченостей.
- Важно употреблять 2 стакана молока или йогурта в течение дня.
- Следует избегать попадания прямых солнечных лучей, особенно в летнее время.
На что следует обратить внимание онкологическим больным?
В целом онкологические больные должны обращать внимание на следующие моменты.
- Натуральные и здоровые продукты питания, свежие овощи и фрукты должны употребляться ежедневно в основные и промежуточные приемы пищи в соответствии с сезоном.
- Неправильное питание во время Кемортерапи приводит к избыточному весу, а также к болезням желудка. Самой главной причиной этого является употребление сладких и мучных продуктов. Предпочтение следует отдавать коричневому сахару, а вместо белого хлеба употреблять ржаной хлеб из цельнозерновой муки. Не следует употреблять твердый или внутренний жир и маргарин.
- Предпочтение следует отдавать небольшому количеству подсолнечного или оливкового масла.
- Важно пить много воды.
- Если у пациентов есть препараты для лечения артериального давления, холестерина, диабета или других хронических заболеваний, которые они применяли до начала химиотерапии, они, безусловно, не должны прекращать прием этих лекарств.
- Прием лекарств пациентами, принимающими разжижающие кровь препараты, также будет регулироваться онкологом.
- Предпочтение следует отдавать ортопедическому матрасу и подушке, а продолжительность сна должна составлять 8 часов.
- Посуду следует мыть в машине, а не вручную.
- Онкологические больные должны избегать их!
- Избыток молока (более 1-2 стаканов в день) не рекомендуется, так как вызывает резкое снижение и повышение уровня сахара в крови. Вместо этого можно съесть 250-500 г йогурта или творога с кефиром.
- Количество красного мяса должно быть снижено. Белок следует получать из других источников белка, таких как белое мясо, сыр и бобовые.
- Следует избегать чрезмерно жирной и тяжелой пищи.
- Не следует отдавать предпочтение продуктам с высоким содержанием сахара.
- Из цитрусовых у пациентов, получающих химиотерапию, не следует употреблять грейпфрут, так как он взаимодействует с лекарственными препаратами, а предпочтение следует отдавать апельсину и мандарину.
- Не следует использовать высокие дозы витаминов, а перед их приемом необходимо проконсультироваться с врачом.
- Ни в коем случае нельзя употреблять смеси с неизвестными ингредиентами.
- Пациентам с опухолями молочной железы перед применением сои и семян льна следует проконсультироваться с врачом.
- Онкологические больные должны отдавать предпочтение тем видам спорта, которые не слишком утомляют организм и от которых они могут получать удовольствие.
- Против сухости кожи следует употреблять большое количество воды. Пациенты, которым неприятен вкус воды, могут пить травяные чаи.
- Телефон не должен быть средством общения для онкологических больных. Следует делать короткие звонки и использовать наушники.
- При использовании ноутбука необходимо следить за тем, чтобы компьютер находился на столе.
- Телевизор должен быть выключен как на выключателе, так и на пульте дистанционного управления. Это предотвращает излучение.
- Онкологические больные могут пройти магнитно-резонансную томографию и томографию. Прохождение через рентгеновский аппарат не наносит вреда пациентам.
Может ли рак вызывать увеличение массы тела?
Хотя потеря веса является более распространенным признаком рака, некоторые больные раком могут набирать вес. Исследования показывают, что более половины женщин с раком молочной железы набирают вес во время лечения и что эти лишние килограммы связаны с худшими результатами. Лишний вес может быть побочным эффектом лекарственных препаратов, таких как стероиды или гормоны. Кроме того, некоторые химиопрепараты могут вызывать задержку жидкости в организме, называемую отеком. Это также может привести к увеличению веса. Кроме того, многие пациенты с онкологическими заболеваниями обнаруживают снижение уровня энергии, что может привести к бездействию и набору веса.
Влияет ли рак на артериальное давление?
Некоторые противоопухолевые препараты, например анти-VEGF, могут вызывать повышение артериального давления. Эти препараты помогают блокировать приток крови к опухолям, но могут воздействовать и на другие кровеносные сосуды в организме, что может привести к повышению артериального давления. Повышенное кровяное давление может быть также признаком некоторых видов рака, например рака надпочечников. Химиотерапия и некоторые целевые препараты, применяемые для лечения рака, также могут вызывать снижение артериального давления.
Какова связь между курением и раком?
Часть смертей от рака вызвана курением и другими табачными изделиями. Выкуривание 1-10 сигарет в день повышает риск развития рака легких на 20% по сравнению с некурящими, а выкуривание двух пачек увеличивает риск на 80%. С другой стороны, даже если человек не курит, пребывание в курящей среде (пассивное курение) увеличивает риск развития рака легких примерно в 1,5 раза. Риск развития рака легких у человека, который выкуривал по пачке сигарет в день в течение 20 лет, снижается вдвое в течение 10 лет после отказа от курения. Отказ от курения является важнейшей профилактикой, позволяющей снизить риск развития рака и других сердечно-сосудистых и легочных заболеваний. При обращении к врачу с этой целью он окажет психологическую и медикаментозную (никотиновые пластыри, жевательные резинки) поддержку, необходимую при отказе от курения. Курение играет очень важную роль в возникновении рака легких, горла, пищевода, мочевого пузыря, поджелудочной железы, почек, шейки матки и молочной железы. Помимо никотина, содержащегося в табаке, многие канцерогенные вещества, такие как никель, кадмий, смола, монооксид, мышьяк и радон, вызывают рак, мутируя ген-супрессор опухолей р53. Пассивные курильщики также находятся в группе риска. Наиболее важной причиной детских онкологических заболеваний является курение родителей. Более того, курение во время беременности является самой важной причиной детского лейкоза.
Какова связь между раком и ожирением?
Снижение физической активности и ожирение приводят к увеличению числа видов рака. Научные исследования показывают, что ожирение является фактором риска развития рака молочной железы, матки, кишечника, пищевода и почек. Предполагается, что этот повышенный риск связан с увеличением количества эстрогена, вызванного ожирением. Поэтому профилактика ожирения и повышение физической активности считаются важными факторами профилактики рака.
Может ли рак вызывать образование тромбов?
У людей с онкологическими заболеваниями повышен риск развития тромбоза глубоких вен (ТГВ: тромб, образующийся в глубокой вене). Многие химиотерапевтические препараты также могут повышать риск развития ТГВ.
Повышает ли загрязнение окружающей среды заболеваемость раком?
Важной причиной возникновения онкологических заболеваний является растущее загрязнение окружающей среды. Человечество копает землю и находит множество полезных ископаемых, но не проявляет должной щепетильности в обезвреживании отходов этих ископаемых, которые не должны находиться в земле. “Батарейки”, которые используются каждый день и выбрасываются, – простейший тому пример. Вклад загрязнения окружающей среды в формирование рака достигает примерно 10%, если учесть разрушение озонового слоя и профессиональные факторы. Сокращение стратосферного озона привело к усилению вредного воздействия ультрафиолетовых лучей, а влияние ультрафиолета на развитие рака кожи несомненно.
Каково значение психологической поддержки в онкологии?
Чувства шока, отрицания, гнева, печали, страха и вины, которые иногда сопровождают чувства шока, отрицания, гнева, печали и страха, испытываемые пациентом, узнавшим, что у него “рак”, когда он обращается к врачу по поводу небольшого уплотнения в груди, кровотечения в моче, не проходящего кашля или родинки, изменившей свою форму, могут вызвать психические проблемы как у самого пациента, так и у его родственников. Эти эмоции могут создать кризисную ситуацию, повлияв на всю жизнь человека, включая работу и социальную жизнь. В борьбе с раком лечение и поддержка души, как и тела, имеет огромное значение для успешного лечения. Психологическая поддержка также улучшает качество жизни пациента. Поддерживающая терапия, которую врачи-специалисты, занимающиеся психологией рака, подберут для каждого пациента, поможет больным и их родственникам легче преодолеть этот сложный процесс. Улучшение психологического состояния пациентов и позитивная перспектива, которую они приобретают, также повышают качество их жизни и шансы на успех лечения. Адаптироваться к процессу болезни, внезапно возникшему на фоне здоровой жизни, почувствовать себя физически и психически здоровым, повысить силу борьбы можно с помощью таких поддерживающих терапий. Кроме того, очень важно оказывать психиатрическую поддержку, чтобы повысить способность справляться с физическими и психическими жалобами, такими как тревога, беспокойство, депрессия, бессонница, слабость, тошнота и боль, включить членов семьи, переживших аналогичный кризис, в систему поддержки пациента здоровым образом, восстановить порядок, связанный с социальной жизнью, распределением обязанностей, работой и экономической жизнью, которая была прервана.
Вызывает ли употребление соли рак?
Хотя сама по себе соль не вызывает рак, она нарушает структуру поверхности желудка и подготавливает среду для воздействия канцерогенных веществ. Опять же, в соленьях, где соль используется в изобилии, важную роль в формировании рака играют вещества, называемые нитрозаминами.
Почему рак может вызывать боль в спине?
В большинстве случаев боль в спине не является следствием рака, однако боль в спине может быть его индикатором. Боль в спине является симптомом многих видов рака, включая первичный рак костей, а также метастазы из молочной железы, толстой кишки, яичек или легких. Часто опухоли давят на позвоночник, поражая окружающие нервы и вызывая боль в спине.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
Гинекологические виды рака, которые называют женскими, перечислены ниже:

Что такое гинекологическая онкология?
Отрасль науки, изучающая раковые заболевания женских репродуктивных органов, называется гинекологической онкологией.
Что ищет гинекологическая онкология?
Яичники, матка, маточные трубы, влагалище и вульва, ограничивающая вход во влагалище, являются женскими репродуктивными органами. Гинекологическая онкология играет роль в профилактике, диагностике и лечении раковых заболеваний этих органов. Гинекологическая онкология – это отделение, в котором работают лучшие врачи. Гинекологическая онкологическая хирургия также является одним из направлений гинекологической онкологии. Гинекологическая онкология также известна многим как гинекологическая онкология, гинекологическая онкология, гинекологическая онкологическая хирургия, гинекологическая онкология.
Каковы симптомы женских онкологических заболеваний?
Онкологические заболевания у женщин имеют различные симптомы в зависимости от типа и стадии заболевания. В общем виде симптомы женского рака можно перечислить следующим образом:
- Кровотечения или выделения у женщин в менопаузе
- Нерегулярность менструального цикла
- Кровотечение вне менструации
- Боль после полового акта, боль в животе
- Вздутие живота
- Раны в области влагалища, зуд
- Проблемы с питанием и питьем
Факторы, предрасполагающие к развитию рака
Многие химические продукты, такие как индустриализация, повышенное загрязнение окружающей среды и воздуха, питание готовыми продуктами и курение, подготавливают почву для развития раковых клеток, нарушая структуру ингибиторных генов, препятствующих возникновению рака и опухолей в организме человека. Предотвратить и уменьшить влияние этих негативных факторов вряд ли возможно. Поэтому необходимо принять реальность рака и принять меры.
Достижения в области медицинской информатики вызывают улыбку у онкологических больных
Несмотря на стремительный рост числа случаев заболевания раком, благодаря важным шагам, предпринятым в области медицинских технологий, возможна его ранняя диагностика. Кроме того, рост медицинских знаний и хирургического опыта делает лечение более эффективным. За последние 10 лет клинические и молекулярные исследования рака репродуктивной системы прояснили многие неизвестные моменты, а факторы, вызывающие рак, стали более понятными. Внедрение таких методов лечения, как прямая терапия раковыми клетками, вакцины и иммунотерапия, также способствует повышению выживаемости.
Отделение медицинской онкологии занимается применением химиотерапии, то есть лечением рака с помощью лекарственных препаратов. В медицинских онкологических центрах нашей страны при лечении рака применяются химиотерапия, таргетные “умные” препараты и молекулы, гормонотерапия, иммунотерапия и биологическая терапия, рекомендованные врачом-онкологом.
Детские и женские онкологические заболевания
Рост заболеваемости раком, увеличение возраста вступления в брак и откладывание зачатия на более поздний возраст в связи с трудовой деятельностью женщины приводят к тому, что рак и желание иметь детей объединяются в среднем у 10% женщин. У нерожавших женщин, если рак обнаружен на ранней стадии, репродуктивную способность можно сохранить, удалив только раковую область с помощью гормонального или хирургического лечения в зависимости от типа заболевания. После рождения ребенка хирургическое лечение может быть завершено, если потребуется лечение.
Операции при раке шейки матки и репродуктивно щадящие операции проводятся в мире уже более 20 лет, и их результаты удовлетворительны в плане наступления беременности после лечения. При ранней стадии рака матки удаляется только раковая зона, а матка и влагалище соединяются.
Двадцать процентов случаев рака матки приходится на возраст до 45 лет и пять процентов – на возраст до 40 лет. Таким образом, число пациенток с раком матки и желанием иметь детей достаточно велико. В этом случае, если заболевание находится на ранней стадии, то есть не распространилось за пределы внутренней стенки матки и тип клеток не очень плохой, его можно лечить медикаментозно, а после регрессии заболевания можно добиться зачатия. В этом случае при лечении прогестероном можно достичь до 70% успеха.
В последние годы все большее распространение получает сохранение фертильности при раке яичников. Особенно при герминогенном раке яичников и раке яичников пограничного типа, выявленном в раннем возрасте, можно забеременеть, удалив только раковую ткань или раковый яичник и сохранив матку и противоположный яичник.
При использовании современных хирургических методов лечения повышается частота успешных операций
Быстрое развитие хирургических технологий и широкое распространение лапароскопических операций в мире и в Турции обеспечивают раннее выздоровление и снижают риски открытых операций. Все это в значительной степени способствует ранней диагностике и эффективному лечению рака.
Лапароскопическая и роботизированная хирургия становятся все более эффективными методами лечения рака матки, шейки матки и яичников, выявленных на ранних стадиях. Благодаря этим методам сокращается время пребывания пациента в стационаре, его восстановление, возвращение к трудовой деятельности и социальной жизни, а также отсутствует косметически значимое повреждение кожи.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ ЭНДОМЕТРИОЗ?

Эндометриоз определяется как наличие слоя эндометрия, который в норме образует внутреннюю часть матки, за ее пределами. Это заболевание обычно наблюдается в нижних отделах брюшной полости, которые мы называем тазом. Однако реже оно может встречаться и по всему телу. Эндометриоз, который, по оценкам специалистов, встречается примерно у 5-10% женщин репродуктивного возраста, является одной из важнейших причин бесплодия.
КАКОВЫ СИМПТОМЫ ЭНДОМЕТРИОЗА?
Симптомы эндометриоза можно перечислить следующим образом:
- Наиболее важными симптомами являются боли во время менструации
- Постоянная сильная боль в нижней части живота
- Сильная боль во время полового акта
- Затруднения и боль при посещении большого туалета, иногда диарея
- Частое мочеиспускание и кровь в моче
- Боль в боку, боль в спине
ЧТО ВЫЗЫВАЕТ ЭНДОМЕТРИОЗ?
Точная причина эндометриоза точно не известна. Хотя существует несколько теорий, ни одна из них сама по себе не может объяснить все случаи эндометриоза. Эндометриоз чаще встречается у худых, высоких, рыжеволосых, цветноглазых женщин. Некоторые из теорий, пытающихся объяснить эндометриоз, следующие:
- С началом менструации у женщин отторгается поверхностная часть эндометрия, являющегося внутренним слоем матки, а из труб в брюшную полость может вытекать кровь. У женщин со здоровой иммунной системой кровь и ткани эндометрия, попавшие в брюшную полость, очищаются, а у некоторых женщин они не могут очиститься и оседают в трубах, яичниках, кишечнике, мочевом пузыре или других органах в брюшной полости. Это вызывает миграцию защитных клеток, называемую воспалением в этих областях. На поздних стадиях заболевания могут возникать кровотечения, заживление тканей и образование спаек в брюшной полости. Очаги эндометриоза, образовавшиеся в яичниках, под действием гормонов во время каждой менструации кровоточат, вызывая поражение, называемое эндометриомой. Кровь, скопившаяся в яичнике, со временем приобретает коричневый цвет, и такие кисты в народе называют шоколадными, поскольку они напоминают шоколад.
- По другой версии, клетки внутреннего слоя матки попадают в другие органы тела по кровеносным сосудам. В литературе встречаются, хотя и редко, очаги эндометриоза, вызывающие кровотечение в глазу пациентки при каждой менструации или скопление крови в грудной полости при каждой менструации. Эти очаги могут быть объяснены с помощью данной теории.
Известны также некоторые условия, препятствующие развитию эндометриоза. К ним относятся беременность, более чем однократные роды и грудное вскармливание. Эндометриоз реже встречается у женщин с избыточным весом, высоким индексом массы тела и большим отношением объема талии к объему бедер.
КАК ДИАГНОСТИРУЕТСЯ ЭНДОМЕТРИОЗ?
Окончательный диагноз эндометриоза ставится, когда ткань эндометрия, которая в норме должна находиться только во внутреннем слое матки, обнаруживается в других частях тела, эти ткани удаляются хирургическим путем и микроскопически исследуются специалистами-патологоанатомами.
Для постановки предварительного диагноза очень важны подробный анамнез и симптомы пациента. Данные, полученные из анамнеза пациентки, такие как боль при менструации, начинающаяся позже, боль в нижней части живота, боль при половом акте, неспособность иметь детей спонтанно, боль при большом туалете, кровавая моча или кровавый кал, важны для выявления заболевания.
При осмотре видны эндометриотические узлы, расположенные во влагалище, если таковые имеются. Шоколадные кисты можно пальпировать. Более четко диагноз шоколадных кист может быть поставлен при гинекологическом УЗИ, проводимом одновременно с осмотром. Можно увидеть эндометриотические узлы на прямой кишке – последнем отделе толстого кишечника. При гинекологическом осмотре предварительный диагноз может быть поставлен в 70% случаев тяжелого эндометриоза.
Иногда могут потребоваться дополнительные обследования. У пациентов с кровянистой мочой эндометриотические поражения мочевого пузыря или мочевыводящих путей можно увидеть с помощью тонкой камеры при процедуре, называемой цистоуретероскопией. У пациентов с кровянистым стулом эндометриотические узлы также можно увидеть при колоноскопии. Кроме того, ценным методом диагностики и планирования хирургического вмешательства при глубоком инфильтративном эндометриозе является магнитно-резонансная томография (МРТ).
Однако следует еще раз отметить, что окончательный диагноз эндометриоза ставится при микроскопическом исследовании очагов, удаленных при лапароскопии.
КАК ЛЕЧИТСЯ ЭНДОМЕТРИОЗ?
Эндометриоз – проблема, поддающаяся лечению. Лечение должно быть индивидуальным в зависимости от жалоб пациентки, ее желания иметь детей и результатов обследования. Может применяться широкий спектр методов лечения – от выжидательной терапии, медикаментозной терапии, вспомогательных репродуктивных технологий до хирургического вмешательства.
Если для женщин с эндометриозом, у которых боль стоит на первом месте, медикаментозное лечение может быть полезным, то в запущенных случаях, когда вспомогательные репродуктивные технологии не дают результата, может быть рассмотрен вопрос о хирургическом лечении.
Если в течение определенного времени не удается зачать ребенка, то на первом этапе используются вспомогательные репродуктивные методы, такие как вакцинация и экстракорпоральное оплодотворение. Некоторые пациенты, прошедшие через вспомогательные репродуктивные методы, такие как ЭКО, могут забеременеть. При отсутствии реакции на эти методы лечения может быть проведено хирургическое удаление заболевания. К хирургическим методам относятся: удаление шоколадных кист с помощью лапароскопической операции, раскрытие спаек, восстановление нормальной анатомии труб или удаление узлов в случаях глубокого инфильтративного эндометриоза с сильными болями, несмотря на лечение. Шоколадные кисты должны находиться под более тщательным наблюдением, особенно у пациенток старше 40 лет. Так как существует риск развития рака яичников на основе шоколадных кист. Если при УЗИ или МРТ обнаруживаются подозрительные образования, может быть рассмотрен вопрос об удалении яичника и трубы. Однако я хотел бы еще раз подчеркнуть, что стандартного подхода у таких пациенток не существует, и лечение должно быть индивидуальным для каждой пациентки.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ ОБ ЭНДОМЕТРИОЗЕ
Каковы факторы риска при эндометриозе?
К факторам риска развития заболевания эндометриозом, помимо таких, как начало менструаций в раннем возрасте, менструации чаще 21 дня, нерожавшие женщины, обильные менструальные кровотечения, высокий рост, рыжие волосы, голубовато-зеленый цвет глаз, веснушки, относятся следующие:
- Бесплодие
- Врожденные структурные дефекты женских репродуктивных органов
- Алкоголь, кофеин
- Диета, богатая жирами и красным мясом
- Низкий индекс массы тела
- Эндометриоз у родственника первой степени родства
- Эндометриоз, не вызывающий никаких жалоб, реже встречается у чернокожих, но чаще у азиатов по сравнению с белой расой.
Препятствует ли эндометриоз зачатию?
Эндометриоз встречается у 5-10% всех женщин репродуктивного возраста в нашей стране. Однако у женщин, имеющих проблемы с зачатием, этот показатель может достигать 25-30%. Эндометриоз может препятствовать зачатию по разным причинам. Эндометриоз может препятствовать прохождению яйцеклетки в трубы, образуя спайки в репродуктивных органах. Иногда он может препятствовать наступлению беременности, блокируя конец трубы, т.е. вызывая “трубную непроходимость”. Эндометриоз может также вызывать образование шоколадных кист, называемых эндометриомой. Эти кисты могут располагаться в яичниках и препятствовать здоровой овуляции, а также снижать вероятность наступления беременности за счет уменьшения резерва яйцеклеток. Цитокины и гуморальные факторы, выделяемые из очагов эндометриоза, могут негативно влиять на развитие и прикрепление эмбриона. После лечения вероятность наступления беременности увеличивается на 40% после двух лет ожидания. Однако если человек по-прежнему не может нормально зачать ребенка, можно попробовать экстракорпоральное оплодотворение.
Что такое глубокий эндометриоз?
“Глубокий инфильтративный эндометриоз”, представляющий собой особый тип эндометриозного заболевания, распространенный у женщин репродуктивного возраста, иногда проявляется сильными болями, а иногда может прогрессировать бессимптомно. Пациентки, у которых нет симптомов заболевания, обычно обращаются к врачу с жалобами на невозможность зачать ребенка. “Глубокий инфильтративный эндометриоз”, под которым понимается распространение эндометриоза вглубь маточных связок между влагалищем и прямой кишкой, кишечником, мочевым пузырем, мочевыводящими протоками и брюшиной, – заболевание, требующее мультидисциплинарного подхода, затрагивающего не только область гинекологии, но и общей хирургии, урологии, гастроэнтерологии.
Эти ткани, которые до поздних стадий могут не проявлять себя никакими симптомами, при достижении очень больших размеров могут блокировать протоки в кишечнике. В этом случае, называемом “глубокий инфильтративный эндометриоз”, важно, чтобы операция проводилась опытными руками и опытными людьми. Потому что во время операции необходимо очень хорошо освободить область между маткой и кишечником, а также мочеточники, которые являются мочевыми трубами. При операции очень важно удалить ту часть кишечника, которая часто вовлекается в процесс, и свести оставшиеся части вместе. Для того чтобы диагностировать глубокий эндометриоз, серьезно влияющий на социальную жизнь пациенток, и не допустить образования серьезных спаек между тканями, важно, чтобы диагностика и лечение проводились опытными руками и в центрах, оснащенных необходимым оборудованием.
Эндометриоз – это заболевание, которое лечится травами?
Эндометриоз не может быть решен с помощью лечения травами. Продаваемые в Интернете препараты под названием “травы от эндометриоза” могут принести больше вреда, чем пользы. Лечение эндометриоза должно планироваться совместно со специалистом – гинекологом и акушером.
Когда чаще всего диагностируется эндометриоз?
Эндометриоз диагностируется в среднем в возрасте 25-35 лет. Период задержки между началом заболевания и постановкой диагноза составляет около 7 лет.
Наблюдается ли эндометриоз после менопаузы?
Эндометриоз является гормонозависимым заболеванием. По мере прекращения выработки гормонов эстрогена и прогестерона яичниками в период менопаузы эндометриоз должен регрессировать. Частота встречаемости эндометриоза в постменопаузальном периоде составляет менее 5%, и у таких женщин обычно в анамнезе имеется заместительная гормональная терапия, применяемая для облегчения климактерических симптомов.
Связан ли эндометриоз с избыточным весом?
Наряду с факторами риска, вызывающими эндометриоз, существуют и факторы, обеспечивающие защиту от этого заболевания. К основным защитным факторам относятся беременность, многоплодие и грудное вскармливание, а эндометриоз реже встречается у женщин с ожирением, высоким индексом массы тела и особенно высоким отношением объема талии к объему бедер.
Являются ли менструальные боли признаком эндометриоза?
Да, сильные менструальные боли могут быть признаком эндометриоза. Однако менструальные боли начинаются не с первой менструации, а с любого более позднего периода. Менструальные боли, возникающие с первой менструации, называются первичной дисменореей, и причины их возникновения обычно другие. К сожалению, многие женщины могут воспринимать менструальные боли как нечто само собой разумеющееся и считать, что с этими болями нужно жить. Большинство женщин могут считать эти боли нормальными, вместо того чтобы обратиться к врачу. Однако эта проблема снижает качество жизни женщины и может негативно повлиять на репродуктивную функцию на более поздних стадиях.
Что такое шоколадная киста?
Шоколадная киста – это разновидность кисты, расположенной в яичниках, трубах и матке женщины, которая растет за счет кровоизлияния в себя во время каждого менструального кровотечения. Шоколадные кисты получили такое название потому, что скапливающаяся в них менструальная кровь становится немного более жидкой и через некоторое время приобретает коричневый цвет, как у шоколада. Настоящее название этих кист – эндометриома. Диагноз чаще всего ставится с помощью УЗИ. Обычно проверяется уровень Ca125 в крови, но он мало помогает в дифференциации опухолей яичников.
Лечение шоколадной кисты зависит от конкретного случая. У молодых бездетных женщин рост шоколадных кист может быть подавлен с помощью противозачаточных таблеток. У женщин, желающих иметь детей, если они не могут зачать ребенка спонтанно, могут потребоваться вспомогательные репродуктивные технологии, такие как вакцинация и экстракорпоральное оплодотворение. У женщин, которые не могут зачать ребенка, несмотря на эти методы лечения, может потребоваться хирургическое вмешательство при наличии кист больших размеров и, соответственно, повышенного риска их перекрута или разрыва. Золотым стандартом лечения таких пациенток является полное удаление стенки кисты с помощью лапароскопической операции. Если полностью удалить кисту не удается, то повышается вероятность рецидива. Поскольку риск развития рака на основе эндометриомы особенно возрастает в возрасте старше 40 лет, при необходимости может потребоваться более детальное обследование и применение таких методов визуализации, как МРТ. При наличии подозрительного поражения может потребоваться удаление яичника и трубы.
Существует ли связь между эндометриозом и бесплодием?
Одной из причин, по которой женщины не могут забеременеть, может быть эндометриоз. У некоторых из них рубцовая ткань, вызванная эндометриозом, приводит к непроходимости труб. Однако причины, по которым эндометриоз влияет на фертильность у большинства женщин, пока точно не известны.
В короткое время эндометриоз может вызывать следующие заболевания:
- Это уменьшает количество яйцеклеток в яичниках, что мы называем овариальным резервом.
- Он нарушает функцию овуляции.
- Это может вызвать непроходимость труб и помешать соединению сперматозоида и яйцеклетки.
- Он вырабатывает естественные токсины, которые убивают сперматозоиды.
- Это предотвращает прикрепление эмбриона к матке.
- Он оказывает пагубное влияние на развитие эмбриона.
Могут ли пациентки с эндометриозом забеременеть с помощью экстракорпорального оплодотворения?
С помощью ЭКО можно достичь беременности у женщин с эндометриозом с частотой до 60% с одной попытки пропорционально их возрасту. Конечно, необходимо повторить процедуру ЭКО у женщин, у которых не получается зачать ребенка с первой попытки. При повторных попытках вероятность наступления беременности может быть достигнута в значительной степени.
Влияет ли иммунная система на развитие эндометриоза?
Точная причина возникновения эндометриоза до сих пор неизвестна. Наиболее распространенной является теория, согласно которой ткани матки во время менструального кровотечения проходят по трубам женщины, оседают в брюшной полости и продолжают здесь свое развитие. Предполагается, что при этом иммунная система также отличается от нормальной.
Встречается ли эндометриоз в прямой кишке?
Эндометриоз – очень распространенная проблема здоровья. Эта ткань может располагаться как в органах внутри брюшной полости (яичник, канал матки, брюшина, кишечник, прямая кишка, мочевой пузырь), так и вне ее (влагалище, пупок, глаз, плевра). В зависимости от выраженности симптомов и скорости достижения эндометриотическими узлами внутреннего канала прямой кишки может потребоваться удаление прямой кишки – последней части толстой кишки, где расположен узел, у некоторых пациентов – повторное соединение оставшихся частей, а у некоторых – выскабливание узла из прямой кишки ножницами.
Что важно в хирургии шоколадной кисты и эндометриоза?
При проведении этих операций гинекологи и акушеры обращают внимание на следующие моменты:
- Не повреждать овариальный резерв: При этих операциях не должна повреждаться ткань яичника за пределами стенки кисты. Поскольку при повреждении ткани яичника расположенные здесь яйцеклетки могут быть повреждены, и в будущем пациентка может столкнуться с ранней менопаузой и проблемами бесплодия. Неповреждение яичников, труб и тканей матки – важнейшие моменты в хирургии кисты шоколада.
- Раскрытие спаек: Шоколадная киста может вызывать образование плотных спаек по сравнению с другими кистами яичников. Вскрытие и коррекция этих спаек во время операции может уменьшить болевые жалобы и повысить процент успешного лечения беременности.
- Удаление глубоко расположенных эндометриозных узлов: Эндометриоз и шоколадные кисты также могут быть связаны с сильными болями в паху и животе. Большое значение имеет предоперационное выявление узлов эндометриоза, особенно глубокого инфильтративного эндометриоза, которые вызывают сильные боли. При наличии таких узлов удаление только шоколадной кисты не позволяет полностью избавиться от боли. Узлы глубокого инфильтративного эндометриоза должны быть удалены вместе с кистой яичника. Эта область очень важна с точки зрения хирургического вмешательства. Поскольку она находится в непосредственной близости от прямой кишки, которая является частью толстой кишки, расположенной за маткой и яичниками, и трубчатых структур, называемых мочеточниками, которые обеспечивают прохождение мочи от обеих почек к мочевому пузырю. Защита этих тканей во время операции имеет большое значение. Поэтому такие операции выполняются опытными врачами.
При кисте шоколадного цвета сколько см требуется операция?
Для операции по удалению шоколадной кисты не существует определенных ограничений по размеру. Необходимо обсудить с пациенткой ее возраст, бесплодие, риски разрыва и перекрута и совместно принять решение. Разрыв – это отрыв части эндометриомы от яичника и вытекание содержимого эндометриомы в брюшную полость. Торсия, напротив, представляет собой поворот яичника и трубы, включая эндометриому, вокруг себя, нарушение кровотока и гангрену. В этом случае яичник и труба снова поворачиваются и восстанавливаются. К сожалению, у некоторых пациенток яичник сохранить не удается.
Проходит ли шоколадная киста сама по себе?
Шоколадные кисты не исчезают сами по себе. Лечение является хирургическим. Хотя некоторые лекарственные препараты препятствуют росту кист, они не могут их устранить. При разрыве кисты ее содержимое может вылиться в брюшную полость, но риск рецидива достаточно высок, поскольку стенка кисты не удаляется.
Как возникает боль при кисте шоколада?
Люди с шоколадными кистами отмечают, что у них возникают менструальные боли. Они также отмечают, что боль начинается непосредственно перед менструацией и продолжается в течение всего менструального периода. Пациентки могут говорить о том, что боль особенно ощущается в паху, ногах и пояснице. Шоколадная киста может также вызывать боль во время полового акта. Иногда наблюдаются боли в кишечнике и мочевом пузыре.
Как распознать разрыв шоколадной кисты?
Пациентки с разрывом эндометриомы отмечают колющую боль в паху, которая затем распространяется по всему животу. Разрыв шоколадной кисты можно обнаружить с помощью УЗИ. Иногда наряду с болью могут наблюдаться тошнота, рвота и слабость.
Каково значение CA 125 в шоколадной кисте?
Значение Ca125 – это анализ крови, который мы используем для того, чтобы отличить, является ли образование злокачественным или раковым у пациентов с образованием в яичниках. Уровень Ca125 может быть повышен во многих других случаях, кроме рака. Одним из таких состояний являются шоколадные кисты. Особенно при разрыве, то есть разрыве шоколадной кисты, значения Ca125 могут достигать очень высоких значений, и вместе с содержимым шоколадной кисты, изливающимся в брюшную полость, это может имитировать прогрессирующий рак яичников.
Вызывает ли шоколадная киста выделения?
Поскольку шоколадные кисты наблюдаются в яичниках, расположенных в брюшной полости и не связанных непосредственно с влагалищем, они не вызывают выделений.
Бывают ли шоколадные кисты у одиноких людей?
Шоколадные кисты могут возникать у одиноких женщин.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ РАК МАТКИ?
Рак матки – один из наиболее распространенных видов рака у женщин. Матка состоит из клеток, называемых эндометрием, которые регулярно утолщаются и отторгаются во время менструации. Иногда эти клетки претерпевают изменения и могут аномально делиться и размножаться. Это называется раком матки или раком эндометрия.
ЧТО ВЫЗЫВАЕТ РАК МАТКИ (ЭНДОМЕТРИЯ)? КАКОВЫ ФАКТОРЫ РИСКА?
Что вызывает рак матки? Точный ответ на этот вопрос не известен. Однако изменение уровня эстрогенов и прогестерона в организме может вызвать рак матки. Изменение уровня эстрогенов и прогестерона может влиять на эндометрий. Такое взаимодействие может предрасполагать к развитию рака матки. Хотя причины возникновения рака матки точно не известны, известны факторы риска.
К факторам риска, вызывающим рак матки, относятся следующие:
- Возраст: Риск развития рака матки увеличивается с возрастом. Однако рак матки может встречаться и в молодом возрасте.
- Начало менструаций в раннем возрасте может привести к раку матки. Воздействие гормона эстрогена в течение многих лет повышает риск развития рака матки.
- Поздняя менопауза Рак матки обычно возникает после наступления менопаузы. Поздний период менопаузы может повышать риск развития рака матки за счет увеличения воздействия гормона эстрогена.
- Ожирение является одним из факторов, повышающих риск развития рака матки. Поскольку избыточная жировая ткань вырабатывает эстроген, риск развития рака матки выше у женщин с ожирением.
- Диабет может повышать риск развития рака матки. Риск развития рака матки у женщин с диабетом 2-го типа почти в 2 раза выше, чем у женщин без диабета.
- Невынашивание беременности. Во время беременности баланс гормонов смещается в сторону прогестерона. Невынашивание беременности может привести к раку матки.
- Синдром поликистозных яичников. При синдроме поликистозных яичников уровень эстрогенов высок, а уровень прогестерона низок. Это повышает риск развития рака матки.
- Некоторые гормоноподавляющие препараты, применяемые при лечении рака молочной железы, также могут вызывать рак матки.
- Лица, имеющие в семейном анамнезе рак кишечника, находятся в группе повышенного риска по раку матки.
- Предрасполагать к развитию рака матки может лучевая терапия, проводимая по поводу других онкологических заболеваний.
- Гормонозаместительная терапия после менопаузы может быть причиной развития рака матки.
КТО МОЖЕТ ЗАБОЛЕТЬ РАКОМ МАТКИ?
Рак матки, как правило, является климактерическим заболеванием. Он чаще встречается в возрасте старше 55 лет. Однако он может встречаться и в молодом возрасте.
КАКОВЫ СИМПТОМЫ РАКА МАТКИ (РАКА ЭНДОМЕТРИЯ)?
Первыми симптомами рака матки являются вагинальные кровотечения. Вагинальные кровотечения, особенно в период менопаузы, следует рассматривать как рак матки, пока не доказано обратное. У менструирующих женщин первыми признаками рака матки могут быть нерегулярные периодические кровотечения и обильные кровотечения.
Помимо вагинальных кровотечений и выделений, при прогрессировании рака матки могут наблюдаться и другие симптомы.
- Тазовая боль
- Боль в животе
- Вздутие живота
- Частое мочеиспускание
- Боль при мочеиспускании
- Кровотечения в постменопаузальном периоде
Эти жалобы могут возникать и в связи с другими проблемами. Однако тем, кто испытывает один или несколько симптомов рака матки, важно обратиться к врачу-гинекологу и акушеру для ранней диагностики.
КАКОВЫ СТАДИИ РАКА МАТКИ?
Для того чтобы правильно спланировать лечение рака матки, важно знать стадию рака. Стадия рака матки определяется размером опухолевого очага, распространением рака матки на лимфатические узлы и наличием метастазов. Обычно рак матки проходит 4 стадии.
- Рак матки 1 стадии: Рак находится только в матке. Распространение на окружающие ткани или отдаленные участки тела отсутствует. Стадия 1 может рассматриваться в двух отдельных рубриках в зависимости от того, насколько раковые клетки распространились на мышечные ткани матки (миометрий).
- Рак матки 2-й стадии: Рак наблюдается в матке и шейке матки. Другими словами, рак распространился из тела матки и перешел на поддерживающие соединительные ткани шейки. Метастазы в лимфатические узлы и отдаленные участки тела отсутствуют.
- Рак матки 3-й стадии: Рак распространился за пределы матки. Однако распространение не достигло прямой кишки или мочевого пузыря. Стадия 3 соответствует распространению на фаллопиевы трубы, яичники, лимфу вблизи матки. Рак матки можно разделить на подразделы.
- Рак матки 4-й стадии: Это последняя стадия рака матки. Рак распространился на прямую кишку, мочевой пузырь или более отдаленные органы тела. Она анализируется в двух подразделах. Рак матки стадии 4А: Рак распространился на слизистую оболочку прямой кишки или мочевого пузыря. Рак матки стадии 4B: Рак распространился на лимфу в паховой области, кости или отдаленные органы, такие как легкие.
При определении стадий рака матки важен также внешний вид раковых клеток под микроскопом. Если раковые клетки выглядят как здоровая ткань и имеют различные группы клеток, то это называется “дифференцированной” или “низкосортной опухолью”. Если раковая ткань выглядит совсем не так, как здоровая, то это называется “плохо дифференцированной” или “высокозлокачественной опухолью”. По степени распространения опухоли можно судить о скорости распространения рака матки.
КАК ДИАГНОСТИРУЕТСЯ РАК МАТКИ (ЭНДОМЕТРИЯ)?
“Как понять, что это рак матки?” Этот вопрос является одним из самых любопытных. Женщинам, обнаружившим у себя один или несколько симптомов рака матки, следует, не теряя времени, обратиться к врачу-гинекологу и акушеру. После осмотра органов малого таза может потребоваться проведение некоторых исследований для уточнения диагноза.
- Ультразвуковое исследование влагалища Ультразвуковая визуализация используется для того, чтобы увидеть опухоли и структуру матки. Толщина стенки матки или другие аномалии могут быть определены с помощью ультразвукового датчика, помещенного у входа в матку.
- Гистероскопия Для диагностики рака матки может быть использован метод визуализации, называемый гистероскопией. В матку вводится тонкая гибкая трубка с оптоволоконной камерой. Таким образом, можно осмотреть внутреннюю поверхность матки и эндометрий.
- Патологическая оценка. Для постановки окончательного диагноза рака матки необходимо провести патоморфологическое исследование образца ткани, взятого из матки путем кюретажа. Биопсия может быть выполнена под гистероскопией и анестезией.
- Компьютерная томография (КТ) и магнитно-резонансная томография (МРТ): методы КТ или МРТ позволяют определить размеры аномалии или опухоли в матке. Для получения более четких изображений при КТ или МРТ может использоваться контрастное вещество. Если план лечения включает гормональную терапию, МРТ может быть полезна для получения детальных изображений. МР-изображения также могут использоваться для того, чтобы увидеть, насколько рак пророс в стенку матки, и определить, можно ли сохранить фертильность.
КАК ЛЕЧИТСЯ РАК МАТКИ (ЭНДОМЕТРИЯ)?
При лечении рака матки учитываются многие факторы, такие как тип рака, стадия, возможные побочные эффекты применяемого лечения, общее состояние здоровья пациента, возраст, влияние применяемого лечения на фертильность.
Хотя хирургические методы занимают первое место в лечении рака матки, могут применяться химиотерапия, лучевая терапия, гормонотерапия, таргетная терапия и иммунотерапия. При лечении рака матки иногда может применяться только один или несколько из этих методов в комбинации.
- Операции при раке матки
Наиболее распространенным методом лечения рака матки является хирургический. Наряду с операцией гистерэктомии основным методом лечения является патологическое исследование матки во время операции, называемое замороженным. В зависимости от результатов замороженного исследования может потребоваться также удаление лимфы вокруг сосуда.
- Химиотерапевтическое лечение рака тела матки
При лечении рака матки химиотерапия может применяться до или после операции. Химиотерапия может быть назначена после операции против риска рецидива рака матки, а предоперационная химиотерапия может быть назначена до операции для уменьшения размеров опухоли и ее полного удаления. Она также может применяться отдельно или в сочетании с радиотерапией.
- Радиотерапевтическое лечение рака матки
Лучевая терапия обычно проводится после операции для уничтожения оставшихся раковых клеток. В некоторых случаях лучевая терапия может применяться и перед операцией по удалению всей опухоли. Лучевая терапия может быть предпочтительна для пациентов, общее состояние здоровья которых не позволяет провести операцию.
- Гормональная терапия при раке матки
Для изменения уровня гормонов можно использовать гормональные и гормонально-блокирующие препараты. Гормональная терапия может замедлить рост клеток рака матки. Гормональная терапия может применяться в случае рецидива рака матки и при метастатическом раке матки. Гормональная терапия часто сочетается с химиотерапией.
ЧТО НЕОБХОДИМО УЧИТЫВАТЬ ДЛЯ ПРОФИЛАКТИКИ РАКА МАТКИ?
Как и в случае рака молочной железы и рака шейки матки, метода скрининга не существует. Наиболее эффективным методом профилактики рака матки (эндометрия) является ранняя диагностика. Поэтому
Каждая женщина должна регулярно проходить гинекологическое обследование.
Можно принимать противозачаточные таблетки. Прием оральных контрацептивов в течение одного года может снизить риск развития рака матки. Однако не следует забывать, что эти оральные контрацептивы имеют побочные эффекты. Решение следует принимать после обсуждения рисков и преимуществ с врачом.
Необходимо обеспечить контроль веса. Ожирение может повышать риск развития рака матки.
Различные факторы способствуют возникновению разных типов рака. Хотя не существует доказанного способа полной профилактики рака матки, вы можете снизить свой риск. Для получения дополнительной информации о личном риске развития рака обратитесь к своему лечащему врачу.
Можно использовать внутриматочную спираль с высвобождением прогестинов (ВМС), являющуюся одним из видов контрацепции.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ О РАКЕ МАТКИ
Среди отзывов больных раком матки есть часто задаваемые вопросы. Часто задаваемые вопросы о раке матки можно перечислить следующим образом:
Как проводится операция по удалению рака матки?
Операции при раке матки могут различаться в зависимости от состояния пациентки и степени распространения рака. Операция по удалению рака матки обычно выполняется методом, известным как гистерэктомия. Гистерэктомия, известная как операция по удалению матки, может быть выполнена открытым, лапароскопическим (закрытым) или роботизированным методом.
После установления диагноза рака матки планирование хирургического вмешательства осуществляется в зависимости от стадии рака и показателей организма пациентки. Как правило, операция выполняется на первых трех стадиях рака матки, а на последней стадии хирургический метод не является предпочтительным.
Хирургическое лечение рака матки может быть выполнено путем сочетания нескольких операций. В зависимости от стадии рака матки хирург может выполнить простую гистерэктомию (удаление матки и шейки матки) или радикальную гистерэктомию (удаление матки, шейки матки, верхней части влагалища и близлежащих тканей). В зависимости от возраста и климактерического статуса пациенток выполняется оофорэктомия с удалением яичников. Если рак матки распространился на лимфоидные ткани, то они также могут быть удалены во время операции.
Каков процент успешного лечения рака матки?
Рак эндометрия – это заболевание, которое при ранней диагностике может быть полностью излечено. При обнаружении рака на ранних стадиях шансы пациенток на 5-летнюю жизнь составляют 95%.
Как проводится скрининг рака матки?
Скринингового теста для выявления рака эндометрия не существует.
Существует ли анализ крови на рак матки?
Не существует известного анализа крови для диагностики рака матки
Убивает ли рак матки? Является ли рак матки смертельным? Сроки выживания при раке матки
Рак – смертельно опасное заболевание. Наиболее важным понятием, определяющим продолжительность жизни, является стадия заболевания.
Существует ли вакцина против рака матки?
Вакцины против рака матки не существует.
Заразен ли рак матки?
Рак матки не является заразным.
Вызывает ли рак матки боль?
Рак матки может прогрессировать безболезненно, но некоторые пациенты могут испытывать боль.
Может ли мужчина заболеть раком матки?
Рак матки не передается мужчинам.
Вызывает ли рак матки боль в ногах?
Если опухоль распространилась на область нерва, это может вызвать боль в ноге.
Сколько часов занимает операция по удалению рака матки?
Продолжительность операции зависит от степени распространения заболевания, т.е. от стадии, и от мастерства хирурга.
Как проводится обследование на рак матки?
После установления диагноза с помощью биопсии может быть проведена магнитно-резонансная томография для изучения размеров опухоли.
Рецидивирует ли рак матки?
Рак матки может рецидивировать.
На что следует обратить внимание после операции по поводу рака матки?
Один из важнейших моментов, на который следует обратить внимание после операции по поводу рака матки, – не прерывать рутинный контроль. Кроме того, следует обратить внимание на здоровое питание.
Куда метастазирует рак матки?
Рак матки в первую очередь распространяется на окружающие ткани. Он распространяется на лимфатические узлы и окружающие ткани в области малого таза.
Может ли больной раком матки вести половую жизнь?
Для больных раком матки нет препятствий к половым контактам.
Является ли рак матки генетическим?
Рак матки может иметь генетические особенности. Особенно в группу риска попадают те, у кого в анамнезе есть онкологические заболевания у родственников 1-й степени родства.
Могут ли девственницы заболеть раком матки?
Это может произойти при наличии фактора риска или семейного анамнеза. Однако в возрасте до 40 лет рак матки встречается редко.
Существует ли лечение рака матки травами?
Лечение рака матки травами не известно.
На что следует обратить внимание людям, перенесшим операцию по удалению рака матки?
После операции по поводу рака матки пациенткам важно обратить внимание на свой образ жизни и питание.
Можно ли обнаружить рак матки при ультразвуковом исследовании?
Ультразвуковая визуализация может дать подозрительные данные на рак матки. Однако для окончательной диагностики необходимо провести биопсию.
Можно ли обнаружить рак матки по анализу крови?
Анализ крови на рак матки не известен.
Каков возрастной диапазон для рака матки?
Рак матки чаще встречается в постменопаузальном периоде.
Вызывает ли рак матки боль в пояснице?
Хотя рак матки встречается редко, он может вызывать боли в пояснице.
Вызывает ли спираль рак матки?
Спираль не вызывает рака матки. Особенно гормональные спирали могут быть защитными.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ РАК ШЕЙКИ МАТКИ?
Рак шейки матки является наиболее распространенным гинекологическим заболеванием в развивающихся и слаборазвитых странах. Ежегодно в мире диагностируется 500 тыс. новых случаев рака шейки матки. Рак шейки матки, который обычно возникает в возрасте около 50 лет, в последние годы стал встречаться у молодых женщин.
Вирус ВПЧ (“вирус папилломы человека”), вызывающий почти все виды рака шейки матки, не имеет ярко выраженных симптомов и очень заразен. Большинство женщин побеждают вирус ВПЧ, с которым они сталкивались в тот или иной момент своей жизни, с помощью собственной защитной системы организма. Некоторые вирусы ВПЧ оказываются сильнее этой защитной системы и могут вызывать рак шейки матки. Соблюдение мер предосторожности для защиты от вируса ВПЧ, вызывающего это заболевание, и регулярные медицинские осмотры и обследования помогают выявить заболевание до его возникновения или на ранних стадиях и способствуют успешному лечению.
ЧТО ТАКОЕ ШЕЙКА МАТКИ?
Шейка матки, нижняя часть матки, соединяет матку и влагалище. Шейка матки, также известная как маточный зев, играет важную роль в обеспечении прохождения жидкостей между маткой и влагалищем. Она также позволяет ребенку пройти через влагалище и покинуть матку во время родов.
КАКОВЫ ПРИЧИНЫ ВОЗНИКНОВЕНИЯ РАКА ШЕЙКИ МАТКИ?
Как и во многих других онкологических заболеваниях, точная причина возникновения рака шейки матки неизвестна. Лишь некоторые факторы могут способствовать развитию рака шейки матки и ускорять течение заболевания. В целом факторы риска развития рака шейки матки следующие;
- Полигамия
- Половые контакты в возрасте до 20 лет
- Курение
- Слабая иммунная система.
- Частые вирусные и бактериальные инфекции половых органов
- Рождение большого количества детей
- Низкий социально-экономический статус
- Дефицит витамина С и витамина А
КАКИЕ СУЩЕСТВУЮТ ВИДЫ РАКА ШЕЙКИ МАТКИ?
Аденокарцинома
Существуют различные виды рака шейки матки. Существует множество типов рака шейки матки, включая инвазивные виды рака, такие как аденокарцинома и сквамозная эпителиально-клеточная карцинома. Среди видов рака шейки матки аденокарцинома, которую труднее обнаружить и которая встречается реже, является относительно агрессивным видом рака. Аденокарциномы обычно образуются во внутреннем канале шейки матки, а не на ее наружной поверхности. При исследовании мазков используются образцы клеток с наружной поверхности. Поэтому к моменту диагностики аденокарциномы рак обычно находится на поздней стадии. Чаще всего аденокарцинома возникает при наличии ВПЧ 16, 18, 45 и 31 типов, которые вызывают рак.
КАКОВЫ СИМПТОМЫ РАКА ШЕЙКИ МАТКИ?
Симптомы рака шейки матки могут не проявляться на ранних стадиях. Даже при гинекологическом осмотре проблема в шейке матки может быть не видна. После того как скрининговые тесты на ВПЧ высокого риска, являющиеся скрининговыми тестами на рак шейки матки, окажутся положительными или будут обнаружены отклонения в мазке из влагалища, называемом мазком, изменения могут быть обнаружены с помощью инструментов, увеличивающих шейку матки, называемых “кольпоскоп”, а окончательный диагноз может быть поставлен с помощью биопсии, взятой из подозрительного участка.
Симптомы рака шейки матки проявляются в основном на поздних стадиях заболевания. К симптомам рака шейки матки относятся кровянистые выделения, кровотечение после полового акта и нерегулярные менструации. В запущенных случаях опухоль может быть обнаружена даже при осмотре. По мере прогрессирования рака шейки матки могут наблюдаться проблемы с мочеиспусканием, затруднения при дефекации и боли в ногах.
Один из симптомов рака шейки матки – кровотечение, неожиданно возникающее сразу после полового акта или на следующий день, называется “посткоитальным кровотечением”. Посткоитальное кровотечение является важной находкой и может быть ранним признаком рака шейки матки.
Генитальные бородавки, вызванные ВПЧ, не считаются признаком рака шейки матки. Ведь если некоторые типы ВПЧ вызывают генитальные бородавки, то некоторые типы вызывают изменения в клетках шейки матки у женщин. Тем не менее, необходимо провести детальное обследование и типирование ВПЧ в связи с возможностью выявления типов ВПЧ высокого риска при обнаружении генитальных бородавок. Для определения наличия ВПЧ-инфекции у человека берется мазок с шейки матки. По результатам обследования можно определить наличие или отсутствие ВПЧ-инфекции, а если есть, то и ее тип.
Симптомы рака шейки матки, особенно если он перешел в поздние стадии, можно суммировать таким образом;
- Подтекание мочи и фекалий из влагалища
- Боль в спине
- Боль в ногах
- Потеря аппетита
- Тазовая боль
- Опухшие ноги
- Снижение веса
- Усталость, слабость
- Боль в костях и переломы
КАКОВЫ ФАКТОРЫ РИСКА РАЗВИТИЯ РАКА ШЕЙКИ МАТКИ?
Среди причин возникновения рака шейки матки – роды, ранние половые контакты, наличие большого числа партнеров и курение. У 98% больных раком шейки матки выявлена ВПЧ-инфекция. Существует более ста типов ВПЧ, который обычно передается при половых контактах. Особенно часто 16-й и 18-й типы вызывают рак шейки матки, а 6-й и 11-й типы – бородавки на половых органах.
К факторам риска развития рака шейки матки относятся полигамия, начало половой жизни в возрасте до 20 лет, курение, слабая иммунная система, частые вирусные и бактериальные инфекции половых органов, многоплодие, низкий социально-экономический статус, дефицит витаминов С и А.
КАКОВЫ МЕТОДЫ ПРОФИЛАКТИКИ РАКА ШЕЙКИ МАТКИ?
Методы профилактики рака шейки матки можно перечислить следующим образом:
- Регулярно проходить медицинские осмотры
- Пройти вакцинацию против ВПЧ
- Отказ от курения и табачных изделий
- Укрепление иммунной системы
- Принимать меры предосторожности против заболеваний, передающихся половым путем
- Здоровое питание
- Принять меры предосторожности против ожирения
СТАДИИ РАКА ШЕЙКИ МАТКИ
Процесс, приводящий к раку шейки матки, развивается как CIN 1, CIN 2, CIN 3 и затем рак шейки матки. Спонтанная регрессия заболевания наблюдается у 70-90% на первой стадии, у 40-45% – на второй и у 30-35% – на третьей. У пациенток, не получающих никакого лечения, заболевание в течение нескольких лет переходит в прогрессирующий рак. На ранних стадиях нет необходимости удалять матку, и полное выздоровление может быть достигнуто путем частичного удаления шейки матки с помощью простых хирургических процедур, называемых LEEP и конизация. После лечения такие пациентки могут забеременеть и родить ребенка.
Стадии рака шейки матки можно перечислить следующим образом;
Стадия 0: аномальные клетки находятся в самом внутреннем слое шейки матки. Эта стадия также называется карциномой insutu.
Стадия I Раковые клетки обнаруживаются только в шейке матки. Размер опухоли может составлять от 3 мм до 4 см.
Стадия II A: Рак распространился за пределы шейки матки в верхние две трети влагалища, но не распространился на ткани вокруг матки.
Стадия II B: Рак распространился за пределы шейки матки на верхние две трети влагалища и ткани вокруг матки.
Стадия III A: Рак распространился на нижнюю часть влагалища, но не на стенки таза.
Стадия IIIB: Рак распространился на стенки таза или вторгся в мочеточники – трубы, соединяющие почки с мочевым пузырем, что препятствует прохождению мочи и приводит к увеличению почек.
IV стадия: рак распространился за пределы шейки матки в мочевой пузырь, прямую кишку или другие части тела.
ВАКЦИНА ПРОТИВ РАКА ШЕЙКИ МАТКИ
ВПЧ, передающийся при половых контактах, может вызывать рак шейки матки. Для защиты от ВПЧ рекомендуется вакцинировать против рака шейки матки девочек, мальчиков и взрослых в возрасте от 9 до 26 лет. Хотя три вакцины (9-валентная, 4-валентная и 2-валентная) получили одобрение FDA и используются в США, 9-валентная вакцина еще не поступила в нашу страну. 2-валентная вакцина содержит вирусоподобные частицы ВПЧ типов 16 и 18, которые чаще всего вызывают опухоли шейки матки, и обеспечивает иммунитет против этих типов, а 4-валентная вакцина защищает от бородавок, поскольку содержит вирусоподобные частицы ВПЧ типов 6 и 11, которые вызывают бородавки в дополнение к этим типам. Последняя вакцина, 9-валентная, содержит вирусоподобные частицы других ВПЧ высокого риска 31, 33, 45, 52 и 58 типов в дополнение к ВПЧ 6, 11, 16, 18 типов в 4-валентной вакцине и обеспечивает более высокий уровень защиты, поскольку обеспечивает иммунитет против большего числа типов ВПЧ, вызывающих рак шейки матки. Эти вакцины также обеспечивают определенный иммунитет против других типов ВПЧ в результате перекрестной реакции.
Для детей в возрасте от 9 до 15 лет достаточно 2 доз вакцины. Между первой и второй дозой вакцины должен быть интервал 6-12 месяцев. В возрасте от 15 до 26 лет рекомендуется вводить 3 дозы вакцины в 0, 1 и 6 месяцев. После 26 лет вакцинация не рекомендуется в связи с высокой вероятностью встречи с ВПЧ до этого возраста, однако в соответствующих случаях ее можно сделать, обсудив этот вопрос с врачом. Вакцина против ВПЧ вводится внутримышечно. Она может вводиться через плечо или бедро.
Вакцинация против рака шейки матки до того, как вы столкнетесь с ВПЧ, может предотвратить большинство случаев рака шейки матки. Помимо рака шейки матки, она также защищает от рака влагалища и вульвы. Вакцины против 4 и 9 типов могут предотвратить появление генитальных бородавок и рака анального отверстия у мужчин и женщин. Поскольку некоторые типы ВПЧ также связаны с раковыми заболеваниями, развивающимися в полости рта и горла, вакцина также обеспечивает защиту от этих видов рака. Центры по контролю и профилактике заболеваний (CDC) рекомендуют проводить плановую вакцинацию против ВПЧ мальчиков и девочек после 9 лет. Идеальное время для вакцинации против рака шейки матки – до начала половой жизни, то есть до контакта с вирусом ВПЧ. При инфицировании ВПЧ вакцина может оказаться не столь эффективной, как при вакцинации в рекомендуемое время.
КАК ДИАГНОСТИРУЕТСЯ РАК ШЕЙКИ МАТКИ?
Рак шейки матки на поздних стадиях может быть диагностирован при гинекологическом осмотре, а на ранних – при кольпоскопическом исследовании и биопсии, проводимой в результате выявления положительного результата теста на ДНК ВПЧ высокого риска или отклонений в мазке, которые являются скрининговыми тестами. При раке шейки матки, успешность лечения которого на ранних стадиях составляет 80-85%, биопсия также очень важна для диагностики заболевания и составления точного плана лечения.
Первым шагом при раке шейки матки является диагностика рака и определение его стадии. Для этого из шейки матки берется биопсия и проводится стадирование рака. Стадирование рака шейки матки определяется в зависимости от распространения рака в организме. Стадирование основывается на данных тазового и ректального обследования, а также рентгенологических исследований и возможных других диагностических тестов. Кроме мазков и биопсии, для диагностики рака шейки матки используются такие тесты, как;
ЧТО ТАКОЕ ИССЛЕДОВАНИЕ МАЗКА?
Анализ мазка – чрезвычайно простой и безболезненный метод скрининга рака. Женщинам очень важно сдавать мазок для профилактики рака шейки матки. Анализ мазка проводится двумя способами. При классическом способе взятые выделения наносятся на стекло и после определения с помощью специального спрея отправляются в лабораторию. При втором способе взятый материал переливается в специальную жидкость во флаконе. В таком виде он поступает в лабораторию, где проходит определенные этапы микроскопического исследования.
Всем женщинам старше 21 года, начавшим активную половую жизнь, необходимо провести исследование мазка. Если активная половая жизнь началась до этого возраста, рекомендуется проводить исследование мазка в течение первых трех лет с момента начала половой жизни. У пациенток с нормальными результатами анализа мазка, при отсутствии других факторов риска, достаточно проводить исследование каждые 3 года. Не следует прерывать тестирование даже в период менопаузы. После 65 лет исследование мазков можно прекратить с ведома врача, если до этого момента у пациентки было не менее трех нормальных результатов исследования мазков. Кроме того, если анализ мазка показывает подозрительную ситуацию, можно проводить исследование чаще или проводить дополнительные исследования.
Кольпоскопия: Это осмотр эпителия, выстилающего шейку матки, с помощью специального прибора, напоминающего бинокуляр. Рак шейки матки не начинается в один день. Разрушение клеток нарастает постепенно, с течением времени. Увидеть и проследить эти изменения можно с помощью кольпоскопического исследования. Если кольпоскопическое исследование оценивается вместе с мазком, то процент ошибок значительно снижается.
Эти тесты также используются для диагностики и стадирования рака шейки матки;
Ректовагинальное исследование; при этом исследовании одновременно осматриваются анус и влагалище. Это простое обследование органов малого таза, которое может быть выполнено в условиях смотровой комнаты. Выясняется, распространился ли рак за пределы шейки матки.
Компьютерная томография; КТ, называемая также компьютерной томографией, начинается с внутривенного введения рентгеноконтрастного вещества. Это вещество обеспечивает лучшую визуализацию внутренних органов на рентгеновских снимках.
МРТ (магнитно-резонансная томография); При этом исследовании используются магнитные радиоволны и компьютер для визуализации внутренних органов и тканей.
ПЭТ (позитронно-эмиссионная томография); радиоактивная глюкоза вводится в вену, и на ПЭТ определяются участки тела, где глюкоза расходуется в больших количествах. Раковые клетки более активны, чем нормальные, и потребляют больше глюкозы. Раковые клетки в этом тесте выглядят ярче.
Кроме того, может быть назначена рентгенография грудной клетки и анализ крови, чтобы определить, распространился ли рак на молочную железу или легкие.
КАК ЛЕЧИТСЯ РАК ШЕЙКИ МАТКИ?
Генитальные бородавки, вызванные инфекцией, вызванной вирусом ВПЧ, можно лечить прижиганием, замораживанием, хирургическим вмешательством или местным нанесением кремов. Исчезновение бородавки в результате такого лечения не означает, что она не появится вновь. У некоторых людей после лечения бородавки не появляются вновь, а у некоторых можно наблюдать образование бородавок через частые промежутки времени. При каждом новом образовании бородавки лечение необходимо повторить. Риск рецидива генитальных бородавок зависит от того, насколько сильна иммунная система. Известно, что при ВПЧ-вирусных инфекциях человек может спонтанно вывести вирус из организма без лечения.
При лечении рака шейки матки используются хирургическое вмешательство, лучевая терапия и методы химиотерапии как самостоятельно, так и в сочетании друг с другом. Если предраковое поражение (CIN 2-3) не перешло в глубину тканей, то участок шейки матки может быть определен с помощью кольпоскопии. Хирургическое удаление этого участка позволяет устранить зону, которая может стать раковой, и добиться высокой скорости выздоровления пациентки. При простом хирургическом вмешательстве пациентка может быть выписана в тот же день. Если рак стал инвазивным, то есть проник глубоко в ткани, то возможны два варианта лечения. В этом случае проводится “радикальная гистерэктомия” – обширная и сложная операция, которая займет много времени. При этом, поскольку раковые клетки захватили лимфатические узлы в области малого таза, они также удаляются. Альтернативным вариантом является химиорадиотерапия: раковые клетки в этой области сенсибилизируются к излучению с помощью химиотерапевтических препаратов, затем пациентке проводится радиотерапия и продолжается наблюдение. Если рак находится на поздней стадии, проводится химиотерапия, но процент излечения таких пациентов довольно низок.
ЧТО ТАКОЕ HPV, КАК ОН ПЕРЕДАЕТСЯ?
ВПЧ – это вирус, передающийся половым путем и способный вызывать рак шейки матки. ВПЧ (вирус папилломы человека), который встречается более чем у 95% женщин с диагнозом “рак шейки матки”, – это вирус, поражающий область половых органов и распространяющийся при контакте. Он вызывает появление бородавок в области половых органов, особенно часто у женщин, и рак шейки матки, наружных половых органов и репродуктивного тракта. Вирус ВПЧ достаточно коварен и может распространяться в течение нескольких месяцев без каких-либо симптомов. Симптомы вируса называют “немой инфекцией”, если они проявляются через несколько месяцев или лет после заражения.
Вирус ВПЧ может вызывать генитальные бородавки у мужчин и женщин, рак шейки матки у женщин и рак полового члена у мужчин. ВПЧ – инфекция, к которой следует относиться серьезно, – может контролироваться иммунной системой некоторых людей. Не следует забывать, что вирус, который не может быть нейтрализован иммунной системой, может годами сохранять свое существование без каких-либо симптомов. Человек может годами переносить инфекцию без каких-либо жалоб. Это не препятствует распространению заболевания, и вирус может продолжать передаваться при половых контактах.
Типы вируса ВПЧ подразделяются на группы риска в зависимости от вероятности возникновения рака шейки матки. Типы, вызывающие большее количество бородавок, относятся к группе низкого риска развития рака шейки матки. Поэтому не факт, что каждая генитальная бородавка перерастет в рак шейки матки.
ЛЕЧЕНИЕ ГЕНИТАЛЬНОГО ГЕРПЕСА
Бородавки, вызванные инфицированием вирусом ВПЧ, можно лечить с помощью прижигания, замораживания, хирургического вмешательства или местного применения кремов. Исчезновение генитальной бородавки в результате такого лечения не означает, что она не возникнет вновь. Хотя у некоторых людей после лечения генитальные бородавки не рецидивируют, у некоторых людей образование генитальных бородавок может наблюдаться вновь через частые промежутки времени. При каждом новом образовании генитальной бородавки лечение необходимо повторить. Известно, что при ВПЧ-вирусных инфекциях человек может самопроизвольно вывести вирус из организма без лечения.
Рак шейки матки после лечения
В зависимости от стадии рака и вида лечения рак шейки матки может не исчезнуть или появиться вновь после лечения. Новый рак может развиться и в другом месте организма. Вот почему регулярные осмотры и исследования мазков важны даже после окончания лечения. В первые несколько лет после лечения врач может попросить вас чаще сдавать мазки. Это делается для того, чтобы убедиться, что все раковые клетки исчезли. Могут потребоваться и другие анализы и процедуры. Ваш врач вместе с вами составит план необходимых обследований и после окончания лечения.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ О РАКЕ ШЕЙКИ МАТКИ
Заразен ли рак шейки матки?
ВПЧ является основной причиной развития рака шейки матки. Этот вирус был обнаружен у 99,7% пациенток. Хотя рак шейки матки не заразен, ВПЧ является наиболее распространенным вирусом, передающимся половым путем. Отмечается высокий уровень контагиозности – 60% после полового контакта с людьми, имеющими бородавки в области гениталий.
ВПЧ передается в основном половым путем и с очень низкой частотой при контакте с руками, туалетными и личными гигиеническими принадлежностями. При наличии нескольких партнеров риск передачи ВПЧ высок.
Каковы первые симптомы рака шейки матки?
Среди первых симптомов рака шейки матки можно выделить такие признаки, как кровянистые выделения, кровотечение после полового акта и нерегулярные менструальные кровотечения.
Где возникает боль при раке матки?
Рак шейки матки может проявляться такими симптомами, как боли в спине, ногах, тазу, костях. Кроме того, могут наблюдаться боль и чувство сдавливания в нижней части живота, боль при половом акте, потеря веса.
Можно ли пальпировать рак шейки матки?
При мануальном исследовании врач помещает два пальца во влагалище, а другую руку кладет на нижнюю часть живота. Таким образом, можно прощупать органы и любые пальпируемые образования.
На какой стадии рака матки проявляются симптомы?
Симптомы рака шейки матки появляются на поздних стадиях заболевания. На поздних стадиях опухоль можно увидеть при осмотре. По мере прогрессирования рака шейки матки могут наблюдаться проблемы с мочеиспусканием, затруднения при дефекации, боли в ногах.
В каком возрасте начинается рак шейки матки?
Рак шейки матки, который обычно возникает в возрасте около 50 лет в период менопаузы, в последнее время стал встречаться и у молодых женщин. Хотя рак молочной железы занимает первое место в списке распространенных онкологических заболеваний у женщин, рак шейки матки по своим жизнеугрожающим характеристикам может превзойти рак молочной железы.
Что видно при исследовании мазка? Можно ли обнаружить рак шейки матки?
Исследование мазка проводится с целью выявления изменений во влагалище до того, как они перерастут в рак. Таким образом, женщина может легко получить лечение до того, как она достигнет стадии рака. Женщинам необходимо сдавать мазки в плановом порядке, определяемом гинекологами.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ КИСТЫ ЯИЧНИКОВ?
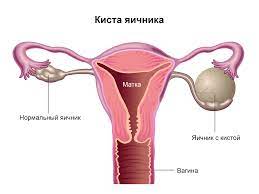
Частота встречаемости кист яичников варьирует в зависимости от возрастных групп. Различные кисты встречаются в подростковом, репродуктивном и климактерическом возрасте. Кисты яичников, наблюдаемые в зависимости от возрастных групп, можно классифицировать следующим образом:
Функциональные кисты: Кисты в период между 13-18 годами, называемый подростковым периодом, в большинстве случаев являются функциональными кистами, обычно не требуют хирургического вмешательства и со временем исчезают. Поскольку в этот период гормональный баланс организма еще не установился, в организме могут образовываться временные кисты. Функциональные кисты, как правило, требуют наблюдения. Поскольку, даже если это маловероятно, из-за веса, создаваемого кистой, может произойти перекрут яичника, называемый “торсией яичника”, или разрыв кисты. Кроме такого наблюдения, никакого медикаментозного лечения не требуется. Функциональные кисты могут наблюдаться и при бесплодии.
Опухоли половых клеток: Это опухоли яичников, которые могут наблюдаться в подростковом и первом репродуктивном возрасте. Если при некоторых типах, определяемых при диагностике, достаточно хирургического вмешательства, то при некоторых типах в дополнение к операции может потребоваться химиотерапевтическое лечение. Они представляют собой солидные кистозные образования, которые чаще всего проявляются в виде солидных органов. Определить, является ли это функциональная киста или солидное кистозное образование, можно легко с помощью ультразвукового контроля.
Кисты лютеинового тела: Это кисты, наблюдаемые во время менструации. Она возникает при овуляции (яйцеклетке). Она почти полностью исчезает, иногда может вызвать кровотечение.
Дермоидные кисты: Часто встречаются во время беременности. Они представляют собой кисты, содержащие эктодермальные ткани, такие как кожа, волосы, жир, кости, зубы во внешней структуре организма. Дермоидные кисты могут очень быстро создавать тяжесть в теле пациентки и превращаться в кисты, требующие срочной операции с торсией, т.е. поворотом яичника. В прошлом при перекруте удаляли все яичники, но сегодня перекрут яичника можно восстановить и удалить вызвавшее его кистозное образование. В большинстве случаев при использовании этого метода удается восстановить функции яичников. Если нет серьезных задержек, то эту проблему можно решить без удаления яичников.
Шоколадные (эндометриотические) кисты: Эндометриотические кисты, в народе называемые шоколадными, получили такое название из-за того, что их структура напоминает растопленный шоколад. Они являются наиболее распространенными особыми кистами в репродуктивном периоде. На самом деле шоколадные кисты являются образованием эндометриоза в яичнике. Шоколадные кисты встречаются у каждой десятой женщины в фертильном периоде. При таких кистах хирургическое вмешательство проводится гораздо более избирательно. Потому что шоколадные кисты в основном встречаются у женщин в фертильном периоде. Другими словами, пациентки планируют стать матерью. По этой причине при шоколадных кистах хирургическое вмешательство сразу не рекомендуется. Однако операция необходима, если пациентка жалуется на боль. Если киста очень большая, например, размером 9-10 см, то операцию следует предпочесть, если она больше не вызывает давления на таз. Однако, например, если размер кисты составляет 5 см, на УЗИ нет подозрительных нарушений, и она представляет собой однородную шоколадную кисту, то за ней ведется наблюдение. Потому что эти кисты могут рецидивировать, если не будет проведена очень удачная операция. А во время операции может снизиться овариальный резерв. Поэтому в зависимости от вида кисты на УЗИ следует избегать операции и по возможности наблюдать за ней, особенно если у пациентки есть желание иметь детей. Однако если CA-125, маркер опухоли, взятый из крови, показывает повышение в крови, то операция у таких пациенток необходима. Риск развития рака при шоколадных кистах в репродуктивном возрасте невысок. С увеличением возраста риск перерождения шоколадных кист в опухолевые возрастает.
КАКОВЫ СИМПТОМЫ КИСТЫ ЯИЧНИКА?
Наиболее важным симптомом, особенно при кистах в молодом возрасте, являются боли в паху и нерегулярность менструаций. При шоколадных кистах могут наблюдаться жалобы на невозможность иметь детей, особенно в фертильный период, очень болезненные менструации, наступающие позже, боли во время полового акта у сексуально активных женщин. Иногда при вовлечении в процесс кишечника может возникать болезненная дефекация. Могут наблюдаться затруднения при мочеиспускании. Могут возникать различные жалобы на органы, расположенные в области малого таза, называемой тазовой областью. Однако наиболее частым симптомом является невозможность зачать ребенка. Кроме того, очень часто возникают длительные боли в паху. При опухолевых кистах в менопаузе встречаются такие симптомы, как вздутие живота, частое мочеиспускание из-за давления на органы в данной области, жалобы на запоры, начало вагинального кровотечения в менопаузе, иногда называемого “постменопаузальным”, и такие жалобы, как боли в животе, особенно при опухолях больших размеров. Кроме того, могут встречаться кисты, которые не дают никаких симптомов и выявляются случайно при рутинном контроле.
КАК ДИАГНОСТИРУЮТСЯ КИСТЫ ЯИЧНИКОВ?
Первым диагностическим инструментом является физикальное обследование. При физикальном исследовании брюшная полость осматривается вручную. Выявляются болезненные участки. Затем наиболее важным инструментом визуализации является ультрасонография. При ультразвуковом исследовании оцениваются размеры, внешний вид и структура опухоли. У необходимых пациентов проводится анализ крови на опухолевые маркеры или МРТ. МРТ назначается не при каждой кисте. Ее назначают в подозрительных случаях. При подозрении на рак может быть применена магнитно-резонансная томография (МРТ), чтобы увидеть, распространилась ли опухоль на другие области. Кроме того, важную роль в постановке диагноза играют анализы на наличие опухоли в крови. В яичниках, особенно при серозных раках и шоколадных кистах, CA-125, CA-19-9 при муцинозных опухолях яичников, альфа-фетопротеин (AFP), бета-ХГЧ при герминогенных опухолях, наблюдаемых в раннем возрасте, также может быть полезен анализ крови на ЛДГ при некоторых специфических опухолях.
Хотя риск развития рака в молодой возрастной группе невелик, при наличии любой сложной кисты необходимо сначала определить, есть ли рак. Поэтому при всех нефункциональных кистах в молодом возрасте обычно рекомендуется хирургическое вмешательство. Функциональные кисты остаются под наблюдением. Если пациентка находится в менопаузе или близка к менопаузе, то есть кисты, наблюдаемые после 40 лет, – это кисты, которые несколько ближе к возможности развития рака. Особенно у пациенток в менопаузе оцениваются такие факторы, как регулярность структуры кисты на ультразвуковом изображении. Как правило, если киста обнаружена в период менопаузы и не рассматривается как функциональная, рекомендуется хирургическое вмешательство.
В ЧЕМ ЗАКЛЮЧАЕТСЯ ЛЕЧЕНИЕ КИСТ ЯИЧНИКОВ?
При наличии кисты оцениваются результаты УЗИ, жалобы пациента, лабораторные исследования и, при необходимости, другие методы визуализации в сочетании с протоколом наблюдения или хирургическим вмешательством. Существуют результаты УЗИ, которые определяют, является ли киста доброкачественной или злокачественной. К ним относятся: размер кисты, структура окружающей ткани, называемой стенкой кисты, наличие дезорганизованных тканей, таких как сосочковые выпячивания и узловые структуры. Например, если имеются солидные участки, т.е. осложненные кисты, то это должно вызывать особое подозрение. В этих случаях, как правило, предпочтение следует отдавать хирургическому вмешательству, а во время операции проводить патоморфологическое исследование. Если киста оказывается доброкачественной, то удаляется только киста и никаких других вмешательств не проводится. Если же при патологоанатомическом исследовании киста оказывается злокачественной, то в зависимости от возраста пациентки и того, планирует ли она иметь детей или нет, следует провести профилактическую или онкологическую операцию.
Если киста не требует хирургического вмешательства и необходимо только наблюдение, то контроль проводится с интервалом в 3 или 6 месяцев. В случае необходимости хирургического вмешательства применяются закрытые методы, такие как лапароскопия, роботизированная или открытая хирургия, в зависимости от размера образования, его расположения, наличия в обоих яичниках, а также желания пациентки иметь ребенка.
Если пациентку очень смущает вопрос о том, является ли данная находка опухолью или нет, то сначала можно применить закрытый лапароскопический метод, чтобы увидеть структуру образования. Однако если речь идет о большом образовании, если в первую очередь рассматривается наличие опухоли и если она распространена, т.е. имеется образование в обоих яичниках, то предпочтение отдается открытой операции.
При лечении функциональных кист применяется протокол наблюдения. За кистами пациенток, не имеющих клинических проявлений, болевых и других жалоб, можно наблюдать длительное время. У таких пациентов пациентка информируется только о риске перекрута яичника, т.е. о риске перекрута, а вмешательство проводится в случае крайней необходимости. Функциональные кисты или кисты, которые не считаются раковыми, часто исчезают спонтанно. Если же они не исчезают, а начинают увеличиваться в размерах, то их удаляют из-под наблюдения и начинают хирургическое лечение.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ
- Препятствует ли киста яичника зачатию?
В зависимости от типа кисты яичников могут быть препятствием для зачатия. Как правило, препятствие к зачатию исчезает после успешного хирургического удаления не слишком развитых (неосложненных) кист яичников.
- Что делать пациентам с кистами, находящимся под наблюдением, в экстренной ситуации?
Если пациент знает, что у него есть киста, врач сообщает ему, с какой стороны она находится – справа или слева. Однако боль в этой области может отражаться с обеих сторон. Поэтому при любой боли в области живота, например, особенно при сильной боли, которая периодически появляется и исчезает, следует в первую очередь обратиться к врачу, который следит за кистой, но если до него дозвониться не удается, то обязательно нужно обратиться в отделение неотложной помощи. В случае обращения к другому врачу следует сообщить ему результаты анализов и снимки УЗИ. Кроме того, при появлении боли следует прекратить пероральное питание. Если боль сопровождается тошнотой, рвотой или вздутием живота, это говорит о раздражении брюшины. Другими словами, это означает, что киста вступила в контакт с брюшной полостью. Это опять-таки симптомы, при которых необходимо срочно обратиться в медицинское учреждение.
- Вызывает ли киста яичника кровотечение?
Некоторые кисты яичников в зависимости от их расположения и размеров могут сопровождаться кровотечением.
- Как определить наличие кисты в яичниках?
Ультразвуковое исследование обычно дает подробную информацию о наличии кист.
- Вызывает ли киста яичника боль?
Да, одним из наиболее частых признаков кисты яичника является боль.
- Что вызывает кисту яичника?
Кисты яичников могут развиваться по многим причинам. Наиболее частой причиной является гормональный дисбаланс в организме. Кроме того, кисты яичников могут развиваться в результате различных инфекций яичников, радиационного облучения, опухолей и некоторых клеточных нарушений.
- Каковы симптомы шоколадной кисты?
При шоколадных кистах могут наблюдаться жалобы на невозможность иметь детей, особенно в детородный период, очень болезненные менструации, боли при половом акте у сексуально активных женщин. Иногда при вовлечении в процесс кишечника может возникать болезненная дефекация. Может наблюдаться затрудненное мочеиспускание. Могут возникать различные жалобы на органы, расположенные в области малого таза, называемой тазовой областью. Однако наиболее частым симптомом является невозможность зачать ребенка. Кроме того, часто возникают длительные боли в паху.
- Что вызывает шоколадную кисту?
Прямых причин возникновения шоколадных кист не существует, но есть факторы, повышающие риск их возникновения. Наиболее важными из них являются генетические и экологические факторы. Также киста может развиваться по разным причинам, таким как слабая иммунная система, затекание менструальной крови в брюшную полость, дифференцировка тканей.
- Вызывает ли шоколадная киста кровотечение?
При наличии шоколадной кисты кровотечение обычно отсутствует.
- Где шоколадная киста вызывает боль?
Он может вызывать боль в паху во время менструации или боль в области влагалища во время полового акта у сексуально активных женщин.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
Что такое роботизированная хирургия при гинекологических заболеваниях?
Параллельно с развитием технологий во всем мире происходят очень важные изменения в хирургических методах и хирургических техниках. Основной целью этих разработок является повышение безопасности операций, снижение частоты осложнений и минимизация нежелательных результатов, связанных с хирургическим вмешательством. Наиболее важным достижением в этой области является то, что операции, которые раньше выполнялись открытым способом, теперь можно проводить малоинвазивными методами, то есть закрытым способом. Новейшей технологической точкой в закрытых операциях являются роботизированные хирургические системы. Роботизированная хирургия, проще говоря, представляет собой закрытую операцию, выполняемую с помощью роботизированных манипуляторов, управляемых хирургом. По сравнению с традиционными лапароскопическими операциями роботизированная система имеет множество преимуществ.
В каких случаях применяется роботизированная хирургия при гинекологических заболеваниях?
Не существует ситуации, при которой роботизированная хирургия не должна применяться при гинекологических заболеваниях. Роботизированная хирургия может быть выполнена во всех случаях, когда целесообразно применение лапароскопической хирургии. Роботизированная хирургия может применяться в хирургии рака матки, шейки матки и яичников, при удалении фибромиомы, гистерэктомии, эндометриозе, кистах яичников, недержании мочи и опущении матки.
Однако технически существуют ситуации, когда преимущество закрытой операции над открытой снижается. В этих случаях вместо роботизированной операции может быть предпочтительна открытая.
Как применяется роботизированная хирургия при гинекологических заболеваниях?
Подготовка пациента при роботизированной хирургии очень похожа на традиционный лапароскопический метод. После укладки пациентки на операционный стол и проведения анестезии ее укладывают в гинекологическое смотровое положение с подставками для ног. Затем в брюшную полость через крошечный разрез, расположенный примерно на 3 см выше пупка, вводится специальная игла, и брюшная полость раздувается углекислым газом. При достижении давления около 15 мм рт. ст. троакар (металлическая трубка или ножны, через которые вводятся и выводятся хирургические инструменты) вводится в брюшную полость через 7-миллиметровый разрез, сделанный на 3 см выше пупка. Камера роботизированной системы продвигается в брюшную полость через первый введенный троакар, и получается первое изображение органов в брюшной полости. После этого операционный стол переворачивается под углом примерно 35 градусов. Для того чтобы пациент не соскользнул со стола, ноги фиксируются на подставках для ног, а на плечи надеваются плечевые упоры. В зависимости от типа выполняемой операции в брюшную полость под контролем первой введенной камеры вводится столько троакаров, сколько роботов будет оперировать. Троакары обычно устанавливаются в брюшную полость по прямой линии или в виде небольшого полумесяца, при этом расстояние между двумя троакарами должно составлять не менее 8 см. После установки всех троакаров через соответствующие троакары в брюшную полость вводятся роботизированные инструменты, которые должны быть использованы, и, наконец, инструменты подключаются к роботизированным манипуляторам, и пациент готов к операции.
Миомэктомия Роботизированная система дает большие преимущества при хирургическом лечении фибромиомы – проблемы, которая встречается у значительного числа женщин репродуктивного возраста. Наиболее важным этапом в хирургии фибромиомы закрытым методом является плотное и многослойное закрытие разрезов в матке после удаления фибромиомы. Невозможность закрыть разрезы в матке после удаления фибромиомы повышает риск разрыва матки при последующих беременностях. При миомэктомии, выполняемой с помощью роботизированной системы, поскольку роботизированные манипуляторы могут имитировать движения запястья по всем осям, ушивание разрезов становится гораздо проще и надежнее.
Гистерэктомия (гистерэктомия): Все операции по гистерэктомии, подходящие для закрытой хирургии, могут быть выполнены с помощью роботизированной системы. Благодаря трехмерному и высококачественному изображению снижается вероятность возникновения нежелательных ситуаций, которые могут возникнуть во время операции гистерэктомии. После рассечения связок матки роботизированной системой верхняя часть влагалища разрезается по всему периметру, и матка, освобожденная от всех связей, выводится из влагалища. Место разреза во влагалище также закрывается роботизированным или вагинальным способом.
Эндометриоз Эндометриоз – это заболевание, затрагивающее матку, трубы, яичники и даже толстую кишку и вызывающее серьезные спайки, потерю функции и боли в этих органах. Хирургия эндометриоза требует опыта, а особенно передовая хирургия эндометриоза – длительной операции. Значительные преимущества в этом случае дает роботизированная хирургия, которая требует высокой концентрации внимания в течение длительного времени и раскрытия спаек в важных органах без их повреждения.
Каковы преимущества роботизированной хирургии при гинекологических заболеваниях?
Преимущества роботизированной хирургии Da Vinci для пациента можно перечислить следующим образом:
- Поскольку операция проводится через маленькие разрезы, количество кровотечений у пациента меньше
- Поскольку размер разреза меньше, чем при открытой операции, пациент испытывает меньше боли
- Сокращение времени заживления ран
- Сокращение времени пребывания пациента в стационаре
- Частота осложнений ниже, чем при открытых операциях
- Пациент возвращается к повседневной и социальной жизни в более короткие сроки
- Поскольку восстановительный период короче, это позволяет начать онкологическое лечение раньше после операции
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ О РОБОТИЗИРОВАННОЙ ХИРУРГИИ ПРИ ГИНЕКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЯХ
Чем роботизированная хирургия отличается от открытых и закрытых методов при гинекологических заболеваниях? Почему при гинекологических заболеваниях предпочтение отдается роботизированной хирургии?
Роботизированная хирургия имеет определенные преимущества как перед открытыми операциями, так и перед традиционными закрытыми методами (лапароскопия).
Преимущества перед открытой операцией:
- Кровопотеря во время операции значительно меньше
- Частота осложнений ниже
- Более короткий период восстановления, более короткое пребывание в стационаре
- Послеоперационная боль меньше
- После операции он быстрее возвращается к нормальной жизни.
- Хирургический шрам значительно меньше
Преимущества перед традиционной лапароскопической хирургией:
- Хирург выполняет операцию в более удобном положении, сидя на консоли. Это позволяет хирургу продолжать операцию, не уставая и не теряя концентрации даже при длительных операциях по удалению рака. При классических лапароскопических операциях хирург испытывает гораздо большие физические трудности, испытывает усталость, физическую боль и потерю концентрации при длительных операциях.
- При использовании роботизированной системы хирург видит операционное поле в трехмерном изображении и в высоком качестве. При классическом лапароскопическом методе, поскольку операция проводится с помощью двухмерного экрана, ощущение глубины исчезает, и в некоторых случаях это может вызвать проблемы.
- В роботизированной системе роботизированные руки пациента сконструированы таким образом, чтобы с высокой точностью имитировать движения пальцев и запястий хирурга. Таким образом, во время операции можно с высокой точностью использовать хирургические инструменты с возможностью движения на 360 градусов. Это невозможно при классической лапароскопии.
- В роботизированной системе хирург сам может управлять всеми инструментами и камерой пациента, то есть той областью, в которой он работает, по своему усмотрению. При классической лапароскопии хирург может одновременно управлять только двумя инструментами. Камерой и инструментом ассистента управляет другой человек. Поэтому успех операции зависит как от хирурга, так и от ассистента.
- Элементы управления роботизированной системы полностью исключают дрожание рук хирурга, обеспечивая отсутствие вибраций и плавность работы с инструментами.
Каков процесс восстановления после роботизированной хирургии?
При роботизированной хирургии используются инструменты диаметром 7 мм, а роботизированные операции выполняются в среднем через 4 разреза диаметром 7 мм. Поэтому восстановительный период после роботизированных операций чрезвычайно короткий.
Существуют ли риски при роботизированной хирургии гинекологических заболеваний?
Риски, характерные для роботизированной хирургии, по сравнению с традиционным лапароскопическим методом при гинекологических заболеваниях отсутствуют. Хотя возможны технические сбои в работе роботизированной системы, они встречаются крайне редко, и в таких случаях операцию можно продолжить традиционным лапароскопическим методом. Другими словами, риски, которые могут возникнуть при стандартном хирургическом вмешательстве, справедливы и для роботизированной хирургии.
Можно ли применять роботизированную хирургию при гинекологических заболеваниях у каждой пациентки?
Роботизированная хирургия может быть выполнена во всех случаях, которые подходят для обычной лапароскопической хирургии. Поскольку некоторые состояния могут стать препятствием для проведения закрытой операции, роботизированная хирургия в этих случаях также не подходит. К таким ситуациям относятся:
- Наличие у пациента медицинских показаний, препятствующих проведению закрытой операции (внутричерепные образования, при которых повышение внутричерепного давления может быть опасным, тяжелые заболевания легких и сердца и т.д.)
- Можно привести примеры, когда планируемое к операции заболевание не подходит для закрытой операции (например, рак яичников с внутрибрюшным диффузным заболеванием, образование или опухоль, занимающая большую площадь в брюшной полости)
Сколько дней в больнице после роботизированной операции?
Продолжительность пребывания в стационаре при роботизированной хирургии значительно меньше по сравнению с открытой. Учитывая, что сегодня с помощью роботизированной хирургии можно выполнять и сложные онкологические операции, длительность пребывания пациента в стационаре варьируется в зависимости от заболевания, общего состояния пациента и выполняемой роботизированной процедуры. Обычно продолжительность пребывания в стационаре составляет 1 ночь при операциях по удалению фиброидов и гистерэктомии и 2 ночи при операциях по удалению рака матки.
Возникает ли боль после операции?
Болевые ощущения после роботизированной операции значительно меньше, чем после открытой операции. Боль обычно ощущается в течение короткого времени в местах введения троакаров. Ее можно купировать с помощью несильных обезболивающих препаратов.
Необходимо ли оставаться в реанимации после операции?
Необходимость в интенсивной терапии после роботизированной хирургии зависит от общего состояния пациента, тяжести заболевания и проведенной процедуры. Как правило, необходимость в интенсивной терапии после роботизированной хирургии отсутствует, если нет других показаний.
Каковы показатели использования роботизированной хирургии при гинекологических заболеваниях?
Особенно в Северной Америке роботизированная хирургия находит все большее применение в хирургическом лечении гинекологических заболеваний. Примерно 30-40% всех закрытых гистерэктомий выполняется роботизированным методом. В результате быстрого распространения роботизированных хирургических систем в Европе с годами уменьшается количество операций лапароскопической гистерэктомии и увеличивается количество операций роботизированной гистерэктомии.
На что следует обратить внимание пациентам после роботизированной операции?
Никаких особых проблем, на которые пациенты должны обратить внимание после роботизированной операции, не существует. Через несколько дней после операции пациенты могут принимать ванну. Особого ухода за швами не требуется, и снимать швы пациентам не нужно, так как обычно используются рассасывающиеся материалы.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
Что такое конизация леп?
Leep-конизация – это хирургическая процедура, выполняемая как для диагностики, так и для лечения в случаях обнаружения CIN 2, CIN 3 (HSIL) у пациенток, проходящих кольпоскопию/биопсию в ходе планового гинекологического обследования с целью выявления клеток-предшественников рака шейки матки. Процедура Leep-конизации может использоваться для подтверждения диагноза и одновременно применяться для лечения. Пациенты задают такие вопросы, как “Что такое конизация Leep?”, “Что такое операция Leep?”, “Что такое процедура Leep?”, “Что такое лечение Leep?”, “Что такое операция Leep?”, “Что означает Leep?”, “Что такое конизация Leep?”, “Что такое процедура Leep?”. Процедура конизации может проводиться двумя способами: горячей конизацией (LEEP) и холодной конизацией. В мире и в нашей стране предпочтение отдается горячей конизации (LEEP).
При горячей конизации (LEEP) под анестезией специальным инструментом производится разрез шейки матки в намеченной области. При холодной конизации разрез выполняется скальпелем. Операция холодной конизации в основном предпочтительна для людей с диагностированной ранней стадией рака шейки матки.
При каких заболеваниях применяется леп-конизация?
Используется ли процедура конизации Leep только при лечении рака шейки матки или клеток-предшественников? Этот вопрос задают пациенты. Процедура Leep-конизации – это процедура, обычно применяемая для лечения шейки матки от гинекологических болей. Она может применяться при раке шейки матки, а при наличии патологии шейки матки – для уменьшения шейки матки в соответствии с жалобами пациентки или для удаления больного участка с целью восстановления шейки матки. Однако при раке шейки матки обычно используется процедура конизации лепса.
Для чего проводится конизация лепса?
- Операция Leep-конизации обычно выполняется как для диагностики, так и для лечения клеточных изменений шейки матки, вызванных ВПЧ-инфекцией. Она выделяется как хирургическое вмешательство, особенно при диагнозах CIN 2 и CIN 3.
- У пациенток, у которых при подозрении на рак шейки матки была проведена биопсия, для уточнения диагноза при наличии сомнений в диагнозе может быть выполнена операция конизации лепестков.
- У пациенток, которым была проведена биопсия шейки матки и диагностирован рак шейки матки, нет необходимости в проведении операции конизации лепса. Тем не менее, конизация лепса может быть рассмотрена у пациенток с диагностированной ранней стадией рака шейки матки. Холодная конизация матки обычно предпочтительна для пациенток с ранней стадией рака матки.
- Поскольку leep может быть использован на ранних стадиях рака шейки матки, операция leep-конизации может быть проведена и в тех случаях, когда видны аномальные клетки, такие как CIN.
- У пациенток с распространенным раком шейки матки достаточно выполнить процедуру биопсии. Методика LEEP не используется, если диагноз разреза установлен по результатам биопсии.
- Решение о проведении процедуры LEEP принимается в зависимости от результатов кольпоскопической биопсии. После удаления участка, определенного процедурой LEEP, он направляется в патологоанатомическое отделение.
Как выполняется операция конизации лепса?
- Если в биоптате шейки матки обнаружены аномальные клетки и принято решение о проведении конизации шейки матки, то эта процедура проводится под общим наркозом.
- Конизация пиявками выполняется на гинекологическом смотровом столе.
- Поскольку пациент будет получать анестезию, целесообразнее проводить процедуру в условиях операционной.
- Конизация шейки матки – это хирургическая процедура. После того как пациентка укладывается на гинекологический стол, гинеколог делает видимой шейку матки с помощью вагинального спекулятора, используемого для осмотра стенок влагалища и влагалищной полости.
- Хирургические границы определяются путем окрашивания шейки матки специальным раствором.
- Пораженная часть шейки матки удаляется хирургическим путем. Поскольку она удаляется в форме конуса, процедура называется Leep-конизация.
- Удаленный хирургическим путем участок отправляется в патологоанатомическую лабораторию для проверки на наличие аномальных изменений клеток.
Часто задаваемые вопросы о конизации Leep
Какова цена операции конизации Липа?
Такие вопросы, как “Сколько стоит конизация Leep?”, “Сколько стоит конизация Leep?”, задают пациенты. Стоимость Leep-конизации может варьироваться в зависимости от ценовой политики врача и больницы, в которой будет проводиться операция, а также от материала, который будет использоваться во время Leep-конизации. Операция конизации пиявки – это безопасная процедура, выполняемая опытными гинекологами и акушерами. Прежде чем ответить на вопрос, сколько стоит операция Leep conisation, необходимо выбрать врача, провести предварительное обследование перед процедурой и определить “дорожную карту” для оптимального решения проблемы.
Бывает ли нарушение менструального цикла после применения препарата Leep?
Такие вопросы, как “Как будет проходить менструация после конизации Леепа?”, “Когда и как наступит первая менструация после конизации Леепа?”, “Будут ли нарушения менструального цикла после конизации Леепа?”, являются одними из самых любопытных тем. После операции Leep-конизации нормальный менструальный ритм не изменяется. Однако в первом менструальном цикле после конизации Липа количество и продолжительность кровотечений могут быть несколько выше. В случае обильных кровотечений необходимо обратиться к врачу.
Существует ли подходящее время для проведения операции конизации лепты?
- Операция конизации подвздошной кости может быть выполнена в любое время, однако для удобства врача и пациентки ее рекомендуется проводить сразу после окончания менструального цикла. Выполнение операции в кратчайшие сроки после окончания менструации дает пациентке некоторые преимущества.
- Период без кровотечения в течение 20-25 дней после операции конизации лепса обеспечивает лучшее заживление тканей. Период заживления после операции без кровотечения может ускорить процесс заживления тканей. Если операция leep проводится в период, близкий к менструации, количество кровотечений увеличивается, а заживление происходит позже. Это ухудшит качество жизни пациента.
- Проведение операции по конизации лепса во время менструального кровотечения также может представлять опасность с точки зрения инфицирования.
Как долго длится восстановительный период после операции конизации Липа?
Восстановление после операции Leep занимает примерно 4-6 недель.
Что показывает результат патологии Leep conisation?
- Патологическая оценка после процедуры конизации Leep сравнивается с результатами биопсии. Проверяется, совпадает ли патология участка, удаленного в ходе процедуры конизации Leep, с результатами биопсии.
- Проверяется глубина поражения и нормальность хирургического края. В глубине ткани проверяется наличие раковых клеток.
- Проверяется, свободен ли хирургический край для непрерывности поражения. Если хирургический край чист, выполняется адекватная операция.
- Результат патологии конизации лепса показывает, правильно ли поставлен диагноз и адекватно ли лечение.
- Патология также имеет решающее значение для определения пути лечения на более поздних стадиях.
На что следует обратить внимание после операции конизации лепестков?
- Пациент может встать в тот же день после операции leep. Поскольку операция проводится под общей анестезией, пациент может вернуться к общественной жизни после 1-2-часового отдыха.
- В течение 1-2 дней после операции конизации лепса не следует повышать внутрибрюшное давление. Особенно важно избегать напряжений в туалете.
- Восстановительный период после операции Leep длится примерно 4-6 недель. В этот период не следует вступать в половые контакты.
- Важно уделять внимание гигиеническим условиям, чтобы избежать заражения.
- После операции конизации лепса может наблюдаться точечное кровотечение, что не является признаком проблемы. Однако в случае фрагментарного или обильного кровотечения необходимо обратиться к врачу.
- Ограничений по приему ванн после операции Leep нет.
Сколько дней длится кровотечение после операции конизации Липа?
Такие вопросы, как “Как долго длится кровотечение после операции конизации по Leep?”, “Будет ли кровотечение после конизации по Leep?”, “Как долго длится кровотечение после Leep?”, являются одними из тех, которые интересуют пациентов.
После операции конизации лепса кровотечение может отсутствовать. Если после операции возникает кровотечение, то оно обычно имеет вид пятен. Точечные кровотечения следует считать нормальным явлением. Такое кровотечение может продолжаться в течение 15 дней.
После процедуры конизации лепса могут наблюдаться выделения, обусловленные отслоением тканей. Главное, чтобы выделения не были инфицированы. Необходимо соблюдать гигиенические условия.
Когда можно вступать в половые отношения после Leep?
В течение 4-6 недель, которые являются периодом восстановления после операции конизации лепса, половых контактов быть не должно. Перед началом половой жизни врач должен проверить и затем принять решение. .
Может ли наступить беременность после операции конизации лепса?
Такие вопросы, как “Будет ли беременность после Leep?”, “Будет ли беременность после Leep?”, “Беременность после конизации Leep”, являются одними из самых любопытных. Операция Leep-конизация не проводится беременным женщинам. После операции конизации лепса проблем с беременностью не существует. Несмотря на отсутствие заболеваний, препятствующих беременности, существует риск преждевременных родов у тех, кто перенес операцию конизации лепса. Хотя после процедуры leep этот риск невелик, риск преждевременных родов может возникнуть из-за укорочения шейки матки.
Возникает ли рецидив после конизации лепса?
Пациенты интересуются, можно ли проводить операцию конизации Леепа второй раз. При необходимости операция конизации пиявки может быть проведена несколько раз.
ВПЧ-инфекция может поражать шейку матки и приводить к образованию аномальных клеток. В таких случаях операция по конизации шейки матки может быть проведена во второй или даже в третий раз, если это необходимо. Люди с ВПЧ-инфекцией и курильщики обычно составляют группу, требующую повторного вмешательства. Курение является важнейшим фактором риска рецидива ВПЧ-инфекции. В последних научных исследованиях было отмечено, что вероятность полного удаления ВПЧ-инфекции из организма очень мала. В тех случаях, когда иммунная система ослаблена, ВПЧ-инфекция проявляется вновь. Курение является одним из важнейших факторов, ослабляющих иммунную систему. Если курение присутствует в социальной жизни человека, то возможно повторное появление аномальных клеток, созданных ВПЧ-инфекцией.
После операции конизации лепса первый контроль проводится через 6 месяцев.
Болезненна ли конизация лепры?
Операция конизации лепса не является болезненной процедурой. Поскольку операция проводится под анестезией, пациент не чувствует боли. После операции пациент может испытывать слабую боль. Однако боль можно купировать простыми обезболивающими препаратами. Боль не влияет на социальную жизнь пациента. Швы при операции конизации лепса обычно не накладываются. Однако при холодной конизации пиявки швы могут быть использованы. Это полностью зависит от предпочтений хирурга.
Каковы осложнения после конизации Leep?
Наиболее важным осложнением после операции Leep является кровотечение. Следует обращать внимание на обильное кровотечение, а не на точечные кровотечения. В отдаленные сроки может возникнуть неполноценность шейки матки при беременности.
Имеет ли место зловонный сброс после конизации фильтрата?
Выделения с неприятным запахом после операции конизации лепса указывают на возможность инфицирования. Однако даже при отсутствии запаха после операции выделения могут появляться из-за отслоения тканей. В случае выделений с неприятным запахом необходимо обратиться к врачу.
Сколько времени занимает процедура конизации лепса?
Операция конизации подкожного жира – это хирургическое вмешательство, которое занимает 15-20 минут.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
Педиатрическая онкология

Рак является второй по распространенности причиной смерти детей, и ежегодно в нашей стране он диагностируется примерно у 3 тыс. детей. Каждый второй ребенок с диагнозом детского рака умирает из-за отсутствия лечения или задержки с постановкой диагноза. Благодаря ранней диагностике и правильной практике лечения большинство детей с онкологическими заболеваниями полностью выздоравливают.
Важнейшим способом достижения успеха в лечении детских онкологических заболеваний является лечение таких пациентов в полноценных центрах с развитой инфраструктурой и высоким качеством обслуживания. Центры детской онкологии Мемориала служат для обеспечения высокого уровня диагностики и лечения детей с онкологическими заболеваниями. Для диагностики и лечения всех видов детских онкологических заболеваний сотрудничают детские онкологи, детские хирурги, ортопедия, нейрохирургия, офтальмология, отделения “ухо-горло-нос”, особенно врачи, специализирующиеся на опухолях и хирургии опухолей.
МУЛЬТИДИСЦИПЛИНАРНЫЙ ПОДХОД В ЛЕЧЕНИИ ВСЕХ ВИДОВ ДЕТСКИХ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ
Наиболее распространенными видами рака у детей являются лейкозы, опухоли головного мозга, лимфомы, опухоли почек и надпочечников, опухоли мягких тканей и костей, опухоли некоторых органов и ретинобластома (опухоль глаза). В то время как осведомленность населения о лейкемиях выше, осведомленность о солидных опухолях и лимфомах, составляющих 75% всех детских опухолей, ниже. Детские онкологические заболевания труднее поддаются лечению, поэтому ранняя диагностика крайне важна. В центрах детской онкологии нашей страны этот сложный процесс успешно осуществляется благодаря командному подходу и сотрудничеству специалистов многих специальностей.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
Что такое онкологическая хирургия (хирургия рака)?
Онкологическая (раковая) хирургия – это удаление раковых опухолей или тканей из организма и очищение его от рака. Онкологическая хирургия, имеющая 100-летнюю историю, с момента своего возникновения выполнялась классически открытым способом, а сегодня она применяется с использованием различных методик, направленных на создание меньших разрезов на теле как для косметического эффекта, так и для сокращения времени заживления. Минимально инвазивная хирургия, называемая “малым разрезом”, лапароскопическая хирургия, выполняемая закрыто через одно или несколько отверстий, и операции нового поколения, выполняемые с помощью роботизированных систем, которые являются наиболее продвинутой точкой, достигнутой технологией, ставят во главу угла комфорт при восстановлении здоровья пациента.
Каковы цели онкологической хирургии?
Целью онкологической (раковой) хирургии, обеспечивающей пациентам привилегии, комфорт и быстрое возвращение к повседневной жизни благодаря большому развитию за последние 20 лет, является полное удаление опухоли из организма. Здесь требуется своевременность и очень хорошая организация работы с другими отделениями. Хирургия – один из самых ответственных этапов лечебного процесса. Для достижения успешного результата в лечении необходимо, чтобы болезнь не рецидивировала в месте расположения опухоли и не было метастазов в отдаленных органах, другими словами, болезнь должна быть полностью ликвидирована. Точный эквивалент этого понятия – куративное лечение. Это главная и неотъемлемая цель онкологической хирургии. Среди индивидуальных вариантов лечения в онкологической хирургии предпочтение отдается открытым, лапароскопическим (закрытым) или роботизированным методам. Цель успешной онкологической операции – максимально точное удаление раковых клеток, снижение болевых ощущений, сохранение всех функций и быстрое восстановление пациента.
При каких видах рака эффективна хирургическая онкология? Какие заболевания лечатся?
Хирургическая онкология или онкологические операции проводятся в таких областях, как общая хирургия, эндокринная хирургия, торакальная хирургия, гинекологическая онкология, урология, хирургия мозга и нервов, хирургия головы и шеи, ортопедическая онкология, хирургия молочной железы и онкопластика.
Общая хирургия
Проводится лечение рака молочной и щитовидной железы, опухолей печени, желчного пузыря и желчевыводящих путей, поджелудочной железы и ее основной части, желудка, толстой и прямой кишки, а также пищевода.
Торакальная хирургия
Выполняются паллиативные методы при раке легкого и плевры, опухолях грудной стенки, опухолях дыхательных путей и средостения, раке легкого и других органов в поздней стадии, интервенционные процедуры и применение стентов при опухолях легкого и дыхательных путей.
Гинекологическая онкология
Операции проводятся при раке матки, шейки матки, яичников, яичников, труб, вульвы и семенного канатика, который также называют женским раком.
Урология
Выполняются лапароскопические и роботизированные операции рака предстательной железы с применением нервосберегающих методик, хирургия опухолей мочевого пузыря и закрытые хирургические применения новых реконструкций мочевого пузыря, хирургия опухолей почки и почечносохраняющие методики, хирургия рака надпочечников и опухолей яичка.
Хирургия головного мозга
Хирургические вмешательства выполняются с использованием микрохирургической и эндоскопической техники при опухолях головного мозга и нервов у детей, опухолях гипофиза и опухолях основания черепа. При операциях на опухолях, расположенных в чувствительной зоне головного мозга, используется технология нейромониторинга, предотвращающая риск паралича, который может возникнуть после операции.
Хирургия головы и шеи
Хирургическое лечение опухолей гортани, глотки, околоносовых пазух и полости носа, рака миндалин и слюнных желез, а также опухолей, расположенных в полости рта, дна полости рта, языка, верхней части глотки, области, соединяющей остальные части глотки с гортанью, нижней части глотки и области под ней, ушной раковины и наружного слухового прохода.
Отделение ортопедической онкологии
Выполняются операции при опухолях, исходящих из самой кости, костных метастазах опухолей других органов, злокачественных опухолях тканей, образующих скелетную систему, опухолях мягких тканей, включая мышцы, жировую ткань, соединительную ткань, сосуды и нервы, а также все операции при опухолях скелетной системы в детском и взрослом возрасте.
Грудная и онкопластическая хирургия
Специальные операции, сочетающие онкологическую и эстетическую хирургию, применяются для устранения потери груди у больных раком молочной железы не только в связи с онкологическим диагнозом, но и после операций на молочной железе. Сочетание принципов онкологической и пластической хирургии позволяет предложить комфортные варианты для пациенток, которые ранее столкнулись с потерей груди в результате онкологического заболевания.
В каких случаях операция по удалению рака не может быть выполнена?
Хирургическое лечение рака перестало быть отдельным методом лечения и стало одной из важнейших составляющих организованного лечебного процесса. Благодаря влиянию технологий на онкологическую хирургию рак стал заболеванием, с которым можно бороться более активно для всех хирургов этой области. Благодаря операциям, которые стали на повестку дня для удобства врача и пациента, постепенно уменьшилось количество операций, которые невозможно выполнить, а вмешательство в органы с иммунитетом стало относительно проще. В хирургии рака поджелудочной железы, которая является лучшим примером этого, помимо искусственных сосудистых операций, выполняемых для предотвращения вовлечения опухолью близлежащих сосудов, при очень эффективных в онкологии лекарственных схемах, пациентов можно оперировать, предварительно уменьшив опухоль, в случаях рака поджелудочной железы или метастазирования в печень, которые считаются неоперабельными. Хирургия рака – это вид лечения, который продлевает качество и продолжительность жизни, как это и должно быть.
Однако, несмотря на все эти достижения, не все раковые опухоли являются операбельными. При опухолях твердых органов возможно хирургическое вмешательство, а при раке крови применяются безоперационные методы лечения. Однако и в этом случае опухоль должна обладать определенными характеристиками, чтобы быть удаляемой хирургическим путем. В случаях, когда опухоль слишком велика для удаления хирургическим путем, метастазы в отдаленных органах влияют на общее состояние здоровья пациента, операция может быть невозможна для групп пациентов, которые не могут перенести осложнения хирургического вмешательства в силу преклонного возраста. В таких случаях предпочтение может быть отдано нехирургическим методам лечения, позволяющим уменьшить опухоль и сделать ее операбельной, а также поддерживающему хирургическому лечению в качестве профилактической меры, исключающей риск сохранения раковых клеток после операции. Если рак желудка обнаружен на ранней стадии, то практически все пациенты могут быть излечены от заболевания с помощью операции. Однако для людей с запущенной стадией рака поджелудочной железы и некоторыми хроническими заболеваниями на первый план выходят различные варианты лечения. Поэтому для применения правильного метода лечения важно правильно выбрать пациента и определить порядок применения лечения. Правильная организация лечения пациентов с диагнозом “рак” под крышей онкологического центра положительно скажется на результатах лечения.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ РАК ПОЛОСТИ РТА?
Рак полости рта – это рост аномальных клеток в любой части полости рта или губ. Хотя для успешного лечения рака полости рта чрезвычайно важно выявить его как можно раньше, хирургическое вмешательство занимает ведущее место в лечении опухолей этой области. Операция должна проводиться как можно шире, безопасно, с оставлением хирургического края, а удаленная во время операции область должна быть подтверждена патологией (заморожена). В некоторых случаях в дополнение к операции может быть применена химиотерапия. При лечении рака в полости рта абсолютно необходима диссекция шеи (за исключением твердого нёба).
КАКОВЫ ФАКТОРЫ РИСКА РАЗВИТИЯ РАКА ПОЛОСТИ РТА?
Риск развития рака полости рта повышается у лиц, длительно и интенсивно употребляющих табак и табачные изделия. Так, установлено, что около 75% людей, страдающих раком полости рта, употребляют табак. С увеличением количества и продолжительности потребления табака возрастает и риск развития рака полости рта. Чрезмерное употребление алкоголя, чрезмерное пребывание на солнце, возраст старше 40 лет и ожирение также повышают риск развития рака полости рта. Люди, имеющие в анамнезе рак головы и шеи, имеют повышенный риск развития рака полости рта, особенно если они продолжают курить и употреблять алкоголь. Кроме того, к факторам, повышающим риск развития рака полости рта, относятся инфекция ВПЧ, ультрафиолетовые лучи, неправильное питание, ослабленная иммунная система, наличие некоторых проблем со здоровьем, таких как болезнь “трансплантат против хозяина” или анемия Фанкони, а также недостаточная гигиена полости рта.
Примечание: У людей, страдающих раком ротовой полости, чаще развивается рак гортани, пищевода или легкого.
КАКИЕ СУЩЕСТВУЮТ ВИДЫ РАКА ПОЛОСТИ РТА?
Рак полости рта классифицируется в зависимости от типа клеток, в которых начинается рост раковой опухоли (карциномы). Сквамозно-клеточная карцинома – наиболее распространенный тип рака полости рта, составляющий 9 из 10 случаев.
К менее распространенным видам рака полости рта относятся:
- Аденокарцинома – рак, развивающийся внутри слюнных желез
- Саркома, развивающаяся из аномалий костной, хрящевой, мышечной или других тканей
- Злокачественная меланома полости рта, при которой рак начинается в клетках, вырабатывающих пигмент или цвет кожи (меланоцитах). Они выглядят как очень темные, крапчатые бугорки, которые часто кровоточат.
- Лимфома, которая обычно развивается из клеток в лимфатических узлах (они также могут расти в полости рта).
С другой стороны, рак полости рта является одним из видов рака, входящих в группу “рак головы и шеи”. К другим видам рака головы и шеи относятся
- Рак гортани
- Рак носоглотки (область за носом (глотка), образующая верхнюю часть горла)
- Рак ротоглотки
- Рак гипофарингеальной области
- Рак щитовидной железы
- Опухоли носа и околоносовых пазух
- Рак пищевода
КАКОВЫ СИМПТОМЫ РАКА ПОЛОСТИ РТА?
Если любой из симптомов рака полости рта сохраняется более 2 недель, необходимо немедленно обратиться к врачу. Симптомы рака полости рта можно перечислить следующим образом:
- Незаживающая язва полости рта/губы
- Припухлость или опухоль в полости рта
- Белые или красные пятна в полости рта
- Область внутри полости рта, которая обесцвечивается и остается такой
- Припухлости или утолщения на щеках
- Боль в горле, которая не проходит в течение длительного времени
- Охриплость голоса
- Неприятный запах изо рта
- Проблемы с жеванием или глотанием
- Неспособность двигать челюстью и языком
- Онемение языка или части полости рта
- Боль вокруг зубов и в челюсти
- Необъяснимая потеря веса
- Постоянное ощущение, что что-то застряло в горле
КАК ДИАГНОСТИРУЕТСЯ РАК ПОЛОСТИ РТА?
Диагностический процесс при раке полости рта начинается с физикального обследования. При наличии или отсутствии симптомов стоматолог во время обычного осмотра заметит ненормальное изменение тканей в полости рта и может нащупать уплотнение или образование.
Подтвердить диагноз можно с помощью прямого осмотра поражения или небольшой биопсии. После постановки диагноза врач использует различные тесты, чтобы определить, распространился ли рак за пределы полости рта и какова его степень. Проводимые тесты могут включать:
- Магнитно-резонансная томография головы и шеи
- Компьютерная томография молочной железы для поиска рака в лимфатических узлах
- Позитронно-эмиссионная томография (ПЭТ) для поиска рака в других частях тела
- Врач также может осмотреть гортань, пищевод и легкие, проведя по горлу трубку с маленькой камерой на конце.
В ЧЕМ ЗАКЛЮЧАЕТСЯ ЛЕЧЕНИЕ РАКА ПОЛОСТИ РТА?
Методы лечения рака полости рта могут различаться в зависимости от общего состояния здоровья пациента, локализации и стадии рака. Хирургическое вмешательство – наиболее распространенный метод лечения рака полости рта – предполагает удаление опухоли и некоторых окружающих здоровых тканей. В тех случаях, когда раковые клетки распространились на лимфатические узлы, хирург удаляет их, чтобы предотвратить распространение рака в другие части тела. Одним из наиболее интересных новых достижений в области лечения рака полости рта является широкое применение роботизированной хирургии.
Радиотерапия является основным методом лечения некоторых небольших опухолей. Для уничтожения раковых клеток в радиотерапии используется высокоэнергетическое рентгеновское излучение. В некоторых случаях пациенты, перенесшие операцию, получают радиотерапию для удаления раковых клеток, которые могли остаться в организме на микроскопическом уровне после операции. Даже если радиотерапия не может вылечить рак, она может облегчить такие симптомы, как кровотечение и затрудненное глотание.
При необходимости врачи могут использовать химиотерапию для уменьшения размеров опухоли перед хирургическим вмешательством. В случаях, когда опухоль слишком велика для проведения операции, химиотерапия и радиотерапия могут облегчить симптомы, вызванные раком.
Если рак диагностирован на более ранней стадии (I и II стадии), то шансы на выздоровление значительно выше. Это связано с тем, что опухоли на этих стадиях имеют размер менее 4 см в самой широкой точке и не распространились на лимфатические узлы. Больных раком на этих стадиях можно лечить с помощью хирургического вмешательства и лучевой терапии. Опухоли III и IV стадий являются более прогрессирующими. На этих стадиях опухоли лечат радиотерапией, химиотерапией или тем и другим вместе, а также проводят более обширные хирургические операции. Целевая лекарственная терапия также может применяться отдельно или в сочетании с химио- и радиотерапией.
При иммунотерапии используются препараты, помогающие иммунной системе бороться с раком. Иммунотерапия может применяться у людей с прогрессирующим раком полости рта, который не отвечает на стандартные методы лечения.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ О РАКЕ ПОЛОСТИ РТА
Как можно снизить риск развития рака полости рта?
Хотя не существует доказанного метода профилактики рака полости рта, риск развития рака полости рта можно снизить, если соблюдать следующие рекомендации.
Употребление табака следует прекратить или не начинать: Употребление табака повышает риск развития рака полости рта. Курение и жевание табака подвергает клетки ротовой полости воздействию опасных химических веществ, которые могут вызвать рак.
Алкоголь следует употреблять умеренно: Чрезмерное употребление алкоголя может вызвать раздражение клеток полости рта, что делает их уязвимыми для рака полости рта. Поэтому следует избегать чрезмерного употребления алкоголя.
Следует избегать чрезмерного воздействия солнца: Как можно чаще находитесь в тени и используйте солнцезащитный крем в качестве основного слоя для защиты губ от вредного воздействия солнечных лучей. Используйте широкополые шляпы, которые эффективно закрывают все лицо, включая рот.
Кроме того, полноценное здоровое питание, включающее разнообразные фрукты и овощи, также может снизить риск развития рака полости рта.
Что такое поддерживающая терапия при раке полости рта?
Поддерживающий уход помогает решать физические, практические, эмоциональные и духовные проблемы, связанные с раком полости рта. Существует множество программ и услуг, помогающих удовлетворить потребности и улучшить качество жизни людей, живущих с раком, и их близких, особенно после лечения.
Восстановление после рака полости рта и адаптация к жизни после лечения – это индивидуальный процесс для каждого человека, зависящий от расположения опухоли, стадии рака, органов и тканей, удаленных во время операции, типа лечения и многих других факторов. Даже после окончания лечения могут оставаться проблемы, например, преодоление долгосрочных побочных эффектов. Человека, проходящего лечение рака полости рта, могут беспокоить следующие вопросы.
Самооценка и образ тела
То, как человек относится к себе, определяется как уверенность в себе. Образ тела – это то, как человек видит свое тело. Рак полости рта и его лечение могут повлиять на самооценку и образ тела человека. Часто это связано со следующими факторами:
- Шрамы
- Изменения кожи
- Изменение формы лица
- Необходимость использования протеза
- Затруднения при разговоре или приеме пищи
- Снижение веса
Некоторые из этих изменений могут быть временными, другие же могут продолжаться долгое время или стать постоянными.
Некоторые люди могут избегать общения, даже если последствия лечения не проявляются внешне. Это связано с опасением, что окружающие будут осуждать их, а также с боязнью испытать расстройство или вспышку гнева.
Тем, чей внешний вид пострадал после операции по удалению рака полости рта, необходимо дать себе время. Помочь в этом могут беседы с людьми, имевшими подобный опыт, поддержка семьи, общение с друзьями. Существуют также средства, которые могут помочь справиться с изменениями на лице, например, камуфляжная косметика для шрамов или ношение шарфов и шапок.
Сухость во рту
Многие люди испытывают сухость во рту во время и после лечения рака полости рта. Радиотерапия или хирургическое вмешательство, повреждающее слюнные железы, могут вызвать сухость во рту. Химиотерапия, проводимая в сочетании с радиотерапией, часто усугубляет жалобу на сухость во рту. Интенсивно-модулированная лучевая терапия (IMRT) может помочь уменьшить это осложнение у многих пациентов.
Затруднения при жевании и глотании
Операции в полости рта, особенно если они связаны с удалением определенных структур, таких как язык и челюстная кость, могут вызвать затруднения при жевании и глотании. В некоторых случаях может потребоваться реконструкция или протезирование для замены структур внутри полости рта. Способы улучшения глотания включают в себя изменение положения головы и выполнение упражнений на диапазон движений для челюсти и языка. Устройство для кормления, называемое глоссэктомической ложкой, позволяет человеку, у которого есть только часть языка, помещать мягкую пищу в заднюю часть рта. Это также помогает при глотании.
Проблемы с речью
Операции по удалению больших частей языка, челюстных костей или нёба могут вызвать проблемы с речью. Реконструкция помогает уменьшить эти осложнения, но восстановить нормальную функцию часто бывает сложно. Оральные протезы могут компенсировать ткани, утраченные во время операции, и помочь улучшить речь.
Логопед может оценить речевые проблемы и помочь справиться с ними.
Изменения вкуса
Радиотерапия головы, шеи или полости рта может привести к повреждению слюнных желез и вкусовых рецепторов на языке, что может повлиять на вкус некоторых продуктов. Химиотерапевтические препараты также могут влиять на вкусовые клетки в полости рта. Операция по удалению части или всего языка может привести к снижению или потере вкусовых ощущений.
Проблемы с зубами
Радиотерапия может вызывать проблемы с зубами. Слюна помогает очищать зубы и десны, поэтому, когда слюны выделяется меньше, повышается риск развития кариеса и заболеваний десен. Радиотерапия также может воздействовать на зубную эмаль. Это повышает риск развития кариеса.
Перед началом лечения можно посетить стоматолога для осмотра. Правильный уход за полостью рта очень важен для предотвращения проблем. Для профилактики кариеса можно применять фторсодержащие средства. После лечения необходимо регулярно посещать стоматолога.
Проблемы с питанием
Затруднения при жевании и глотании, а также потеря аппетита могут привести к недоеданию и потере веса. Можно принять меры для повышения аппетита и помочь людям есть больше и продолжать правильно питаться. Могут быть рекомендованы пищевые добавки. Зарегистрированный врач-диетолог часто может помочь людям в управлении питанием и анорексией.
Снижение функции щитовидной железы (гипотиреоз)
От 30 до 40 процентов людей, получающих радиотерапию по поводу рака головы и шеи, включая рак полости рта, заболевают гипотиреозом. Некоторые симптомы гипотиреоза включают сильную усталость, сухость кожи и волос, выпадение волос, увеличение веса и непереносимость холода.
Людям с гипотиреозом после лечения рака полости рта может потребоваться ежедневный прием лекарственных препаратов.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ РАК ПОЧКИ?
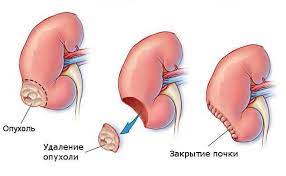
Рак почки – это заболевание, при котором клетки почки становятся злокачественными (раковыми) и неконтролируемо растут, образуя опухоль. Другими словами, рак почки возникает в результате аномального роста клеток в почках. Почти все виды рака почки сначала возникают в выстилке маленьких трубочек (канальцев) почки. Этот тип рака почки называется почечно-клеточной карциномой.
На долю почечно-клеточных карцином (ПКК) приходится около 90% случаев рака почки. Другими видами рака почки являются:
- Переходноклеточная карцинома или рак почечной лоханки, начинающийся на внутренней поверхности почечной лоханки
- Опухоль Вильмса (нефробластома) – наиболее распространенное онкологическое заболевание у детей в возрасте 14 лет и младше
- Редкая саркома почки развивается в мягких тканях почки.
ЧТО ТАКОЕ ДОБРОКАЧЕСТВЕННЫЕ ОПУХОЛИ ПОЧКИ (НЕРАКОВЫЕ ОБРАЗОВАНИЯ В ПОЧКЕ)?
Доброкачественные опухоли почек можно лечить, разрушая их с помощью многих тех же методов, которые применяются при раке почки, например, хирургического вмешательства или радиочастотной абляции. Выбор метода лечения зависит от многих факторов, включая размер опухоли и наличие симптомов, количество опухолей, наличие опухолей в обеих почках и общее состояние здоровья пациента.
Ангиомиолипома
Ангиомиолипомы являются наиболее распространенной доброкачественной опухолью почки. Они чаще встречаются у женщин. Они могут развиваться у людей с туберозным склерозом – генетическим заболеванием.
Эти опухоли состоят из различных видов соединительной ткани (кровеносных сосудов, гладкой мускулатуры и жира). Если они не вызывают никаких симптомов, за ними обычно можно внимательно наблюдать. Если они начинают вызывать проблемы (например, боль или кровотечение…), может потребоваться их лечение.
Онкоцитома
Онкоцитомы – это доброкачественные опухоли почек, которые встречаются нечасто и иногда могут достигать значительных размеров. Они чаще встречаются у мужчин и не распространяются на другие органы.
КАКОВЫ ПРИЧИНЫ ВОЗНИКНОВЕНИЯ РАКА ПОЧКИ?
На долю рака почки приходится около 2,5% всех онкологических заболеваний. У мужчин рак почки встречается в два раза чаще, чем у женщин. Риск развития рака почки увеличивается с возрастом. Фактически большинство случаев рака почки встречается у людей старше 50 лет. Хотя причина возникновения рака почки точно не известна, перечисленные ниже факторы могут повышать риск развития рака почки.
Курение: У курильщиков риск развития рака почки почти в два раза выше, чем у некурящих. Считается, что примерно 1 из 3 случаев всех видов рака почки связан с курением
Ожирение Ожирение может вызывать изменение уровня некоторых гормонов, что может привести к развитию рака почки.
Высокое кровяное давление Высокое артериальное давление может повышать риск развития рака почки.
Почечная недостаточность: Люди с почечной недостаточностью имеют повышенный риск развития рака почки.
Семейный анамнез рака: Люди, у которых родители, братья или сестры (родственники первой степени родства) больны раком почки, относятся к группе высокого риска.
Наследственные заболевания: Около 2-3% случаев рака почки развивается у людей с некоторыми наследственными синдромами, включая болезнь фон Хиппеля-Линдау, наследственный папиллярный РСС, синдром Бирта-Хогга-Дюбе и синдром Линча.
Радиационное облучение: Риск развития рака почки может быть повышен у людей, которые ранее проходили лучевую терапию с лечебной целью или подвергались длительному воздействию радиации по другим причинам.
Воздействие токсичных веществ на производстве: Риск развития рака почки может быть повышен при регулярном воздействии химических веществ, таких как некоторые обезжириватели металлов, мышьяк или кадмий, используемые в горнодобывающей промышленности, сельском хозяйстве, при сварке и покраске.
КАКОВЫ СИМПТОМЫ РАКА ПОЧКИ?
На ранних стадиях рак почки обычно не вызывает никаких явных или беспокоящих симптомов. Опухоли небольших размеров на ранних стадиях обычно обнаруживаются случайно, особенно при ультразвуковом исследовании брюшной полости или томографии, проводимой по поводу другого заболевания.
По мере роста опухоли почки могут появляться перечисленные ниже симптомы:
- В некоторых случаях кровь может появляться в моче. В других случаях следы крови обнаруживаются при анализе мочи – лабораторном исследовании, которое обычно проводится в рамках регулярного медицинского обследования
- Припухлость или образование в области почек
- Не очень сильная, постоянная боль, особенно в поясничной области
Менее распространенные симптомы рака почки могут включать
- Усталость
- Потеря аппетита
- Снижение веса
- Высокая температура
Повышенное артериальное давление или аномально низкий уровень эритроцитов в крови (низкий уровень RBC) (анемия) также могут указывать на опухоль почки. Эти симптомы встречаются реже.
С другой стороны, если опухоль распространилась на такие органы, как кости и легкие, могут наблюдаться такие симптомы, как кашель, кровянистая мокрота и боль в костях, вызванные этим распространением.
КАК ДИАГНОСТИРУЕТСЯ РАК ПОЧКИ?
Поскольку рак почки обычно протекает бессимптомно, т.е. не вызывает никаких симптомов, опухоль часто обнаруживается при прохождении пациентом медицинского обследования по другой причине. При ультразвуковом и компьютерно-томографическом исследовании, проводимом при любых жалобах пациента, опухоль почки, о которой он не подозревает, может быть обнаружена, когда заболевание еще находится на ранней стадии. Например, если пациент обратился к врачу с жалобами на желчный пузырь и был направлен на УЗИ специалистом по внутренним болезням, вероятность выявления развивающейся опухоли почки при УЗИ достаточно высока.
Компьютерная томография (КТ) и магнитно-резонансная томография часто являются единственными исследованиями, необходимыми врачам для диагностики рака почки. Иногда врачи также проводят так называемую чрескожную биопсию, если им необходимо получить больше информации об опухоли, прежде чем рекомендовать лечение. Во время этой процедуры врач обезболивает кожу с помощью местного анестетика. Затем с помощью небольшой иглы врач вынимает часть ткани.
Врачи могут использовать компьютерную томографию или ультразвук (использование звуковых волн для создания изображения на мониторе компьютера) для определения местоположения опухоли и направления введения и извлечения иглы. Патологоанатом, врач, изучающий заболевания в лаборатории, исследует образцы тканей под микроскопом на предмет наличия признаков рака.
Анализы мочи не диагностируют рак почки; однако врач может захотеть проверить, нет ли в моче крови, что является обычным признаком прогрессирующего рака почки. Анализы крови, напротив, помогают врачу определить, правильно ли работают почки, но не используются для диагностики рака почки.
КАКОВЫ СТАДИИ РАКА ПОЧКИ?
Стадирование – это процесс определения степени распространения рака, который является важной частью диагностики. В зависимости от стадии рака определяются наиболее подходящие варианты лечения. Стадии рака почки варьируются от I (наименее тяжелая стадия) до IV. Когда у пациента подтверждается наличие рака почки, врач обсуждает вопрос о стадиях.
I стадия (наименее тяжелая стадия)
Опухоль имеет размер 7 см или меньше и располагается только в почке. Она не распространилась на лимфатические узлы или отдаленные органы.
Этап II
Опухоль имеет размер более 7 см и располагается только в почке. Она не распространилась на лимфатические узлы или отдаленные органы.
Фаза III
На III стадии опухоль распространяется на окружающие ткани за пределами почки и может распространиться на регионарные лимфатические узлы.
IV стадия
Опухоль распространилась на участки за пределами фасции Жеро, слоя соединительной ткани, сдавливающего почки и надпочечники, и доходит до надпочечника. Кроме того, рак распространился на многочисленные лимфатические узлы или на отдаленные участки тела, такие как кости, печень или легкие.
В ЧЕМ ЗАКЛЮЧАЕТСЯ ЛЕЧЕНИЕ РАКА ПОЧКИ?
Варианты лечения рака почки могут зависеть от ряда факторов, включая общее состояние здоровья пациента, тип рака почки, степень распространения рака и предпочтения в лечении. Стандартным методом лечения рака почки является хирургическое вмешательство. Целью хирургического вмешательства является удаление раковой опухоли с сохранением, по возможности, нормальной функции почки. В зависимости от стадии рака, размера образования, области почки, в которой оно расположено, и его количества закрытым методом удаляется вся почка или только образование. Если рак распространился за пределы почки, может быть рекомендовано дополнительное лечение.
Удаление пораженной почки (нефрэктомия)
Полная (радикальная) нефрэктомия подразумевает удаление всей почки, здоровой тканевой границы и иногда дополнительных близлежащих тканей, таких как лимфатические узлы, надпочечник или другие структуры.
Хирург может выполнить нефрэктомию через один разрез в брюшной полости или сбоку (открытая нефрэктомия) или через серию небольших разрезов в брюшной полости (лапароскопическая или робот-ассистированная лапароскопическая нефрэктомия).
Удаление опухоли из почки (частичная нефрэктомия)
Эта процедура, называемая также почечносохраняющей или нефроносохраняющей операцией, является распространенным методом лечения опухолей на ранних стадиях. Цель почечносохраняющей операции – максимально сохранить функцию почек и снизить риск последующих осложнений, таких как болезнь почек и необходимость в диализе.
Эффективность нехирургических методов лечения, таких как химиотерапия и лучевая терапия, при лечении рака почки невысока.
Иммунотерапия направлена на укрепление собственной иммунной системы организма. Иммунотерапия является одним из вариантов лечения людей с распространенным раком почки. Цитокины (белки, активизирующие иммунную систему) могут вводиться внутривенно или перорально и уменьшать размеры раковой опухоли. Таргетная терапия также может быть использована при распространенном раке почки. Таргетная терапия направлена на определенные молекулы. Препараты для таргетной терапии обычно вводятся в виде таблеток или внутривенно. Ингибиторы тирозинкиназы (TKIs) были протестированы на людях с распространенным раком почки и показали, что они вызывают меньше побочных эффектов, чем химиотерапевтические препараты.
Примечание: Роботизированная хирургия Da Vinci дает большие преимущества пациенту при операциях по удалению опухоли почки. В таких случаях, как частичное удаление почки или удаление опухолевой части почки, проблема решается путем ввода 4-5 отверстий из брюшной полости, отделения опухолевой ткани, без необходимости больших операционных разрезов, без нарушения онкологических и хирургических принципов.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ О РАКЕ ПОЧКИ
Что такое эмболизация при лечении рака почки?
Хирург устанавливает катетер и вводит в кровеносный сосуд синтетический материал. Этот материал блокирует кровоснабжение почки, что лишает опухоль кислорода и питательных веществ и приводит к ее уменьшению.
Можно ли предотвратить рак почки?
Стопроцентная профилактика заболевания невозможна, так как причины возникновения рака почки до конца не выяснены, однако ведение здорового образа жизни, сочетание рационального питания и регулярных физических нагрузок поможет предотвратить ожирение, являющееся одним из основных факторов риска развития рака почки.
Является ли рак почки смертельным?
Выздоровление при раке почки зависит от стадии рака. Хотя средняя продолжительность жизни больных раком почки определяется в зависимости от стадий рака, у разных людей она может быть разной.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ РАК ЯЗЫКА?
Рак языка – это серьезный, угрожающий жизни вид рака полости рта. Язык является наиболее распространенным местом локализации рака полости рта после губ.
КАКОВЫ СИМПТОМЫ РАКА ЯЗЫКА?
Симптомы рака языка схожи с симптомами других видов рака полости рта. В зависимости от стадии развития наиболее распространенным симптомом рака языка является незаживающая ранка в полости рта. Некоторые симптомы рака полости рта или рака языка могут быть обусловлены и другими заболеваниями, поэтому, если соответствующие симптомы сохраняются более двух недель, необходимо провести тщательное клиническое обследование, сдать лабораторные анализы и обратиться к врачу для получения окончательного заключения.
Симптомы рака языка обычно безболезненны и не характерны для данного заболевания. Из-за неспецифических и часто безболезненных симптомов рак языка и другие виды рака полости рта часто не выявляются на ранних стадиях. Симптомы рака языка, который чаще всего можно увидеть и почувствовать, чем рак гипофарингеального отдела языка (рак языка полости рта), включают
- Серовато-розоватое образование или язва на боковых поверхностях языка
- Боль в языке
- Боль в горле
- Затруднения при глотании или жевании
- Затруднение движения языка
Рак, развивающийся в корне языка, обычно диагностируется на поздней стадии, когда опухоль увеличивается в размерах и распространяется на лимфатические узлы шеи.
Ниже перечислены некоторые симптомы, вызываемые раком корня языка:
- Боль в горле
- Затруднения при глотании
- Ощущение комка в горле
- Изменения в голосе
- Боль в ухе
Важно, чтобы люди, жалующиеся на любой из этих симптомов, прошли обследование у специалиста по лечению рака уха, носа и горла. Поскольку, как и в случае большинства видов рака, ранняя диагностика очень важна для успешного лечения рака языка.
КАКОВЫ ФАКТОРЫ РИСКА РАЗВИТИЯ РАКА ЯЗЫКА?
Двумя наиболее важными факторами риска развития рака языка являются табакокурение и употребление алкоголя. Вероятность развития рака языка у мужчин в два раза выше, чем у женщин. Хотя рак языка редко встречается у молодых людей, он чаще всего возникает у людей в возрасте 40 лет и старше.
Факторы риска развития рака языка представлены следующим образом:
- Курение или использование других видов табака (жевательного и т.д.)
- Употребление алкоголя
- ВПЧ-16 и 18: вирус папилломы человека
- Воздействие асбеста
- Факторы, связанные с недоеданием
- Генетическая предрасположенность
- Плохая гигиена полости рта и длительное раздражение
КАК ДИАГНОСТИРУЕТСЯ РАК ЯЗЫКА?
Биопсия – это первый шаг в диагностике рака языка. Во время биопсии берется небольшое количество ткани с той части языка, где подозревается рак. Ткань отправляется к патологоанатому, который изучает ее под микроскопом и помогает поставить диагноз. Исследование патологоанатомом образца ткани из предполагаемого места рака является ключевым моментом в постановке диагноза. После диагностики рака языка проводятся рентгенологические исследования, такие как УЗИ, компьютерная и магнитно-резонансная томография, позволяющие оценить размер, стадию, распространение и связь с другими органами. Таким образом, принимается решение о методе лечения.
Стадия рака на момент постановки диагноза определяет варианты лечения и оказывает сильное влияние на выживаемость. Чем раньше диагностирован рак языка, тем выше шансы на выживание через пять лет после постановки диагноза.
КАКИЕ СУЩЕСТВУЮТ ВИДЫ РАКА ЯЗЫКА?
Наиболее распространенным видом рака языка является плоскоклеточная карцинома (СКК). Сквамозные клетки – это плоские, похожие на кожу клетки, которые выстилают внутреннюю поверхность рта, носа, гортани, щитовидной железы и горла. Карцинома сквамозных клеток – это название рака, который начинается в этих клетках.
КАКОВЫ СТАДИИ РАКА ЯЗЫКА?
Стадия рака показывает, насколько велика опухоль и распространилась ли она. Классификация стадий рака в организме – это классификация TNM. В соответствии с ней
T – размер опухоли в месте ее возникновения,
N; для опухолей в области головы и шеи – размер и состояние опухоли, которая метастазировала (распространилась) в шейные лимфатические узлы,
M указывает на наличие метастазов за пределами шеи, в отдаленных органах, часто через кровь.
В целом стадия рака зависит от следующих факторов:
- Насколько сильно рак разрастается в местных тканях
- Распространилось ли заболевание на близлежащие лимфатические узлы
- Распространилось ли заболевание на другие части тела
КАКОВЫ МЕТОДЫ ЛЕЧЕНИЯ РАКА ЯЗЫКА?
Варианты лечения рака языка зависят от общего состояния здоровья пациента, типа и стадии опухоли. Ранняя диагностика очень важна для выживания и комфортной жизни при раке языка.
Хирургическое вмешательство
При небольших размерах рака языка хирургическое удаление опухоли обычно является единственным необходимым методом лечения. Однако в зависимости от стадии опухоли и результатов рентгенологического исследования может потребоваться диссекция шеи и хирургическое удаление пораженных или потенциально пораженных шейных лимфатических узлов.
Радиотерапия
Радиотерапия обычно используется в сочетании с химиотерапией или до/после операции, чтобы остановить размножение раковых клеток.
Лучевая терапия с модуляцией интенсивности (IMRT) использует современную компьютерную систему для расчета необходимой дозы облучения опухоли. Это позволяет свести к минимуму чрезмерное облучение нормальных тканей, окружающих опухоль, ограничить количество побочных эффектов, которые могут возникнуть в результате радиотерапии, и обеспечить максимальную эффективность лучевой терапии.
Химиотерапия
Химиотерапия используется в сочетании с другими методами лечения, такими как хирургическое вмешательство и/или облучение. Цель химиотерапии – помочь контролировать рост раковой опухоли. В сочетании с облучением она называется химиорадиацией. Химиотерапия также называется паллиативным лечением, если она проводится отдельно для борьбы с симптомами заболевания. Химиотерапию можно проводить и после операции, чтобы снизить риск возвращения рака.
После хирургического вмешательства, лучевой и химиотерапии для улучшения качества жизни больных раком языка могут применяться диета и терапия речи, глотания, физическая и трудовая реабилитация.
ЧТО МОЖНО СДЕЛАТЬ ДЛЯ ПРОФИЛАКТИКИ РАКА ЯЗЫКА?
Хотя не существует доказанного метода профилактики рака языка, риск его развития можно снизить, если соблюдать следующие рекомендации.
- Не курить и не использовать табачные изделия. Курильщикам и/или потребителям табачных изделий следует при необходимости обратиться за профессиональной помощью, чтобы отказаться от этих привычек.
- Следует избегать употребления алкоголя.
- Необходимо регулярно посещать врача для осмотра и скрининговых исследований на рак.
- Необходимо уделять внимание гигиене полости рта.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ РАК ПЕЧЕНИ?

Злокачественные опухоли, возникающие из собственных клеток печени, называются первичным раком печени. Поскольку опухоль возникает из собственных клеток печени, она называется гепатоцеллюлярной (печеночно-клеточной) карциномой. Это один из наиболее распространенных и опасных для жизни видов опухолей. Кроме того, существуют опухоли печени, не происходящие из гепатоцитов. Это холангиоцеллюлярная карцинома (опухоли, происходящие из желчевыводящих путей). Однако есть и ангиосаркома, то есть опухоли печени, происходящие из сосудистых структур. Если печень человека здорова, то риск развития этого вида рака очень низок. Особенно подвержены риску развития рака печени лица с заболеваниями печени, имеющие структурные нарушения в печени (лица с циррозом или основаниями цирроза). Рак печени – одно из самых распространенных онкологических заболеваний в мире. Это заболевание, которое необходимо диагностировать на ранних стадиях, поскольку оно несет риск для жизни. Ранняя диагностика этого заболевания очень важна. Основным методом лечения является удаление раковой ткани. Очень трудно удалить только опухолевую часть печени, поскольку печень больна и ее хватает человеку только по функциям. Важным методом лечения больных раком печени является трансплантация печени.
КАКОВЫ СИМПТОМЫ РАКА ПЕЧЕНИ?
Рак печени на ранних стадиях не имеет специфических признаков. Поэтому при постановке диагноза обычно обнаруживается, что рак достиг больших размеров. Часто наблюдаются такие признаки, как снижение массы тела, потеря аппетита, слабость, утомляемость, желтуха, скопление жидкости в брюшной полости. Иногда может возникать ощущение боли и полноты в правой верхней части живота. Поскольку на фоне рака часто присутствует хроническое заболевание печени (например, цирроз), а эти заболевания нередко дают сходные симптомы, случай можно спутать. Хотя рак печени занимает 6-е место в мире по распространенности, в нашей стране он встречается чаще из-за большого числа заболеваний, связанных с циррозом. Поэтому пациенты с хроническим гепатитом и циррозом печени на ранней стадии должны находиться под рентгенологическим наблюдением с помощью таких методов, как УЗИ и, при необходимости, МРТ и КТ с интервалом 6 месяцев – 1 год, для исключения риска развития опухоли.
ЧТО ВЫЗЫВАЕТ РАК ПЕЧЕНИ?
Причины, вызывающие заболевания печени, можно перечислить следующим образом:
- Инфекции, вызванные вирусом гепатита В,
- Гепатит С и
- Инфекции, вызванные вирусом гепатита D,
- Афлатоксин (яд аспергилла флавус),
- Цирроз,
- Генетические врожденные болезни обмена веществ,
- Гемохроматоз
- Болезнь Вильсона
- Болезнь хранения гликогена,
- Химические вещества (нитриты, углеводороды, растворители) являются одной из причин рака печени.
Печень – это фабрика организма, центр, влияющий на все системы, резервуар крови и часть защитной системы. Группу с наибольшим риском развития рака печени составляют люди, больные гепатитом. Поскольку рак печени не дает симптомов в начальном периоде, вероятность ранней диагностики невелика. В 80% случаев рак развивается преимущественно у людей с циррозом печени, поэтому за пациентами необходимо тщательно наблюдать. По сравнению с людьми, не входящими в группу риска, вероятность развития рака печени у лиц, инфицированных гепатитами В и С, в 200 раз выше. Гепатит В можно предотвратить с помощью вакцинации. Лечение, разработанное для гепатита С, также дает весьма положительные результаты. Цирроз – это заболевание, вызванное повреждением клеток печени в результате воздействия алкоголя, гепатита, причин, связанных с иммунной системой, и т.д. Риск развития рака печени существует у 5% больных циррозом. Ожирение также относится к числу важных факторов риска, поскольку оно может спровоцировать развитие жировой дистрофии печени и цирроза.
КАК ДИАГНОСТИРУЕТСЯ РАК ПЕЧЕНИ?
В некоторых случаях рак печени может не давать никаких симптомов до тех пор, пока не достигнет запущенной стадии. По мере прогрессирования рака могут появиться такие симптомы, как беспричинная потеря веса, постоянное вздутие живота, скопление жидкости, потеря аппетита и постоянная слабость, желтуха. Людям с подобными жалобами необходимо как можно скорее обратиться к врачу. Сегодня с помощью методов визуализации можно выявить любые образования в печени. Особенно пациентам из группы риска следует проводить ультразвуковое исследование, которое является наиболее дешевым и легко применимым методом. Также можно использовать компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ) и ангиографию. Иногда для уточнения диагноза можно использовать сразу несколько методов визуализации. Альфа-фетопротеин (АФП), маркер опухоли, может быть обнаружен в крови. Высокий уровень этого теста является показательным с точки зрения наличия рака. Однако не следует забывать, что он может быть нормальным даже у пациентов с известным раком. Нормальный результат не означает отсутствия опухоли. В некоторых случаях для диагностики может быть проведена игольчатая биопсия печени. Однако этот метод не следует применять часто. Вопрос о необходимости проведения биопсии должен решаться опытными в этих вопросах врачами, т.е. гастроэнтерологами и/или хирургами, интересующимися заболеваниями печени.
КАК ЛЕЧИТСЯ РАК ПЕЧЕНИ?
Последствия нелеченого рака печени неблагоприятны. Продолжительность жизни в таких случаях составляет 6-9 месяцев. Наиболее эффективным методом является хирургическое удаление опухоли. Возможность хирургического лечения зависит от стадии опухоли и от того, распространилась ли она на окружающую область или нет, а также от наличия у пациента заболевания печени, степени этого заболевания. При раке печени, распространившемся за пределы печени, хирургическое вмешательство не проводится. Успех операции также зависит от диаметра опухоли. Выживаемость после операции значительно лучше у пациентов с диаметром опухоли <5 см по сравнению с пациентами с опухолью более 5 см. Ожидаемая 5-летняя выживаемость после хирургического удаления при идеальных условиях (опухоль <5 см, одиночная, без инвазии) составляет около 60%. В тех случаях, когда хирургическое вмешательство невозможно, специалист по интервенционной радиологии может применить такие методы, как радиоэмболизация, химиоэмболизация, химиотерапия, введение спирта, радиочастотная абляция. В соответствующих случаях они также могут применяться вместе с хирургическим вмешательством. При проведении операции следует учитывать, что оставшаяся печень должна быть достаточного качества и размера для поддержания здоровой жизни пациента. Если хирургическое удаление опухоли в печени нецелесообразно, может быть использована трансплантация печени. Существует множество причин, которые приводят к трансплантации печени. Опухоли печени – одна из них. Если опухоль отвечает соответствующим критериям, то трансплантация печени является наиболее идеальным методом лечения с точки зрения результатов. При трансплантации печени больная печень с потенциальным риском развития опухоли полностью удаляется. На ее место пересаживается здоровая печень. Риск рецидива опухоли у пациентов, перенесших трансплантацию, ниже.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ О РАКЕ ПЕЧЕНИ
Каковы первые симптомы рака печени?
Рак печени на ранних стадиях не имеет специфических признаков. Поэтому при постановке диагноза обычно обнаруживается, что рак достиг больших размеров. Часто наблюдаются такие признаки, как снижение массы тела, потеря аппетита, слабость, утомляемость, желтуха, скопление жидкости в брюшной полости.
Проходит ли рак печени?
Последствия нелеченого рака печени неблагоприятны. Продолжительность жизни в таких случаях составляет 6-9 месяцев. Наиболее эффективным методом является хирургическое удаление опухоли. Возможность хирургического лечения зависит от стадии опухоли, от того, распространилась ли она на близлежащие участки, а также от степени поражения печени пациента. При раке печени, распространившемся за пределы печени, хирургическое вмешательство не проводится. Успех операции также зависит от диаметра опухоли. Выживаемость после операции значительно выше у пациентов с диаметром опухоли <5 см по сравнению с пациентами с опухолью более 5 см. Ожидаемая 5-летняя выживаемость после хирургического удаления при идеальных условиях (опухоль <5 см, одиночная, без инвазии) составляет около 60%. В тех случаях, когда хирургическое вмешательство невозможно, специалист по интервенционной радиологии может применить такие методы, как радиоэмболизация, химиоэмболизация, химиотерапия, введение спирта, радиочастотная абляция. В соответствующих случаях они также могут применяться вместе с хирургическим вмешательством. При проведении операции следует учитывать, что оставшаяся печень должна быть достаточного качества и размера для поддержания здоровой жизни пациента. Если хирургическое удаление опухоли в печени нецелесообразно, может быть использована трансплантация печени. Существует множество причин, которые приводят к трансплантации печени. Опухоли печени – одна из них. Если опухоль отвечает соответствующим критериям, то трансплантация печени является наиболее идеальным методом лечения с точки зрения результатов. При трансплантации печени больная печень с потенциальным риском развития опухоли полностью удаляется. На ее место пересаживается здоровая печень. Риск рецидива опухоли у пациентов, перенесших трансплантацию, ниже.
Как распознается рак печени?
Рак печени на ранних стадиях не имеет специфических признаков. Поэтому при постановке диагноза обычно обнаруживается, что рак достиг больших размеров. Часто наблюдаются такие признаки, как снижение массы тела, потеря аппетита, слабость, утомляемость, желтуха, скопление жидкости в брюшной полости. Иногда может возникать ощущение боли и полноты в правой верхней части живота. Поскольку на фоне рака часто присутствует хроническое заболевание печени (например, цирроз), а эти заболевания нередко дают сходные симптомы, случай можно спутать. Хотя рак печени занимает 6-е место в мире по распространенности, в нашей стране он встречается чаще из-за большого числа заболеваний, связанных с циррозом. Поэтому пациенты с хроническим гепатитом и циррозом печени на ранней стадии должны находиться под рентгенологическим наблюдением с помощью таких методов, как УЗИ и, при необходимости, МРТ и КТ с интервалом 6 месяцев – 1 год, для исключения риска развития опухоли.
Где рак печени вызывает боль?
Часто наблюдаются такие признаки, как снижение массы тела, потеря аппетита, слабость, утомляемость, желтуха, скопление жидкости в брюшной полости. Иногда может возникать ощущение боли и полноты в правой верхней части живота.
Кто может заболеть раком печени?
Опухоли печени, развивающиеся у больных гепатитом В и гепатитом С или циррозом, в раннем периоде часто могут протекать бессимптомно. Гепатит В и гепатит С являются одними из наиболее распространенных заболеваний в нашей стране. Наличие вируса гепатита также является важным фактором риска развития рака печени.
В каком возрасте возникает рак печени?
Средний возраст при диагностике рака печени составляет 62 года. Более 90% пациентов с диагнозом рака печени старше 45 лет, 3% – в возрасте 35-44 лет и менее 3% – моложе 35 лет.
Сколько стадий рака печени?
Для планирования лечения рака печени в первую очередь необходимо провести стадирование. Рак печени принято разделять на 4 стадии:
Стадия 1: При раке печени опухолевая ткань располагается в печени и не затрагивает другие органы и структуры.
2 стадия: При раке печени в ткани печени располагаются небольшие опухолевые образования или обнаруживается злокачественная опухолевая ткань, достигшая кровеносных сосудов.
Стадия 3: При раке печени в ткань печени проникает несколько крупных опухолей или одна крупная опухоль проникает в крупный кровеносный сосуд.
Стадия 4: При раке печени рак печени уже дал метастазы и распространился на другие части тела.
Что полезно при раке печени?
Что полезно при раке печени? Этот вопрос часто задают пользователи. В лечении рака печени нет места вспомогательным средствам или каким-либо продуктам питания/напиткам. Любой продукт, о котором говорят, что он полезен, никогда не следует использовать без консультации с врачом.
На что указывает образование в печени?
Образование в печени также называется опухолью. Как правило, это доброкачественные или злокачественные опухоли, возникающие из собственных тканей органа. С другой стороны, могут встречаться и доброкачественные образования, распространившиеся на печень в результате другого заболевания.
Опасно ли образование в печени?
Большинство образований в печени являются доброкачественными опухолями. Хотя большинство злокачественных опухолей являются метастазами, распространившимися в печень из других органов, нередко встречаются и образования, сформировавшиеся в собственной ткани печени.
Вызывает ли образование в печени боль?
На ранних стадиях рак печени может не проявляться никакими симптомами. По мере увеличения образования в диаметре появляется диффузная боль в правой половине живота. На поздних стадиях сильные боли в животе сопровождаются потерей веса и вздутием живота.
Что такое доброкачественное образование в печени?
Наиболее распространенными доброкачественными опухолями печени являются гемангиома, аденома и фокальная узловая гиперплазия. Гемангиомы являются наиболее распространенными доброкачественными опухолями печени. Они не подвержены канцерогенезу и имеют низкий риск разрыва и кровотечения. Поэтому за пациентами обычно наблюдают с помощью серийных визуализационных исследований.
Как лечить образование в печени?
Наиболее эффективным методом является хирургическое удаление опухоли. Возможность хирургического лечения зависит от стадии опухоли и от того, распространилась ли она на окружающую область, а при наличии у пациента заболеваний печени – от степени ее поражения. При раке печени, распространившемся за пределы печени, хирургическое вмешательство не проводится. Успех операции также зависит от диаметра опухоли. Если хирургическое удаление опухоли в печени нецелесообразно, может быть использована трансплантация печени. Существует множество причин для трансплантации печени. Опухоли печени – одна из них.
Как распознать доброкачественную кисту печени?
Кисты печени обычно не вызывают никаких симптомов, и большинство из них являются доброкачественными. Кисты, не проявляющие себя симптомами, в большинстве случаев имеют небольшие размеры. Однако по мере роста кисты могут появляться некоторые жалобы в животе.
Сколько см киста печени опасна?
Выживаемость после операции значительно лучше у пациентов с опухолями диаметром менее 5 см по сравнению с опухолями более 5 см. Ожидаемая 5-летняя выживаемость после хирургического удаления при идеальных условиях (опухоль <5 см, одиночная, без инвазии) составляет около 60%.
Сколько времени занимает операция по удалению образований в печени?
Хотя это зависит от размера образования и наличия или отсутствия метастазов, это занимает примерно 1-2 часа.
Как предотвратить рак печени?
Для предотвращения рака печени необходимо проводить профилактику вирусов гепатита. Необходимо сделать прививку от вируса гепатита В, пока не стало слишком поздно. Следует также избегать чрезмерного употребления алкоголя, поскольку в долгосрочной перспективе он может стать причиной цирроза и рака печени. Если снизить риск ожирения и диабета с помощью здорового питания, то риск развития жировой болезни печени, цирроза и рака печени также снизится.
Каково значение применения интервенционной радиологии в лечении рака печени?
Виды интервенционного радиологического применения в лечении рака и их эффективность в последние годы постепенно увеличиваются по мере развития технологий. Наиболее важными из них являются радиочастотная (РЧ) и микроволновая (МВ) абляция, которая представляет собой выжигание опухоли иглой, введенной в опухоль под визуальным контролем через кожу, химиоэмболизация и радиоэмболизация (Yitrium 90-Y-90), при которых высокие дозы химиотерапевтических или радиоактивных препаратов, заряженных изотопами, вводятся в опухоль через кровеносные сосуды с помощью ангиографических методов и одновременно блокируют сосуды для прекращения питания опухоли и ее разрушения. Эти методы, обеспечивающие полное лечение небольших опухолей на ранних стадиях, могут быть использованы для замедления или остановки распространения опухоли или для уменьшения ее размеров у пациентов на поздних стадиях, когда другие методы лечения не могут быть применены.
Что отличает препарат Yitrium 90 при лечении рака печени?
Этот метод лечения, известный также как радиоэмболизация или селективная внутренняя радиотерапия (SIRT), основан на принципе достижения опухоли в печени через артерии и введения радиоизотопа иттрий-90, загруженного в микросферы, для получения дозы излучения, слишком высокой для внешнего облучения, что позволяет ликвидировать жизнеспособность опухоли. Лечение иттрием-90 проводится в два этапа. На первом этапе детально определяются печеночные артерии пациента, и если есть сосуды, связанные с желудочно-кишечным трактом, то они блокируются. Затем в печень вводится тестовый препарат, имитирующий реальный радиоактивный препарат Y90, и проводится подготовительная ангиография для проверки реального лечения. Для проведения подготовительной ангиографии пациент не нуждается в госпитализации. Если выясняется, что сосудистое русло печени пригодно для такого лечения, врач по ядерной медицине рассчитывает соответствующую лечебную дозу и определяет день проведения процедуры. Как правило, примерно через 7-10 дней после подготовительной ангиографии лечение вводится в печень с помощью ангиографии в рамках второго этапа процедуры.
Кто имеет право на лечение рака печени препаратом Ииттриум-90?
В группу пациентов, пригодных для лечения, входят больные, у которых имеющееся опухолевое заболевание ограничено печенью и не имеет значительного опухолевого очага за ее пределами. Кроме того, пригодность пациента к лечению оценивается и при проведении подготовительной ангиографии.
Возможно ли лечение метастазов в печени?
Лечение метастазов в печени зависит от происхождения распространения (рак какого органа), степени распространения (сколько метастазов находится в печени), расположения метастазов в печени и наличия распространения в других местах, помимо печени. Лимфомы, в частности, можно лечить с помощью определенных комбинаций химиотерапии. При раке молочной железы и раке легкого химиотерапия помогает частично. Лечение метастазов в печени необходимо отличать от лечения метастазов рака толстой кишки (колоректального рака). Колоректальные раки часто метастазируют в печень, и хирургическое удаление метастазов в печени очень важно с точки зрения лечения.
Что такое метастазы в печени?
Распространение рака в любой части тела от места его возникновения (органа) в другое место называется метастазированием этого рака. Появление таких метастазов в печени называется метастазированием в печень.
Является ли метастазирование в печень распространенным заболеванием?
Да, это так. Печень – это большой орган, который фильтрует кровь. Поэтому раковые клетки, попадающие в кровь, застревают в этом органе и продолжают расти. Метастазы в печень при раке органов пищеварительной системы (кишечника) встречаются особенно часто, поскольку кровь из этих органов сначала проходит через печень. Раковые опухоли таких органов, как толстый кишечник, желудок, поджелудочная железа, желчевыводящие пути и тонкий кишечник, часто метастазируют в печень. Также часто встречаются метастазы при раке молочной железы, раке легкого и лимфомах.
Какова продолжительность выживания при метастатическом раке печени?
Этот период варьируется от пациента к пациенту, зависит от вида лечения и многих параметров.
Является ли рак печени проблемой, которую можно решить с помощью лечения травами?
Травяные растворы не имеют места в лечении рака печени. Никогда не следует прибегать к лечению травами, не посоветовавшись с врачом.
Каковы факторы риска развития рака печени?
- Инфекции, вызванные вирусом гепатита В
- Инфекции, вызванные вирусом гепатита С
- Инфекции, вызванные вирусом гепатита D
- Афлатоксин (яд аспергиллус флавус)
- Цирроз
- Генетические, врожденные, метаболические заболевания
- Гемахроматоз, болезнь Вильсона, гликогеновая болезнь
- Химические вещества; нитриты, углеводороды, растворители
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ РАК ТОЛСТОЙ КИШКИ?
Рак толстой кишки – заболевание, развивающееся в последнем отделе пищеварительной системы, обычно называемом “толстой кишкой”, – в течение жизни встречается у каждого двадцатого человека.
Толстая и прямая кишки являются частью пищеварительной системы. Толстая кишка следует за тонкой и имеет длину около 1,5 м. Она начинается от слепой кишки в правой нижней части живота в виде перевернутой буквы U, поднимается вверх и пересекает брюшную полость в горизонтальном направлении, делая поворот под печенью. Она проходит под селезенкой, расположенной в левом верхнем углу, и снова делает поворот, поворачивает вниз с левой стороны и соединяется с прямой кишкой. Прямая кишка – это последний отдел пищеварительной системы длиной около 15 см, образующийся при расширении толстой кишки.
Рак толстой кишки начинается в клетках толстой кишки. По мере увеличения количества клеток он распространяется по толстой кишке по кругу, как кольцо салфетки. При ранней диагностике раковые клетки могут быть обнаружены только в толстой кишке. Если рак не диагностировать на ранней стадии, он может распространиться на близлежащие органы, лимфатические узлы и через кровоток попасть в печень, легкие и другие органы.
Важнейшим критерием успеха в лечении рака толстой кишки является ранняя диагностика. При выявлении рака толстой или прямой кишки на ранней стадии возможно полное избавление от заболевания.
ФАКТОРЫ РИСКА РАЗВИТИЯ РАКА ТОЛСТОЙ КИШКИ
В развитых странах заболеваемость раком толстой и прямой кишки в 4-10 раз выше, чем в развивающихся. Причинами возникновения рака толстой кишки можно назвать образ жизни, изменение факторов окружающей среды и наследственные генетические факторы.
Генетические факторы
Люди с семейным анамнезом колоректального рака имеют повышенный риск его возникновения. Наследственные генетические факторы повышают риск. Как семейные аденоматозные полипы в толстой кишке, так и наследственный неполипозный колоректальный рак, известный также как синдром Линча, повышают риск развития рака толстой кишки. Хотя на долю генетического рака толстой кишки приходится всего 5-10% случаев заболевания, люди с этими генетическими факторами имеют более молодой возраст начала заболевания и более высокий риск выживания по сравнению с другими пациентами с раком толстой кишки.
Наследственный неполипозный колоректальный рак (синдром Линча) является наиболее распространенным генетическим колоректальным раком. Он вызывается наследственной мутацией генов в результате несовместимого совпадения ДНК. Средний возраст постановки диагноза составляет 45 лет. Данный тип генной мутации предрасполагает к раку эндометрия (внутренней выстилки матки), яичников, тонкой кишки, мочеточников (мочеиспускательного канала) и почечной лоханки (бассейна почки).
Наличие онкологических заболеваний в семье человека и у его родственников первой степени родства существенно влияет на возникновение заболевания. Людям с семейным анамнезом рака толстой кишки следует начинать проходить колоноскопию за 10 лет до того возраста, в котором рак толстой кишки был выявлен у их родственников. Абсолютно здоровые люди, не имеющие семейного анамнеза рака толстой кишки и не предъявляющие никаких жалоб, должны проходить колоноскопию не реже одного раза, начиная с 50-летнего возраста. Вы можете легко записаться на прием к врачам-специалистам через Интернет.
ЧТО ВЫЗЫВАЕТ РАК ТОЛСТОЙ КИШКИ?
В возникновении рака толстой кишки играют роль чрезмерно жирное питание на основе красного мяса, ожирение, курение и употребление алкоголя, а также полипы. При обнаружении полипов в толстой кишке во время скрининговой колоноскопии можно предотвратить заболевание, удалив их до того, как они станут раковыми. Наличие в анамнезе рака молочной железы и яичников у женщин также повышает риск развития рака толстой кишки у этих лиц. Рекомендуется проводить скрининг на рак толстой кишки лицам с раком молочной железы и яичников в возрасте до 50 лет.
Полипы обычно начинают давать симптомы в позднем периоде, то есть когда они превращаются в рак. Лишь небольшая часть полипов переходит в рак. Однако, поскольку большинство раковых опухолей развивается из полипов, на эту проблему необходимо обратить внимание. Если рассматривать население в целом, то этот показатель составляет около 10-15%. В возрасте около 50 лет примерно 25% населения имеют различные виды полипов. В возрасте 70 лет этот показатель приближается к 50%, т.е. с возрастом частота полипов увеличивается.
Характеристика полипов;
- Оно не проходит само по себе.
- Он имеет генетические особенности. Пациенты, имеющие родственников первой степени родства с раком толстой кишки и полипами, выявленными при предыдущих обследованиях, составляют группу риска и требуют тщательного наблюдения.
- Размер полипов обычно составляет около 1 см. Полипы размером более 2 см могут представлять опасность и подлежат удалению.
- Такие симптомы, как сильная боль, кишечная непроходимость и потеря веса, обычно являются поздними симптомами. Такие проблемы, как геморрой и трещины заднего прохода, могут стать причиной задержек в диагностике и лечении рака прямой кишки у некоторых пациентов, поскольку имеют схожие симптомы. Эти симптомы могут вводить в заблуждение как пациентов, так и редко врачей. В целом, при кровотечениях из области прямой кишки в возрасте 40 лет и старше следует хорошо изучить возможность рака прямой кишки и толстого кишечника.
- Предотвратить образование полипов пока не представляется возможным. В группе риска находятся люди, ведущие малоподвижный образ жизни, люди, испытывающие чрезмерные стрессы, курящие и употребляющие алкоголь, страдающие ожирением, а также те, кто преимущественно употребляет красное мясо. Однако употребление в пищу продуктов с целлюлозой, отказ от курения, то есть все то, что регулирует работу кишечника, является важным фактором профилактики образования полипов.
Другие факторы риска рака толстого кишечника
Возраст: Хотя рак может возникнуть в любом возрасте, в основном он встречается у людей старше 50 лет. Риск развития рака толстой кишки увеличивается с возрастом. У пациентов старше 60 лет вероятность развития рака толстой и прямой кишки в 10 раз выше, чем у людей моложе 40 лет.
Воспаления кишечника: Существует в основном два типа воспаления кишечника. Первый – язвенный колит, представляющий собой изъязвление слизистой оболочки толстой кишки вследствие инфекции. Второй – болезнь Крона – периодически возникающее воспаление в любом отделе пищеварительной системы от рта до ануса или в нескольких отделах одновременно. Хотя это длительное хроническое заболевание, оно поддается лечению. В связи с высоким риском развития рака необходимо чаще проводить скрининговые исследования на рак толстой кишки.
Питание: Заболеваемость раком толстой и прямой кишки достаточно высока, особенно в США и европейских странах, где распространено потребление фастфуда. Употребление пищи без мякоти усиливает запоры, что приводит к длительному пребыванию каловых масс в кишечнике и вызывает рак в этой области. Деликатесы, маринованные, копченые блюда, продукты типа барбекю и жареная пища являются продуктами, вызывающими запоры. Кроме того, установлено, что употребление пищи, богатой фруктами, овощами, бобовыми, курицей и злаками, снижает уровень риска.
Ожирение: Избыточная масса тела повышает риск развития рака толстой кишки, независимо от того, мужчина это или женщина.
Курение: Многие исследования показали, что существует связь между курением и раком толстой кишки.
КАКОВЫ СИМПТОМЫ РАКА ТОЛСТОЙ КИШКИ?
На вопрос “Каковы симптомы рака толстой кишки?” можно ответить следующим образом. Наиболее распространенные симптомы рака толстой кишки:
- Постоянная диарея и запоры,
- Истончение большого мочевого пузыря, который всегда имеет нормальную толщину,
- Выделение крови из заднего прохода и обильное омовение,
- Это выделения, напоминающие яичный белок, при обильном омовении.
При прогрессировании рака толстой кишки и его непроходимости возникают вздутие живота и боли. При наличии таких жалоб необходимо обратиться к врачу для ранней диагностики.
- Ощущение, что кишечник не может достаточно опорожниться,
- Затрудненная дефекация
- Болезненная дефекация
- Необъяснимая потеря веса
- Рвота
Симптомы – одни из наиболее важных симптомов рака толстой кишки, также известного как рак ободочной кишки. Рак толстой кишки, поражающий правую сторону кишечника, и рак толстой кишки, поражающий левую сторону, могут давать разные симптомы. Поскольку левая сторона кишечника является более узкой, при раке этой области чаще возникают такие жалобы, как разжижение стула, кровотечение, изменение характера стула, в то время как при раке правой стороны, поскольку кишечник шире, рак здесь прогрессирует незаметно и дольше дает симптомы.
У пациента наблюдаются такие симптомы, как слабость, анемия, потеря аппетита и боль в животе. Болезненная дефекация, железодефицитная анемия, ощущение массы в животе – важные симптомы рака толстой кишки. Диагностика рака толстой кишки до прогрессирования заболевания значительно повышает шансы на жизнь. Поэтому очень важно следить за симптомами рака толстой кишки для ранней диагностики.
КАК ДИАГНОСТИРУЕТСЯ РАК ТОЛСТОЙ КИШКИ?
Рак толстого кишечника – это вид рака, который включен в программы скрининга. Наиболее эффективным способом профилактики рака или выявления заболевания на ранней стадии является регулярное проведение эндоскопических исследований. Наиболее важным из них является колоноскопия. Колоноскопия – это процедура, которая позволяет как обнаружить уже существующую опухоль на ранней стадии, так и выявить полипы и другие подобные проблемы, которые могут привести к раку, до того, как они станут раковыми, и защитить человека от развития рака. Каждому человеку старше 50 лет рекомендуется проходить колоноскопическое обследование с интервалом 2-5 лет в соответствии со статусом риска, личной историей болезни и семейным анамнезом. Сегодня подготовка и проведение колоноскопии стали намного проще и комфортнее для пациента. Новые колоноскопы очень просты в применении и позволяют получить желаемые результаты, не причиняя пациенту дискомфорта.
Диагностика рака толстой кишки проводится с помощью ряда тестов под руководством врачей-специалистов. После обращения пациента к врачу и физикального обследования выполняются соответственно следующие исследования;
- Исследование фекальной оккультной крови: Это очень простой тест, при котором небольшой образец фекалий исследуется в лаборатории.
- Рентгенологические исследования: Проводится рентгенография толстой кишки с двойным контрастированием и компьютерная томография.
- Лабораторные исследования: Проводится полный анализ крови и биохимические тесты. Среди них CEA (карциноэмбриональный антиген) – один из тестов, который может быть повышен в крови при раке толстой кишки и помогает в постановке диагноза.
- Эндоскопические исследования для постановки окончательного диагноза: Проводятся ректоскопия, сигмоидоскопия, колоноскопия и биопсия. Берется кусочек поражения и исследуется патологоанатомом.
Если в семье есть случаи заболевания раком толстой кишки в возрасте до 50 лет, то колоноскопия обязательна с 40 лет. Очень важно повторять колоноскопию раз в 5 лет. Кроме того, для выявления и ранней диагностики рака очень важно раз в год проверять кал на наличие скрытой крови в нем. Если у человека нет семейного анамнеза рака толстой кишки, то колоноскопию целесообразно проводить регулярно каждые 5 лет, начиная с 50-летнего возраста.
Классическая колоноскопия позволяет диагностировать наличие полипов или рака, а при наличии полипов у пациента – лечить их и предотвращать образование рака. Один раз в 5 лет это не должно составлять труда для пациента. Ведь в настоящее время колоноскопия – это процедура, которая проводится путем расслабления пациента с помощью внутривенной иглы и становится более переносимой с помощью седативных и обезболивающих средств.
КАКОВЫ МЕТОДЫ ЛЕЧЕНИЯ РАКА ТОЛСТОЙ КИШКИ?
При раке толстой кишки операция может не потребоваться, если рак выявлен на ранней стадии по полипам, взятым при колоноскопии. Необходимо лишь тщательное наблюдение. Колоноскопия имеет большое значение для диагностики полипов на ранней стадии, пока они не переросли в рак. Последние исследования показали, что рак толстой кишки можно в значительной степени предотвратить с помощью колоноскопии и удаления полипов на ранней стадии. По этой причине каждый мужчина после 45 лет и каждая женщина после 50 лет должны проходить скрининг фекальной оккультной крови и колоноскопию. Большое значение при проведении колоноскопии имеет комфорт пациента. Поэтому пациент находится в полубессознательном состоянии с помощью легкого внутривенного обезболивающего препарата, называемого “седацией с сознанием”. Предварительно кишечник должен быть полностью опорожнен различными методами. Затем в кишечник вводится фиброоптическая камера и удаляются все полипы. Однако здесь большое значение имеет опыт врача, проводящего колоноскопию, дезинфекция используемого прибора и высокое качество изображения.
Стандартным методом лечения распространенного рака толстой кишки является хирургическое вмешательство, т.е. удаление опухолевого очага вместе с некоторыми окружающими здоровыми тканями и лимфатическими узлами. Исследования показывают, что операция, выполненная в соответствии с принципами онкологии и опытными хирургами, является наиболее важным фактором для будущего пациента. При раке толстой кишки после операции назначается дополнительная, профилактическая химиотерапия в зависимости от стадии заболевания. Например, при “III стадии”, когда опухоль распространилась на лимфатические узлы, прилегающие к кишечнику, “адъювантная” химиотерапия (предотвращающая распространение заболевания) в настоящее время является стандартной практикой во всем мире.
При раке толстой кишки, при опухолях, расположенных очень близко к анусу, иногда неизбежно приходится отменять анус и переходить на дефекацию через брюшную полость (с помощью колостомических мешков). Однако в последние годы предоперационная химиотерапия в сочетании с лучевой терапией позволяет значительно сохранить анус. У больных, распространившихся на другие органы (метастатический), применяются все три метода лечения (операция, химиотерапия, лучевая терапия) в зависимости от общего состояния больного, возраста и степени распространения заболевания. Цель – увеличить продолжительность и качество жизни пациентов. Благодаря новым таргетным биологическим лекарственным препаратам, найденным в последние несколько лет, показатели успешности лечения растут с каждым днем.
Большое значение в профилактике рака толстой кишки имеют диета и скрининговые исследования. Важно употреблять большое количество волокнистой пищи, такой как овощи, фрукты и злаки, а также получать достаточное количество кальция и витамина D. В качестве вторичной профилактики особое значение имеют скрининговые исследования и ранняя диагностика. Для этого скрининговые тесты рекомендуется проводить для обоих полов, начиная с 50-летнего возраста. У лиц с семейным анамнезом рака толстой кишки скрининговые исследования следует начинать в более раннем возрасте.
ЧТО НЕОБХОДИМО УЧИТЫВАТЬ ДЛЯ ПРОФИЛАКТИКИ РАКА ТОЛСТОЙ КИШКИ
Хотя предотвратить рак толстой кишки пока невозможно, риск его возникновения можно снизить, если обратить внимание на такие вредные привычки, как неправильное питание, малоподвижный образ жизни, ожирение, курение и алкоголь. Для этого необходимо внести некоторые изменения в свою жизнь. К ним относятся;
- Питание: Питание, богатое фруктами, овощами и бобовыми, способствует снижению риска развития рака толстой кишки. Употребление красного мяса и алкоголя должно быть умеренным, так как они повышают риск развития рака толстой кишки. Здоровое питание и употребление продуктов с низким содержанием жиров поможет удерживать вес в определенном диапазоне.
- Физические упражнения: Исследования показали, что регулярные физические упражнения снижают риск развития рака толстой и прямой кишки, а также многих видов рака. Прежде чем приступить к выполнению программы физических упражнений, необходимо проконсультироваться с врачом. Врач поможет вам подобрать подходящую программу упражнений. Рекомендуется выполнять физические упражнения 5 или более дней в неделю по 30 минут. Упражнения продолжительностью от 45 минут до 1 часа могут принести больше пользы. Умеренные упражнения включают бодрую ходьбу, езду на велосипеде по ровной местности… Энергичные упражнения включают скалолазание и бег.
- Нестероидные противовоспалительные препараты (например, аспирин): По результатам исследований в толстой кишке можно предположить, что этот вид лекарств снижает риск развития рака. Они имеют потенциальную пользу при регулярном применении. Однако, если существует потенциальный риск развития рака толстой кишки, в ваших интересах использовать их под наблюдением врача. В противном случае это может принести вред, связанный с риском желудочного кровотечения.
- Кальций: Может принести определенную пользу при раке толстой кишки. Известно, что 1200 мг кальция, потребляемые ежедневно, снижают образование аденом толстой кишки на 20%, а прогрессирующих аденом – на 45%. Кроме того, установлено, что совместное употребление витамина D и кальция уменьшает форму аденомы.
- Витамин D – жирорастворимый витамин, содержащийся в таких пищевых продуктах, как обогащенное молоко, зерновые, скумбрия, лосось, тунец и некоторые виды рыбы, а также в солнечном свете. Предполагается, что витамин D играет важную роль в профилактике некоторых видов рака, в том числе рака толстой кишки.
- Скрининг и лечение предраковых (полипов, которые могут привести к раку) полипов: Скрининговые тесты, применяемые при раковых заболеваниях, особенно при раке молочной железы, не предотвращают развитие рака, но повышают процент успешного лечения, поскольку помогают поставить диагноз на ранней стадии. Развитие рака можно предотвратить с помощью скрининговых тестов, применяемых для выявления предраковых полипов. Удаление обнаруженных полипов может предотвратить развитие рака в дальнейшем.
- Профилактическое хирургическое вмешательство: Профилактическая операция может быть рекомендована людям с высоким риском развития колоректального рака. При такой операции толстая кишка, а иногда и прямая кишка, а также другие органы удаляются до развития рака. Однако этот вид операции может быть доступен только для пациентов с высоким риском развития рака толстой и прямой кишки. Прежде чем принять решение о проведении операции, необходимо обсудить с врачом ее преимущества и последствия.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ О РАКЕ ТОЛСТОЙ КИШКИ
Каковы стадии рака толстой кишки?
Рак толстой кишки имеет четыре стадии. На первой стадии рак распространился на стенку кишечника. На 2-й стадии рак распространяется на все слои кишечника. На 3-й стадии рак распространяется на лимфатические узлы. На четвертой стадии рак распространяется на такие места, как печень, брюшина и легкие.
В каком возрасте возникает рак толстой кишки?
Рак толстой кишки, который может возникнуть на любом этапе жизни, часто встречается в пожилом возрасте. Генетическая предрасположенность, гиподинамия, избыточная масса тела, избыточный вес, употребление алкоголя, табака и чрезмерное потребление переработанного мяса – вот основные риски при раке толстой кишки, где фактор преклонного возраста играет важную роль.
Какой самый важный симптом рака толстой кишки?
При раке толстой кишки одним из наиболее важных симптомов является кровотечение из 15-сантиметрового участка толстой кишки, расположенного вблизи ануса. Однако рак толстой кишки, исходящий из начального отдела толстой кишки, близкого к тонкой кишке, вызывает не ректальное, а оккультное кровотечение и проявляется анемией.
Как возникает кровотечение при раке толстой кишки?
Кровотечение из заднего прохода, являющееся одним из симптомов рака толстой кишки, может быть свежим, ярко-красным.
Можно ли полностью вылечить рак толстой кишки?
При многих видах рака заболевание может распространяться и переходить на различные органы. Как правило, рак толстой кишки может метастазировать в печень. Для предотвращения такой ситуации после операции может быть применена химиотерапия.
Можно ли вылечить рак толстой кишки с помощью операции?
Исследования, операции, выполненные в соответствии с принципами онкологии и проведенные опытными хирургами, являются наиболее важными факторами для будущего пациента.
Возникают ли рецидивы рака толстой кишки после операции?
При раке толстой кишки химиотерапия назначается после операции для профилактики рецидивов в зависимости от стадии заболевания.
Каков риск смерти от рака толстой кишки?
Рак толстой кишки, наиболее распространенный вид рака, занимает третье место среди причин смертности от онкологических заболеваний как у мужчин, так и у женщин. Однако риск смерти от рака толстой кишки может быть снижен при ранней диагностике и лечении.
Где возникает боль при раке толстой кишки?
При раке толстой кишки, симптомами которого являются диарея и запор, частое желание сходить в туалет и сильные боли в животе негативно влияют на качество жизни. Эти симптомы, приводящие к потере уверенности в себе, могут стать причиной психологически сложного периода. На этом этапе может быть оказана психологическая поддержка, при которой возможно возникновение депрессии и тревожных расстройств.
У меня нет семейного анамнеза рака толстой кишки или полипов. Следует ли мне начать обследование на рак толстой кишки?
Не исключено, что заболевания могут передаваться следующему поколению по наследству. Однако отсутствие семейного анамнеза не означает, что рак толстой кишки не будет наблюдаться. Поэтому даже в контрольных целях в раннем периоде необходимо проводить обследования.
Означают ли полипы, что у меня будет рак толстой кишки?
Полипы обычно являются доброкачественными. Однако вопрос о том, могут ли полипы вызывать рак или нет, должен решаться под наблюдением врача-специалиста.
Является ли рак толстой кишки генетическим?
При раке толстой кишки, в развитии которого важную роль играют факторы окружающей среды, возможна передача некоторых генетических нарушений от родителей к следующему поколению. Генетические нарушения могут развиваться под влиянием факторов окружающей среды.
Могут ли женщины заболеть раком толстой кишки?
Рак толстой кишки, известный как рак ободочной кишки, являющийся одним из наиболее опасных для жизни видов рака, может встречаться у мужчин и женщин независимо от пола.
Какую диету следует соблюдать для профилактики рака толстой кишки?
Специалисты считают, что диета средиземноморского типа играет важную роль в профилактике рака толстой кишки. Согласно исследованиям, чрезмерное потребление красного мяса может спровоцировать развитие рака толстой кишки. Согласно диете средиземноморского типа, потребление красного мяса сводится к минимуму, а овощи употребляются часто. Потребление свежих овощей и фруктов путем приготовления пищи в повседневной жизни является частью этой диеты.
Кто может заболеть раком толстой кишки?
Указывается, что он чаще встречается у людей старшего возраста, ведущих малоподвижный образ жизни, имеющих избыточную массу тела, употребляющих алкоголь и табак, а также потребляющих переработанные мясные продукты.
Где чаще всего встречается рак толстой кишки?
Согласно исследованиям, рак толстой кишки чаще встречается у представителей африканской и американской рас. В нашей стране это также распространенное онкологическое заболевание.
Можно ли обнаружить рак толстой кишки по анализу крови?
Рак толстой кишки нельзя диагностировать только по анализу крови. Необходимы дополнительные обследования.
Почему возникает рак толстой кишки?
Причины возникновения колоректального рака можно перечислить: образ жизни, неправильное питание, избыточная масса тела, изменение факторов окружающей среды и наследственно-генетические факторы
Излечим ли рак толстой кишки 4-й стадии?
На 4-й стадии хирургическое вмешательство не является предпочтительным. Химиотерапия и лучевая терапия направлены на уменьшение размеров раковых клеток. Лечение и прогноз для каждого пациента с 4-й стадией не одинаковы. Они зависят от степени распространения заболевания и реакции на лечение.
Является ли рак толстой кишки доброкачественным?
Рак толстой кишки – это злокачественная опухоль толстой кишки. Иногда доброкачественные полипы могут превращаться в рак.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ РАК МОЧЕВОГО ПУЗЫРЯ?
Мочевой пузырь, основной функцией которого в организме является хранение мочи, является органом, который может растягиваться по мере заполнения его пустой мочой. Рак мочевого пузыря обычно начинается из уротелиальных клеток слизистой оболочки, выстилающей внутреннюю поверхность мочевого пузыря. Опухоли мочевого пузыря могут быть злокачественными или доброкачественными. Однако встречаются и нераковые доброкачественные опухоли мочевого пузыря.
КАКОВЫ СИМПТОМЫ РАКА МОЧЕВОГО ПУЗЫРЯ?
Симптомы рака мочевого пузыря следующие;
- Кровь в моче (гематурия): При раке мочевого пузыря кровотечение в моче обычно безболезненно. В моче может быть видимое кровотечение, а также кровотечение, которое можно увидеть под микроскопом. Кровоизлияния могут быть не в целой моче, а в виде сгустков крови. Кровь в моче может быть вызвана многими причинами, кроме опухолей. Не следует забывать, что кровь в моче могут вызывать различные заболевания, например, камни в почках или инфекции.
- Болезненное мочеиспускание
- Частое мочеиспускание
- Ургентность мочеиспускания
- Дискомфорт, например затрудненное мочеиспускание или даже невозможность мочеиспускания из-за образования сгустков крови, может быть симптомом рака мочевого пузыря.
В некоторых случаях, когда появляются первые симптомы рака мочевого пузыря, рак может уже метастазировать в другую часть тела. Симптомы, возникающие у пациентов с метастазами, могут различаться в зависимости от области распространения рака. При прогрессирующих опухолях мочевого пузыря;
- Боль в спине
- Боль в нижней части живота
- Могут наблюдаться такие симптомы, как потеря аппетита и снижение веса.
КАКОВЫ ПРИЧИНЫ ВОЗНИКНОВЕНИЯ РАКА МОЧЕВОГО ПУЗЫРЯ?
Хотя точная причина возникновения рака мочевого пузыря неизвестна, существуют факторы риска, которые могут его вызвать.
- Курение Наиболее распространенным фактором риска развития рака мочевого пузыря является курение и табакокурение. У курильщиков сигарет и табачных изделий риск развития рака мочевого пузыря в 4-7 раз выше, чем у некурящих. Пассивное курение также повышает риск.
- Возраст: Рак мочевого пузыря чаще встречается после определенного возраста. Большинство людей, у которых диагностируется рак мочевого пузыря, старше 50 лет.
- Пол: Вероятность развития рака мочевого пузыря у мужчин в 3-4 раза выше, чем у женщин. Однако широкое распространение сигарет среди женщин в последние годы привело к росту заболеваемости раком мочевого пузыря у женщин. Вероятность смерти от рака мочевого пузыря у женщин выше, чем у мужчин.
- Химические вещества Химические вещества, используемые в текстильной, резиновой, кожевенной, лакокрасочной, химической, аккумуляторной или полиграфической промышленности, повышают риск развития рака мочевого пузыря
- Принадлежность к белой расе
- Хронические инфекции мочевого пузыря
- Недостаточное потребление жидкости и чрезмерная задержка мочи
- Употребление большого количества продуктов с высоким содержанием жиров или добавок
- Семейный анамнез рака мочевого пузыря
- Риск развития рака мочевого пузыря выше у пациентов, получавших химиотерапию циклофосфамидом, а также у пациентов, перенесших по другим причинам лучевую терапию на прилегающие области мочевого пузыря.
КАК ДИАГНОСТИРУЕТСЯ РАК МОЧЕВОГО ПУЗЫРЯ?
Рак мочевого пузыря выявляется по симптомам или в результате подозрений при плановом обследовании. Прежде всего, необходимо обследование у опытного врача-уролога.
Урологическое обследование
Сначала уролог оценит факторы риска развития рака мочевого пузыря, такие как генетика, курение или радиационное облучение. Уролог проведет физикальное обследование;
- Провести системный осмотр и определить наличие признаков рака.
- Проверяется наличие абдоминальной и печеночной дистензии.
- Проверяется наличие увеличенных лимфатических узлов в паху, брюшной полости и на шее.
При патологии и подозрении на рак мочевого пузыря могут быть запрошены дополнительные исследования для уточнения диагноза.
Анализ мочи при раке мочевого пузыря
- Анализ мочи; это простой лабораторный тест. Он проводится для проверки наличия крови и других веществ в образце мочи.
- Цитология мочи: Образец мочи исследуется под микроскопом на предмет наличия раковых клеток.
- Культура мочи: Какие микробы исследуются в образце мочи, хранящемся в лаборатории. Это важно для определения наличия инфекции мочевого пузыря.
- Тесты на определение опухолевых маркеров в моче: Чувствительный и специфичный маркер пока не найден. Эти тесты позволяют обнаружить вещества, выделяемые в кровь клетками рака мочевого пузыря.
Диагностика рака мочевого пузыря методами визуализации
- Ультразвуковое исследование (УЗИ): Ультразвуковое исследование, не требующее введения контрастного вещества, легко обнаруживает опухоли мочевого пузыря размером более 5 мм, а также помогает определить, не заблокированы ли почки или мочеточники. Ультразвук также может быть использован для определения размеров рака мочевого пузыря и того, распространился ли он на близлежащие органы или ткани.
- Компьютерная томография (КТ-урограмма): Позволяет получить информацию о размерах, форме и расположении всех опухолей в мочевыводящих путях, включая мочевой пузырь. Кроме того, с ее помощью можно увидеть увеличенные лимфатические узлы, в которых может находиться рак, а также другие органы в брюшной полости и тазу. Иногда для получения более детального изображения пациенту вводят контрастное вещество через рот или внутривенно. Пациенты с аллергией на йод и другие вещества должны заранее сообщить об этом врачу.
- Внутривенная пиелограмма (IVP): Этот метод, использовавшийся в прошлом для определения аномалий мочевого пузыря и мочевыделительной системы, заменен более новыми методами, дающими более полную информацию.
- Ретроградная пиелограмма: Процедура аналогична внутривенной пиелограмме. Контрастное вещество вводится не внутривенно, а непосредственно в мочевыделительную систему с помощью цистоскопии. Процедура ретроградной пиелограммы используется для выяснения причины, препятствующей нормальному оттоку мочи. Она также может помочь диагностировать рак в слизистой оболочке мочеточника или почки.
- МРТ (магнитно-резонансная томография): С его помощью можно измерить глубину и размер опухоли мочевого пузыря, а также визуализировать лимфу, по которой распространился рак. Для получения детального изображения опухоли и ее последствий пациенту необходимо ввести контрастное вещество.
- ПЭТ КТ: В организм пациента вводится небольшое количество радиоактивного вещества. Поскольку это радиоактивное вещество поглощается раковыми клетками, которые стремятся использовать энергию, визуализируется место распространения рака в организме. ПЭТ-КТ не принята в качестве стандартного метода визуализации при раке мочевого пузыря. Она может играть потенциальную роль в оценке метастатического рака мочевого пузыря.
- Рентгенография грудной клетки: Может использоваться для определения того, распространился ли рак мочевого пузыря на легкие. Если была проведена компьютерная томография грудной клетки, рентгенография грудной клетки не требуется.
Цистоскопия
Цистоскопия является одним из золотых стандартов диагностики рака мочевого пузыря. Тонкий гибкий эндоскоп со светом и камерой на конце используется для осмотра уретры и внутренней поверхности мочевого пузыря. Во время цистоскопии можно определить размер, расположение и характер роста аномалий в мочевом пузыре. Во время цистоскопии можно также проводить биопсию и брать образцы мочи.
Биопсия – трансуретральная резекция опухоли мочевого пузыря (TUR-BT)
Во время цистоскопии уролог берет кусочек аномальной ткани и отправляет его в лабораторию для исследования. Во время этой процедуры, которая также называется трансуретральной резекцией опухоли мочевого пузыря (ТУР-МП), может быть удален образец опухоли мочевого пузыря и близлежащей к опухоли мышцы мочевого пузыря. Во время биопсии врач может осмотреть мочевой пузырь и определить, не прощупываются ли в нем какие-либо образования. ТУР-БТ может также применяться при лечении немышечно-инвазивных опухолей мочевого пузыря.
ЛЕЧЕНИЕ РАКА МОЧЕВОГО ПУЗЫРЯ
Варианты лечения рака мочевого пузыря зависят от различных факторов, таких как общее состояние здоровья пациента, тип рака, его степень и стадия.
Хирургическое лечение рака мочевого пузыря
Вид хирургического лечения при раке мочевого пузыря может быть различным в зависимости от типа опухоли мочевого пузыря и стадии рака.
Операция ТУР (трансуретральная резекция): Трансуретральная резекция опухоли мочевого пузыря (ТУР) обычно используется для удаления опухолей, не являющихся мышечно-инвазивными, т.е. опухолей, расположенных в слизистой оболочке мочевого пузыря и не распространяющихся на мышечный слой стенки мочевого пузыря. ТУР также может быть использована для диагностики и стадирования рака мочевого пузыря.
Операция ТУР может проводиться под общим наркозом или под регионарной анестезией. Операция ТУР проводится без разреза на теле, через естественное отверстие в конце мочеиспускательного канала.
Во время операции ТУР врач-уролог проникает в мочевой пузырь с помощью эндоскопа с небольшим проводом в форме буквы “U” на конце. Раковая ткань разрезается электрическим током и удаляется из организма. При очень маленьких опухолях лечение сводится к выжиганию участка раковых клеток после удаления кусочка.
После операции ТУР уролог может рекомендовать проведение химиотерапии через катетер в мочевой пузырь один раз в неделю в течение 6-8 недель для уничтожения оставшихся раковых клеток и предотвращения рецидива.
Частичная или сегментарная цистэктомия: Хирургическое удаление опухоли и части мочевого пузыря. Роль операции частичной цистэктомии в лечении рака мочевого пузыря крайне ограничена и применяется только при лечении рака с особой гистологией.
Радикальная цистэктомия: Это хирургический метод, при котором вместе с опухолью удаляется весь мочевой пузырь и близлежащие ткани и органы. При радикальной цистэктомии, помимо мочевого пузыря, удаляется простата и семенные пузырьки у мужчин, а у необходимых пациентов – весь мочеиспускательный канал. У женщин в классическом понимании удаляются полностью или частично матка, фаллопиевы трубы, яичники и матка, однако в последние годы применяется и удаление мочевого пузыря с соблюдением безопасных пределов при сохранении гинекологических органов.
Как у мужчин, так и у женщин частью операции является также диссекция тазовых лимфатических узлов – удаление лимфы в тазу. Диссекция тазовых лимфатических узлов является наиболее точным способом выявления рака, распространившегося на лимфу.
При радикальной цистэктомии, которая может быть выполнена лапароскопически или роботизированно, хирургическое вмешательство может быть завершено с помощью небольших разрезов вместо больших разрезов при открытых операциях.
Новый мочевой пузырь из кишечника (реконструкция неомочевого пузыря): У пациентов, перенесших радикальную цистэктомию, мочевой пузырь удален, и им необходим новый путь отвода мочи из организма. Существуют различные виды операций по отводу мочи, включая методы, при которых новый мочевой пузырь создается из части кишечника. Какой метод отведения мочи подходит пациенту, решает врач-уролог, оценивая биологический возраст пациента, стадию заболевания и возможность проведения в дальнейшем таких видов лечения, как химио- и радиотерапия. Окончательное решение принимается после детального обсуждения с пациентом.
Химиотерапевтическое лечение рака мочевого пузыря
Он используется для уничтожения раковых клеток мочевого пузыря, распространившихся по всему организму. Жизнь без мочевого пузыря иногда может негативно влиять на социальную жизнь пациента. Химиотерапия и лучевая терапия могут быть использованы в качестве альтернативы удалению мочевого пузыря для подходящих пациентов, чтобы сохранить весь мочевой пузырь или его часть.
Химиотерапия при раке мочевого пузыря может проводиться двумя различными способами.
- Системная химиотерапия: Системная химиотерапия также известна как химиотерапия всего организма или внутривенная химиотерапия. При этом методе, применяемом врачом-онкологом, химиотерапевтические препараты, вводимые внутривенно, направлены на циркуляцию по всему организму и уничтожение раковых клеток. В отдельных случаях она применяется при метастазирующем раке мочевого пузыря или после операции радикальной цистэктомии. Системная химиотерапия может также использоваться для уменьшения размеров опухоли перед операцией.
- Внутрипузырная химиотерапия: Внутрипузырная или локальная химиотерапия обычно назначается урологом. Поскольку при поверхностном раке мочевого пузыря раковые клетки не достигают глубоких мышечных тканей, внутрипузырная химиотерапия может быть использована в качестве дополнения к ТУР у таких пациентов. При внутрипузырной химиотерапии лекарственные препараты доставляются в мочевой пузырь через катетер, введенный в уретру.
Лучевая терапия при раке мочевого пузыря
Он может применяться в дополнение к ТУР или после ТУР в сочетании с химиотерапией для лечения рака мочевого пузыря у пациентов, не подходящих для операции или не желающих хирургического лечения. Его можно предпочесть для уменьшения жалоб, вызванных опухолью, таких как боль, кровотечение или обструкция, а также при лечении метастазированного рака.
Иммунотерапия при раке мочевого пузыря
Иммунотерапия, называемая также биологическим лечением, представляет собой использование лекарственных препаратов, помогающих иммунной системе распознавать и уничтожать раковые клетки. При лечении рака мочевого пузыря иммунотерапия обычно проводится непосредственно в мочевом пузыре. В качестве стандартного препарата для иммунотерапии рака мочевого пузыря используется вакцина БЦЖ. Вакцина БЦЖ, вводимая в мочевой пузырь в виде жидкости через катетер, обеспечивает лечение за счет активации клеток иммунной системы в мочевом пузыре.
В последние годы положительные результаты дали исследования Т-клеток, которые поддерживают иммунную систему и, как известно, оказывают защитное действие против инфекций и рака.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ О РАКЕ МОЧЕВОГО ПУЗЫРЯ
Насколько распространен рак мочевого пузыря?
Рак мочевого пузыря занимает седьмое место по распространенности среди мужчин, реже встречается у женщин. Однако у женщин рак мочевого пузыря является более смертоносным. По оценкам Американского онкологического общества, в 2019 году в США рак мочевого пузыря будет диагностирован у 80 тыс. человек (62 тыс. мужчин и 18 тыс. женщин).
К какому врачу следует обратиться по поводу рака или доброкачественных опухолей мочевого пузыря?
Диагностикой и лечением рака мочевого пузыря или доброкачественных опухолей мочевого пузыря, которые могут возникнуть в любом возрасте, хотя обычно встречаются после 50 лет, занимаются врачи-урологи. Поскольку в лечении рака мочевого пузыря и доброкачественных опухолей мочевого пузыря применяются и хирургические методы, важно выбрать врача-уролога, специализирующегося в этой области.
Каковы типы рака мочевого пузыря?
Различные типы клеток в мочевом пузыре могут быть раковыми. Рак мочевого пузыря можно разделить на типы в зависимости от того, в какой клетке мочевого пузыря начинается рак. Тип и стадия рака мочевого пузыря определяются также с помощью тестов, используемых при диагностике рака мочевого пузыря.
- Уротелиальная карцинома, известная также как карцинома переходных клеток, является наиболее распространенным типом опухоли мочевого пузыря. Она возникает в уротелиальных клетках, выстилающих внутреннюю поверхность мочевого пузыря. Уротелиальные клетки встречаются и в других частях мочевыводящих путей. По этой причине пациентам с раком мочевого пузыря необходимо обследовать весь мочеиспускательный канал.
- Сквамозно-клеточная карцинома: Начинается с образования тонких плоских клеток в мочевом пузыре после длительной инфекции, раздражения мочевого пузыря или длительного использования катетера. Под микроскопом эти клетки выглядят очень похожими на плоские клетки, расположенные на поверхности кожи.
- Аденокарцинома Около 1% случаев рака мочевого пузыря составляют аденокарциномы. Она возникает в слизевыделяющих железах мочевого пузыря. Возникает после длительного раздражения или инфекции в мочевом пузыре.
- Мелкоклеточная карцинома: Менее 1% случаев рака мочевого пузыря составляют мелкоклеточные карциномы. Она начинается в нервных клетках, называемых нейроэндокринными. Такие раковые опухоли часто быстро растут и требуют химиотерапии, которая обычно применяется при мелкоклеточной карциноме легкого.
- Саркома: Саркомы зарождаются в мышечных клетках мочевого пузыря, но встречаются очень редко.
Классификация опухолей рака мочевого пузыря может быть также основана на микроскопических изображениях раковых клеток.
- Низкодифференцированная опухоль мочевого пузыря: Также называется хорошо дифференцированной опухолью мочевого пузыря. Внешний вид и организация раковых клеток близки к нормальным здоровым клеткам. Опухоль мочевого пузыря низкой степени растет медленнее.
- Опухоль мочевого пузыря высокой степени дифференцировки: Ее также называют плохо дифференцированной опухолью мочевого пузыря. Внешний вид раковых клеток и опухоли не похож на нормальные здоровые клетки. Опухоли мочевого пузыря высокого класса отличаются более агрессивным поведением.
Разновидностью рака мочевого пузыря может быть также близость к стенке мочевого пузыря.
В стенке мочевого пузыря имеется множество слоев различных клеток. Большинство случаев рака мочевого пузыря начинается во внутреннем слое мочевого пузыря при контакте с мочой и со временем распространяется на мышцы мочевого пузыря. Те из них, которые достигают мышечного слоя мочевого пузыря, впоследствии распространяются за пределы мочевого пузыря и на близлежащие соседние структуры. Рак мочевого пузыря может метастазировать в близлежащие лимфоузлы или другие части тела. Обычно рак мочевого пузыря распространяется на отдаленные лимфатические узлы, кости, легкие или печень.
- Неинвазивный рак мочевого пузыря: Это рак мочевого пузыря, который не распространяется на мышцы и остается во внутреннем слое. Его также называют поверхностным раком мочевого пузыря или раком мочевого пузыря на ранней стадии.
- Инвазивный рак мочевого пузыря: Это означает, что раковые клетки распространились глубже внутреннего слоя мочевого пузыря, в мышечный слой. Если не проводить лечение, существует риск распространения рака в другие части тела. Такие раковые опухоли имеют большую вероятность распространения и подлежат обязательному лечению.
Рак мочевого пузыря также дифференцируют в зависимости от способа его роста.
- Папиллярная уротелиальная карцинома: Папиллярные опухоли – это новообразования, начинающиеся в уротелиальных клетках слизистой оболочки мочевого пузыря и распространяющиеся во внутреннюю полость мочевого пузыря. Иногда, несмотря на рост, эти раковые опухоли остаются в мочевом пузыре, не распространяясь. Однако более агрессивные типы этого рака могут распространяться в более глубокие слои мочевого пузыря, а затем и в другие органы.
- Плоская карцинома (carcinoma insitu): Не прорастает в глубокую часть или внутреннюю полость мочевого пузыря. Это инвазивная форма опухоли, которая распространяется по стенке мочевого пузыря в виде плоского опухолевого слоя.
Каковы стадии рака мочевого пузыря?
Для определения стадии рака мочевого пузыря учитываются 3 критерия.
- Глубина залегания раковой опухоли в стенке мочевого пузыря и ее протяженность
- Распространилась ли опухоль мочевого пузыря на регионарные лимфатические узлы
- Исследуется, не метастазировал ли рак мочевого пузыря в другие органы, такие как легкие или печень.
Информация, полученная при патологоанатомическом исследовании, используется для выяснения того, какие участки мочевого пузыря являются раковыми, распространился ли рак от места своего возникновения и куда он распространился. Стадирование рака мочевого пузыря проводится в соответствии с международной системой TNM.
Риски и побочные эффекты хирургического лечения рака мочевого пузыря
Операция ТУР
- Побочные эффекты операции ТУР при раке мочевого пузыря обычно незначительны и длятся недолго. После ТУР могут наблюдаться боль при мочеиспускании и легкое кровотечение. Эти явления нормализуются в течение 1-2 недель.
- Несмотря на то, что опухоль мочевого пузыря полностью удалена после операции ТУР, возможен рецидив опухоли.
- Многократные операции ТУР могут привести к таким проблемам, как стеноз мочеиспускательного канала.
Радикальная цистэктомия и установка нового мочевого пузыря из кишечника или операция отведения петли подвздошной кишки
- Операция радикальной цистэктомии тяжелее, чем операция ТУР. Могут наблюдаться побочные эффекты анестезии.
- Кровотечение
- Инфекция
- Тромбы в ногах или легких
- Повреждение соседних органов
- Недержание или препятствие оттоку мочи
- У мужчин наблюдается исчезновение выработки спермы и проблемы с эрекцией. Проблемы с эрекцией и сексуальное нежелание могут быть предотвращены с помощью новых хирургических методик, щадящих нервы. У женщин может наступить менопауза и сексуальное нежелание, однако у пациентов соответствующего возраста предпочтение отдается органосохраняющим методикам.
Каким должно быть последующее наблюдение после лечения рака мочевого пузыря?
Поскольку после лечения у больных раком мочевого пузыря существует риск рецидива рака мочевого пузыря, процесс наблюдения за ними очень важен. Последующее наблюдение является важной частью лечения рака. Последующее наблюдение после лечения рака мочевого пузыря может варьироваться в зависимости от стадии и степени рака, а также от вида применяемого лечения. Вероятность рецидива рака мочевого пузыря высока в течение первых 2 лет после лечения, после чего наблюдение продлевается до 10 лет, хотя вероятность рецидива снижается.
Хотя процесс наблюдения за пациентом варьируется в зависимости от его состояния, в течение первого года важно обследоваться каждые 3 месяца. В ходе наблюдения проверяется состояние печени и лимфатических узлов, а мочевой пузырь осматривается с помощью цистоскопии, чтобы определить, нет ли рецидива в мочевом пузыре. При необходимости лечащий врач также использует такие методы визуализации, как КТ, МРТ, УЗИ, ПЭТ-КТ.
Какова продолжительность выживания при раке мочевого пузыря?
Выздоровление от рака мочевого пузыря или время выживания у разных людей разное. Успех зависит от типа рака мочевого пузыря, его стадии, количества и размера опухолей, характеристик рака, рецидивов, выбранных методов лечения и реакции пациента на лечение. Поэтому показатели выживаемости при раке мочевого пузыря фактически индивидуализированы. В исследовании Американского онкологического общества, учитывающем все стадии рака мочевого пузыря, 5-летняя выживаемость больных раком мочевого пузыря составляет 77%, 10-летняя – 70%, 15-летняя – 65%.
В какой орган чаще всего метастазирует рак мочевого пузыря?
Рак мочевого пузыря чаще всего дает метастазы в легкие, печень или кости.
Как следует питаться при раке мочевого пузыря?
Неизвестно, что именно снижает частоту рецидивов после лечения рака мочевого пузыря. Польза питания при развитии рака мочевого пузыря или после его лечения в научных исследованиях не выяснена. Однако отказ от курения, натуральное и сбалансированное питание и регулярные физические нагрузки могут быть полезны.
Существует ли травяной или натуральный метод лечения рака мочевого пузыря?
Не существует научных доказательств того, что диета, растительные препараты, витамины и минералы предотвращают развитие рака мочевого пузыря или снижают вероятность рецидива. Было проведено множество исследований на эту тему, и в целом рекомендуется натуральное и здоровое питание и активная подвижность.
Встречается ли рак мочевого пузыря у молодых людей?
Опухоль мочевого пузыря является распространенным заболеванием, как правило, в возрасте старше 50 лет. Однако на практике она наблюдается и в 20-летнем возрасте. Кроме того, частота опухолей мочевого пузыря у мужчин примерно в 4 раза выше, чем у женщин. Однако если опухоль встречается у женщин, то прогноз ее, как правило, хуже.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ МЕТАСТАТИЧЕСКИЙ РАК?

Метастазирование – это распространение раковой опухоли дальше от органа, в котором она возникла. Метастазирование становится заметным, когда раковые клетки распространяются из очага в другую часть тела по кровеносным или лимфатическим сосудам и образуют новые опухолевые очаги.
Рак может распространяться одним из трех способов:
- Через ткани: Рак может расти и распространяться из места возникновения в близлежащие области по соседству.
- Через лимфатическую систему: Через лимфатические сосуды раковые клетки могут распространяться в другие части тела.
- Через кровь: Раковые клетки могут перемещаться по кровеносным сосудам в другие части тела.
Лимфатические узлы являются наиболее распространенным местом метастазирования рака. Раковые клетки также имеют тенденцию распространяться в различные органы, такие как печень, мозг, легкие и кости. Некоторые виды рака чаще всего распространяются в определенные органы. Например, рак предстательной железы чаще всего распространяется в кости. Раковые клетки, возникшие в костной ткани, чаще всего оседают в легких.
КАКОВЫ СИМПТОМЫ МЕТАСТАТИЧЕСКОГО РАКА?
Жалобы (т.е. симптомы) метастатического рака зависят от типа рака и места его распространения. Например, при распространении рака в головной мозг, т.е. метастазах в мозг, могут наблюдаться головная боль, судороги, проблемы со зрением (нечеткость, двоение, дефекты поля зрения), головокружение, а при метастазах в печень – потеря аппетита, вздутие живота, раннее насыщение, несварение желудка, желтуха (пожелтение кожи или глаз).
В некоторых случаях раковые клетки могут распространяться даже после лечения первичного рака. Метастатические опухоли могут возникать через несколько месяцев или даже лет после первоначального лечения рака.
КАКОВЫ ОТЛИЧИТЕЛЬНЫЕ ОСОБЕННОСТИ МЕТАСТАЗИРОВАНИЯ?
Для того чтобы раковая клетка стала “метастатической”, она должна обладать следующими характеристиками:
Мобильность и вторжение
Инвазия – определяющая характеристика злокачественного новообразования – заключается в способности опухолевых клеток нарушать фундальную мембрану (тонкий, волокнистый, внеклеточный тканевый матрикс, отделяющий внутреннюю или внешнюю поверхность тела от нижележащей соединительной ткани) и проникать через нижележащую соединительную ткань (соединительную ткань опухоли). Подвижность, т.е. способность раковых клеток к перемещению, не является достаточным условием для метастазирования; если раковая клетка может успешно отделиться от опухолевого очага, но не выживает после этого, она не может метастазировать.
Возможность изменения вторичных зон
Раковые клетки привлекают новые клетки в локальное микроокружение, мобилизуют иммунные/воспалительные клетки, перестраивают другие ткани, изменяют метаболизм окружающей стромы, подавляют все противоопухолевые действия иммунной системы, манипулируют и изменяют поведение других раковых клеток. Восстанавливает внеклеточный матрикс и нормальное поведение других клеток.
Пластичность
Первичные или вторичные опухоли не являются статичными, на клеточном уровне они очень динамичны. Раковые клетки должны адаптировать свой метаболизм для удовлетворения потребностей, сопровождающих быстрый рост первичной опухоли и колонизацию различных метастатических очагов. Более того, неопластические клетки могут изменять скорость роста других клеток, лекарственную устойчивость и способность к метастазированию.
Способность колонизировать вторичные ткани
Колонизация вторичных тканей является отличительной чертой метастатического рака. Согласно исследованию Hurst-Welch, если опухолевая клетка или клетки отрываются от первичной опухоли, выживают, но не приживаются в других частях организма, то метастазирование невозможно.
КАКОВЫ ВОЗМОЖНОСТИ ЛЕЧЕНИЯ МЕТАСТАТИЧЕСКОГО РАКА?
Метастатический рак труднее поддается лечению, чем рак на ранних стадиях. Варианты лечения значительно отличаются для каждого типа рака. Действительно, не существует единого общепризнанного метода лечения рака или метастазов. По мере того как исследователи продолжают совершенствовать методы лечения, некоторые виды метастатического рака становятся все более излечимыми.
В некоторых клинических ситуациях метастазы можно лечить определенными способами.
При метастазах в головной мозг;
В зависимости от количества опухолей и степени распространения заболевания на остальные части тела, варианты лечения могут включать хирургическое вмешательство (в особых случаях), радиотерапию, операцию на гамма-ноже, интеллектуальную терапию, химиотерапию и/или стероиды.
При костных метастазах
Если костные метастазы не вызывают боли и не угрожают переломами, то за ними можно наблюдать во время системного лечения или лечить их медикаментозно. При наличии сильной боли или хрупкости костей может быть проведено хирургическое вмешательство и/или лучевая терапия в месте поражения. Известны нехимиотерапевтические препараты, снижающие риск боли и переломов при костных метастазах.
При метастазах в легкие
Лечение метастазов в легких зависит от количества и размера метастазов, а также от того, как лечится основной рак. В большинстве случаев они лечатся так же (теми же препаратами), как и основной рак. Если метастазы вызывают образование жидкости вокруг легкого, может быть проведена процедура удаления жидкости для облегчения дыхания (торакоцентез) и процедура герметизации легочных мембран для предотвращения повторного образования жидкости (плевродез).
При метастазах в печень
Существуют различные способы лечения метастазов в печени, зависящие от типа и степени распространения первичного рака, а также от количества и размеров метастазов в печени. В большинстве случаев метастазы в печени лечат тем же способом (теми же препаратами), что и первичный рак.
В случаях ограниченного заболевания, как первичного, так и метастатического, существуют различные новые подходы, например, хирургическое вмешательство и радиочастотная абляция (РЧА), радио- или химиоэмболизация (например, TARE, TAKE), микросферная терапия. Трансплантация печени при метастатическом заболевании, как правило, не является возможной.
Примечание В тех случаях, когда рак не поддается лечению, основным методом лечения является замедление роста раковой опухоли, уменьшение или облегчение вызываемых ею симптомов.
КАКОВЫ СТАДИИ МЕТАСТАЗИРОВАНИЯ?
Распространение раковых клеток на новые участки тела происходит по следующим этапам:
- Отделение от первичной опухоли
- Инвазия из тканей, окружающих очаг поражения, и проникновение через их базальную мембрану
- Попадание в кровеносные сосуды и выживание в крови. (Распространение через кровеносные сосуды называется гематогенным распространением)
- Попадание в лимфатическую или перитонеальную полость (так называемое лимфогенное распространение, распространяющееся по лимфатическим протокам)
- Легкие, печень, мозговые кости и т.д. достигают удаленного органа
- Образование нового очага поражения с новыми кровеносными сосудами, питающими опухоль (образование новых кровеносных сосудов называется ангиогенезом).
КАК КОНТРОЛИРОВАТЬ МЕТАСТАЗИРОВАНИЕ?
Некоторые виды рака являются метастатическими в момент постановки диагноза, другие становятся метастатическими после прогрессирования или рецидива рака. Для выявления метастазов врачи используют различные медицинские тесты:
Лабораторные исследования включают в себя проверку тканей организма, крови, мочи или других веществ в организме. Эти анализы помогают специалистам узнать, как работают органы пациента.
Для визуализации используются рентгеновские лучи, магниты, радиоволны и компьютерные технологии. Эти тесты создают детальные изображения костей и внутренних органов и структур для проверки на наличие рака.
ПОЧЕМУ МЕТАСТАЗИРОВАНИЕ ОПАСНО?
Метастазирование имеет большое значение, поскольку большинство случаев смерти от рака происходит в результате распространения первичной опухоли на отдаленные участки. В большинстве случаев онкологические больные с локализованными опухолями имеют больше шансов на выживание, чем больные с метастатическими опухолями.
Новые данные свидетельствуют о том, что у 60%-70% пациентов метастатический процесс начинается уже на момент постановки диагноза. Кроме того, даже пациенты, у которых на момент постановки диагноза отсутствуют признаки распространения опухоли, подвержены риску метастазирования.
ЧТО ТАКОЕ ТЕОРИЯ МЕТАСТАЗ СЕМЯН И ПОЧВЫ?
Некоторые органы более склонны к метастазированию первичных опухолей, чем другие. Впервые об этом заговорил Стивен Пейджет сто лет назад, в 1889 году, как о теории “семян и почвы”. Например, кости являются предпочтительным местом для рака простаты, рак толстой кишки распространяется в печень, рак желудка может метастазировать в яичники. Теория утверждает, что раковым клеткам трудно выжить вне своего первичного очага. Другими словами, для распространения раковым клеткам необходимо найти место со сходными характеристиками. Например, раковым клеткам молочной железы для размножения необходимы ионы кальция из грудного молока. Поэтому, поскольку кости богаты кальцием, кость может быть местом распространения.
Злокачественная меланома поддерживает меланоциты и нервы и поэтому может распространяться в мозг, поскольку нервная ткань и меланоциты происходят из одной и той же клеточной линии в эмбрионе.
Теория “семян и почвы” была опровергнута Джеймсом Юингом в 1928 году. Юинг предположил, что метастазирование происходит чисто анатомическим и механическим путем. Юинг постулировал распространение по лимфатическим каналам и кровеносным сосудам, отмечая, что раковые клетки поражают региональные лимфатические узлы, расположенные вблизи первичной опухоли.
МОЖНО ЛИ ПРЕДОТВРАТИТЬ МЕТАСТАЗИРОВАНИЕ?
Риск развития вторичного рака зависит от многих факторов, таких как тип рака и возраст пациента. Хотя у значительной группы пациентов удается предотвратить метастазирование, полностью предотвратить его, к сожалению, пока не удается.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ РАК ЖЕЛУДКА?
Рак желудка, занимающий 4-е место по распространенности среди всех онкологических заболеваний, локализуется в любой части желудка и, как правило, может распространяться на такие органы, как лимфатические узлы, печень и легкие. Рак желудка возникает в результате развития злокачественных опухолей в слизистой оболочке желудка по различным причинам. Рак желудка, являющийся одним из наиболее распространенных онкологических заболеваний в нашей стране, ежегодно уносит жизни 800 тыс. человек в мире. Рак желудка, который чаще встречается у мужчин, чем у женщин, благодаря развитию технологий в последние годы можно диагностировать на ранних стадиях и контролировать с помощью правильного лечения. Предупредить рак желудка и избавиться от него можно с помощью квалифицированного контроля и правильного питания.
КАКОВЫ СИМПТОМЫ РАКА ЖЕЛУДКА?
На ранних стадиях рак желудка может не давать никаких симптомов. Первыми симптомами рака желудка являются несварение и вздутие живота. Нежелание есть мясную пищу также относится к симптомам рака желудка. На более поздних стадиях рака желудка наблюдаются боли в животе, тошнота, рвота, вздутие живота после еды, потеря веса. Особенно пациенты старше 40 лет, у которых ранее не было подобных жалоб, должны обязательно обращать внимание на несварение желудка и потерю веса.
Симптомы рака желудка очень важны для выявления заболевания на ранней стадии. Как только вы заметили различные нарушения в работе пищеварительной системы, боли в области желудка и жалобы на несварение, необходимо обратиться к врачу-специалисту, чтобы выявить рак желудка на ранней стадии.
Вкратце можно перечислить следующие симптомы рака желудка.
- Повышенная кислотность и отрыжка: Повышенная кислотность желудка и отрыжка – очень частые симптомы при раке желудка. Однако это не означает, что все, кто испытывает эти жалобы, больны раком желудка.
- Чувство сытости Одним из характерных симптомов рака желудка является ощущение сытости раньше, чем обычно, во время приема пищи. Длительное ощущение сытости может привести к потере веса.
- Кровотечение и усталость: На ранних стадиях рак желудка может вызывать кровотечения в желудке. Непрерывное кровотечение может также вызвать анемию. По мере уменьшения количества красных кровяных телец вы можете начать выглядеть бледнее и испытывать одышку. В некоторых случаях может возникнуть рвота кровью.
- Тромбы: У людей с раком желудка повышена вероятность образования тромбов. Поэтому при внезапной боли в груди, одышке и отеках ног необходимо срочно предотвратить образование тромбов. В этом случае необходимо немедленно обратиться к врачу-специалисту.
- Тошнота и затрудненное глотание: Тошнота и дисфагия – очень важные симптомы рака желудка. Это два наиболее характерных симптома, которые наблюдаются более чем у половины людей с раком желудка. Эти симптомы сопровождаются болью в желудке или под грудной костью.
- Симптомы прогрессирующего рака желудка: При прогрессировании рака желудка могут наблюдаться кровь в стуле, жидкость в брюшной полости, потеря аппетита и снижение веса.
Иногда рак желудка может прогрессировать скрытно, без каких-либо симптомов. При появлении симптомов в поздние сроки пациент может потерять шанс на оперативное вмешательство. Поэтому при раке желудка очень важна ранняя диагностика.
ЧТО ВЫЗЫВАЕТ РАК ЖЕЛУДКА?
Рак желудка может иметь множество причин. Рак желудка может развиваться и распространяться в любой части органов пищеварительной системы. Поведение и факторы риска, влияющие на все органы, участвующие в процессе пищеварения, также могут спровоцировать развитие рака желудка. Их можно перечислить следующим образом;
- Диета: Важнейшей причиной рака желудка является неправильное питание. Особенно мясо, приготовленное на барбекю, и другие подобные продукты, пересоленные и маринованные овощи, обработанные пищевые продукты создают почву для развития рака желудка. Лучшим способом профилактики рака желудка является диета средиземноморского типа. Органические и свежие фрукты и овощи защищают от рака желудка.
- Инфекции: Важным фактором, вызывающим рак желудка, является инфекция H.plori.
Инфекция H.plori наблюдалась в 65-85% случаев рака желудка. Рак желудка также встречается в 2% случаев с инфекцией H.plori.
- Курение и алкоголь: Одной из предотвратимых причин рака желудка является курение. Особенно в сочетании с алкоголем оно повышает вероятность развития рака желудка. Риск развития рака желудка можно снизить, отказавшись от курения и алкоголя.
- Генетика: При раке желудка, как и при других видах рака, большое значение имеют генетические факторы. Генетические факторы выходят на первый план в 10% случаев рака желудка.
КАК РАСПОЗНАТЬ РАК ЖЕЛУДКА? КАК ЕГО ДИАГНОСТИРУЮТ?
Ранняя диагностика при раке желудка очень важна для успешного лечения. Поэтому очень важно, чтобы люди с заболеваниями желудка в ранние сроки проходили эндоскопию под контролем врачей-специалистов. При эндоскопии врач осматривает пищевод, желудок и первые отделы тонкой кишки с помощью длинной трубки с освещенной камерой. Если обнаруживаются участки, которые выглядят ненормальными, то для постановки окончательного диагноза берется биопсия. При правильном использовании эндоскопии можно выявить заболевание на ранней стадии. Помимо эндоскопии, другими важными диагностическими методами, позволяющими установить диагноз рака желудка, являются контрастная рентгенография и компьютерная томография.
Для определения стадии рака желудка и распространения его на другие органы необходимы дополнительные исследования. Эти исследования также необходимы для определения наиболее подходящего для пациента лечения. Могут применяться такие исследования, как компьютерная томография (КТ) для определения размера и локализации рака желудка, лапароскопия и МРТ для проверки распространения рака, ПЭТ-КТ, УЗИ почек, рентгенография грудной клетки.
ВИДЫ РАКА ЖЕЛУДКА
После постановки диагноза “рак желудка” и определения типа рака решается вопрос о применяемом лечении. Наиболее распространенным типом рака желудка является аденокарцинома. Типы рака желудка можно объяснить следующим образом;
- Аденокарцинома: 95 из каждых 100 случаев рака желудка являются аденокарциномой. Аденокарцинома, являющаяся наиболее распространенным видом рака желудка, зарождается в клетках выстилающей желудок железы.
- Сквамозно-клеточный рак: Сквамозно-клеточный рак, который лечится так же, как и аденокарцинома, представляет собой клетки, похожие на клетки кожи, расположенные между клетками желез, составляющих выстилку желудка.
- Лимфома желудка Лимфома желудка встречается очень редко, но она отличается от других видов рака желудка.
- Гастроинтестинальные стромальные опухоли (GIST):Редкие гастроинтестинальные стромальные опухоли (GIST) могут быть доброкачественными или злокачественными. Этот вид рака возникает в клетках соединительной ткани, поддерживающей органы пищеварительной (желудочно-кишечной) системы, чаще всего в желудке.
- Нейроэндокринные опухоли (NETs):Нейроэндокринные опухоли (NETs) могут быть доброкачественными или злокачественными (рак). Этот редкий вид рака обычно растет в гормонопродуцирующих тканях пищеварительной системы.
КАК ЛЕЧИТСЯ РАК ЖЕЛУДКА?
После установления диагноза рака желудка и определения типа рака решается вопрос о том, какое лечение будет применяться. Лечение рака желудка требует мультидисциплинарного подхода. Успех может быть достигнут при слаженной работе специалистов и хорошем оснащении больницы. При лечении рака желудка наиболее важной частью лечения является правильное удаление опухоли, вызвавшей рак. Успешные хирургические операции, проведенные на ранних стадиях, очень важны для продолжительности жизни пациента. В ходе операции может быть удалена часть или весь желудок пациента. У пациентов, у которых удален весь желудок, из кишечника изготавливается новый желудок, и пациент может продолжать нормальную жизнь. Пациентам, живущим таким образом, предлагаются диетические рекомендации, согласно которым они должны есть мало и часто. У некоторых пациентов после удаления желудка может быть применена лучевая терапия или медикаментозное лечение, в зависимости от формы рака, определяемой врачом.
ЛЕЧЕНИЕ ГИПЕРТЕРМИЕЙ ПРИ РАКЕ ЖЕЛУДКА
В ходе лечения, которое зависит от стадии рака желудка, применяется химиотерапия, если опухоль распространилась на лимфатические узлы. Химиотерапевтическое лечение, проводимое до операции, особенно при раке желудка, начиная со второй стадии, очень важно для повышения эффективности после операции. Кроме того, успешные результаты у подходящих пациентов дает горячая химиотерапия, называемая “гипертермией”, при лечении рака желудка. Горячая химиотерапия под названием “гипертермия” – это фактически метод лечения, который применяется в течение последних 20-30 лет. Этот метод, впервые примененный при раке женских половых органов, в последнее время часто используется при раке толстой кишки и желудка.
Хирургия рака желудка
Во время операции на желудке, которая занимает примерно 2-5 часов, удаляется большая часть желудка или весь желудок. После операции на желудке рекомендуется кормить пациента через частые промежутки времени, небольшими порциями, хорошо пережевывая и проглатывая пищу. После операции и лечения рака желудка следует продолжать регулярный контроль.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ О РАКЕ ЖЕЛУДКА
Вызывают ли шашлыки и копчености рак желудка?
Несмотря на популярность шашлыка, приготовление мяса на мангале до степени подгорания и использование слишком большого количества соли при мариновании приводит к превращению мяса в канцерогенный продукт. Особенно в восточных регионах мы чаще встречаем копченые продукты. Копченое мясо, рыба, сыр, маринованные продукты, сырое мясо, продукты, содержащие нитратные соли, консервированные и готовые продукты могут привести к раку желудка.
Как горячий чай влияет на желудок?
Хотя чай обычно пьют горячим, слишком горячий напиток вызывает раздражение слизистой пищевода и желудка. Это раздражение также подготавливает почву для развития рака. Горячий чай является одной из наиболее распространенных причин рака желудка в Черноморском и Восточно-Черноморском регионах.
Какова связь между курением и раком желудка?
Рак желудка чаще встречается у курильщиков. Однако рак желудка – это вид рака, который чаще встречается у людей с полипами в желудке, у людей с инфекцией helicobacter pylori или в азиатских обществах, потребляющих много копченостей и солений. Однако частота рака желудка снижается там, где люди имеют больший доступ к свежим фруктам и овощам.
Могут ли гастрит и язва перерасти в рак?
Инфекция Helicobacter pylori вызывает гастриты и язвы и является одной из причин рака желудка. В случае гастрита и язвы необходимо устранить эту бактерию. Кроме того, для профилактики рака желудка следует избегать курения и употребления алкоголя. Важным фактором, вызывающим рак желудка, является содержание цинка и свинца в воде, которую вы пьете. Кроме того, факторы окружающей среды, такие как тальк и асбестоз, содержащиеся в воздухе, которым вы дышите, также являются факторами риска.
Бывает ли неприятный запах изо рта у больных раком желудка?
В выходных отделах желудка людей, страдающих раком желудка, появляется мертвая ткань. В том месте, где находится эта мертвая ткань, выводятся бактерии, которые начинают питаться отсюда. Такая ситуация приводит к появлению крайне неприятного запаха. Однако если рак желудка уже достаточно развит, чтобы вызывать неприятный запах изо рта, значит, он уже дал о себе знать и другими проявлениями. Поэтому человеку с неприятным запахом изо рта не стоит беспокоиться о том, что причиной этого запаха является рак желудка.
Как подготовиться к химиотерапии при раке желудка?
В процессе лечения важно иметь помощника. Особенно в дни химиотерапии важно иметь помощника, следить за гигиеной и подготовиться к процессу химиотерапии, коротко подстригая волосы, так как они будут выпадать.
Как долго длится восстановительный период после операции по поводу рака желудка?
После операции на желудке может потребоваться время для адаптации к новой диете. В течение этого времени спазмы в животе могут ощущаться на дискомфортном уровне. Как правило, в процессе восстановления после операции по удалению рака желудка онкологические препараты можно принимать через 1 месяц.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ РАК ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ?
Поджелудочная железа – бифункциональная железа длиной 15 см, расположенная в брюшной полости, окружена желудком, тонким кишечником, селезенкой и печенью. Поджелудочная железа, выполняющая две основные задачи, называемые экзокринной и эндокринной, имеет две отдельные группы клеток, которые позволяют ей выполнять эти задачи. Экзокринная выделяет сок, способствующий пищеварению, и передает его в тонкий кишечник. Таким образом, углеводы, белки и жиры, содержащиеся в пище, разделяются и запасаются в виде энергии. Эндокринная функция старается поддерживать уровень глюкозы в крови на определенном уровне, выделяя гормоны гликоген и инсулин.
ЧТО ВЫЗЫВАЕТ РАК ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ?
Рак поджелудочной железы возникает, когда клетки поджелудочной железы начинают бесконтрольно размножаться. Чаще всего рак поджелудочной железы начинает формироваться в области расположения экзокринных клеток, окружающих протоки поджелудочной железы. Рак поджелудочной железы, начинающийся в этой области, представляет собой экзокринную опухоль, известную также как аденокарцинома. Гораздо более редкая разновидность рака поджелудочной железы – эндокринная опухоль – начинается в островковых клетках.
ВИДЫ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Рак поджелудочной железы подразделяется на редкий “нейроэндокринный” или “островково-клеточный” тип, возникающий в гормонпродуцирующих клетках, и более распространенный “экзокринный” тип, возникающий в протоках, выводящих панкреатический сок. При экзокринном раке поджелудочной железы реже встречаются кистозные опухоли и ацинарные типы клеток. Опухоли “Ampulla Vateri”, которые могут возникать в месте соединения поджелудочной железы и желчного протока с двенадцатиперстной кишкой, до операции не считаются отличными от рака поджелудочной железы.
ФАКТОРЫ РИСКА ПРИ РАКЕ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Хотя причины возникновения рака поджелудочной железы точно не известны, наиболее важными факторами риска формирования рака признаны курение и генетические факторы.
Основные известные причины возникновения рака поджелудочной железы можно перечислить следующим образом;
- Тридцать процентов случаев рака поджелудочной железы вызваны курением.
- Преклонный возраст является важным фактором риска развития рака поджелудочной железы.
- Диета, содержащая в основном белки и лишенная овощей и фруктов, повышает риск развития рака.
- Люди с высоким индексом массы тела (ИМТ) более склонны к развитию рака поджелудочной железы.
- Рак поджелудочной железы чаще встречается у людей, подвергающихся воздействию бензина и химических веществ.
- Хронический панкреатит, который долгое время не лечится, повышает риск развития рака поджелудочной железы.
- Диабет увеличивает частоту рака поджелудочной железы в 2 раза по сравнению со здоровыми людьми.
КАКОВЫ СИМПТОМЫ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ?
На первых стадиях рак поджелудочной железы может протекать бессимптомно. Когда симптомы начинают проявляться, заболевание часто оказывается запущенным.
Симптомами рака поджелудочной железы являются тошнота, потеря аппетита, снижение массы тела, медленно развивающаяся желтуха, непроходимость и боли в выходном отделе желудка. При раке, расположенном в головке поджелудочной железы, наблюдается безболезненная желтуха и светлый цвет большого пузыря, похожий на стеклянную замазку. Боль в спине, возникающая при раке поджелудочной железы, как правило, является предвестником местного распространения заболевания и обычно наблюдается в теле и хвосте поджелудочной железы и рассматривается как признак прогрессирования заболевания. Менее распространенными симптомами заболевания являются диабет, диарея и депрессия, которые мы можем вспомнить как “3 D”. Эти симптомы могут наблюдаться и при раке поджелудочной железы;
- Усиление боли в животе после еды или при принятии горизонтального положения
- Газовые боли, вздутие живота
- Рвота и потеря аппетита
- Темная или кровянистая моча
- Общее недомогание
- Увеличение печени и желчного пузыря
- Зуд
- Варикозное расширение вен
При появлении подобных симптомов необходимо немедленно обратиться к врачу.
ДИАГНОСТИКА РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Ранняя диагностика рака поджелудочной железы может быть не очень простой. Ведь на ранних стадиях рака поджелудочной железы нет никаких симптомов и находок. В отсутствии ранней диагностики играет роль и тот факт, что симптомы рака поджелудочной железы напоминают симптомы многих заболеваний, а также то, что поджелудочная железа скрыта за такими органами, как желудок, тонкий кишечник и печень.
Диагноз рака поджелудочной железы обычно ставится на основании детальной визуализации поджелудочной железы и ее окрестностей с помощью различных тестов. Стадирование используется для определения степени распространения раковых клеток в поджелудочную железу и за ее пределы (степень распространения рака). Для стадирования используются методы рентгенологической визуализации. Для правильного плана лечения рака поджелудочной железы очень важны ранняя диагностика и стадия рака.
Можно перечислить следующие тесты, применяемые для диагностики рака поджелудочной железы;
- История болезни и физикальное обследование пациента: Проводится общий физикальный осмотр пациента и опрос о перенесенных заболеваниях. Рассматриваются такие заболевания, как диабет и панкреатит, которые являются факторами риска развития рака поджелудочной железы.
- Анализ крови Анализ крови позволяет определить количество определенных веществ, например билирубина. Показатели, превышающие или снижающие норму, считаются признаком заболевания органов или тканей, выделяющих это вещество.
- Опухолевые маркеры: Чтобы определить наличие рака в крови или тканях, берется образец ткани, мочи или крови и проводятся некоторые измерения. В ходе этих измерений два опухолевых маркера, называемые CA 19. 9 и CEA, могут дать полезную информацию о раке поджелудочной железы. Эти тесты направлены не на постановку диагноза, а на наблюдение за пациентами с диагностированным раком поджелудочной железы. Здоровые люди таким исследованиям не подвергаются.
- Магнитно-резонансная томография (МРТ): МРТ является одним из важнейших методов визуализации при раке поджелудочной железы, как и при всех других онкологических заболеваниях. Она особенно эффективна для понимания взаимосвязи поджелудочной железы с окружающими тканями и печенью.
- Компьютерная томография (КТ): Является одним из наиболее надежных методов визуализации в диагностике рака. При проведении КТ, называемой также компьютерной или компьютерной аксиальной томографией, пациенту может быть введено контрастное вещество внутривенно или перорально для улучшения изображения.
- Позитронно-эмиссионная томография (ПЭТ-сканирование): ПЭТ-сканирование также используется для определения местоположения и размеров опухоли. Пациенту вводят небольшое количество глюкозы, меченной радионуклидами, и определяют места, где накапливается глюкоза. Поскольку раковые клетки накапливают больше глюкозы, они имеют более темный цвет и обнаруживаются.
- Абдоминальное ультразвуковое исследование При абдоминальном ультразвуковом исследовании в брюшную полость направляются высокоэнергетические звуковые волны. Эти звуковые волны ударяются о ткани и отражаются от них. Таким образом, визуализируются брюшная полость и органы.
- Эндоскопическое ультразвуковое исследование (ЭУЗИ): Это диагностический метод, обычно выполняемый путем введения через задний проход или рот эндоскопического прибора с осветительной и визуализирующей линзой на конце. Эхо, формируемое высокочастотными звуковыми волнами, улавливается прибором, и получается детальное изображение органов, называемое сонограммой, позволяющее при необходимости взять биопсию из подозрительных участков.
- Эндоскопическая ретроградная холангиопанкреатикография (ERCP): С помощью этого метода можно визуализировать проток поджелудочной железы, общий желчный проток и желчные протоки из двенадцатиперстной кишки. Через эндоскоп в протоки поджелудочной железы вводится небольшой трубчатый катетер и вводится контрастное вещество для получения детального изображения желчных протоков.
- Перкутанная транспеченочная холангиография (ПТХ): Через кожу с помощью ультразвука вводится катетер для доступа к желчным протокам. Желчные протоки визуализируются с помощью рентгеновских лучей с контрастным веществом, вводимым через катетер. При необходимости катетер оставляют на месте для оттока желчи. Эта процедура применяется только в тех случаях, когда невозможно выполнить ERCP.
- Лапароскопия: Это хирургический метод, позволяющий контролировать симптомы заболевания путем осмотра брюшной полости и внутренних органов изнутри. Через миллиметровые разрезы в брюшной стенке вводятся трубчатые инструменты, называемые портами. Камера и инструменты, вводимые через эти порты, используются для осмотра брюшной полости. Визуализируется расположение опухоли и то, распространилась ли она на брюшину или другие органы. Для диагностики может быть взята биопсия.
- Биопсия Это процесс взятия образца клетки или ткани для детального исследования раковых образований в ткани. Существует несколько различных методов биопсии при раке поджелудочной железы. Можно взять образец клеток из поджелудочной железы с помощью тонкой иглы во время рентгена или УЗИ, а также провести ту же процедуру во время лапароскопии.
СТАДИИ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Раковые клетки распространяются по всему организму через ткани, лимфатическую систему и кровь. Раковые клетки могут отделяться от основной опухоли и по кровеносным или лимфатическим сосудам перемещаться в другие части тела, образуя различные опухоли. Это называется метастазированием. Вторичные или метастатические опухоли имеют те же характеристики, что и основная опухоль. Стадии рака поджелудочной железы трудно определить с помощью визуализирующих тестов. Поэтому очень важно принять решение об удалении всей раковой опухоли до хирургического вмешательства. Стадии рака поджелудочной железы можно объяснить таким образом;
0: На этой стадии распространения нет. Рак поджелудочной железы ограничивается одним слоем клеток. Рак поджелудочной железы не виден ни при визуализации, ни невооруженным глазом.
Стадия I: На этой стадии рак растет локально. Рак поджелудочной железы ограничивается поджелудочной железой.
Стадия II: Рак поджелудочной железы растет за пределами поджелудочной железы или вблизи лимфатических узлов.
Стадия III: На этой стадии рак поджелудочной железы распространился более широко. Опухоль распространяется на близлежащие магистральные сосуды, лимфатические узлы или нервы, но не метастазирует.
IV стадия: На этой стадии рак поджелудочной железы распространяется на отдаленные органы, например, на печень.
ЛЕЧЕНИЕ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Лечение рака поджелудочной железы состоит из трех различных методов: хирургии, химиотерапии и радиотерапии. Это обусловливает вмешательство и контроль различных специалистов при лечении рака поджелудочной железы. Лечением рака поджелудочной железы занимаются врачи, специализирующиеся в области гастроэнтерологии, хирургии, медицинской онкологии, радиационной онкологии, интервенционной радиологии и многих других областях.
Большинство пациентов с раком поджелудочной железы не являются кандидатами на проведение лечебной операции из-за раннего распространения рака в отдаленные органы или распространенного местного поражения. Таким пациентам выполняются хирургические вмешательства для облегчения обструктивных симптомов, таких как желтуха и боль, которые не продлевают жизнь, но направлены на обеспечение более комфортного периода. В зависимости от общего состояния и сопутствующих заболеваний средняя продолжительность жизни пациентов, у которых рак поджелудочной железы распространился на другие органы тела, составляет от 3 до 6 месяцев. У пациентов с местным распространением заболевания средняя продолжительность жизни составляет от 6 до 10 месяцев.
Стадия заболевания играет очень важную роль в определении метода лечения рака поджелудочной железы.
Резектабельные (пригодные для хирургического вмешательства, операбельные): Если опухоль при раке поджелудочной железы резектабельна, то следует применить хирургическое вмешательство, которое является единственным методом лечения рака поджелудочной железы. Несмотря на удаление опухоли хирургическим методом, рак поджелудочной железы в большинстве случаев может рецидивировать. Химиотерапевтическое лечение гемцитабином (гемзар) или 5-ФУ после операции на поджелудочной железе может отсрочить рецидив рака на срок до 6 месяцев.
Местнораспространенный: Рак поджелудочной железы локально прогрессирует, но не распространяется на отдаленные органы. Если пациент не подходит для оперативного вмешательства, то вмешательства выполняются в соответствии с клиникой пациента. При обструкции желчных протоков может быть установлен стент. Если рак перекрывает участок кишечника, то с помощью шунтирования открывается новый путь между желудком и тонкой кишкой.
Метастатический (широко распространенный): Если рак поджелудочной железы распространился на брюшную полость, печень, легкие, кости и головной мозг, то одной радиотерапии или хирургического вмешательства недостаточно. Одним из стандартных методов лечения распространившегося рака поджелудочной железы является химиотерапия. В ходе этого лечения раковая опухоль
продлевает срок жизни пациента за счет уменьшения размеров.
Рецидив рака поджелудочной железы: После операции по удалению рака поджелудочной железы рецидив рака в той же области или рядом с ней называется рецидивом. Если рак рецидивирует в отдаленном месте, то сначала он возникает в печени. При рецидиве экзокринного рака поджелудочной железы планируется такое же лечение, как и при метастатическом раке, и пациент получает химиотерапию.
Нейроэндокринный рак поджелудочной железы (Pnet)
Резектабельные (пригодные для оперативного вмешательства): Если операция может быть выполнена, ее проводят, определяя соответствующую хирургическую технику в зависимости от типа, размера и расположения опухоли в поджелудочной железе. Для определения стадии и точного расположения опухоли может быть проведена предоперационная лапароскопия.
Нерезектабельные (не подлежащие оперативному вмешательству): Нейроэндокринные опухоли поджелудочной железы обычно растут медленно. При таких опухолях используется метод Gallium 68 DOTATOC, один из методов молекулярной визуализации, называемый визуализацией эндокринного рака, позволяющий исследовать опухоль. При лечении два метода применяются совместно. Для устранения проблем, вызванных гормоном, выделяемым опухолью, пациенту назначаются ингибиторы протонной помпы, называемые препаратами, снижающими секрецию кислоты в желудке. Затем для регрессии опухоли применяется химиотерапия, применение “умных” лекарств и/или целевых радиоизотопов.
ОПЕРАЦИЯ УИППЛА ПРИ РАКЕ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Операции по поводу рака поджелудочной железы являются наиболее трудными и сложными операциями в хирургии. Особенно в связи с риском осложнений, которые могут возникнуть в послеоперационном периоде, для пациента жизненно важно, чтобы и хирург, и больничные условия были на должном уровне.
Операция Уиппла при раке поджелудочной железы – это спасительная операция при опухолях головки поджелудочной железы, желчевыводящих путей и двенадцатиперстной кишки. Операция Уиппла идеально подходит для опухолей, расположенных в трех близко расположенных и связанных друг с другом органах, чтобы полностью очистить эту область. Во время операции Уиппла выполняется операция “Pylorus Protective Whipple” для защиты мышечной системы, которая также называется клапаном желудка. Таким образом, после операции не возникает жалоб со стороны пищеварительной системы. При операции Уиппла полностью удаляется головка поджелудочной железы, почти половина желудка, вся 12-перстная кишка и часть желчных протоков, прилегающая к этой области. Наиболее важным аспектом операции является обеспечение правильной координации этих органов друг с другом. Поэтому операция Уиппла должна выполняться врачами-специалистами.
ПЕРЕД ОПЕРАЦИЕЙ ПО УДАЛЕНИЮ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Примерно у 85% пациентов с диагнозом “рак поджелудочной железы” нет шансов на операцию. В этом случае используются некоторые варианты лечения. К ним относятся уменьшение размеров опухоли до операции и приведение ее в соответствие с хирургическим краем, а также поддерживающее лечение после операции.
ЛУЧЕВАЯ ТЕРАПИЯ ПРИ РАКЕ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Наиболее часто при лечении рака поджелудочной железы используется наружно-лучевая лучевая терапия. Как правило, химиотерапия и лучевая терапия применяются одновременно, поскольку они более эффективны. Одновременное проведение химио- и радиотерапии помогает уменьшить и уничтожить опухоль поджелудочной железы.
ХИМИОТЕРАПИЯ ПРИ РАКЕ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Химиотерапия, т.е. медикаментозное лечение, используется для того, чтобы остановить рост и деление клеток рака поджелудочной железы.
ТАРГЕТНАЯ ТЕРАПИЯ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Таргетная терапия рака поджелудочной железы – это метод лечения, направленный на определенные гены, белки или тканевую среду, которые способствуют росту и выживанию раковой опухоли.
ЛЕЧЕНИЕ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ С ПОМОЩЬЮ НАНОНОЖЕЙ
Важным вариантом для пациентов, у которых нет шансов на операцию при раке поджелудочной железы, является лечение абляцией наноножом. Это процедура, позволяющая разрушить опухоль, не оставляя повреждений в таких тканях, как сосуды, нервы и кишечник. Наиболее подходящей группой пациентов при раке поджелудочной железы, которая является одной из важнейших областей применения метода, являются больные, не имеющие отдаленных метастазов, но не могущие перенести операцию из-за вовлечения окружающих сосудов. В этой группе пациентов, называемой местно-распространенной стадией, нанонож может уничтожить окружающую опухолевую ткань, не повреждая вовлеченные сосуды, и сделать пациентов вновь пригодными для операции, либо увеличить время выживания за счет уменьшения размеров опухоли.
Пациенты, являющиеся кандидатами на операцию по поводу рака поджелудочной железы, должны быть внимательны перед операцией. Большое значение имеет общение пациента и врача перед операцией, полноценная операция и хорошая подготовка к ней, проведение всех обследований в соответствии с возрастом и общим состоянием пациента и принятие решений в соответствии с этими обследованиями, скрупулезное выполнение метода операции и предварительных обследований в соответствии с состоянием опухоли.
ЧТО ПРОИСХОДИТ ПОСЛЕ ЛЕЧЕНИЯ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ?
Операция по удалению рака поджелудочной железы является одной из основных операций в общей хирургии. Для ее эффективности важно иметь опытную хирургическую бригаду. Некоторым людям после таких операций может потребоваться снизить потребление сахара. После операции пациент должен следовать рекомендациям врача. Лечение зависит от состояния пациента и стадии заболевания. Может потребоваться химио- и радиотерапия. По окончании лечения врачи захотят наблюдать пациента через определенные промежутки времени. Эти назначения следует соблюдать. Врачам следует подробно рассказать о том, какой дискомфорт испытывает пациент. На контроле могут потребоваться различные обследования. Иногда после окончания лечения могут возникнуть побочные эффекты. О них необходимо сообщать врачам. Иногда в связи с раком может происходить потеря веса. В связи с этим врачи могут попросить пациента принять различные пищевые добавки или перейти на новый режим питания. Некоторые пациенты могут испытывать боль. О любой боли следует сообщать врачу. В этом случае может быть обеспечено эффективное и быстрое обезболивание. Правильное питание, регулярная физическая активность и поддержание здорового веса очень важны после лечения. При необходимости пациентам может потребоваться эмоциональная поддержка.
КАКОВЫ СИМПТОМЫ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ?
После операции Уиппла, которая является очень важной опцией в лечении рака поджелудочной железы, пациент может восстановиться и вернуться к нормальной жизни примерно через 6 месяцев. Операция, которая в последние 10 лет не рассматривалась как вариант для пациентов с диагнозом “рак поджелудочной железы”, в современных условиях является важной альтернативой для пациентов с множеством различных методов. Благодаря современным методам визуализации шансы пациента на операцию определяются заранее, и проводится соответствующее лечение. На смену длительным восстановительным периодам, связанным с открытыми операциями, которые приводят к большим разрезам на теле, пришли лапароскопические (закрытые) и роботизированные операции, которые позволяют быстрее вернуться к нормальной жизни, где эстетические проблемы исключены. Быстрое восстановление после операции позволяет пациентам быстрее получить дополнительные виды лечения, которые могут понадобиться. Таким образом, после лечения исчезают десять наиболее распространенных симптомов, указывающих на наличие рака поджелудочной железы; такие симптомы, как сильная тошнота, потеря аппетита, непроизвольная потеря веса, потемнение цвета мочи, непроходимость выходного отдела желудка, медленно развивающаяся желтуха, боли в спине, диарея, диабет и депрессия.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ О РАКЕ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Можно ли обнаружить рак поджелудочной железы с помощью УЗИ?
Рак поджелудочной железы может быть обнаружен с помощью таких методов, как УЗИ брюшной полости, МРТ, КТ, ПЭТ-сканирование.
Куда в первую очередь метастазирует рак поджелудочной железы?
На 4-й стадии рак поджелудочной железы может метастазировать в отдаленные органы. Сначала рак может распространиться в брюшную полость и печень. Затем он может распространиться на легкие и кости.
Как распознать заболевание поджелудочной железы?
Могут наблюдаться такие симптомы, как потеря аппетита, тошнота, потеря веса, изменение цвета стула, боли в спине, боли при газообразовании, слабость, зуд.
Кто может заболеть раком поджелудочной железы?
Риск развития рака поджелудочной железы чаще наблюдается у курильщиков, больных сахарным диабетом, хроническим воспалением поджелудочной железы, семейным анамнезом, ожирением, преклонным возрастом, а также у людей с недостаточным питанием.
Убивает ли рак поджелудочной железы?
Рак поджелудочной железы является одним из наиболее опасных видов рака, поскольку обычно выявляется поздно. Ранняя диагностика продлевает жизнь пациентов.
Можно ли выжить при раке поджелудочной железы?
При ранней диагностике рак поджелудочной железы является излечимым заболеванием.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
Рак предстательной железы
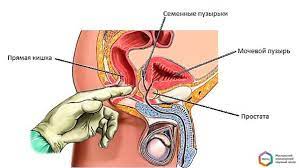
является одним из наиболее распространенных видов рака у мужчин, и если в мире его частота составляет 28 на 100 тыс. населения, то в нашей стране этот показатель несколько выше и составляет 37 на 100 тыс. населения. По данным Американского онкологического общества, риск столкнуться с раком простаты в течение жизни составляет 16,7%, а риск ухода из жизни – 2,5%. Каждый 5-6-й мужчина имеет пожизненный риск заболеть раком простаты. В мире каждые 3 минуты у одного человека диагностируется рак предстательной железы, а каждые 14 минут происходит потеря жизни из-за рака предстательной железы.
Рак предстательной железы – один из видов рака, при выявлении которого на ранних стадиях достигается высокий успех лечения. Поскольку на начальной стадии рак обычно не дает симптомов, каждый мужчина, начиная с 40-летнего возраста, должен ежегодно проходить обследование предстательной железы и сдавать анализы крови. Среди хирургических вмешательств, занимающих важное место в лечении рака предстательной железы, важное место занимает роботизированная хирургическая система “Да Винчи”, которая произвела революцию в медицине и дает пациенту важные привилегии в плане качества жизни, а также в плане избавления от рака. С помощью роботизированной хирургии можно лучше защитить нервы, обеспечивающие удержание мочи и продолжение половой жизни.
ГДЕ РАСПОЛОЖЕНА ПРЕДСТАТЕЛЬНАЯ ЖЕЛЕЗА И КАКИЕ ФУНКЦИИ ОНА ВЫПОЛНЯЕТ?
Предстательная железа, являющаяся частью мужской репродуктивной системы, представляет собой железу, расположенную чуть ниже мочевого пузыря, перед кишечником, и окружающую выходное отверстие мочевого пузыря. Предстательная железа, основной задачей которой является выработка жидкости, защищающей сперматозоиды, и здоровое хранение сперматозоидов в этой жидкости, также предотвращает недержание мочи, сдавливая устье мочевого пузыря мышцами сфинктера. Капсула простаты, разделенная на три области, окруженные капсулой, отделяет простату от других частей тела.
ЧТО ТАКОЕ ДОБРОКАЧЕСТВЕННОЕ УВЕЛИЧЕНИЕ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ?
С возрастом у мужчин увеличивается предстательная железа. Такое увеличение называется доброкачественной гиперплазией предстательной железы (доброкачественным увеличением простаты) и обычно происходит в переходной зоне простаты, окружающей уретру (мочеиспускательный канал). Увеличенная простата может блокировать мочевой пузырь или уретру, препятствуя оттоку мочи. У мужчин могут наблюдаться частые, болезненные, кровянистые выделения мочи или проблемы со спермой, а также скованность и боль в пояснице. Эти симптомы могут быть следствием доброкачественного увеличения предстательной железы или признаком рака.
ЧТО ТАКОЕ РАК ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ?
Рак предстательной железы развивается в простате – небольшой железе в форме грецкого ореха, которая является частью репродуктивной системы мужчины. Рак простаты возникает, когда клетки предстательной железы выходят из-под контроля. Сначала раковые клетки неконтролируемо разрастаются и распространяются в предстательной железе. Затем они распространяются на капсулу, окружающую простату, пробивают ее и выходят за пределы простаты. В отличие от доброкачественного увеличения предстательной железы, рак простаты возникает не из центра простаты, а из области, расположенной вблизи капсулы, в стороне от центра. Поэтому жалобы на мочеиспускание при раке простаты беспокоят пациента на более поздних стадиях. В период роста и распространения рака он может распространяться в близлежащие органы, лимфатическую систему и другие части тела через кровообращение. Поскольку рак предстательной железы имеет медленное течение, опухоль может проявлять очень агрессивный характер и распространяться на кости и другие органы.
СИМПТОМЫ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Симптомы рака предстательной железы могут проявляться в зависимости от прогрессирования заболевания. В этом отношении это коварное заболевание. Особенно на ранних стадиях симптомы и жалобы могут отсутствовать. При появлении симптомов рака предстательной железы пациент может потерять часть шансов на лечение, поэтому регулярный контроль врача имеет большое значение для успеха лечения.
Симптомы рака предстательной железы можно перечислить следующим образом;
- Затрудненное мочеиспускание
- Снижение силы струи мочи
- Кровь в сперме или моче
- Боль во время эякуляции
- Дискомфорт в паховой области
- Боль в костях
- Эректильная дисфункция
Эти симптомы, указывающие на рак предстательной железы, иногда могут быть признаком доброкачественного увеличения простаты. Подобные симптомы и жалобы могут наблюдаться и при доброкачественной гиперплазии предстательной железы (доброкачественном увеличении простаты), которая развивается вследствие увеличения предстательной железы. Если рак предстательной железы распространился на другие части и органы тела, он также может давать симптомы, связанные с этой областью. Например, если рак распространился на кости, могут появиться боли в костях…
ФАКТОРЫ РИСКА РАЗВИТИЯ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Причина возникновения рака предстательной железы точно не известна. Рак предстательной железы возникает, когда некоторые клетки простаты из-за генетических дефектов на клеточном уровне выходят из-под контроля и замещают нормальные клетки. При этом рак может распространяться на окружающие ткани, а на поздних стадиях – на отдаленные органы.
Причины и факторы риска развития рака предстательной железы можно перечислить следующим образом;
- Наследственные или генетические факторы
9% случаев рака предстательной железы являются наследственными, а у 15% больных раком предстательной железы заболевание наследуется от родственников первой степени родства по мужской линии. Мутация в гене BRCA2, которая, как известно, связана с раком груди и яичников у женщин, повышает риск развития рака предстательной железы у мужчин.
- Негенетические (экологические) факторы
Экологические факторы более эффективны, чем генетические, в отношении рака предстательной железы. Например, у китайца, живущего в Китае, риск развития рака предстательной железы очень низок по сравнению с американцем, в то время как у того же китайца при длительном проживании в США риск развития рака предстательной железы начинает быть таким же, как у американца.
- Влияние возраста
Риск развития рака предстательной железы увеличивается с возрастом. Рак предстательной железы редко встречается у мужчин в возрасте до 50 лет, а у мужчин старше 55 лет – часто. Известно, что в течение жизни рак предстательной железы будет диагностирован у каждого шестого мужчины. - Расовый фактор
Расовый фактор также имеет большое значение при раке предстательной железы. Чаще всего рак предстательной железы встречается у чернокожих мужчин, затем у белых. В редких случаях он встречается и у мужчин, проживающих на островах Азиатско-Тихоокеанского региона.
- Питание
Прямое влияние диеты на развитие рака предстательной железы не доказано. Более ранние исследования показали, что селен и витамин Е могут снижать риск развития рака предстательной железы, однако более четкие результаты более поздних исследований показали, что ни один из них не является полезным. Тем не менее, поскольку здоровое питание снижает риск развития рака, употребление нездоровой пищи может напрямую повышать риск развития рака предстательной железы.
ДИАГНОСТИКА РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Если результаты анализа крови на ПСА и/или ректального пальцевого исследования указывают на возможность рака предстательной железы, подозрение должно быть подтверждено биопсией. Рак предстательной железы диагностируется после одной или нескольких биопсий предстательной железы. Биопсия позволяет определить, есть ли у пациента доброкачественная гиперплазия предстательной железы, рак или другие медицинские проблемы. Во время биопсии через прямую кишку вводится игла и берется несколько небольших кусочков ткани предстательной железы. Эти образцы ткани анализируются под микроскопом, и в них обнаруживаются раковые клетки.
Для диагностики рака предстательной железы выполняются следующие виды сканирования;
Анализ крови на ПСА: Уровень ПСА в крови пациента с диагнозом “рак предстательной железы” равен количеству рака в организме. ПСА (простатоспецифический антиген) – это белок, вырабатываемый клетками предстательной железы, и чем выше его уровень в крови, тем более запущен рак предстательной железы. В то же время уровень ПСА чрезвычайно полезен для контроля успешности проводимого лечения или для обнаружения регенерации после операции.
Пальцевое обследование при ягодичном предлежании: Это один из наиболее часто используемых скрининговых тестов на рак предстательной железы. Простата пациента ощупывается пальцем, и по ее размерам и характеристикам определяются отклонения от нормы.
Трансректальная ультрасонография: При трансректальной ультрасонографии в прямую кишку вводится небольшой зонд. Зонд излучает высокочастотные звуковые волны, которые, ударяясь о предстательную железу, вызывают эхо и отражаются от нее. Компьютер использует эти эхо-сигналы для создания изображения сонограммы, на которой могут быть видны аномальные участки. В настоящее время проводятся исследования, показывающие, что трансректальная ультрасонография снижает риск выживания при раке предстательной железы.
Усовершенствованный тест на ПСА: В настоящее время ведутся работы по усовершенствованию теста на ПСА для получения более специфических результатов при раке поджелудочной железы. Чем четче результаты ПСА, тем меньше беспокойства испытывает пациент и тем меньше необходимость в других исследованиях.
Инсулиноподобный фактор роста: Инсулиноподобный фактор роста (IGF) является важным ростовым и антиапоптотическим (ингибирующим клеточную смерть) фактором для раковых клеток при многих видах рака. Связывающий белок-3 инсулиноподобного фактора роста (IGFBP-3) стимулирует апоптоз (гибель клеток) независимо от IGF-1 и подавляет рост. Последние исследования показывают, что высокий уровень IGF-I и низкий уровень GFBP-3, или повышенное соотношение обоих факторов, связаны с повышенным риском развития рака предстательной железы.
РАННЯЯ ДИАГНОСТИКА РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Как и в случае других онкологических заболеваний, ранняя диагностика рака предстательной железы позволяет снизить уровень смертности. Еще одним преимуществом ранней диагностики является минимизация побочных эффектов, связанных с лечением рака предстательной железы. Для раннего выявления рака предстательной железы используются анализ крови, измеряющий уровень белка, известного как простатический специфический антиген (ПСА), цифровое ректальное исследование и/или трансректальный ультразвуковой метод. Однако скрининг рака простаты – сложный и противоречивый вопрос, и нет достаточных доказательств того, что он снижает риск выживания. Более того, все скрининговые исследования сопряжены с определенным риском. Важно, чтобы неопределенности, связанные с пользой и потенциальным вредом, обсуждались с врачом-специалистом до начала скрининговых исследований рака предстательной железы. После обсуждения потенциальных преимуществ, неопределенностей и рисков скрининговых исследований пациент должен сам решить, проводить или не проводить скрининговые исследования.
СТАДИИ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Рак предстательной железы подразделяется на стадии в зависимости от степени его распространения. Важнейшими критериями стадирования являются распространение опухоли предстательной железы на окружающие ткани, такие как мочевой пузырь или прямая кишка, поражение лимфатических узлов и костей. Для определения стадий рака предстательной железы также важны показатель Глисона и уровень ПСА, которые указывают на степень распространения опухоли.
- Фаза
В 1-й стадии опухоль находится только в предстательной железе. Иногда она может быть слишком мала, чтобы ее можно было прощупать при ректальном исследовании. Оценка по шкале Глисона – 6 или ниже. Уровень ПСА ниже 10.
- Фаза
- На этой стадии опухоль еще находится в предстательной железе. Однако структура опухоли агрессивна. Она отчетливо прощупывается при пальцевом исследовании, либо степень выраженности опухоли может быть высокой.
- Фаза
- На этой стадии рак предстательной железы распространился за пределы простаты. Обычно он распространяется на семенные пузырьки. Однако он еще не распространился на кости и лимфатические узлы.
- Фаза
На этой стадии рак предстательной железы распространился на мочевой пузырь, прямую кишку или окружающие ткани (кроме семенных пузырьков). Рак также может распространиться на близлежащие лимфатические узлы и кости.
ЛЕЧЕНИЕ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
При лечении рака предстательной железы предпочтение может быть отдано различным методам лечения в зависимости от скорости роста раковой опухоли, ее распространения, общего состояния здоровья пациента и эффективности применяемого лечения, а также возможных побочных эффектов. Если рак предстательной железы находится на ранней стадии, то вместо немедленного лечения может быть рекомендовано наблюдение. Хирургия является одним из наиболее распространенных и эффективных методов лечения рака предстательной железы. Существуют роботизированные, лапароскопические и открытые хирургические методы, и каждый из них должен быть предпочтителен в зависимости от состояния пациента. Целью хирургического вмешательства является удаление всей предстательной железы. В соответствующих случаях нервы вокруг простаты, которые помогают эрекции полового члена, могут быть сохранены.
Предпочтительной операцией при ранних стадиях рака предстательной железы является лапароскопия. Радиотерапия (лучевая терапия) предстательной железы также является важным методом лечения у соответствующих пациентов. Лапароскопическая хирургия обеспечивает пациенту комфортный процесс операции и имеет высокие показатели успешности в плане борьбы с раком. После таких операций, которые проводятся через 4-5 небольших отверстий, пациент испытывает меньше боли и может в короткие сроки вернуться к повседневной деятельности. Поскольку хирургический разрез отсутствует, эти операции приносят пациенту большое удовлетворение с косметической точки зрения. Благодаря значительным достижениям в области диагностики и лечения рака предстательной железы это заболевание перестало вызывать опасения.
ЛЕЧЕНИЕ В ЗАВИСИМОСТИ ОТ СТАДИИ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Если рак предстательной железы находится в 1 или 2 стадии, то его можно лечить хирургическим вмешательством или радиотерапией. После этого можно начать гормональное лечение или действовать в зависимости от состояния пациента. При лечении рака предстательной железы в 3-й стадии планируется либо хирургическое вмешательство, либо лучевая терапия. Согласно проведенным исследованиям, установлено, что 5-месячная химиотерапия после операции и радиотерапии увеличивает продолжительность жизни при раке предстательной железы. У пациентов с уровнем ПСА выше 40, поражением лимфатических узлов или баллом Глисона выше 7 после операции или лучевой терапии в дополнение к гормональному лечению следует рассмотреть возможность проведения химиотерапии. При 4-й стадии основным методом лечения рака предстательной железы должна быть гормональная терапия. При гормональном лечении можно хирургически удалить яичники или блокировать мужской гормон с помощью инъекций каждые 1-3 месяца. После 2010 года в лечении рака предстательной железы 4-й стадии появилось много инноваций. Было показано, что некоторые препараты и химиотерапия значительно увеличивают продолжительность жизни при 4-й стадии. Кроме того, были разработаны некоторые препараты, которые применяются в тех случаях, когда традиционные блокаторы гормонов не помогают. Хотя вакцина против рака простаты была опробована, она не показала ожидаемого эффекта. Радиотерапевтические средства оказались эффективными только для пациентов с костными метастазами. Кроме того, в нашей стране возможно лечение рака простаты с помощью PSMA в сочетании с радиоактивным лютецием.
РОБОТИЗИРОВАННАЯ ХИРУРГИЯ DA VINCI
Операции по удалению рака предстательной железы, выполняемые с помощью роботизированной системы da Vinci, особенно важны для того, чтобы пациент не испытывал потери половой функции после операции. Для опытного лапароскопического хирурга манипуляторы робота da Vinci, обеспечивающие трехмерное изображение качества “высокой четкости” с 10-20-кратным увеличением, позволяют удалить раковую опухоль простаты и провести радикальное лечение, легко защитив нервы и сосуды в организме и даже в самом труднодоступном месте.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ О РАКЕ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Что такое предстательная железа?
Предстательная железа является частью мужской репродуктивной системы. Эта железа вырабатывает жидкость, которая смешивается со спермой во время эякуляции. Эта жидкость помогает сохранить сперматозоиды.
У кого выше риск развития рака предстательной железы?
Мужчины старше 55 лет более подвержены этому заболеванию. Риск развития рака предстательной железы увеличивается с возрастом. Так, около 60% случаев рака предстательной железы приходится на мужчин старше 65 лет. К другим факторам риска развития рака предстательной железы относятся:
- Этническая принадлежность (наибольший риск имеют чернокожие мужчины)
- Семейный анамнез рака предстательной железы
- Курение
- Ожирение
Каковы осложнения рака предстательной железы?
Некоторые агрессивные виды рака быстро распространяются за пределы предстательной железы (метастазируют). Чаще всего рак предстательной железы распространяется на кости и лимфатические узлы. Он также может развиваться в печени, головном мозге, легких и других органах.
Что такое ультрасонографическое исследование предстательной железы?
Ультрасонография – диагностический метод исследования внутренних органов с помощью звуковых волн с частотой, слишком высокой для человеческого уха. Прибор состоит из консоли, содержащей компьютерные и электронные элементы, экрана с видеодисплеем и частей, называемых зондами, с помощью которых производится сканирование тела. Ультрасонографическое исследование, применяемое для выявления доброкачественных и злокачественных образований предстательной железы, называется трансабдоминальным (TAUS), если оно проводится через переднюю брюшную стенку, и транректальным (TRUS), если оно проводится через задний проход.
Как проводится ультразвуковое исследование предстательной железы?
При процедуре TAUS ультразвуковой датчик помещается на живот, и предстательная железа визуализируется с помощью усиливающего воздействия ультразвуковых волн. Для проведения процедуры мочевой пузырь должен быть полным. Достаточно выпить 1,5 литра (примерно 6 стаканов) воды за 1,5-2 часа до процедуры. При процедуре TRUS предстательная железа визуализируется через задний проход с помощью специального ультразвукового зонда со стерильным покрытием. Поскольку для проведения этой процедуры требуется очищение кишечника, накануне необходимо выпить слабительное после ужина и опорожнить мочевой пузырь непосредственно перед процедурой.
Каковы преимущества ультрасонографии предстательной железы?
Важным преимуществом ультрасонографии при контроле простаты является то, что она не наносит вреда пациенту. Другими существенными преимуществами являются простота применения, низкая стоимость и отсутствие ионизирующего излучения. При трансабдоминальном УЗИ определяются размеры, масса и анатомическая форма предстательной железы. При трансректальном УЗИ, помимо этого, оцениваются также тканевые детали простаты. Во время этой процедуры могут использоваться методы цветной допплерографии и энергетической допплерографии для оценки кровоснабжения в зонах, где подозревается рак, а биопсия может быть проведена в ходе того же сеанса с предварительной подготовкой. Ультразвуковое исследование позволяет врачу получить подробную информацию о состоянии предстательной железы пациента, помочь в постановке правильного диагноза и планировании соответствующего лечения.
Какие меры можно предпринять против рака предстательной железы?
Существуют эффективные меры, позволяющие снизить риск развития рака предстательной железы, – от здорового и правильного питания до образа жизни. Ликопин, который придает красный цвет таким фруктам, как помидоры, арбузы, шиповник, розовый грейпфрут и папайя, является мощным антиоксидантом. Многие исследования показывают, что изофлавон, обладающий противовоспалительными свойствами, обеспечивает защиту от рака простаты. Употребление граната, особенно гранатового сока, защищает от рака простаты и позволяет держать под контролем уровень ПСА. Благодаря противовоспалительным свойствам куркумы, а также содержащемуся в ней веществу куркумину, куркума является отличным средством защиты от увеличения простаты и рака простаты. С другой стороны, различные исследования показывают, что регулярные физические нагрузки снижают вероятность развития рака предстательной железы.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ РАК ПРЯМОЙ КИШКИ?
Рак прямой кишки – это заболевание, при котором в тканях прямой кишки образуются раковые, т.е. злокачественные клетки. Причиной рака прямой кишки обычно являются полипы в ее слизистой оболочке. Рак прямой и ободочной кишки часто называют “колоректальным раком”.
КАКОВЫ СИМПТОМЫ РАКА ПРЯМОЙ КИШКИ?
Симптомы рака прямой кишки могут проявляться по-разному. Однако многие виды рака прямой кишки выявляются при плановом обследовании без симптомов. Симптомы рака прямой кишки обычно включают следующее.
- Кровотечение из заднего прохода или кровь в стуле – один из наиболее распространенных симптомов рака прямой кишки. Почти 8 из 10 пациентов испытывают симптомы кровотечения.
- Слизь в фекалиях
- Изменения в работе кишечника, такие как запор, диарея, повышенное газообразование, могут быть первым признаком рака прямой кишки.
- Помимо изменений в работе кишечника, к симптомам рака прямой кишки относятся также ощущение опорожнения кишечника или невозможность адекватной дефекации, несмотря на частые посещения туалета.
- Болезненные движения кишечника
- Незамеченное кровотечение в стуле может привести к анемии. Одышка, головокружение, учащенное сердцебиение, вызванные анемией, должны быть серьезно восприняты как симптомы рака прямой кишки.
- Кишечная непроходимость может возникнуть, когда опухоль разрастается и перекрывает отводящий канал. Кишечная непроходимость может вызывать сильную боль и спазмы в животе.
- Рост опухоли может привести к изменению размеров стула. Тонкий, как карандаш, стул может быть признаком рака прямой кишки.
- Необъяснимая потеря веса, не связанная с диетой или физическими нагрузками, является одним из первых признаков рака прямой кишки.
ЧТО ВЫЗЫВАЕТ РАК ПРЯМОЙ КИШКИ?
Причина возникновения рака прямой кишки точно не известна. Однако существует множество факторов риска, вызывающих рак прямой кишки.
- Большинство случаев рака прямой кишки возникает в пожилом возрасте.
- Алкоголь и курение повышают риск развития рака прямой кишки.
- Причиной рака прямой кишки может быть высокожировая диета животного происхождения.
- Наличие в анамнезе рака толстой кишки или полипов может стать причиной рака прямой кишки.
- Хронические воспалительные заболевания толстой и прямой кишки, такие как язвенный колит и болезнь Крона, повышают риск развития рака прямой кишки.
- Генетические синдромы, такие как ненаследственный колоректальный рак без полипов (Lynch) и семейный аденоматозный полипоз (FAP), относятся к причинам возникновения рака прямой кишки.
- Малоподвижный образ жизни и ожирение
- Получение лучевой терапии при лечении рака, особенно брюшной полости, может стать причиной развития рака прямой и толстой кишки.
- Диабет (Диабет)
- Наличие рака толстой и прямой кишки в семье, особенно у родственников первой степени родства, является важной причиной возникновения рака прямой кишки.
КАК ДИАГНОСТИРУЕТСЯ РАК ПРЯМОЙ КИШКИ?
- Для раннего выявления рака прямой кишки необходимо внедрять программы рутинного скрининга. Для ранней диагностики рака прямой кишки крайне важно начинать плановый скрининг в возрасте 50 лет у людей, не имеющих факторов риска. У людей, имеющих факторы риска, скрининг можно начинать раньше. Рак прямой кишки обычно диагностируется при контрольных обследованиях, проводимых после ректального кровотечения или дефицита железа, которые являются симптомами рака прямой кишки.
- Колоноскопия является наиболее распространенной процедурой, используемой в скрининговых программах и для диагностики. Во время колоноскопии часто удается взять небольшие образцы тканей из подозрительных участков. Лабораторный анализ образцов тканей, взятых для биопсии, помогает в диагностике рака прямой кишки.
ЛЕЧЕНИЕ РАКА ПРЯМОЙ КИШКИ
Лечение планируется после определения стадии и класса рака прямой кишки. При лечении рака прямой кишки планирование осуществляется в соответствии со стадией и классом рака, расположением и размерами опухоли в прямой кишке, возрастом и общим состоянием здоровья пациента.
Химиотерапевтическое и радиотерапевтическое лечение рака прямой кишки
Химиотерапевтическое лечение рака прямой кишки обычно состоит из двух или более препаратов, направленных против раковых клеток. При раке прямой кишки химио- и радиотерапия может применяться до или после операции. Операция может быть единственным необходимым шагом в лечении рака прямой кишки 1 стадии. При раке прямой кишки 1 стадии риск рецидива после операции невелик, поэтому химиотерапия обычно не рекомендуется. При 2-й и 3-й стадиях рака прямой кишки химиотерапевтическое и радиотерапевтическое лечение применяется после операции для предотвращения рецидива рака. У пациентов со 2-й и 3-й стадиями рака прямой кишки химиотерапия и радиотерапия могут быть применены для уменьшения размеров опухоли перед операцией.
Операции при раке прямой кишки
Хирургия является одним из наиболее часто используемых методов лечения рака прямой кишки. Операции при раке прямой кишки планируются в зависимости от расположения и размера опухоли.
Операции при раке прямой кишки можно разделить на 2 группы: операции на прямой кишке, щадящие прямую кишку, и операции на прямой кишке, требующие ее потери.
Хирургия рака прямой кишки;
- Конечная колостома
- Колоанальный анастомоз
- Низкая передняя резекция
- Локальное иссечение – локальное или трансанальное иссечение – трансанальная эндоскопическая микрохирургия
- Интраоперационная лучевая терапия (ИОРТ).
- Абдоминоперинеальное иссечение (APR) – экстралеваторное абдоминоперинеальное иссечение
- Полипэктомия
- Радиочастотная абляция
- Криохирургия
Могут быть использованы такие хирургические методы, как малоинвазивная хирургия
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ О РАКЕ ПРЯМОЙ КИШКИ
Кто может заболеть раком прямой кишки? Распространен ли этот вид рака?
Рак прямой кишки чаще встречается у мужчин, чем у женщин. С развитием эндоскопических и рентгенологических исследований рак прямой кишки диагностируется легче. С ростом информированности населения увеличивается и уровень заболеваемости. Ежегодно в мире рак толстой и прямой кишки диагностируется примерно у 1 млн. человек. Хотя в нашей стране точных данных нет, по оценкам, ежегодно рак толстой и прямой кишки диагностируется у 30 тыс. человек. Наиболее распространенным видом рака прямой кишки является аденокарцинома – рак, происходящий из слизистой оболочки.
В каком возрасте выявляется рак прямой кишки?
Определенного возраста возникновения рака прямой и толстой кишки не существует. Однако рак прямой кишки обычно встречается в возрасте после 35 лет. Большинство пациентов старше 50 лет.
К какому врачу следует обращаться при раке прямой кишки?
При появлении одного или нескольких симптомов рака прямой и ободочной кишки следует немедленно обратиться к врачам гастроэнтерологического или общехирургического отделения. Поскольку в лечении рака прямой и ободочной кишки на первый план выходят хирургические методы, важно выбрать врача-специалиста в этой области. Поскольку лечение колоректального рака требует мультидисциплинарного подхода, объединяющего многие медицинские подразделения, такие как общая хирургия, гастроэнтерология и онкология, важно выбирать больницы с достаточной медицинской инфраструктурой.
Заразен ли рак прямой кишки?
Рак прямой кишки не передается от одного больного к другому. Нет никаких доказательств того, что рак передается при дыхании, по воздуху, контактным или половым путем. Однако рак прямой и толстой кишки имеет генетические особенности. Люди, имеющие в семейном анамнезе рак прямой и толстой кишки, чаще болеют раком толстой кишки.
Чем отличается рак прямой кишки от рака толстой кишки?
Симптомы и причины рака прямой и толстой кишки очень похожи. Несмотря на то что рак прямой и ободочной кишки во многом схож, его лечение отличается. Основная причина этого заключается в том, что прямая кишка располагается в узком пространстве, которое практически не отделено от других органов и структур в полости таза
Вызывает ли геморрой рак прямой кишки?
Взаимосвязи между раком прямой кишки и геморроем не существует. Однако кровотечение, особенно в области прямой кишки, и испытываемая боль наблюдаются как при геморрое, так и при раке прямой кишки. Многие люди с раком толстой и прямой кишки также страдают геморроем. Пациенты могут откладывать обращение к врачу, списывая возникшие проблемы на геморрой. При появлении симптомов важно обратиться к специалисту, не теряя времени на раннюю диагностику.
Какие исследования проводятся для стадирования рака прямой кишки?
После физикального обследования у общего хирурга, специализирующегося на колоректальных раках, и проведения колоноскопии необходимо определить стадию рака прямой кишки.
Стадирование рака прямой кишки важно для принятия решения о наиболее подходящем курсе лечения. При стадировании рака прямой кишки могут применяться следующие обследования.
- Ректальное обследование: Это пальцевое исследование с использованием скользкой перчатки, помещаемой в задний проход для прощупывания раковой опухоли в стенке прямой кишки. В тех случаях, когда опухоль находится далеко от ануса, рак прямой кишки при таком исследовании может быть не обнаружен. Если при цифровом ректальном исследовании обнаруживается отклонение от нормы, то для дальнейшего обследования рака проводится эндоскопия.
- Гибкая сигмоидоскопия: Как и при методе колоноскопии, гибкая трубка с установленной на ней камерой вводится через задний проход в прямую кишку. Это обследование может дать представление как о диагнозе рака прямой кишки, так и о стадии рака прямой кишки.
- Жесткая сигмоидоскопия: Это введение жесткого оптического прицела через задний проход в прямую кишку. Ригидная сигмоидоскопия обычно выполняется гастроэнтерологом или хирургом общего профиля. Преимуществом жесткой сигмоидоскопии является возможность более точного измерения расстояния от опухоли до ануса.
- Полный анализ крови: Определение низкого уровня эритроцитов в крови важно для того, чтобы показать, вызывает ли опухоль кровопотерю. Высокий уровень лейкоцитов может быть признаком инфекции, которая несет риск прорастания опухоли через стенку прямой кишки.
- Анализы на опухолевые маркеры: При раке в крови могут появляться вещества, называемые опухолевыми маркерами. Увеличение количества опухолевых маркеров в крови по сравнению с нормой может быть признаком рака прямой кишки. При раке прямой кишки можно проверить карциноэмбриональный антиген и углеводный антиген. Карциноэмбриональный антиген (CEA) обычно обнаруживается в крови взрослых на очень низком уровне. Уровень CEA может быть повышен при некоторых видах рака и при нераковых (доброкачественных) состояниях.
- Компьютерная томография (КТ): С помощью компьютерной томографии можно проверить, распространился ли рак прямой кишки на лимфатические узлы в груди, брюшной полости и тазу или на такие органы, как легкие и печень. С помощью компьютерной томографии можно также определить расстояние опухоли от заднего прохода и провести стадирование рака прямой кишки.
- Магнитно-резонансная томография (МРТ): Можно получить детальное изображение мышц, органов и других тканей, окружающих опухоль в прямой кишке. Кроме того, с помощью магнитного резонанса можно визуализировать лимфатические узлы, расположенные рядом с прямой кишкой, и различные слои тканей в стенке прямой кишки.
- Рентгенография грудной клетки С помощью рентгенографии можно определить, не метастазировал ли рак прямой кишки в легкие.
- Эндоскопическое ультразвуковое исследование (EUS): Оно основано на сочетании эндоскопии и ультрасонографии. ЭУС детально отображает слои стенки пищеварительного тракта. Это облегчает диагностику заболеваний пищеварительного тракта или органов, расположенных рядом с ним.
- ПЭТ-сканирование (позитронно-эмиссионная томография): процедура, позволяющая обнаружить злокачественные опухолевые клетки в организме. В вену вводится небольшое количество радиоактивной глюкозы. ПЭТ-сканер вращается вокруг тела и показывает, где в организме используется глюкоза. Клетки злокачественной опухоли выглядят на снимке ярче, поскольку они более активны и потребляют больше глюкозы, чем нормальные клетки.
- Исследования клеток и тканей: Исследования клеток и тканей – это исследования, направленные на выявление типа рака толстой или прямой кишки. KRAS – это ген, который мутирует в некоторых клетках колоректального рака. Исследование KRAS обычно проводится при метастазировании опухолей толстой кишки. Это важно с точки зрения целесообразности применения таргетных препаратов. Также может быть проведен тест MSI для определения наличия в опухоли синдрома Линча.
Стадии рака прямой кишки
Класс рака прямой кишки и стадия рака прямой кишки имеют важное значение для лечения. Градация рака прямой кишки – это то, как выглядят раковые клетки по сравнению с нормальными и здоровыми клетками. Зная класс рака прямой кишки, можно получить представление о скорости роста рака и вероятности его метастазирования, т.е. распространения.
При низкозлокачественном раке прямой кишки клетки аномальны, но выглядят как нормальные. Рак прямой кишки низкой степени тяжести растет медленно и реже дает метастазы. При высокозлокачественном раке прямой кишки больше недифференцированных раковых клеток. Рак прямой кишки высокой степени тяжести, клетки которого не похожи на нормальные, имеет тенденцию к быстрому росту и более склонен к метастазированию, чем рак низкой степени тяжести.
Стадирование рака прямой кишки зависит от информации, полученной при обследовании, от того, в каких отделах прямой кишки имеется рак, от размера опухоли, от того, распространился ли рак от места его возникновения. Стадирование важно для планирования лечения рака прямой кишки. При стадировании рака прямой кишки;
- Насколько глубоко опухоль расположена в стенке прямой кишки
- Имеется ли рак в лимфе
- Оценивается, не метастазировал ли рак прямой кишки в другие органы, такие как легкие или печень.
Стадии рака прямой кишки оценены в 5 группах.
- Рак прямой кишки 0 стадии: Раковые клетки находятся только во внутренней оболочке толстой или прямой кишки, называемой слизистой оболочкой. Раковые клетки не пересекли мышечный слой слизистой оболочки.
- Рак прямой кишки 1 стадия: Опухоль распространилась на соединительнотканный слой, окружающий слизистую оболочку или толстый наружный мышечный слой прямой кишки.
- Рак прямой кишки 2 стадии: 2 стадия рака прямой кишки проходит в три этапа.
- Рак прямой кишки 2 стадии – A; рак достиг наружного слоя стенки прямой кишки и не распространился на окружающие органы. Метастазы в лимфу и отдаленные органы отсутствуют.
- Рак прямой кишки 2 стадии B: Рак поразил все слои стенки прямой кишки, но не распространился на окружающие органы или ткани Метастазы в лимфу или отдаленные органы отсутствуют.
- Рак прямой кишки 2 стадии – C; Рак распространился за пределы стенки прямой кишки. Он пророс в близлежащие органы или ткани. Метастазы в лимфу и отдаленные органы отсутствуют.
- Рак прямой кишки 3-й стадии: Рак распространился на близлежащие лимфатические узлы. 3 стадия рака прямой кишки рассматривается в трех частях в зависимости от того, куда выросла опухоль и на сколько лимфатических узлов она распространилась.
- Рак прямой кишки 4 стадии: Рак прямой кишки 4-й стадии метастазирует в такие органы, как печень или легкие. Рак может находиться только в одном органе или в отдаленных лимфатических узлах. Лечение проводится в 3 стадии.
- Рак прямой кишки стадия А: Рак распространился на область или орган, не расположенный рядом с прямой кишкой, например, на печень, легкое, яичник или отдаленную лимфу.
- Стадия В рака прямой кишки: Рак распространился на более чем одну область или орган, не расположенный рядом с прямой кишкой, например, на печень, легкое, яичник или отдаленный лимфатический узел.
- Стадия С рака прямой кишки: рак распространился на ткани, выстилающие брюшную стенку, и может распространиться на другие области или органы.
Что такое метастазы рака прямой кишки?
Когда рак распространяется в другую часть тела, это называется метастазированием. Клетки рака прямой кишки покидают место своего возникновения (первичную опухоль) и могут метастазировать в различные части тела через лимфатическую систему или кровь.
Ответ на вопрос о том, в какие органы распространяется рак прямой кишки, включает следующее;
- Метастазирование рака прямой кишки чаще всего происходит в близлежащие лимфатические узлы.
- Рак прямой кишки может распространяться на брюшину.
- Метастазы могут возникать в тканях, расположенных вблизи брюшной полости или таза.
- Он может быть виден в отдаленных лимфатических узлах.
- Рак прямой кишки может метастазировать в почки и надпочечники.
- Метастазы в печень при раке прямой кишки обычно наблюдаются в 4-й стадии.
- Метастазы в легкие при раке прямой кишки обычно наблюдаются в 4-й стадии.
- Метастазы рака прямой кишки могут наблюдаться в костях и головном мозге.
Какова продолжительность жизни при раке прямой кишки?
Один из самых любопытных вопросов пациентов с раком прямой кишки – “Сколько живут при раке прямой кишки?”. Продолжительность жизни при раке прямой кишки зависит от многих факторов, таких как класс рака, стадия, уровень карциноэмбрионального антигена (CEA), общее состояние здоровья пациента, выбранный метод лечения и реакция пациента на лечение. Ответ на такой вопрос, как “Сколько живут при раке прямой кишки?”, не является однозначным и варьируется от пациента к пациенту.
Статистические данные о выживаемости при раке прямой кишки являются очень общими оценками и должны интерпретироваться очень осторожно.
Согласно общепринятой мировой статистике, показатели 5-летней выживаемости выглядят следующим образом
Рак прямой кишки 1 стадии 5-летняя выживаемость 80-88
Рак прямой кишки 2 стадии 5-летняя выживаемость 60% – 81
Рак прямой кишки 3 стадии 5-летняя выживаемость 40-75
Рак прямой кишки 4 стадии (последняя стадия рака прямой кишки) 5-летняя выживаемость 8-13
Каким должно быть последующее наблюдение после лечения рака прямой кишки?
Некоторые анализы, проводимые для диагностики рака прямой кишки или определения стадии рака прямой кишки, могут быть повторены после лечения. Решение о продолжении или изменении лечения может быть принято на основании результатов этих анализов.
После лечения рака прямой кишки такие исследования, как измерение количества карциноэмбрионального антигена, колоноскопия, виртуальная колоноскопия, могут быть повторены, чтобы проверить, не возник ли рецидив рака.
Можно ли предотвратить рак прямой кишки?
Рак прямой кишки, как и рак толстой кишки, является предотвратимым заболеванием. Рак прямой кишки может развиться из доброкачественных полипов в стенке прямой кишки. Обнаружение и удаление этих полипов с помощью колоноскопии снижает риск развития рака прямой кишки. Учитывая семейный анамнез, скрининг на рак прямой кишки после 45-50 лет имеет жизненно важное значение. Наиболее точным и эффективным скрининговым тестом является колоноскопия.
Помимо скринингового контроля, существует множество научных исследований, показывающих, что диета также связана с раком прямой кишки. Потребление продуктов с низким содержанием жира, таких как цельное зерно с высоким содержанием клетчатки, фрукты, овощи и орехи, может снизить риск развития рака прямой кишки.
Для профилактики рака прямой кишки в целом;
- Не следует пренебрегать рутинным колоректальным скринингом
- Необходимо обеспечить контроль веса
- Предпочтение следует отдавать активному образу жизни. Необходимо регулярно заниматься физическими упражнениями и спортом
- Необходимо часто употреблять такие овощи, как зелень, помидоры, лук, брокколи, баклажаны, морковь, чеснок, а также такие фрукты, как дыни, яблоки, груши, апельсины и бананы. Кроме того, в рацион следует включить такие продукты, как овес, черный рис, ячмень, дикий рис, чечевица, фасоль.
- Следует избегать красного мяса, переработанного мяса, питания в стиле фаст-фуд.
- Следует отказаться от употребления алкоголя и курения.
Питание при раке прямой кишки
Сбалансированное питание до, во время и после лечения рака прямой кишки может помочь человеку чувствовать себя хорошо, сохранить силы и ускорить выздоровление.
- Обеспечьте контроль веса. Такие виды лечения, как химиотерапия, радиотерапия и хирургическое вмешательство при раке прямой кишки, часто могут вызывать нежелательную потерю веса. Важно предотвратить чрезмерную потерю веса во время лечения, поскольку плохое и несбалансированное питание может привести к снижению способности организма бороться с инфекцией.
- Принимайте пищу небольшими порциями в течение дня. Частое употребление небольших порций пищи обеспечивает организм достаточным количеством калорий, белка и питательных веществ, необходимых для переносимости лечения. Небольшие порции пищи также помогают уменьшить побочные эффекты, связанные с лечением, такие как тошнота.
- Выбирайте продукты, богатые белком. Белок помогает организму восстанавливать клетки и ткани. Он также помогает иммунной системе восстанавливаться после болезней. Включите источник постного белка во все приемы пищи и перекусы. Хорошими источниками постного белка являются:
- Нежирное мясо, например, курица, рыба или индейка
- Яйца
- Молоко с низким содержанием жира или молочные продукты, такие как молоко, йогурт и сыр
- Орехи
- Фасоль
- Соевые продукты
- Включите в свой рацион продукты из цельного зерна. Цельнозерновые продукты являются хорошим источником углеводов и клетчатки, которые помогают поддерживать высокий уровень энергии.
- Хорошими источниками цельнозерновых продуктов являются:
- Овсянка
- Цельнозерновой хлеб
- Коричневый рис
- Цельнозерновые макаронные изделия
- Ежедневно употребляйте в пищу разнообразные фрукты и овощи. Овощи и фрукты насыщают организм антиоксидантами, которые помогают бороться с раком. Чтобы получить максимальную пользу, выбирайте разнообразные цветные фрукты и овощи.
- Выбирайте здоровые источники жиров. Избегайте жареной, жирной и жиросодержащей пищи
- Ограничьте сладости.
- Не забывайте пить воду. Пить достаточное количество жидкости во время лечения рака очень важно для предотвращения обезвоживания.
- Следите за изменениями в привычках кишечника. Колоректальный рак и его лечение часто могут вызывать изменения в привычках кишечника, такие как диарея, запоры, вздутие живота и газообразование. Расскажите врачу о любых изменениях в привычках кишечника.
- Перед приемом любых витаминов и добавок проконсультируйтесь со своим лечащим врачом
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ РАК ЖЕЛЧНОГО ПУЗЫРЯ?

Рак желчного пузыря – это злокачественная опухоль, возникающая из стенки желчного пузыря. Полипы в желчном пузыре, воспаления желчного пузыря, ожирение, некоторые химические вещества, например нитрозамины, могут быть основными причинами рака желчного пузыря. Рак желчного пузыря, который гораздо легче диагностируется у людей с камнями в желчном пузыре, выявляется на поздней стадии рака, когда он начинает давать симптомы по разным причинам.
СИМПТОМЫ РАКА ЖЕЛЧНОГО ПУЗЫРЯ
Хотя рак желчного пузыря встречается в основном у людей в возрасте 60 лет и старше, это очень коварный вид рака. Поскольку пациент может продолжать жить, даже если желчный пузырь не выполняет свою функцию, он может не давать много симптомов или его симптомы могут указывать на другие заболевания.
Симптомы рака желчного пузыря часто включают;
- Желтуха
- Боль в животе
- Проблемы с пищеварением,
- Тошнота, рвота,
- Пищевая непереносимость,
- Похудение
- Наблюдаются темная моча и белый стул.
Наиболее важными симптомами прогрессирующего рака желчного пузыря являются желтуха, ощущение большого образования в брюшной полости и в области расположения желчного пузыря, а также боль. Симптомы рака желчного пузыря обычно дают о себе знать за 3-6 месяцев до начала заболевания. У некоторых пациентов рак желчного пузыря может возникнуть через 1 год после начала заболеваний, связанных с желчным пузырем. Желтуха без каких-либо симптомов также считается признаком только рака желчного пузыря. В 75% случаев рак желчного пузыря встречается у женщин, а у 80% таких пациентов в желчном пузыре имеются камни. Если размеры камней превышают 3 см, риск развития рака желчного пузыря возрастает. При появлении любого из симптомов рака желчного пузыря необходимо как можно скорее обратиться в отделение общей хирургии полностью оборудованной больницы.
ФАКТОРЫ РИСКА РАЗВИТИЯ РАКА ЖЕЛЧНОГО ПУЗЫРЯ
К факторам риска развития рака желчного пузыря относятся полипы желчного пузыря и заболевание желчного пузыря, называемое “фарфоровым желчным пузырем”. Ожирение, неправильное питание и воздействие химических веществ, таких как нитрозамины, также признаны важными факторами риска. Кроме того, одним из факторов, приводящих к раку желчного пузыря, считаются рецидивирующие инфекции желчевыводящих путей. Инфекции сопровождаются желтухой, высокой температурой и жалобами на боли, при тяжелых приступах пациент госпитализируется. Хотя связь с раком окончательно не доказана, пациентам с камнями в желчном пузыре рекомендуется не прерывать контроль и регулярно наблюдаться.
ВЫЗЫВАЕТ ЛИ КАМЕНЬ В ЖЕЛЧНОМ ПУЗЫРЕ РАК?
Наличие камней в желчном пузыре более чем у 90% пациентов с раком желчного пузыря доказано исследованиями. Однако, хотя эта ситуация и привела к мнению о возможном влиянии желчных камней на развитие рака, мнение о том, что “желчные камни вызывают рак”, не приобрело определенности. Только тесная связь желчных камней и рака уже много лет вызывает скепсис. Рак занимает последнее место среди заболеваний, вызываемых желчными камнями. Перед раком желчные камни вызывают инфекцию, обструкцию желчных путей, желтуху и панкреатит.
ДИАГНОСТИКА И СТАДИИ РАКА ЖЕЛЧНОГО ПУЗЫРЯ
Очень важно диагностировать рак желчного пузыря на ранней стадии. Методы визуализации, такие как УЗИ, томография и МРТ, используются в зависимости от симптомов, наблюдаемых у пациента. Как и при многих других видах рака, окончательный диагноз рака желчного пузыря ставится с помощью биопсии после применения современных методов визуализации. Методы диагностики определяются в зависимости от состояния здоровья пациента, его возраста, симптомов заболевания и результатов предыдущих исследований.
Эти методы используются для диагностики рака желчного пузыря;
Анализы крови: Для диагностики рака желчного пузыря необходимо измерить аномальный уровень билирубина и других веществ в крови.
Ультразвук: Использование звуковых волн для обнаружения опухолей в организме. Раковые ткани излучают звуковые волны, отличные от нормальных тканей.
Компьютерная томография (КТ): Компьютерная томография позволяет получить трехмерное изображение тела. Оно проверяется на наличие опухолей или каких-либо аномалий. Это также позволяет определить размер опухоли.
Магнитно-резонансная томография (МРТ): С помощью МРТ можно определить, распространился ли рак за пределы желчного пузыря и каковы размеры опухоли.
Биопсия Окончательный диагноз может быть поставлен с помощью биопсии, при которой под микроскопом исследуется небольшой образец ткани. Биопсия может быть выполнена с помощью малоинвазивной хирургической техники, тонкоигольной или толстоигольной аспирации. Также могут использоваться компьютерная томография и эндоскопия.
Эндоскопическая ретроградная холангиопанкреатография (ERCP): С помощью эндоскопа, вводимого через пищевод в желудок и тонкий кишечник, визуализируются внутренние органы пациента. Через эндоскоп в желчные протоки вводится небольшая трубка или катетер. Эта процедура чаще всего используется для диагностики рака желчных протоков. Она также применяется в тех случаях, когда рак желчного пузыря распространился и закупорил желчные протоки.
Перкутанная холангиография: При этом методе визуализации через кожу в область желчного пузыря вводится тонкая игла с цветным красителем, что позволяет получить четкое изображение на рентгеновских снимках. Рентгеновские лучи используются для определения наличия опухоли в желчном пузыре.
Лапароскопия: Для осмотра желчного пузыря и других внутренних органов через небольшой разрез в брюшной полости вводится эндоскоп и выполняется визуализация.
Эндоскопическая ультрасонография (эндосонография): С помощью более широкого и специализированного эндоскопа можно под седацией проникнуть в желудок и кишечник, начиная через рот.
Позитронно-эмиссионная томография (ПЭТ): ПЭТ-сканирование – это способ создания изображений органов и тканей внутри организма. Это позволяет определить, на какие органы в организме распространилась имеющаяся опухоль, и определить стадию рака.
Стадии работы желчного пузыря можно определить следующим образом;
Стадия 1: карцинома in-situ, опухоль желчного пузыря расположена только внутримышечно.
Стадия 2: Опухоль затрагивает только мышечный слой желчного пузыря.
Стадия 3: во всех слоях стенки желчного пузыря обнаруживается раковая опухоль. Лимфатические узлы Ductus cysticus могут вовлекаться или не вовлекаться в процесс.
Стадия 4: На этой стадии рак желчного пузыря распространяется на печень и другие соседние органы. В процесс вовлекаются желчные протоки и другие лимфатические узлы.
ЛЕЧЕНИЕ РАКА ЖЕЛЧНОГО ПУЗЫРЯ
Лечение рака желчного пузыря основано на хирургическом удалении опухоли. В ходе лечения, состоящего из масштабной операции, может потребоваться также удаление части печени. Поскольку рак желчного пузыря обычно диагностируется на поздних стадиях, у пациентов часто нет шансов на операцию. Однако ранняя диагностика рака обеспечивает успешное лечение рака желчного пузыря. Некоторые эндоскопические процедуры, направленные на снятие желтухи и боли, обезболивание, чрескожное дренирование (радиологическое вмешательство) могут быть выполнены у пациентов с поздней стадией заболевания, не подлежащей операции. Горячая химиотерапия и некоторые недавно разработанные “умные” препараты также могут повлиять на прогрессирование опухоли.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ РАК ЖЕЛЧНЫХ ПРОТОКОВ?
Рак желчных путей (холангиокарцинома) – это редкая опухоль, состоящая из клеток стенки желчных протоков. Хотя она развивается из всех отделов желчевыводящих путей, в 60% случаев она берет начало в бифуркации – месте соединения правого и левого главных желчных протоков.
ЧТО ВЫЗЫВАЕТ РАК ЖЕЛЧНЫХ ПРОТОКОВ?
Наиболее частыми причинами рака желчевыводящих путей являются первичный склерозирующий холангит, киста холедоха (общего протока), гепатит В-С, язвенный колит, гепатолитиаз (камень в печени), пожилой возраст, ожирение, билиентериальные анастомозы и хроническое носительство брюшного тифа у пожилых людей.
КАК ПРОЯВЛЯЮТСЯ СИМПТОМЫ РАКА ЖЕЛЧНЫХ ПРОТОКОВ?
При раке желчевыводящих путей одним из первых симптомов является безболезненная желтуха. Затем появляется зуд, связанный с накоплением билирубина под кожей. На поздних стадиях заболевания наблюдается потеря веса, приводящая к кахексии. Симптомы могут сопровождаться лихорадкой.
КАК ДИАГНОСТИРУЕТСЯ РАК ЖЕЛЧНЫХ ПРОТОКОВ?
Очень важно диагностировать рак желчного пузыря на ранней стадии. Первым шагом в обследовании рака желчных протоков является УЗИ желчевыводящих путей. Если наблюдается расширение желчных протоков, то диагноз помогает поставить поперечная томография с использованием компьютерной или магнитно-резонансной томографии. Внезапное закрытие желчных протоков может быть обнаружено и без образования в желчных протоках. Биопсия или мазок могут быть взяты с помощью ERCP (эндоскопической ретроградной толстокишечной панкреатографии). Оценка с помощью ЭУС также полезна, особенно при дистально расположенных раковых опухолях. Наличие у пациента клинической желтухи, зуда и потери веса, а также опухолевого маркера CA19-9 в количестве 100 Ед/мл также подтверждает диагноз. Методы диагностики определяются в зависимости от состояния здоровья пациента, его возраста, симптомов заболевания и результатов предыдущих исследований.
КАК ЛЕЧИТСЯ РАК ЖЕЛЧНЫХ ПРОТОКОВ?
При диагностировании рака желчевыводящих путей более чем у половины больных нет шансов на операцию. Поскольку это коварное заболевание, оно дает поздние симптомы. Уровень рака у пациентов, которые могут быть прооперированы, определяет тип операции. Если при проксимальном раке требуется гепатэктомия, то при дистальном раке обычно выполняется операция Уиппла.
Лечение рака желчных протоков основано на хирургическом удалении опухоли. В ходе лечения, состоящего из масштабной операции, может потребоваться также удаление части печени. Поскольку рак желчного пузыря обычно диагностируется на поздней стадии, у пациентов часто нет шансов на операцию. Однако ранняя диагностика рака обеспечивает успешное лечение рака желчного пузыря. Некоторые эндоскопические процедуры, направленные на снятие желтухи и боли, обезболивание, чрескожное дренирование (радиологическое вмешательство) могут быть выполнены у пациентов с поздней стадией заболевания, не поддающейся операции.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ О РАКЕ ЖЕЛЧНЫХ ПРОТОКОВ
Что происходит при закупорке желчного протока?
Желтуха развивается в основном из-за непроходимости желчных протоков. Желчные протоки в печени увеличиваются в размерах. Воспаление желчевыводящих путей (холангит) развивается вследствие повышения давления и плотности бактерий в желчных протоках. Это состояние, считающееся билиарным сепсисом, может привести к летальному исходу.
Каковы стадии рака желчевыводящих путей?
Рак желчевыводящих путей подразделяется на 3 стадии.
- При первой стадии рака желчевыводящих путей рак находится в желчевыводящих путях. Именно эта группа лучше всего реагирует на хирургическое вмешательство.
- На второй стадии рак поражает желчный пузырь, печень, поджелудочную железу или часть воротной вены и печеночной артерии.
- На третьей стадии появляются метастазы рака в близлежащие органы, а на четвертой – в отдаленные.
Каковы типы рака желчевыводящих путей?
Рак желчевыводящих путей различают в зависимости от их локализации. Существуют внутрипеченочные, хилярные и дистальные типы. Хилярный тип встречается наиболее часто – 60%. Хилярный рак желчевыводящих путей имеет специальную классификацию Bizmuth.
Тип I: Рак в общем печеночном протоке и на расстоянии от его бифуркации.
Тип II: Рак находится в общем печеночном протоке и инвазирован в его бифуркацию.
Тип III: Рак находится в общем печеночном протоке и вовлекает правый или левый печеночный проток с бифуркацией.
Тип IV: рак, затрагивающий бифуркацию, включает в себя как правый, так и левый протоки, а также сегменты, открывающиеся в эти протоки.
Можно ли установить стент в желчный проток?
Для снижения показателей желтухи в желчный проток вставляется стент. Причиной стентирования может быть доброкачественный стеноз или рак. У пациентов, перенесших операцию по поводу рака желчных протоков, стент устанавливается на той стороне сегмента печени, которая останется у пациента.
На что следует обратить внимание пациенту после операции по поводу рака желчевыводящих путей?
Они должны регулярно проходить послеоперационную химиотерапию (химиопрепараты) и тесно контактировать с врачом. Не следует пренебрегать контрольной визуализацией и обследованиями.
Вызывает ли камень в желчном пузыре рак?
Наличие камней в желчном пузыре более чем у 90% пациентов с раком желчного пузыря доказано исследованиями. Однако, хотя эта ситуация и привела к мнению о возможном влиянии желчных камней на развитие рака, мнение о том, что “желчные камни вызывают рак”, не приобрело определенности. Только тесная связь желчных камней и рака уже много лет вызывает скепсис. Рак занимает последнее место среди заболеваний, вызываемых желчными камнями. Перед раком желчные камни вызывают инфекцию, обструкцию желчных путей, желтуху и панкреатит.
Что вызывает сужение желчных протоков?
Сужение желчных протоков обычно вызывается наличием камней в желчных протоках. Оно также может быть вызвано предшествующими процедурами (операции – стентирование).
Опасны ли полипы в желчном пузыре?
Существует риск развития рака при наличии полипов размером более 10 мм и более одного полипа в желчном пузыре. Целесообразно удаление желчного пузыря путем холецистэктомии (лапароскопической или открытой). Одиночные полипы размером менее 10 мм подлежат контролю с помощью УЗИ через 6 месяцев.
Какие недостатки вызывает удаление желчного пузыря в организме?
Удаление желчного пузыря не оказывает негативного влияния на организм. Желчь вырабатывается печенью. Дефицита желчи после операции на желчном пузыре не бывает.
Вызывают ли желчные камни рак?
Из-за хронического воспаления он может стать причиной рака. Камни в желчном пузыре наблюдаются у 90% пациентов, оперированных по поводу рака желчного пузыря.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ ТЕСТИС?
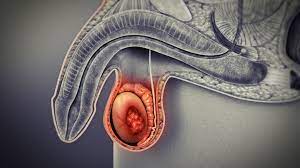
Яички, входящие в состав мужской репродуктивной системы, представляют собой две овальные железы, расположенные позади полового члена в кожном мешке, называемом мошонкой. Яички производят и хранят сперму. Помимо этой функции, они также вырабатывают тестостерон, который отвечает за развитие волос на лице, увеличение мышечной массы, а также за половое влечение (либидо). Образование сперматозоидов и секреция тестостерона контролируются гормонами ФСГ и ЛГ, которые выделяются гипофизом.
ЧТО ТАКОЕ РАК ЯИЧКА?
Рак яичка – это опухолевое образование, возникающее в яичках и иногда распространяющееся на другие части тела. Рак яичка возникает, когда раковые (злокачественные) клетки развиваются в тканях одного яичка. Рак яичка является наиболее распространенным онкологическим заболеванием у мужчин в возрасте от 20 до 35 лет. Обычно это заболевание успешно поддается лечению. Частота встречаемости рака яичка в правом яичке составляет 52,3%, а в левом – 47,7%. Развитие раковых клеток может происходить в обоих яичках, но это бывает очень редко (2-3%).
КАКОВЫ ФАКТОРЫ РИСКА РАЗВИТИЯ РАКА ЯИЧКА?
Факторы риска развития рака яичка обычно включают следующие:
Возраст
Большинство случаев заболевания приходится на возраст от 15 до 40 лет. Рак яичка – наиболее распространенный вид рака у мужчин в возрасте от 20 до 35 лет.
Раса-этническая принадлежность
Риск развития рака яичек в 5 раз выше у белых мужчин, чем у чернокожих. Во всем мире риск развития этого заболевания выше в Америке и Европе и ниже в Африке и Азии.
Семейный анамнез рака яичка
Семейный анамнез повышает риск развития рака яичка. В самом деле, если в семье один мужчина болен раком яичка, то вероятность развития рака яичка у брата и/или сына в той же семье возрастает.
Неопущенное яичко (крипторхизм)
Мужчины, у которых яички не опустились в мошонку до рождения, относятся к группе высокого риска. Мужчины, перенесшие операцию по исправлению этого состояния, по-прежнему подвержены риску развития рака яичек.
Аномальное развитие яичек
Состояния, вызывающие аномальное развитие яичек, могут повышать риск развития рака яичек
ВИЧ-инфекция
Риск развития рака яичек повышен у мужчин с ВИЧ-инфекцией, особенно у больных СПИДом.
История рака другого яичка
Примерно у 3-4% мужчин, излечившихся от рака одного яичка, рак обнаруживается и в другом яичке.
Синдром Клайнфельтера
Синдром Клайнфельтера является одним из факторов, повышающих риск развития рака яичек.
КАКОВЫ ТИПЫ РАКА ЯИЧКА?
Примерно 90-95% случаев рака яичка возникает из так называемых “половых клеток”, которые служат для производства спермы. Существует два основных типа рака яичка: семинома и несеминома.
Опухоли семиномы
Опухоли семиномы имеют две основные характеристики:
- Развивается медленнее, чем несеминомные опухоли
- Хотя обычно это заболевание возникает в возрасте от 25 до 45 лет, оно может встречаться и в более старшем возрасте
Несеминомные опухоли (несеминомные)
Для несеминомных опухолей характерно следующее:
- Имеет тенденцию к более быстрому развитию, чем рак семиномы
- Существует четыре основных подтипа: Тератома, хориокарцинома, опухоль желточного мешка и эмбриональная карцинома
- Обычно она возникает в позднем подростковом возрасте и в начале 30-х годов.
Другие опухоли
Смешанные опухоли
Иногда рак яичка может содержать смесь клеток семиномы и несеминомы или сочетание различных подтипов клеток несеминомы (смешанные опухоли).
Стромальные опухоли
Стромальные опухоли возникают в клетках, образующих опорную (структурную) и гормонопродуцирующую ткань яичек. Обычно они являются доброкачественными и удаляются хирургическим путем.
Примечание: Некоторые виды рака яичка начинаются как состояние, называемое интратубулярной неоплазией герминогенных клеток (ITGCN или IGCN). В этом случае клетки аномальны, но они не распространяются за пределы области, где развиваются сперматозоиды. ИТГКН не является раком, но существует 50-процентный риск того, что в течение пяти лет она перерастет в рак яичка. Примерно 5-10% людей с диагнозом “рак яичка” имеют ИТГКЯ. ИТГКЯ имеет те же факторы риска, что и рак яичка. Диагностика ИТГКЯ затруднена из-за отсутствия симптомов, и ее можно установить только при исследовании образца ткани.
КАКОВЫ ПРИЗНАКИ И СИМПТОМЫ РАКА ЯИЧЕК?
Первым признаком рака яичка обычно является опухшее яичко или твердая шишка на нем. Боли в яичках обычно не бывает, но боль или дискомфорт часто ощущаются в мошонке – мешковидном органе, в котором расположены яички у мужчин.
Другие симптомы рака яичка следующие:
- Тянущее ощущение или чувство дискомфорта в мошонке
- Яичко, которое кажется больше обычного
- Умеренная боль в нижней части живота и паховой области
- Скопление жидкости в мошонке (гидроцеле)
В зависимости от стадии рака яичка могут появиться и другие симптомы, в том числе
- Боль в спине
- Кашель
- Отек одной или обеих ног или одышка, вызванная тромбом, могут быть симптомами рака яичка. Тромб в крупной вене называется глубоким венозным тромбозом или ТГВ. Тромб в артерии легкого называется легочной эмболией. Это вызывает одышку.
- Снижение веса
- Инфекция: Инфекция яичка называется орхитом. Инфекция придатка яичка называется эпидидимитом. При подозрении на инфекцию пациенту могут быть назначены антибиотики. Если антибиотики не помогают решить проблему, необходимо провести дополнительные исследования, обычно при подозрении на рак яичка.
- Нагрубание или увеличение груди: Хотя это встречается редко, некоторые опухоли яичек вырабатывают гормоны, которые вызывают болезненность или увеличение молочных желез, что называется гинекомастией.
Поскольку ранняя диагностика рака яичка повышает процент успешного лечения, при появлении вышеперечисленных симптомов необходимо немедленно обратиться к врачу.
КАК ДИАГНОСТИРУЕТСЯ РАК ЯИЧКА?
Для диагностики опухолей яичек необходимы физикальное обследование, УЗИ яичек и анализы крови. В дополнение к этим исследованиям проводятся рентгенография и томография грудной клетки в случае распространения опухоли. Как и в случае со многими другими онкологическими опухолями, промедление в диагностике может быть опасным. Задержка в диагностике рака яичка на 6 недель увеличивает риск смерти от рака в 2 раза.
Если в яичке обнаруживается пальпируемое образование, его принимают за опухоль и начинают соответствующее лечение, если иное не подтверждено обследованиями. Больное яичко следует немедленно удалить и провести необходимое патологоанатомическое исследование для подтверждения диагноза.
Для определения уровня белков-маркеров опухоли будут также проводиться следующие анализы крови
- Альфа-фетопротеин (АФП)
- Бета-хорионический гонадотропин человека (бета-ХГЧ)
- Молочная дегидрогеназа (LDH)
- Плацентарная щелочная фосфатаза
По результатам всех исследований (КТ, МРТ, рентгенография грудной клетки) и патологоанатомического исследования определяется стадия заболевания и подтипы, различающиеся в зависимости от клеточной структуры. На основании полученных результатов определяется необходимость дополнительного лечения, такого как “химиотерапия” или “радиотерапия”. После операции необходимо тщательное наблюдение в соответствии со стадией и типом опухоли. Как и при других видах рака, шансы на успех очень высоки при ранней диагностике и соответствующем лечении в короткие сроки.
КАКОВЫ МЕТОДЫ ЛЕЧЕНИЯ РАКА ЯИЧКА?
Лечение рака яичка зависит от области распространения раковых клеток, типа рака и общего состояния здоровья пациентов. Стадия 1 означает, что рак находится только в яичке; стадия 2 означает, что рак распространился на лимфатические узлы в брюшной полости или тазу. Третья стадия рака яичка означает, что рак распространился за пределы лимфатических узлов в другие части тела, например, в легкие. Можно сказать, что основным методом лечения является хирургическое вмешательство, особенно при раке, диагностированном на ранней стадии. Другими словами, если рак находится только в яичке (1-я стадия), то удаление яичка (орхидэктомия) может быть единственным необходимым методом лечения. Если рак распространился за пределы яичка, пациенту также может быть проведена химио- и/или радиотерапия. Рак яичка может рецидивировать или распространяться на другие части тела. Поэтому после успешного лечения важно обеспечить последующее наблюдение.
Операция
Основным методом лечения рака яичка является операция по удалению пораженного раком яичка, называемая орхидэктомией. Можно сказать, что основным методом лечения рака яичка, диагностированного на ранних стадиях, является операция.
После операции команда специалистов, включая консультанта-онколога, изучит все результаты. Например, если рак прогрессирует дальше, может потребоваться еще одно хирургическое вмешательство для удаления лимфатических узлов в брюшной полости.
Химиотерапия
Химиотерапия часто используется для лечения рака яичка, если рак распространился за пределы яичка или рецидивировал после операции. Даже если рак не распространился, врач может назначить пациенту курс химиотерапии, если это необходимо. Это делается для того, чтобы снизить вероятность повторного возникновения рака яичка в будущем.
Радиотерапия
Радиотерапия использует излучение для уничтожения раковых клеток. Радиотерапия используется для лечения рака яичка типа семиномы, поскольку семиномы очень чувствительны к излучению. Радиотерапия может быть использована для предотвращения рецидива рака после операции или в случаях, когда рак распространился за пределы яичка.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ О РАКЕ ЯИЧКА
Каковы стадии рака яичка?
Стадия 1: При стадии 1 опухоль находится только в яичке.
Стадия 2: На стадии 2 опухоль распространилась на лимфатические узлы брюшной полости.
Стадия 3: На стадии 3 опухоль распространилась в лимфатические узлы брюшной полости и за ее пределы (чаще всего в легкие).
Могу ли я иметь детей после рака яичка?
Если при орхидэктомии удаляется только одно яичко, то бесплодия или проблем с эрекцией обычно не возникает. Это объясняется тем, что другое яичко вырабатывает больше сперматозоидов и больше гормона тестостерона, чтобы компенсировать отсутствующее яичко. Однако химиотерапия и радиотерапия могут снизить фертильность. Если в ходе лечения удаляются оба яичка и лимфатические узлы, это также может повлиять на фертильность.
Можно ли предотвратить рак яичек?
Предотвратить рак яичка невозможно, но важно его раннее выявление. Мужчины должны проводить самообследование яичек (СОЯ) один раз в месяц. При обнаружении каких-либо изменений в яичках (уплотнения или узелки, твердость, постоянная боль, увеличение или уменьшение яичек) следует немедленно обратиться к врачу.
Лучшее время для самообследования яичек – когда кожа мошонки расслаблена во время или после купания.
Для осмотра каждого яичка следует использовать обе руки. Указательный и средний пальцы должны располагаться под яичком, а большие пальцы – над ним. Яички следует осторожно вращать между пальцами (в норме яички могут быть разного размера).
Над и позади яичка можно заметить структуру, похожую на шнур. Эта структура называется эпидидимис. Эпидидимис хранит и переносит сперму, не путать с яичком.
При наличии твердости в яичке следует проверить его на наличие образования или припухлости. Если прощупывается какая-либо припухлость, необходимо обратиться к врачу (припухлости могут быть размером с горошину или больше и обычно безболезненны).
Каков прогноз (вероятность излечения) для мужчин с раком яичка?
Этот вид рака успешно лечится более чем в 95% случаев. Даже у мужчин с неблагоприятными факторами риска шансы на излечение составляют в среднем 50%.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ ОПУХОЛЬ НОГТЯ
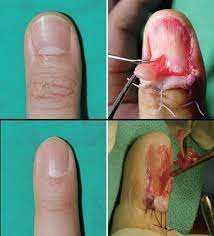
Опухолями ногтей называют образования, возникающие под ногтевой пластиной и по ее краям. Это опухоли, происходящие из основных клеток ногтя, называемых ногтевым матриксом, и ногтевого ложа, в которое врастает ногтевая пластинка. Большинство опухолей ногтей являются доброкачественными. Некоторые опухоли ногтей чаще встречаются на руках, а некоторые – на ногах. Особенно часто они встречаются на больших пальцах ног и рук. Опухоли ногтей, вызывающие серьезную деформацию ногтя, должны быть удалены хирургическим путем. Доброкачественные (доброкачественные опухоли) и злокачественные (раковые) опухоли могут поражать ноготь и вызывать изменение структуры (дистрофию) и цвета (дихоляризацию) ногтя.
Доброкачественные опухоли ногтей:
Миксоидные опухоли
Опухоли Гламоса
Пиогенные гранулемы
Onychomatricoma
Злокачественные опухоли ногтей:
Болезнь Боуэна
Сквамозно-клеточная карцинома
Злокачественная меланома
КАКОВЫ ПРИЧИНЫ ВОЗНИКНОВЕНИЯ ОПУХОЛЕЙ НОГТЕЙ
Как и в случае с другими видами рака кожи, наиболее важной причиной возникновения опухолей ногтей является солнечное излучение. Ногти, как и кожу, необходимо защищать от вредного воздействия солнечных лучей. Для ногтей также следует использовать солнцезащитные кремы. Особенно осторожными должны быть люди с чувствительной кожей.
К другим причинам возникновения опухолей ногтей относятся хронические травмы, воздействие химических веществ, лучевая терапия, виды рака, подавляющие иммунную систему, такие как лимфома, лейкемия, а также препараты, влияющие на иммунную систему, например, химиотерапия и инфекции (СПИД). Помимо этих причин, возможность рака следует рассматривать при всех видах хронических ран и кровотечений.
КАКОВЫ СИМПТОМЫ ОПУХОЛИ НОГТЯ?
Опухоли ногтей особенно заметны по нарушению структуры ногтя. Опухоли ногтей могут давать такие симптомы, как деформация, например, растрескивание, утолщение, нарушение структуры и формы ногтя, образования и припухлости под ногтем. При злокачественных опухолях можно наблюдать изменение цвета ногтя, припухлость под ногтем и кровотечение. К симптомам злокачественных опухолей ногтей относятся также изменения черного или коричневого цвета вокруг ногтевой пластинки, ногтевого ложа и ногтя, распространение опухоли вокруг и незаживающие раны.
Опухоли ногтей часто путают с грибком ногтей. Опухоли ногтей, которые не удается правильно диагностировать, могут рассматриваться как грибок ногтей. Лечение опухоли ногтя, которая рассматривается как грибок ногтя и лечится соответствующим образом, также может быть отложено на ранней стадии.
Ранние и непрогрессирующие доброкачественные или злокачественные опухоли легко поддаются лечению, в то время как поздно выявленный рак ногтя может распространяться и даже переходить на внутренние органы. Позднее выявление опухоли ногтя может привести к ампутации пальца или сустава.
КАК ДИАГНОСТИРУЕТСЯ ОПУХОЛЬ НОГТЯ?
Диагностика опухолей ногтей проводится путем осмотра, дермоскопического исследования и, при необходимости, биопсии ногтя. Врач-дерматолог обычно может определить наличие опухоли ногтя после осмотра и дермоскопического исследования с помощью дермоскопа. В случаях подозрения на рак для подтверждения диагноза проводится биопсия ногтя и подногтевого пространства, после чего опухоль удаляется хирургическим путем как можно скорее.
КАК ЛЕЧАТ ОПУХОЛИ НОГТЕЙ?
Опухоли ногтей часто лечатся хирургическим путем. Область расположения опухоли местно обезболивается, и проводится хирургическое вмешательство, соответствующее опухоли. Опухоли ногтей могут лечиться кюретажем, прижиганием электрокаутером или радиотерапией. Даже если вид опухолей различен, наиболее успешным методом лечения является хирургическое лечение опухолей.
Миксоидные кисты – это полупрозрачные кисты, содержащие жидкость. Их можно лечить путем дренирования жидкости, но при этом существует вероятность рецидива. Миксоидные кисты можно также лечить путем хирургического удаления.
Пиогенные гранулемы представляют собой слегка приподнятые, красные, геморрагические образования, образующиеся в результате разрастания капилляров. Они вызывают отек окружающих тканей. Эти опухоли легко кровоточат и могут быть удалены кюретажем, электрокаутеризацией или хирургическим путем. Пиогенные гранулемы иногда можно спутать с амеланотической формой злокачественной меланомы. Поэтому целесообразно проводить патоморфологическое исследование удаленной опухоли.
Гломусные опухоли состоят из клеток сосудистых структур, называемых гломусами. Они могут возникать в любой области, где проходят сосуды. Они также могут возникать в гломусных структурах сосудов ногтей на ногах и ногтях. В зависимости от места локализации они могут быть болезненными. Среди симптомов могут быть также отек и деформация ногтей. В большинстве случаев это доброкачественное заболевание, однако его бывает трудно диагностировать из-за небольших размеров. Лечение заключается в хирургическом удалении.
Опухоль ониматрикома возникает вследствие избыточной выработки кератина. Они проявляются в виде темной линии под ногтем и утолщения ногтевой пластины. При онихоматрикоме также наблюдаются пожелтение ногтя, отек, продольные линии и кровотечение из осколков. Лечение заключается в хирургическом удалении опухоли.
Лечение злокачественных новообразований ногтей заключается в биопсии опухоли и ее скорейшем хирургическом удалении. Дальнейшие варианты лечения оцениваются в зависимости от стадии рака.
Сквамозно-клеточная карцинома – это злокачественное новообразование ногтей. Одной из важнейших причин является чрезмерное воздействие ультрафиолетовых лучей. У мужчин он встречается в 2 раза чаще, чем у женщин. Кроме ногтей, рак может возникать на лице, кистях, руках и ногах.
Болезнь Боуэна также называется внутриэпидермальной сквамозной карциномой. Она представляет собой раннюю форму рака кожи. Это заболевание, как правило, поражает верхние слои кожи. При раннем обнаружении и удалении опухоли лечение развивается благоприятно.
Злокачественная меланома – это рак, возникающий из клеток меланоцитов, вырабатывающих пигмент меланин, который придает цвет коже, волосам и глазам. Этому заболеванию чаще подвержены темнокожие люди. Наиболее распространенная возрастная группа – 40-70 лет.
Меланома называется подногтевой, если она возникает в ногтевом ложе, унгуальной, если она возникает под ногтевой пластиной, и периунгуальной, если она возникает в ногтевой пластине и коже. Злокачественная меланома подлежит хирургическому удалению.
Проверка изменений, происходящих в ногте, специалистом и регулярные медицинские осмотры являются одними из лучших мер по борьбе с раком ногтя.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ ТИМУСНАЯ ЖЕЛЕЗА?

Вилочковая железа, расположенная в организме за областью, называемой вериной доской, перед трахеей, под щитовидной железой и перед сердцем, в народе известна как “сонная железа”. Вилочковая железа – небольшой инкапсулированный орган, напоминающий букву H, – имеет розово-серый цвет. Вилочковая железа, имеющая большие размеры при рождении, в подростковом возрасте может уменьшаться и становиться незаметной. У пожилых людей ее масса оценивается примерно в 5 г. Вилочковую железу, которая у мальчиков несколько больше, чем у девочек, можно увидеть на прямой рентгенограмме до трехлетнего возраста у детей. Хотя после полового созревания вилочковая железа уменьшается в размерах и становится незаметной, она продолжает выполнять свои функции в течение всей жизни.
КАКОВЫ ФУНКЦИИ ВИЛОЧКОВОЙ ЖЕЛЕЗЫ?
Вилочковая железа, один из малоизвестных органов, выполняет важные функции в организме. Вилочковая железа, являющаяся незаменимым органом иммунной системы, полностью сформирована при рождении. Она вырабатывает Т-клетки, которые являются важнейшими элементами иммунной системы. Вилочковая железа вырабатывает антитела против чужеродных для организма микроорганизмов. Вилочковая железа вместе с миндалинами, аденоидами и селезенкой входит в состав лимфатической системы, а также эндокринной системы. Вилочковая железа вырабатывает Т-клетки, которые помогают уничтожать инфицированные или раковые клетки в организме. Т-клетки, вырабатываемые тимусом, также помогают другим органам иммунной системы правильно развиваться.
ЧТО ТАКОЕ РАК ВИЛОЧКОВОЙ ЖЕЛЕЗЫ?
Рак вилочковой железы – редкий вид рака. Существует два типа рака вилочковой железы. Наиболее часто встречающийся тип рака вилочковой железы называется тимомой. Другой вид рака, который встречается в вилочковой железе очень редко, называется тимической карциномой.
ЧТО ТАКОЕ ТИМИЧЕСКАЯ КАРЦИНОМА?
Опухоли тимической карциномы – самый редкий вид рака вилочковой железы. Опухоли тимической карциномы растут быстрее. Кроме того, они могут быстрее распространяться на другие части тела. Поэтому опухоли тимической карциномы труднее поддаются лечению. Аутоиммунные заболевания при карциноме тимуса встречаются гораздо реже, чем при тимоме.
ЧТО ТАКОЕ ОПУХОЛЬ ТИМОМА?
Тимома – наиболее распространенная опухоль, исходящая из вилочковой железы, и самая частая опухоль средостения у взрослых. В детском возрасте это злокачественное заболевание встречается крайне редко. Опухоли тимомы, одинаково часто встречающиеся у мужчин и женщин, обычно возникают в возрасте 50-60 лет. Поскольку опухоли тимомы растут медленно, выживаемость пациентов выше, чем при других видах рака.
КАК ДИАГНОСТИРУЕТСЯ ОПУХОЛЬ?
Поскольку опухоли тимомы обычно прогрессируют без каких-либо симптомов, их обычно обнаруживают случайно при обследовании по поводу другого заболевания. Если размеры вилочковой железы не очень велики, она не видна на рентгенограмме грудной клетки. Если размеры и форма вилочковой железы заметны на КТ, МРТ или ПЭТ/КТ, выполненных по другим причинам, проводится биопсия и устанавливается диагноз. Биопсия выполняется с помощью тонкоигольной аспирационной биопсии, медиастинотомии и VATS (видеоопосредованная торакоскопическая хирургия). Поскольку тонкоигольная аспирационная биопсия имеет более низкую точность, чаще всего используется метод VATS.
КАКОВЫ СТАДИИ ОПУХОЛЕЙ ТИМОМЫ?
Существует 4 стадии опухоли тимомы.
- Опухоль тимомы 1 стадии: На первой стадии опухоль тимомы еще находится в капсуле.
- Опухоль тимомы 2-й стадии: на второй стадии опухоль тимомы может распространиться на капсулу и прогрессировать в окружающие жировые ткани.
- Опухоль тимомы 3-й стадии: на третьей стадии опухоль тимомы может достигнуть окружающих тканей за пределами капсулы, трахеи, легких и сердечной оболочки.
- Опухоль тимомы 4-й стадии: На четвертой стадии опухоль тимомы может распространиться на плевру и другие отдаленные органы.
В ЧЕМ ЗАКЛЮЧАЕТСЯ ЛЕЧЕНИЕ ОПУХОЛЕЙ ТИМОМЫ?
Лечение опухоли тимомы проводится в зависимости от ее стадии. Опухоли тимомы, диагностированные на ранних стадиях, лечатся только хирургическими методами. Опухоль удаляется с помощью торакоскопической или открытой операции. На более поздних стадиях опухоли тимомы химиотерапия или химиорадиотерапия может сочетаться с хирургическим лечением. Тимомы, распространившиеся на отдаленные органы, не оперируются.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ О РАКЕ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Что вызывает опухоли тимомы?
Известные причины возникновения опухолей тимомы до конца не выяснены. В некоторых исследованиях было установлено, что радиотерапия и инфицирование вирусом EBV в раннем возрасте могут представлять риск развития опухолей тимомы, причина и потенциальные факторы риска которых до конца не известны. В настоящее время проводятся исследования, направленные на выяснение того, являются ли опухоли тимомы генетическим заболеванием, т.е. связи между тимомой и хромосомами.
Какие жалобы вызывают опухоли тимомы?
У большинства пациентов опухоль тимомы обычно не вызывает никаких жалоб и симптомов. Однако у 30-35% пациентов она проявляется следующими симптомами:
- Кашель
- Боль в груди
- Хрипота
Наиболее частым паранеопластическим синдромом, связанным с тимомой, является “миастения гравис”. Паранеопластические синдромы – это эффекты, которые вызываются не непосредственно самой опухолью, а гормонами или веществами, выделяемыми опухолью. Миастения гравис сопровождает от 30 до 50% опухолей тимомы.
Что такое миастения гравис?
Миастения гравис – это заболевание нервно-мышечной системы, характеризующееся быстрой утомляемостью волевых мышц. Наиболее важным симптомом является мышечная слабость, которая нарастает при утомлении и исчезает в покое. Обычно пациенты чувствуют себя хорошо, когда просыпаются утром. Однако в течение дня общее состояние больных постепенно ухудшается. Заболевание может также проявляться в виде опущения век. Чаще всего симптомы проявляются в виде затруднений в работе мышц лица, глаз, рта, языка, жевательных и глотательных мышц.
Является ли рак вилочковой железы смертельным заболеванием?
Опухоли тимомы, представляющие собой рак вилочковой железы, могут привести к летальному исходу, если их не лечить. Однако, поскольку тимома является медленно растущей опухолью, период выживания пациента более длительный, чем при других видах рака. Особенно если операция проводится на ранних стадиях, то выживаемость пациентов очень велика.
Какое отделение и какой врач проводит диагностику и лечение рака вилочковой железы?
Диагностикой и лечением рака вилочковой железы занимаются специалисты по торакальной хирургии в отделениях торакальной хирургии больниц.
Является ли рак вилочковой железы генетическим заболеванием?
Точная причина возникновения рака вилочковой железы пока не известна. Однако считается, что радиотерапия и люди, инфицированные вирусом EBV в раннем возрасте, имеют более высокий фактор риска. В настоящее время изучается вопрос о том, являются ли опухоли вилочковой железы генетическим заболеванием.
Рак вилочковой железы чаще встречается у женщин или мужчин?
Одинаково ли часто встречается рак вилочковой железы у мужчин и женщин?
В каком возрасте чаще всего встречается рак вилочковой железы?
Рак вилочковой железы, особенно опухоли тимомы, слишком редко встречается в детском возрасте. Опухоли тимомы чаще встречаются в возрасте 50-60 лет.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ ТИРЕОИДИТ?

Щитовидная железа в народе известна как заболевание. Однако на самом деле щитовидная железа – это орган в форме бабочки, расположенный перед трахеей, чуть ниже области, известной как “адамово яблоко” в горле. Щитовидная железа отвечает за выработку многих гормонов, которые управляют жизненно важными функциями организма.
ЧТО ТАКОЕ УЗЛЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ?
Щитовидная железа, т.е. ткань щитовидной железы, представляет собой твердую или жидкую нормальную структуру, которая может иметь различные размеры. Большинство узлов щитовидной железы не являются раковыми и могут расти без каких-либо симптомов. Они могут быть обнаружены случайно во время плановых медицинских осмотров или при обследовании. Однако некоторые узлы щитовидной железы могут вырасти достаточно большими, чтобы быть заметными, и вызывать различные жалобы.
ЧТО ТАКОЕ РАК ЩИТОВИДНОЙ ЖЕЛЕЗЫ?
Рак щитовидной железы – это опухоль щитовидной железы, которая возникает, когда нормальные клетки щитовидной железы превращаются в аномальные и растут неконтролируемо.
ЧТО ВЫЗЫВАЕТ РАК ЩИТОВИДНОЙ ЖЕЛЕЗЫ?
Рак щитовидной железы – это опухоль, возникающая из узлов щитовидной железы. Семейный анамнез рака щитовидной железы, облучение шеи по другой причине, а также различные мутации, происходящие на клеточном уровне, могут стать причиной развития рака из узлов щитовидной железы.
КАКОВЫ ФАКТОРЫ РИСКА РАЗВИТИЯ РАКА ЩИТОВИДНОЙ ЖЕЛЕЗЫ?
Факторы риска развития рака щитовидной железы можно перечислить следующим образом.
- Рак щитовидной железы чаще встречается у женщин, чем у мужчин. Хотя причина более высокой заболеваемости раком щитовидной железы у женщин точно не известна, считается, что она связана с гормоном эстрогеном.
- Лучевая терапия, особенно на область головы и шеи, может повышать риск развития рака щитовидной железы.
- Генетические факторы могут повышать риск развития рака щитовидной железы.
КАКОВЫ СИМПТОМЫ РАКА ЩИТОВИДНОЙ ЖЕЛЕЗЫ?
Наиболее частым симптомом рака щитовидной железы является увеличение и припухлость в передней части шеи, где расположена щитовидная железа. В некоторых случаях могут появиться и компрессионные проявления, такие как ощущение прилипания при глотании, затрудненное глотание, затрудненное дыхание, кашель и охриплость. Иногда рак может быть обнаружен случайно при пальпации или при визуализации, проведенной по другой причине, не вызывая никаких симптомов. Симптомы рака щитовидной железы можно перечислить следующим образом:
- Увеличение в области щитовидной железы
- Отек
- Затрудненное дыхание
- Кашель
- Хрипота
КАК ДИАГНОСТИРУЕТСЯ РАК ЩИТОВИДНОЙ ЖЕЛЕЗЫ (ЗОБ)?
Наиболее важным методом исследования в диагностике рака щитовидной железы является ультразвуковое исследование щитовидной железы. Если при ультразвуковом исследовании обнаруживается узел щитовидной железы с подозрительными на рак признаками, то проводится тонкоигольная аспирационная биопсия. Тонкоигольная аспирационная биопсия щитовидной железы является золотым стандартом диагностики рака щитовидной железы во всем мире. Если в результате оценки цитолога образец, полученный при биопсии, подозрителен на рак щитовидной железы, то окончательный диагноз ставится при исследовании удаленной в результате операции ткани щитовидной железы специалистом-патологоанатомом.
КАКОВЫ МЕТОДЫ ЛЕЧЕНИЯ РАКА ЗОБА?
Основным методом лечения рака щитовидной железы является хирургическое удаление всей щитовидной железы или ее пораженной половины. Если заболевание распространилось на лимфатические узлы шеи, они также подлежат хирургическому удалению. После операции некоторые виды рака щитовидной железы требуют дополнительного лечения, называемого терапией радиоактивным йодом (атомотерапия). Решение о необходимости такого лечения принимается лечащим врачом в соответствии с результатами патологии и риском рецидива заболевания. Обычно перед лечением необходимо прекратить прием препаратов для лечения щитовидной железы и соблюдать специальную диету в течение определенного времени. Лечение проводится в радиационно-защищенном помещении в связи с возможностью радиационного излучения, и некоторое время после лечения необходимо соблюдать меры предосторожности, чтобы не подвергать опасности окружающих. После операции на щитовидной железе пожизненно проводится пероральная гормональная терапия, как для удовлетворения потребности организма в тиреоидных гормонах, так и для профилактики рецидивов заболевания. Помимо этого, в последующем лечении рака щитовидной железы редко требуется применение других методов лечения, таких как лучевая и химиотерапия.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ О РАКЕ ЗОБА
Какова частота встречаемости рака щитовидной железы у мужчин и женщин?
Примерно в 5% случаев из всех узловых образований щитовидной железы развивается рак щитовидной железы. У женщин они встречаются в 4 раза чаще, чем у мужчин.
Каким должно быть последующее наблюдение при раке щитовидной железы?
Больные раком щитовидной железы должны регулярно наблюдаться. В дополнение к физикальному обследованию в некоторых случаях могут потребоваться анализы крови, ультразвуковое исследование шеи, ядерные скрининговые исследования и другие методы визуализации. Частоту наблюдений и то, какие тесты будут проводиться, должен определять врач, осуществляющий наблюдение.
Можно ли предотвратить факторы, которые могут вызвать рак щитовидной железы?
Как и при любом другом онкологическом заболевании, необходимо придерживаться здорового питания и вести активный образ жизни. Кроме того, следует принимать необходимые меры предосторожности для защиты области шеи от радиационного воздействия.
Каким должно быть питание при раке щитовидной железы?
У больных раком щитовидной железы, если после операции планируется лечение радиоактивным йодом, рекомендуется диета, бедная йодом. Однако, если нет иных рекомендаций врача, нет никаких специальных диетических рекомендаций, кроме здорового питания, которое применимо ко всем.
Когда людям с семейным анамнезом рака щитовидной железы следует пройти первое обследование?
Необходимо как можно скорее пройти обследование у эндокринолога и запланировать необходимые анализы.
Является ли рак щитовидной железы смертельным?
Хотя существуют различные типы рака щитовидной железы, большинство из них относится к папиллярному типу рака щитовидной железы. Папиллярный тип рака щитовидной железы прогрессирует очень медленно. Хотя он часто распространяется на лимфатические узлы в шее, это заболевание очень хорошо поддается лечению. Рак щитовидной железы – это вид рака с очень высоким процентом выживаемости при правильном лечении.
Распространяется ли рак щитовидной железы?
Рак щитовидной железы может развиваться внутри ткани щитовидной железы или распространяться на близлежащие ткани и лимфатические узлы в шее. Различные виды рака щитовидной железы, например фолликулярный рак щитовидной железы, могут распространяться на легкие и кости.
Можно ли полностью вылечить рак щитовидной железы?
При ранней диагностике и соответствующем лечении рак щитовидной железы может быть полностью излечен. Однако рак щитовидной железы также может рецидивировать.
Является ли каждая щитовидная железа раковой?
Большинство узловых образований щитовидной железы являются доброкачественными. Большинство узлов щитовидной железы представляют собой кисты, заполненные жидкой или коллоидной формой гормона щитовидной железы. Твердые узлы чаще всего являются раковыми.
Сколько часов занимает операция по удалению рака щитовидной железы?
Продолжительность операции по удалению рака щитовидной железы может варьироваться в зависимости от типа и распространенности рака щитовидной железы, а также от применяемого хирургического метода. В целом операция по удалению рака щитовидной железы может занимать 2-3 часа.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ УРЕТРА?

Уретра – это полая трубка, по которой моча, хранящаяся в мочевом пузыре, выводится из организма. Длина уретры у мужчин составляет 8 дюймов, она проходит от мочевого пузыря через предстательную железу до кончика полового члена. У женщин уретра имеет длину 1,5 дюйма и расположена чуть выше влагалища.
ЧТО ТАКОЕ РАК УРЕТРЫ?
Рак уретры – это разновидность рака, развивающегося в уретре. Рак уретры вызывается раковыми (злокачественными) клетками в тканях, выстилающих уретру – узкую трубку, по которой моча выводится из мочевого пузыря за пределы организма. Рак уретры – самый редкий вид рака среди всех урологических онкологических заболеваний. Риск развития рака уретры, который чаще встречается у мужчин, чем у женщин, выше у людей старше 60 лет и у тех, у кого в анамнезе был рак мочевого пузыря. Кроме того, некоторые заболевания, передающиеся половым путем, такие как частые инфекции мочевыводящих путей и ВПЧ (вирус папилломы человека), также повышают риск развития рака уретры, вызывая хроническое воспаление в уретре. Рак уретры, который может прогрессировать скрытно, без каких-либо симптомов, проявляется кровью в моче, частым, слабым или прерывистым мочеиспусканием, выделениями из уретры или увеличением лимфатических узлов вокруг уретры.
КАКОВЫ ПРИЧИНЫ ВОЗНИКНОВЕНИЯ РАКА УРЕТРЫ?
Причины возникновения рака уретры, как и многих других видов рака, пока точно не известны. Известно, что рак уретры возникает, когда здоровые клетки начинают неконтролируемо расти, и эти клетки собираются вместе, образуя опухоль. Однако пока точно не известно, почему эти клетки быстро растут и вызывают рак уретры. Многолетние исследования пациентов с раком уретры позволяют предположить, что эти причины повышают риск развития рака:
- У людей старше 60 лет риск развития рака уретры выше, чем у молодых.
- Пациенты, у которых в анамнезе был рак мочевого пузыря, имеют высокий риск развития рака уретры. Кроме того, рак уретры может развиться позже, даже если мочевой пузырь удален у тех, кто лечится от рака мочевого пузыря.
- Заболевания, передающиеся половым путем, такие как ВПЧ (вирус папилломы человека), могут повышать риск развития рака уретры.
- Риск развития рака уретры выше у людей с частыми инфекциями мочевыводящих путей.
- Хроническое воспаление уретры может привести к раку уретры.
- Стеноз уретры может стать причиной хронического отека и воспаления у мужчин, что повышает риск развития рака уретры.
- Наличие образования в уретре может повышать риск развития рака уретры у женщин.
- Риск развития рака уретры у чернокожих в два раза выше, чем у европеоидов.
КАКОВЫ СИМПТОМЫ РАКА УРЕТРЫ?
Рак уретры – это заболевание, которое вначале протекает бессимптомно. Это объясняется тем, что раковые опухоли имеют небольшие размеры. По мере роста опухоли рак уретры может вызывать у пациента такие симптомы:
- Кровь в моче
- Выделения или кровотечение из уретры
- Частое мочеиспускание и позывы к мочеиспусканию без полного мочеиспускания
- Проблемы с мочеиспусканием
- Боль при мочеиспускании или слабый поток мочи
- Недержание мочи
- увеличенные лимфатические узлы в паху
- Шишка или нарост в области между гениталиями и анусом
Большинство из перечисленных симптомов может быть вызвано и другим заболеванием. Однако не следует пренебрегать этими симптомами и необходимо определить наличие рака, обратившись к опытному урологу в этой области. Ведь рак уретры может стать причиной риска для жизни, если не провести раннюю диагностику.
КАК ДИАГНОСТИРУЕТСЯ РАК УРЕТРЫ?
Поскольку симптомы рака уретры часто схожи с симптомами других заболеваний, пациентов часто лечат от разных болезней. Такими методами лечения могут быть инфекции мочевыводящих путей или доброкачественная гиперплазия предстательной железы у мужчин. Пациенты, не получающие результатов от такого лечения, должны быть детально обследованы. После получения информации о причинах обращения к врачу, факторах риска и семейном анамнезе заболевания проводится физикальное обследование пациента. Для получения информации об опухолях вокруг уретры проводится цифровое ректальное исследование у мужчин и тазовое исследование у женщин. Кроме того, для окончательной диагностики врач может назначить следующие анализы и процедуры:
- Анализ мочи
- Анализ крови
- Ультразвук
- Эндоскопическое исследование (цистоскопия или уретероскопия)
- Компьютерная томография
- Биопсия
Как и в случае большинства видов рака, наиболее важным исследованием для окончательной диагностики рака уретры является биопсия. После постановки окончательного диагноза рака уретры могут быть проведены другие исследования для получения более подробной информации о раке. Эти тесты позволяют определить стадию рака и степень его распространения (метастазирования). После того как рак уретры полностью диагностирован, врач как можно скорее начинает процесс лечения, составляя вместе с пациентом план лечения.
КАК ЛЕЧИТСЯ РАК УРЕТРЫ?
Варианты лечения рака уретры планируются в зависимости от типа рака уретры, места его расположения в уретре, пола, результатов анализов и стадии рака. Наиболее важными методами лечения рака уретры являются следующие:
Хирургическое лечение
Наиболее распространенным методом лечения рака уретры является хирургическое вмешательство. Раковая опухоль удаляется хирургическим путем изнутри или снаружи уретры. Кроме того, хирургическим путем удаляются пораженные раком лимфатические узлы вокруг уретры.
Лучевая терапия
Лучевая терапия разрушает раковые клетки с помощью интенсивных пучков энергии. При раке уретры облучение обычно используется в сочетании с хирургическим вмешательством или химиотерапией.
Химиотерапия
Препараты для профилактики раковых опухолей уратов используются для уменьшения опухоли до операции и после операции для предотвращения рецидива заболевания.
Наблюдение
При лечении рака уретры в некоторых случаях пациент находится только под наблюдением. Это означает, что рак не лечится сразу. Другими словами, если опухоль не вызывает у пациента никаких проблем, не имеет тенденции к росту или распространению, то пациент находится под наблюдением врача с проведением регулярных осмотров и анализов. В том случае, если опухоль начинает расти или распространяться, применяются другие методы лечения.
Последующее наблюдение после лечения
При лечении рака уретры опухоль может быть полностью удалена. Однако это не исключает возможности рецидива рака. Поэтому пациент должен находиться под контролем врача для раннего выявления риска рецидива рака и предотвращения его возможного распространения.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ О РАКЕ УРЕТРЫ
Каковы побочные эффекты лечения рака уретры?
В процессе лечения рака уретры могут возникать такие побочные эффекты, как выпадение волос, язвы в различных частях тела, особенно во рту, рвота, потеря аппетита и нервозность, вызванные химиотерапией и другими лекарственными препаратами.
Является ли рак уретры смертельным заболеванием?
Рак уретры – коварное заболевание, которое может протекать без каких-либо симптомов. При ранней диагностике рака уретры его можно лечить с помощью хирургического вмешательства, химио- и радиотерапии.
Рецидивирует ли рак уретры?
Вероятность рецидива после лечения рака уретры зависит от начальной стадии и локализации раковой опухоли. Рак малых стадий и рак передней уретры имеют более низкий риск рецидива.
Рак уретры чаще встречается у мужчин или женщин?
Длина уретры составляет 8 дюймов у мужчин и 1,5 дюйма у женщин. Рак уретры чаще встречается у мужчин, чем у женщин.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ РАК ЯИЧНИКОВ?
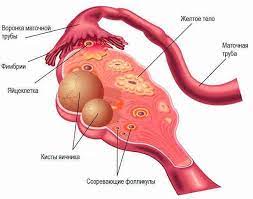
Эпителиальные клетки образуют основную структуру яичников, в ткани которых имеется множество различных клеток. Рак яичников может возникнуть в результате неконтролируемого деления и пролиферации эпителиальных клеток или клеток эмбрионального периода. В 80 процентах случаев рак яичников возникает в эпителиальной ткани, в основном после менопаузы. 60% случаев рака яичников, наблюдаемых в возрасте до 20 лет, являются эмбриональными опухолями.
КАКОВЫ СИМПТОМЫ РАКА ЯИЧНИКОВ?
Симптомы рака яичников обычно не проявляют себя сильно. Хотя большинство симптомов, связанных с раком яичников, зависят от конкретного пациента, типичных находок не существует. В качестве симптомов рака яичников, которые также можно назвать симптомами многих заболеваний, можно перечислить боль в животе, вздутие живота и дискомфорт в желудке.
Наиболее ярким симптомом рака яичников является пальпируемое образование в брюшной полости, ощущение давления внизу живота, скопление жидкости в брюшной полости, вздутие живота, жалобы на мочеиспускание и кишечник вследствие сдавления окружающих органов.
При некоторых видах рака яичников могут наблюдаться гормональные нарушения. Соответственно, могут наблюдаться нарушения менструального цикла, рост волос при повышенной секреции мужских гормонов, выпадение волос по мужскому типу. Большинство жалоб при раке яичников связано с вздутием живота.
Общие симптомы рака яичников можно перечислить следующим образом;
- Изменение привычек кишечника, особенно появление запоров,
- Изменение привычек мочевого пузыря, частые позывы к мочеиспусканию,
- Потеря аппетита или чувство быстрого насыщения,
- Вагинальное кровотечение
- Снижение веса,
- Ощущение давления в брюшной полости и вздутие живота,
- Ощущение полноты или боли в паху,
- Длительное несварение желудка, метеоризм или тошнота.
ЧТО ВЫЗЫВАЕТ РАК ЯИЧНИКОВ?
Хотя причины возникновения рака яичников не вполне ясны, можно говорить о том, что некоторые факторы риска вызывают это заболевание. Среди причин рака яичников можно выделить генетические, экологические и гормональные факторы. Можно перечислить следующие причины рака яичников;
- Риск повышается у людей, имеющих в семейном анамнезе рак молочной железы или яичников.
- В последние годы изменения в некоторых генах привели к повышению риска развития рака яичников.
- Риск развития рака яичников повышается у тех, кто принимает препараты, улучшающие овуляцию.
- Прием противозачаточных таблеток снижает риск развития рака яичников.
- Риск развития рака яичников выше у женщин, которые никогда не были беременны. У рожавших женщин риск снижается.
КАК ДИАГНОСТИРУЕТСЯ РАК ЯИЧНИКОВ?
Ранняя диагностика рака яичников, как и всех других онкологических заболеваний, очень важна. Для ранней диагностики женщинам рекомендуется не пренебрегать ежегодным плановым гинекологическим контролем. Пальпируемое образование при гинекологическом осмотре или образования в яичниках при ультразвуковом исследовании дают возможность вмешаться на ранних стадиях рака.
Не каждая киста яичника означает рак. Большинство кист, особенно у женщин репродуктивного возраста, являются простыми и безвредными образованиями. Эти кисты, которые со временем исчезают сами по себе, не несут онкологической опасности. Поэтому врач-специалист определяет, являются ли кисты, наблюдаемые с помощью УЗИ, вредными или не содержат никаких негативных последствий для организма. Кроме того, опухолевому риску подвержены все виды кист у женщин в климактерическом периоде и молодых девушек перед менструацией. В связи с этим их необходимо обследовать.
На поздних стадиях кист яичников и образований с опухолевыми характеристиками проводится исследование опухолевых маркеров в крови. Некоторые опухолевые маркеры (особенно CA 125) повышены при некоторых типах опухолей яичников. Однако высокий уровень CA125 и других опухолевых маркеров не всегда свидетельствует о раковом характере образования, а низкий уровень опухолевых маркеров не исключает рак. Помимо опухолевых маркеров, дифференцировать доброкачественные и злокачественные опухоли помогает допплеровское ультразвуковое исследование, показывающее изменения кровотока. Все эти методы являются вспомогательными. Ни один из них не является достаточным для постановки окончательного диагноза. В случаях, когда кисты и образования, которые считаются опухолевыми (как доброкачественные, так и злокачественные), невозможно дифференцировать, окончательный диагноз ставится с помощью хирургического вмешательства и взятия патологического образца биоптата во время операции.
При наличии кисты, если опухолевые маркеры и допплерографическое исследование в норме, при УЗИ и осмотре не обнаружено признаков опухоли, а размер кисты не превышает 8 см, за ней можно наблюдать некоторое время. Если в процессе наблюдения не происходит уменьшения или исчезновения опухоли, предпочтительнее хирургическое вмешательство.
КАК ЛЕЧИТСЯ РАК ЯИЧНИКОВ?
Лечение рака яичников хирургическое, при этом удаляются не только матка и яичники, но и все ткани, которые могут быть вовлечены в процесс в организме. После хирургического лечения применяется химиотерапия. Хирургический метод применяется на всех стадиях рака яичников. Если удаление образования при лечении рака яичников сопряжено с риском повреждения жизненно важных органов, то сначала проводится химиотерапия, направленная на уменьшение образования. Затем хирургическим методом производится вмешательство в раковую массу и ткани. После операции по поводу рака яичников, если рак не распространился по организму, химиотерапия может не потребоваться. При распространении рака яичников необходимо проведение химио- или радиотерапии. Химиотерапия проводится в течение 6-9 циклов после операции, в зависимости от стадии заболевания.
В нашей стране стали часто применяться новые методы лечения рака яичников. Лечение таргетными препаратами повышает вероятность излечения, продлевает выживаемость и обеспечивает значительное симптоматическое облегчение. При лечении рака яичников очень важна защита репродуктивной функции. Особенно при герминогенном раке яичников и раке яичников пограничного типа, наблюдаемом в раннем возрасте, удаляется только раковая ткань или раковый яичник, а матка и противоположный яичник сохраняются, что позволяет зачать ребенка.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ О РАКЕ ЯИЧНИКОВ
Каковы стадии рака яичников?
Стадия, на которой диагностируется рак яичников, очень важна для лечения рака яичников. Необходимо знать, распространился ли рак из яичника на окружающие и близлежащие органы. Стадии при раке яичников определяются в зависимости от степени распространения рака.
Стадия 1: Рак находится в одном или обоих яичниках, но только в яичнике.
Стадия 1а: рак ограничен одним яичником и находится в его пределах.
Стадия 1b: Рак находится в обоих яичниках, но все еще локализуется в пределах яичников.
Стадия 1c: Рак находится в одном или обоих яичниках, а также распространился за пределы яичников. Опухолевая киста на яичнике лопнула, или раковые клетки были обнаружены в жидкости в брюшной полости.
Стадия 2: Рак распространился на другие органы в тазу – области, окруженной тазовыми костями.
Стадия 2a: рак распространился на матку, трубы или оба органа.
Стадия 2b: Рак распространился на мочевой пузырь или толстую кишку.
Стадия 2c: Рак распространился любым из способов, описанных в пунктах 2a и 2b. Кроме того, рак распространился за пределы яичника, лопнула опухолевая киста на яичнике или раковые клетки были обнаружены в брюшной жидкости.
Стадия 3: рак распространился в брюшную полость или затронул лимфатические узлы.
Стадия 3a: раковые клетки распространились в брюшную полость, но только в виде очагов, настолько мелких, что их можно увидеть только под микроскопом.
Стадия 3b: Раковые клетки распространились в брюшную полость, но их размер не превышает 2 см.
Стадия 3c: Раковые клетки распространились в брюшную полость и достигли размера более 2 см, либо распространились в лимфатические узлы, либо присутствуют оба этих условия.
Стадия 4: рак распространился на печень, легкие или другие отдаленные органы.
В чем заключается важность ранней диагностики рака яичников?
Реакция рака яичников на лечение напрямую зависит от того, насколько далеко распространилась опухоль. Если рак яичников диагностируется на ранних стадиях и проводится соответствующее лечение, от него можно избавиться на 80-90%. При раке яичников, диагностированном на поздних стадиях, процент излечения составляет 40-50%. После
операции по удалению рака яичников и химиотерапии пациентка должна регулярно обследоваться на предмет возможности рецидива заболевания.
Является ли рак яичников смертельным?
Рак яичников (рак яичников) – очень важное заболевание, серьезно угрожающее здоровью и жизни женщины, которое может проявиться в любом возрасте. Рак яичников является наиболее смертоносным из всех онкологических заболеваний женских половых органов. По сравнению с другими гинекологическими онкологическими заболеваниями, рак яичников на ранних стадиях обычно диагностируется очень поздно, поскольку не дает практически никаких предварительных симптомов. Поэтому рутинная гинекологическая УЗИ имеет большое значение для ранней диагностики.
Существует ли высокий риск развития рака яичников после менопаузы?
Рак яичников подразделяется на два типа в зависимости от типа ткани, из которой он исходит. От типа заболевания зависит вероятность его возникновения и возраст начала. Повышенный риск развития заболевания имеют нерожавшие женщины, имеющие в семейном анамнезе рак молочной железы и яичников. Однако наиболее важным фактором риска признан пожилой возраст. Только гормональная поддержка эстрогенами, особенно после менопаузы, относится к числу факторов, провоцирующих развитие рака яичников.
Что такое CA 125?
CA125 – это белок, содержащийся на поверхности большинства клеток рака яичников. Он может быть значительно повышен в крови женщин с раком яичников. Небольшое количество этого белка может вырабатываться и при некоторых других видах рака.
Что такое CA 125 при раке яичников?
Значения от 0 до 35 в тесте CA 125 являются нормальными. Если число находится в диапазоне 35-50, то пациентка должна находиться под контролем. При значениях выше 50 возникает подозрение на рак яичников. Однако СА 125 может быть высоким не при каждом раке яичников.
Куда метастазирует рак яичников?
На поздних стадиях рак яичников может распространяться на различные органы. При лечении необходимо знать, распространился ли он на яичник и окружающие органы. Наиболее важной особенностью этого рака является распространение на органы брюшной полости. Поскольку рак может распространиться на внутрибрюшные органы за короткое время, диагноз обычно ставится на поздних стадиях. Рак яичников может распространяться на тонкий и толстый кишечник. Он также может метастазировать в брюшину, таз, легкие и печень.
Можно ли спутать рак яичников с другими заболеваниями? Поскольку такие симптомы, как жалобы на
пищеварение, боль в паховой области, запоры, могут наблюдаться
при раке яичников, пациенты могут терять время в гастроэнтерологических или внутренних медицинских службах, задаваясь вопросом, нет ли проблем в пищеварительной системе. Иногда диагноз может быть поставлен именно этими врачами. Если проблемы с пищеварительной системой возникают в пожилом возрасте, следует обратиться в гинекологическое отделение.
Является ли операция при раке яичников открытой?
При наличии скопления жидкости в брюшной полости и распространении опухоли на поздней стадии проводится открытая операция. В некоторых случаях для наблюдения за размерами опухоли используется лапароскопия, и если опухоль не сильно распространилась, ее можно удалить в ходе одной операции. Также у таких пациенток в группе, нуждающейся в удалении матки, яичников, лимфатических узлов, аппендицита, может быть использована лапароскопическая или роботизированная хирургия. Химиотерапия планируется в зависимости от
патологии.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ ЛУЧЕВАЯ ТЕРАПИЯ?
Излучение – это особый вид энергии, переносимой в виде волн или частиц. Оно может вырабатываться специальными устройствами или выделяться так называемыми радиоактивными веществами. Эта энергия используется в медицине для визуализации, а также для лечения рака и некоторых других заболеваний. Для того чтобы направить излучение на больной орган, необходимы специальные устройства. Таким образом, использование высоких доз радиационной энергии для лечения называется “радиотерапией” или “лучевой терапией”.
КАК РАДИОТЕРАПИЯ ВОЗДЕЙСТВУЕТ НА ОРГАНИЗМ?
Высокие дозы радиации способны убивать клетки или препятствовать их делению и размножению. Поскольку раковые клетки делятся и размножаются гораздо быстрее, чем нормальные, лучевая терапия более эффективна в отношении раковых клеток, чем в отношении нормальных. Кроме того, нормальным здоровым клеткам гораздо легче восстановиться и выздороветь, чем раковым. На этапе, называемом “планирование”, составляются необходимые чертежи, чтобы больные ткани подверглись максимальному облучению, а нормальные – минимальному, и лечение применяется целенаправленно.
КАКОВЫ ПРЕИМУЩЕСТВА И ЦЕЛИ ЛУЧЕВОЙ ТЕРАПИИ?
Радиотерапия применяется практически при всех видах рака, который может возникнуть практически в любой части тела, и примерно у 50% онкологических больных. Для некоторых видов рака радиотерапия является единственным методом лечения. Радиотерапия сама по себе или в сочетании с хирургическим вмешательством и/или лекарственным лечением (“химиотерапия“) – это метод лечения, который позволяет добиться полного выздоровления у многих пациентов.
Радиотерапия
- Для однократного, целенаправленного, высокодозного и краткосрочного лечения (стереотаксическое)
- Для уменьшения опухоли перед операцией (неоадъювантная терапия),
- Для удаления раковых клеток, которые могут остаться в организме на микроскопическом уровне после операции (адъювант),
- Во время операции (интраоперационно) при некоторых видах рака,
- Для прямого лечения без операции, в комбинации с химиотерапией (лечебной),
- В некоторых случаях, когда полностью вылечить заболевание не удается, для уменьшения жалоб пациента, таких как боль и кровотечение, может быть применена радиотерапия. Этот вид лечения называется “паллиативным”.
КТО ПРОВОДИТ ЛУЧЕВУЮ ТЕРАПИЮ?
Радиационный онколог”, врач, специализирующийся на лечении заболеваний с помощью радиации, определяет тип и план лечения, необходимый пациенту.
Во время лечения лучевые онкологи работают со специальной командой. В этой команде; 0
Физик-радиационщик: Проверяет правильность работы приборов и доставку соответствующей дозы излучения.
Медсестра по радиотерапии: Обеспечивает сестринское обслуживание во время лечения, помогает минимизировать побочные эффекты, которые могут возникнуть у пациента, и оказывает помощь в питании во время лечения.
Техник по радиотерапии: Подготавливает пациента к лечению и выполняет ежедневные плановые процедуры с использованием лечебных аппаратов.
КАКИЕ СУЩЕСТВУЮТ ВИДЫ ЛУЧЕВОЙ ТЕРАПИИ?
Радиотерапия применяется двумя способами. Внешняя (наружная) и внутренняя (внутренняя). У некоторых пациентов эти две формы могут применяться последовательно.
External (внешний):
У большинства пациентов лучевая терапия проводится наружно. Обычно она проводится в лечебных центрах и амбулаториях и осуществляется путем направления лучей на пораженную ткань с помощью радиотерапевтических аппаратов. До последних лет наружное лечение проводилось в двух измерениях с помощью аппаратов, называемых Cobalt-60 или линейными ускорителями. Поскольку для доставки достаточной дозы в целевой объем при двухмерном лечении требовались большие запасы прочности, повреждение нормальных тканей и побочные эффекты были выше. Однако благодаря технологическим изменениям, произошедшим в последние годы в радиотерапевтических аппаратах, можно применять трехмерную конформную радиотерапию, IMRT (радиотерапию с модулированной интенсивностью), стеротактическую радиотерапию (на основе linac, gamaknife, cyberknife), обеспечивающие получение максимальной дозы в целевом объеме при минимальной дозе на нормальные ткани. При принятии решения о применении лучевой терапии врач также решает, какой аппарат больше подходит пациенту.
Внутренние:
При внутреннем облучении радиоактивный материал или источник вводится непосредственно в опухоль или в полость тела с помощью тонких проводов или трубок. Этот метод, часто применяемый при гинекологических опухолях, может быть использован и для облучения полости, оставшейся после операции.
КАК ВРАЧ СОСТАВЛЯЕТ ПЛАН ЛЕЧЕНИЯ ПРИ НАРУЖНОЙ ЛУЧЕВОЙ ТЕРАПИИ?
Источники излучения, используемые в радиотерапии, разнообразны. Врач может использовать рентгеновские лучи или пучки электронов. Выбор источника излучения зависит от типа опухоли, ее расположения в организме и особенно глубины. Высокоэнергетическое рентгеновское излучение используется для лечения многих видов рака. Электронными пучками можно лечить некоторые кожные заболевания.
Перед началом лечения проводится подготовительный сеанс компьютерной планирующей томографии. Это делается для того, чтобы индивидуализировать лечение и определить методику облучения, которая должна быть выбрана в зависимости от типа и степени распространения рака. Подробности подготовительного сеанса и самого лечения (в частности, частота и продолжительность сеансов) будут разъяснены пациенту врачом-радиоонкологом во время первичного осмотра. Прежде всего, определяется положение пациента в аппарате во время сеансов лучевой терапии, а затем в этом положении выполняется компьютерная томография. КТ-сканирование плана лечения позволяет определить наиболее рискованные зоны для опухолей и/или их распространения, а также нормальные ткани, которые необходимо защитить. Во время КТ могут использоваться иммобилизирующие устройства, пластиковые маски или введение контрастного вещества в вену.
Для того чтобы “целевой объем” облучался в одинаковых условиях от одного сеанса радиотерапии к другому, на коже пациента делаются отметки. Для этого используются чернильные ручки, которые не так легко отстирываются, или можно сделать татуаж. Поскольку используются водостойкие ленты, ежедневное купание не будет представлять проблемы. В случае стирания маркировки целесообразно предупредить техника и не доводить дело до конца самостоятельно.
После того как врач определит объем мишени и нормальные ткани с помощью томографических срезов, врач проконсультируется с физиком-радиологом, чтобы определить, какая доза облучения необходима пациенту, как она будет вводиться и сколько сеансов будет длиться. Процесс планирования может происходить в тот же день, а может занять несколько дней.
После начала лечения врач следит за реакцией пациента на лечение, его общим состоянием и возможными побочными эффектами лечения. Обычно прием у лучевого онколога осуществляется раз в неделю, но в зависимости от потребностей пациента можно посещать его и чаще. Очень важно вовремя получать запланированное лечение. Прерывание лечения, ненужные перерывы могут снизить ожидаемую эффективность лечения.
ЧТО ТАКОЕ ГИПЕРФРАКЦИОННАЯ ЛУЧЕВАЯ ТЕРАПИЯ?
Радиотерапия делится на суточные дозы в зависимости от типа и локализации опухоли. При гиперфракционной радиотерапии суточная доза также делится на несколько небольших частей. Если в течение одного дня необходимо провести несколько процедур, то они обычно проводятся с интервалом в 4-6 часов.
ЧТО ТАКОЕ ИНТРАОПЕРАЦИОННАЯ ЛУЧЕВАЯ ТЕРАПИЯ?
При интраоперационной лучевой терапии операция и лучевая терапия проводятся одновременно. Хирург удаляет как можно больше опухолевой ткани, а сразу после операции в операционной проводится лучевая терапия опухолевого очага, чтобы удалить все опухолевые клетки, которые могли остаться в удаленной области.
ЧТО ПРОИСХОДИТ ВО ВРЕМЯ СЕАНСА РАДИОТЕРАПИИ?
Перед началом процедуры пациент раздевается и надевает халат. Поэтому рекомендуется приходить на процедуру в одежде, которую можно легко сменить.
По линиям, предварительно нанесенным на кожу пациента, техник-радиотерапевт определяет местоположение зоны воздействия. Пациент должен сидеть в специальном кресле или лежать на процедурном столе. Во время каждого сеанса пациент находится в процедурном кабинете в среднем 15 минут, а доза излучения вводится в течение 1-5 минут. Внешняя радиотерапия безболезненна, как рентгеновский снимок.
Пациенту не нужно задерживать дыхание во время процедуры, если нет особых условий и достаточно дышать нормально. При проведении сеансов радиотерапии важно, чтобы определенная доза облучения была дана наиболее точно, чтобы лучи достигли нужного места в организме, чтобы положение пациента не нарушалось на протяжении всей процедуры, чтобы при каждой процедуре создавалось одно и то же положение и чтобы окружающая обстановка была иммобилизована для обеспечения наилучшего комфорта пациента. В этом процессе, называемом иммобилизацией, в зависимости от обрабатываемой области могут использоваться такие приспособления, как маски для головы и шеи, вакуумные кровати, подколенные стабилизаторы или плечевые съемники.
Перед подачей луча техник-радиотерапевт покидает помещение. Управление оборудованием осуществляется из небольшого помещения рядом. Пациент также может наблюдать за происходящим через монитор или окно. Если пациент говорит, то его голос слышен через громкоговоритель и может быть установлена связь с техником и врачом. Из-за больших размеров аппаратов для радиотерапии может возникать небольшой шум при их вращении под разными углами вокруг зоны лечения. Однако пациенты должны помнить, что аппараты обслуживаются соответствующим техническим персоналом и их работа регулярно проверяется. Любые вопросы, касающиеся процедурного кабинета или аппаратов, можно задать техническому специалисту или врачу.
Излучение невозможно увидеть, услышать или почувствовать. Если во время сеанса лечения возникает ситуация, когда пациент чувствует себя очень плохо или испытывает дискомфорт, следует немедленно сообщить об этом техническому специалисту. При необходимости работа приборов может быть немедленно остановлена.
СУЩЕСТВУЮТ ЛИ ПОБОЧНЫЕ ЭФФЕКТЫ РАДИОТЕРАПИИ?
Внешняя радиотерапия не приводит к радиоактивному облучению организма. Поэтому нет необходимости избегать контакта с людьми, получающими лечение. Даже при таких контактах, как объятия и поцелуи, нет риска негативного воздействия на других людей.
Побочными эффектами радиотерапии обычно являются жалобы в зоне лечения. Врач и медсестра информируют пациента о том, как справиться с этими побочными эффектами. Необходимо сообщить врачу или медсестре о появлении каких-либо жалоб во время лечения, например, кашля, повышения температуры, потливости или необычных болей. Побочные эффекты обычно исчезают в течение нескольких недель после окончания лечения и могут контролироваться с помощью лекарств или диеты. С более длительными побочными эффектами также можно справиться с помощью соответствующего лечения.
Эффективность лечения контролируется врачом. После лечения ощущается уменьшение боли, кровотечения и других подобных жалоб, а со временем появляются и другие признаки улучшения. В процессе наблюдения за результатами лечения врач может назначить некоторые анализы крови.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
Что такое лучевая терапия?
Радиотерапия – один из наиболее часто используемых методов борьбы с раком. Немецкий физик Вильгельм Рентген, работая с катодными лучами, назвал эти лучи, ранее им не обнаруженные и не распознанные, рентгеновскими, т.е. неизвестными лучами. Рентгеновские лучи с повышенной энергией направляются на раковые ткани. Радиотерапия, при которой воздействие осуществляется только на область расположения раковых тканей, применяется при многих видах рака. Основная цель – нарушить структуру раковых клеток и заставить их потерять способность к делению. Таким образом, удается контролировать заболевание. Радиотерапия применяется с различными целями (радикальная, адъювантная, неоадъювантная, профилактическая, паллиативная).
При каких заболеваниях применяется лучевая терапия?
Радиотерапия может применяться к онкологическим больным, которые считаются подходящими. Радиотерапия может использоваться в качестве первичного лечения рака, особенно при лимфоме (лимфоматозе) и раке головы и шеи.
Национальный институт рака (National Cancer Institute, NCI) перечисляет следующие виды рака, при которых применяется лучевая терапия:
- Рак молочной железы
- Рак легкого
- Рак предстательной железы
- Рак толстой кишки
- Рак головы или шеи
Сообщается, что брахитерапия может быть особенно эффективным методом лечения рака в определенных частях тела.
- Рак шейки матки (рак шейки матки)
- Рак матки
- Рак прямой кишки
- Онкологические заболевания головы и шеи
- Опухоли глаза
- Опухоль головного мозга
- Рак легкого
- Рак кожи
- Рак молочной железы
- Рак пищевода
- Раковые заболевания области заднего прохода
- Рак мочевого пузыря
Каковы преимущества лучевой терапии?
От 50 до 60% всех видов рака требуют проведения лучевой терапии. Примерно у 25% людей, которые восстанавливают свое здоровье, эта картина реализуется благодаря воздействию радиотерапии. Радиотерапия используется для удаления раковых клеток, которые могут продолжать существовать после операции по лечению рака. Одновременно радиотерапия используется и для уменьшения симптомов рака.
Преимущества лучевой терапии заключаются в следующем:
- При раке, обнаруженном на ранней стадии, выздоровление может быть достигнуто в короткие сроки.
- Распространение рака на другие части тела может быть остановлено.
- Эффективное лечение рецидивов рака может быть достигнуто
- Симптомы могут быть облегчены при запущенных формах рака в домашних условиях
- Отсутствие болезненности и болевых ощущений при нанесении
- При нанесении не ощущается никакого излучения
Как применяется радиотерапия (лучевая терапия)?
Радиотерапия подразделяется на внешнюю (наружное лечение) и брахитерапию (внутреннее лечение). Как правило, применение осуществляется внешним (наружным) методом. Во время лечения пациента просят неподвижно лежать на столе, на котором будет проводиться лечение. Радиотерапия, имеющая свои приборы и аппараты, часто применяется у лиц с диагнозом “рак”, а также у лиц с некоторыми доброкачественными опухолями. В этом помещении, где расположены специальные аппараты, лечение проводится сеансами. При радиотерапии прицельно облучается место, где находится раковое образование. Ситуация проверяется с помощью камер в другом помещении, подтверждается длительность облучения и точность зоны облучения. Во время радиотерапии не ощущается ни боли, ни жжения, ни шока. Люди не осознают, что получают облучение. Для уменьшения подвижности во время радиотерапии в некоторых анатомических областях используются маски и аксессуары.
Часто задаваемые вопросы
Каковы этапы лучевой терапии?
Как и при любом другом заболевании, лечение рака проходит по определенной схеме или пути. Для лучевой терапии “дорожная карта” планируется следующим образом:
- Основным этапом является оценка состояния пациента (стадирование, показания к лечению).
- Моделирование (планирование, компьютерная томография)
- Рисунки тканей и органов-мишеней, которые необходимо защитить, с помощью компьютерных программ и создания трехмерных структур (размер опухоли, расположение, интактность, окружение, ткани)
- Планирование лечения (типы пучков, расчет дозы, сравнение методик)
В чем разница между радиотерапией и химиотерапией?
Прицельное воздействие на область образования раковых клеток и лечение с помощью лучей называется радиотерапией или лучевой терапией. Этот метод лечения, ориентированный на конкретную область, направлен на уничтожение раковой клетки в этой области и предотвращение повторного образования раковых клеток в той же области. Метод лечения, направленный на уничтожение раковых клеток путем прицельного воздействия на весь организм и применяемый с помощью лекарственных препаратов, называется химиотерапией. Вариант лечения в зависимости от вида и стадии рака определяется врачами-специалистами.
На какой стадии рака применяется лучевая терапия?
Лучевая терапия (РЛТ) может применяться при всех органных заболеваниях, связанных с опухолями, начиная с диагностического периода и заканчивая последней стадией.
Сколько сеансов составляет лучевая терапия?
Этот процесс варьируется в зависимости от стадии рака и текущих условий. Этот процесс, осуществляемый под наблюдением врачей-специалистов, обычно завершается ежедневным (кроме выходных) введением небольших доз радиотерапии в течение 10-40 дней.
Как долго длится лучевая терапия?
Радиотерапия – это лечение, которое длится примерно 10-20 минут каждый день, в зависимости от зоны обработки и стадии заболевания.
Ощущается ли боль во время радиотерапии?
Во время радиотерапии не ощущается ни боли, ни неприятных ощущений. Радиотерапия невидима для глаз. Вкус, обоняние или слух отсутствуют.
Когда лучевая терапия дает результаты?
От радиотерапии, как правило, нельзя ожидать очень быстрых и немедленных результатов. Радиотерапия не уничтожает очаги раковых клеток сразу. Гибель раковых клеток может быть выражена в течение нескольких дней, недель или месяцев. Эти клетки продолжают гибнуть даже после окончания радиотерапии.
Как должен питаться пациент, получающий лучевую терапию?
Важно, чтобы пациенты, получающие лучевую терапию, употребляли пищу, богатую белком. На этапе лечения может наблюдаться потеря аппетита. Проблемы с аппетитом могут возникать не у каждого человека, но боль в горле, рвота, усталость, истощение, проблемы с зубами и деснами, изменение вкусовых ощущений могут привести к проблемам с питанием. Помимо важности потребления белка для регенерации тканей, потребление углеводов, обеспечивающих организм энергией, очень важно для борьбы с чувством слабости и усталости в этой фазе. В процессе лучевой терапии следует очень внимательно относиться к уходу за полостью рта и зубами, а также к состоянию кишечника.
Испускает ли пациент, получающий радиотерапию, излучение?
Это положение относится к числу распространенных в обществе заблуждений. Излучение после радиотерапии невозможно.
Что должен делать человек, получающий радиотерапию?
Прежде всего, необходимо соблюдать рекомендации врача, наблюдающего заболевание на первой стадии. В целом не следует превышать или снижать идеальный вес. Как и у всех здоровых людей, важно обеспечить организм энергией за счет потребления с пищей витаминов, белков, углеводов и т.д., особенно за счет потребления жидкости. При этом важное значение должно придаваться потреблению продуктов, обеспечивающих обновление клеток. Однако дополнительные продукты питания, травяные чаи, витамины, специальные рецепты, которые, как считается, обеспечивают оздоровление, ни в коем случае не должны применяться без консультации с врачом-специалистом. Следует позаботиться о защите кожи от солнечных лучей, выбирая одежду из ткани с такой фактурой, которая не будет раздражать кожу. В этом процессе может быть оказана профессиональная психологическая поддержка.
Каковы побочные эффекты радиотерапии?
Как и любое другое лечение, радиотерапия может иметь некоторые побочные эффекты. Эти побочные эффекты зависят от локализации и стадии заболевания. Важно помнить, что поскольку радиотерапия – это местное лечение, то побочные эффекты не выходят за пределы области, где она применяется. Как правило, к ним относятся раздражение, выпадение волос в области применения радиотерапии. Могут возникнуть затруднения при глотании, изменения вкуса, жжение при мочеиспускании, чувство истощения, диарея и сухость во рту. Например, если раздражение кожи и затрудненное глотание ожидаются у лиц, проходящих радиотерапию молочной железы, то выпадение волос в результате такого лечения не ожидается. При лечении рака брюшной полости могут наблюдаться диарея, боль в животе, жжение при мочеиспускании, учащенное мочеиспускание. Таким образом, побочные эффекты, которые могут возникнуть после лечения каждой области, могут отличаться друг от друга. Кроме того, следует знать, что во время сеанса лучевой терапии можно спокойно продолжать вести повседневную жизнь.
Что произойдет, если лучевая терапия будет прервана?
Радиотерапия – это лечение с различными дозами и продолжительностью в зависимости от типа и стадии рака, которое обычно применяется в будние дни. Для успеха лечения важно, чтобы оно проводилось непрерывно в этих условиях, за исключением технических причин. Однако для уменьшения побочных эффектов, которые иногда могут возникнуть, под контролем врача можно сделать перерыв, а если лечение прерывается из-за технических проблем, то можно пересмотреть период лечения, сделав необходимые расчеты под контролем врача.
Где применяется лучевая терапия?
Лучевая терапия применяется в передовых онкологических центрах. Лечение онкологических больных может осуществляться на основе мультидисциплинарного подхода группами, включающими врачей-онкологов, радиационных онкологов, врачей ядерной медицины и врачей смежных специальностей.
Какие аппараты используются в лучевой терапии?
В нашей стране для проведения лучевой терапии используются такие передовые технологии, как Electa Versa Hd, Elecra Versa Signature и TrueBeam STx.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
Что такое лучевая терапия?
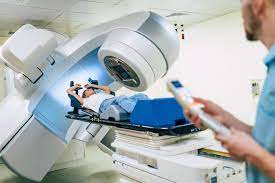
Излучение – это особый вид энергии, переносимой в виде волн или частиц. Оно может вырабатываться специальными устройствами или выделяться так называемыми радиоактивными веществами. Эта энергия используется в медицине для визуализации, а также для лечения рака и некоторых других заболеваний. Для того чтобы направить излучение на больной орган, необходимы специальные устройства. Таким образом, использование высоких доз радиационной энергии для лечения называется “радиотерапией” или “лучевой терапией”.
При каких заболеваниях он применяется?
Радиотерапия применяется практически при всех видах рака, который может возникнуть практически в любой части тела, и примерно у 50% онкологических больных. Для некоторых видов рака радиотерапия является единственным методом лечения. Радиотерапия сама по себе или в сочетании с хирургическим вмешательством и/или лекарственным лечением (“химиотерапией“) – это метод лечения, который позволяет добиться полного выздоровления у многих пациентов.
Радиотерапия
- Для уменьшения размеров опухоли перед операцией,
- Для удаления раковых клеток, которые могут остаться в организме на микроскопическом уровне после операции,
- Только в качестве основного лечения заболевания
- Для прямого лечения в комбинации с химиотерапией, без хирургического вмешательства,
- В некоторых случаях, когда полностью вылечить заболевание не удается, для уменьшения жалоб пациента, таких как боль и кровотечение, может быть применена радиотерапия. Этот вид лечения называется “паллиативным”.
Как сделать/применить?
Радиотерапия применяется двумя способами. Внешняя (наружная) и внутренняя (внутренняя). У некоторых пациентов эти две формы могут применяться последовательно.
External (внешний):
У большинства пациентов лучевая терапия проводится наружно. Обычно она проводится в лечебных центрах и амбулаториях и осуществляется путем направления лучей на пораженную ткань с помощью радиотерапевтических аппаратов. До последних лет наружное лечение проводилось в двух измерениях с помощью аппаратов, называемых Cobalt-60 или линейными ускорителями. Поскольку для доставки достаточной дозы в целевой объем при двухмерном лечении требовались большие запасы прочности, повреждение нормальных тканей и побочные эффекты были выше. Однако благодаря технологическим изменениям, произошедшим в последние годы в радиотерапевтических аппаратах, можно применять трехмерную конформную радиотерапию, IMRT (радиотерапию с модуляцией интенсивности), стеротактическую радиотерапию тела (на основе linac, gamaknife, cyberknife), обеспечивающие получение максимальной дозы в целевом объеме при минимальной дозе на нормальные ткани. При принятии решения о применении лучевой терапии врач также решает, какой аппарат больше подходит пациенту.
Внутренние:
При внутреннем облучении радиоактивный материал или источник помещается непосредственно в опухоль или в полость тела с помощью тонких проводов или трубок. Иногда он может быть помещен в полость, оставшуюся после операции.
Стереотаксическая лучевая терапия
При лучевой терапии аблятивная (разрушающая) доза излучения подводится к определенным точкам, при этом обеспечивается максимальная защита нормальных тканей. Такие методы лечения часто наиболее эффективны при опухолях размером 3 см и менее.
Это наиболее распространенная область применения у пациентов, которые не могут перенести операцию на ранней стадии рака легкого. Она также может применяться индивидуально в очагах метастатического поражения.
Зачастую лечение проводится в 1-3 приема после специального планирования. Могут использоваться специальные аппараты, а также некоторые линейные ускорители.
Это безболезненный метод лечения с минимальными побочными эффектами.
Что представляет собой план лечения радиотерапией и процесс подготовки к нему?
- Компьютерная томография планирования: Перед началом радиотерапевтического лечения проводится подготовительный сеанс компьютерной планирующей томографии. Это делается для того, чтобы индивидуализировать лечение и определить методику облучения, которая должна быть выбрана в соответствии с типом и степенью распространения рака. Подробную информацию о подготовительном сеансе и о самом лечении (в частности, о частоте и продолжительности сеансов) пациенту расскажет врач-радиоонколог во время первичного осмотра.
- Выявление участков с опухолями или распространением опухоли: Во время сеанса радиотерапии определяется положение пациента в аппарате, а затем в этом положении делается компьютерная томограмма. Использование компьютерной томографии при планировании лечения позволяет выявить наиболее опасные участки с опухолями или распространением опухоли, а также нормальные ткани, которые необходимо защитить. Во время компьютерной томографии в зависимости от визуализируемой области может потребоваться инъекция в вену, а иногда и мочевой катетер.
- Корректировка дозы облучения: После того как врач определит объем мишени и нормальную ткань с помощью томографических срезов, врач и физик-радиолог совместно определяют, какая доза облучения необходима пациенту, как она будет подаваться и сколько сеансов потребуется. Обычно это занимает несколько дней.
- Определение источника излучения: Источники излучения, используемые в радиотерапии, разнообразны. Врач может использовать рентгеновские лучи или пучки электронов. Выбор источника излучения зависит от типа опухоли, ее расположения в организме и особенно глубины залегания. Высокоэнергетическое рентгеновское излучение используется для лечения многих видов рака. Электронными пучками можно лечить некоторые кожные заболевания.
- Маркировка области облучения: Лучевой терапевт делает отметки на коже пациента для того, чтобы “целевой объем” облучался в одинаковых условиях от одного сеанса радиотерапии к другому. Для этого используются чернильные ручки, которые легко стираются, или татуаж. Тем не менее необходимо следить за тем, чтобы не удалить эти метки во время стирки. Ведь эти метки будут нужны до конца лечения пациента. Если они стираются, об этом следует сообщить терапевту. Пациент не должен сам дорисовывать стертые метки.
- Контроль эффекта лечения: После начала лечения врач следит за реакцией пациента на лечение, его общим состоянием и возможными побочными эффектами терапии. Обычно такой контроль проводится раз в неделю, но частота может меняться в зависимости от потребностей пациента. Очень важно, чтобы запланированные процедуры проводились вовремя. Нарушение плана может снизить ожидаемую эффективность лечения.
В чем заключается процесс лечения?
Перед началом процедуры пациент раздевается и надевает халат. Поэтому рекомендуется приходить на процедуру в одежде, которую можно легко сменить.
По линиям, предварительно нанесенным на кожу пациента, техник-радиотерапевт определяет местоположение зоны воздействия. Пациент должен сидеть в специальном кресле или лежать на процедурном столе. Каждый сеанс длится от 15 до 30 минут в процедурном кабинете, а доза излучения вводится в течение 1-5 минут. Внешняя радиотерапия безболезненна, как рентгеновский снимок.
Во время процедуры пациенту не нужно задерживать дыхание, достаточно обычного дыхания. Во время сеансов радиотерапии важно, чтобы определенная доза облучения была дана наиболее точно, чтобы лучи достигли нужного места в организме, чтобы положение пациента не нарушалось на протяжении всего лечения, чтобы при каждой процедуре создавалось одно и то же положение и чтобы окружающая обстановка была иммобилизована для обеспечения наилучшего комфорта пациента. В этом процессе, называемом иммобилизацией (обездвиживанием), в зависимости от обрабатываемой области могут использоваться такие приспособления, как маски для головы и шеи, вакуумные кровати, подколенные стабилизаторы или плечевые съемники.
Перед подачей луча техник-радиотерапевт покидает помещение. Управление оборудованием осуществляется из небольшого помещения рядом. Пациент также может наблюдать за происходящим через монитор или окно. Когда пациент говорит, его голос можно услышать через громкоговоритель и связаться с техником. Из-за своих больших размеров аппараты для радиотерапии могут создавать шумную обстановку, поскольку они вращаются под разными углами вокруг зоны лечения. Однако пациенты должны помнить, что аппараты обслуживаются соответствующим техническим персоналом и их работа регулярно проверяется. Любые вопросы, касающиеся процедурного кабинета или аппаратов, можно задать техническому персоналу или врачу.
Излучение невозможно увидеть, услышать или почувствовать. Если во время сеанса лечения возникает ситуация, когда пациент чувствует себя очень плохо или испытывает дискомфорт, следует немедленно сообщить об этом техническому специалисту. При необходимости работа приборов может быть немедленно остановлена.
Часто задаваемые вопросы о лучевой терапии
КАК ЛУЧЕВАЯ ТЕРАПИЯ ВЛИЯЕТ НА ОРГАНИЗМ?
Высокие дозы радиации способны убивать клетки или препятствовать их делению и размножению. Поскольку раковые клетки делятся и размножаются гораздо быстрее, чем нормальные, лучевая терапия более эффективна в отношении раковых клеток, чем в отношении нормальных. Кроме того, нормальным здоровым клеткам гораздо легче восстановиться и выздороветь, чем раковым. На этапе, называемом “планирование”, составляются необходимые чертежи, чтобы больные ткани подверглись максимальному облучению, а нормальные – минимальному, и лечение применяется целенаправленно.
КТО ПРОВОДИТ ЛУЧЕВУЮ ТЕРАПИЮ?
Радиационный онколог”, врач, специализирующийся на лечении заболеваний с помощью радиации, определяет тип и план лечения, необходимый пациенту.
Во время лечения лучевые онкологи работают со специальной командой. В эту команду входят
- Физик-радиационщик: Проверяет правильность работы приборов и дозировку излучения.
- Дозиметрист Определяет количество и продолжительность сеансов в процедурах.
- Медсестра по радиотерапии: Обеспечивает сестринское обслуживание во время лечения, помогает минимизировать побочные эффекты, которые могут возникнуть у пациента, и помогает ему переносить их.
- Техник по радиотерапии: Подготавливает пациента к процедуре и обеспечивает работу лечебных аппаратов.
ЕСТЬ ЛИ ПОБОЧНЫЕ ЭФФЕКТЫ ОТ ЛЕЧЕНИЯ?
Внешняя радиотерапия не приводит к радиоактивному облучению организма. Поэтому нет необходимости избегать контакта с людьми, получающими лечение. Даже при таких контактах, как объятия и поцелуи, нет риска негативного воздействия на других людей.
Побочными эффектами радиотерапии обычно являются жалобы в зоне лечения. Врач и медсестра информируют пациента о том, как справиться с этими побочными эффектами. Необходимо сообщить врачу или медсестре о появлении каких-либо жалоб во время лечения, например, кашля, повышения температуры, потливости или необычных болей. Побочные эффекты обычно исчезают в течение нескольких недель после окончания лечения и могут контролироваться с помощью лекарств или диеты. Побочные эффекты, которые могут сохраняться в течение длительного времени, также могут быть устранены с помощью соответствующего лечения.
Эффективность лечения контролируется врачом. После лечения ощущается уменьшение боли, кровотечения и других подобных жалоб, а со временем появляются и другие признаки улучшения. В процессе наблюдения за эффектом лечения врач может также назначить некоторые анализы крови. Нормальным считается, если во время лечения эти показатели будут низкими.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
Что такое гипертермия?
Гипертермия означает “лечение теплом”. Этот метод, известный также как термотерапия, представляет собой важный способ лечения, который применяется путем повышения температуры всего тела пациента с помощью специально разработанных устройств и является предпочтительным при лечении многих заболеваний.
Для лечения каких заболеваний используется гипертермия?
Методы гипертермии используются при лечении различных подтипов рака. Существует множество исследований, показывающих, что этот метод усиливает эффект основных методов лечения рака, таких как химиотерапия и лучевая терапия. Таким образом, гипертермия является доказательным “дополнительным” методом в области онкологии.
Как применяется гипертермия в лечении рака?
Гипертермия анализируется по двум основным разделам: “Все тело” и “Региональная”.
Лечение рака с помощью гипертермии всего тела
Здоровый человек реагирует на угрозу заболевания повышением температуры тела, т.е. лихорадкой. Нагревая все тело, лихорадка вызывает усиление иммунного ответа. Лихорадка играет важную роль в активации и регуляции иммунной системы. Это можно назвать “естественной, временной иммунологической специальной программой”. Основная роль гипертермии всего тела в лечении рака заключается в повышении эффективности сопутствующей химиотерапии и укреплении иммунной системы. Особенно у пациентов с обширными опухолями она делает лечение более эффективным при совместном применении с химиотерапией, а также может вызвать заметное повышение функций иммунной системы.
При гипертермии всего тела одним из старейших терапевтических принципов является повышение температуры путем направления безопасных для кожи и эффективных по глубине водных фильтрованных инфракрасных ламп А-излучения непосредственно на живот и туловище. Во время процедуры проводится мониторинг жизненно важных функций пациента (артериальное давление, пульс, насыщение кислородом, частота дыхания и температура тела), что позволяет обеспечить контролируемое и целенаправленное повышение температуры тела. Поскольку исследования показали, что оптимальная температура тела для активации иммунной системы составляет 39-40 °C, целевая температура тела для лечения рака составляет 39-40 °C, что также называется “умеренной” гипертермией всего тела. Хотя продолжительность процедуры может варьироваться в зависимости от реакции организма и времени, необходимого для достижения целевой температуры, в среднем она занимает 4 часа.
Лечение рака с применением региональной (локальной) гипертермии
Региональная гипертермия была разработана после многолетних исследований в области лечения рака. Основанный на принципе нагрева опухолевой области радиочастотными волнами, этот метод позволяет безопасно и эффективно повысить эффективность существующих методов лечения рака, таких как химиотерапия и радиотерапия. При этом методе, называемом также “региональной глубокой электрогипертермией”, на область опухоли подается интенсивная энергия, а целевая температура в тканях составляет от 42 до 44 °C. Опухолевые клетки скрыты от иммунной системы с помощью различных клеточных механизмов. Однако под воздействием тепла, получаемого при применении регионарной гипертермии, эти клетки становятся видимыми. Таким образом, гипертермия может повысить эффективность лучевой и/или химиотерапии. В некоторых случаях химио- и/или радиотерапия, которые не были эффективны при предыдущем применении, могут дать более успешные результаты при использовании в сочетании с гипертермией.
Под воздействием гипертермии раковые клетки образуют “белки теплового шока”, которые появляются на поверхности разрушенных клеток. Собственная иммунная система организма распознает эти белки как чужеродные клетки. Это является четким указанием для иммунных клеток бороться с раковыми клетками. При гипертермии не наблюдается значительного увеличения количества белков теплового шока в здоровых клетках, и нормальные клетки не повреждаются гипертермией.
Во время процедуры, которая длится в среднем 60 минут, пациент удобно располагается на кушетке. Регулируемые по мощности радиочастотные волны направляются на область опухоли с помощью двух противоположных электродных головок, при этом достигается высокая температура – от 42 до 44 °C. Такая температура разрушает раковые клетки и сосуды опухоли.
- Первичные опухоли или опухоли, которые распространились (метастазы)
- Опухоли в органах (печень, поджелудочная железа, почки, легкие и т.д.)
- Опухоли пищеварительной системы
- Опухоли тазобедренного сустава (таза)
- Опухоли головы и шеи
- Опухоли головного мозга или их распространение на головной мозг (метастазы)
- Рак молочной железы (местный рецидив рака молочной железы)
- Рак предстательной железы
- Меланома
- Применяется при поверхностных опухолях.
Часто задаваемые вопросы о применении гипертермии
Какое действие оказывает тепло, применяемое при гипертермии, на раковые клетки?
Индуцированный теплом клеточный стресс и вызванные им повреждения заставляют раковые клетки подвергаться апоптозу (запрограммированной клеточной гибели).
Как гипертермия усиливает эффект химио- и радиотерапии?
В раковой ткани наблюдается гипоксия (недостаток кислорода) и кислая среда. Это снижает действие химиотерапевтических препаратов и лучевой терапии на раковую ткань. При повышении температуры увеличивается кровоснабжение опухоли, что уменьшает кислотную среду и способствует более эффективному действию других методов лечения.
Как гипертермия влияет на функционирование иммунной системы?
Тепло увеличивает выработку “белков теплового шока” на клеточном уровне. Это повышает активность иммунных клеток, известных как “естественные киллеры”. Под действием тепла также увеличивается выработка опухолеспецифических антигенов и их внеклеточное высвобождение. Иными словами, в некотором смысле спадают маски, позволяющие раковым клеткам скрываться от иммунной системы. Таким образом, иммунной системе становится легче распознать рак. Как гипертермия всего тела, так и региональная гипертермия способствуют прохождению антигенпрезентирующих клеток – специализированных клеток иммунной системы – в лимфатические узлы и иммунологическому ответу Т-клеток “на месте опухоли”.
Какие изменения вызывает гипертермия в капиллярной структуре опухоли?
Строение капилляров, питающих опухоль в раковой ткани, отличается от нормальных сосудов, и, особенно при регионарной гипертермии, в этих сосудах может возникнуть микротромбоз (тромбоз) и нарушиться питание опухоли.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ РАК ПЛЕВРЫ (МЕЗОТЕЛИОМА)?
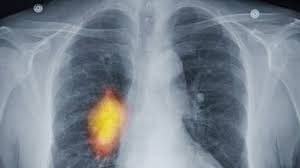
В грудной полости находится легочная ткань. Легкое покрыто очень тонкой мембранной тканью, похожей на луковую мембрану. Эта мембранная ткань, покрывающая легкое, доходит также до внутренней стороны ребер. Рак, возникающий в этой мембранной ткани, называется мезотелиомой, т.е. раком плевры.
КАКОВЫ СИМПТОМЫ РАКА ПЛЕВРЫ (МЕЗОТЕЛИОМЫ)?
Симптомом рака плевральной полости (мезотелиомы) обычно является появление жидкости вокруг легкого, что обычно называется легочным пузырем. На какой стороне развивается рак плевры (мезотелиома), на той стороне может ощущаться колющая боль. Кашель при мезотелиоме наблюдается реже. Пациенты ощущают одышку из-за скопления жидкости в легком. Жгучая боль в легком также может быть признаком рака плевры. Симптомы рака плевры на ранних стадиях встречаются редко. Рак легочной оболочки, который по многим параметрам отличается от рака легкого, отличается и по симптомам. Если на рак плевры указывает скопление жидкости, то он обычно находится на 2-й стадии.
Симптомы рака плевры (мезотелиомы) следующие;
- Волдыри в легких
- Одышка
- Agri
- Необъяснимая потеря веса
- В редких случаях кашель, похожий на рак легкого
КАКОВЫ ПРИЧИНЫ ВОЗНИКНОВЕНИЯ РАКА ПЛЕВРЫ (МЕЗОТЕЛИОМЫ)?
Вопросы “Что вызывает рак плевры (мезотелиому)?”, “Каковы причины рака плевры (мезотелиомы)?” относятся к числу тем, интересующих пациентов.
Асбест является наиболее важной из известных причин возникновения мезотелиомы. Хотя среди причин рака плевры он маловероятен, можно отметить развитие событий, связанных с вирусами. Хотя воздействие асбеста является наиболее важным фактором, мезотелиома не является редким заболеванием. Люди, работающие в судостроительной промышленности, в секторе изоляции, в строительном секторе, в хозяйственном магазине, в секторе футеровки, на заводе по производству поддонов для резервуаров, люди, работавшие в инвестиционном секторе или жившие рядом с этими рабочими местами, более склонны к развитию мезотелиомы из-за высокого риска воздействия асбеста.
Для возникновения рака плевры должно пройти 10 лет после контакта с асбестом. У людей, работавших с асбестом в молодом возрасте, рак плевры развивается через много лет.
Асбест встречается не только в промышленном секторе. В Турции асбест естественным образом содержится в почве в таких провинциях, как Диярбакыр-Чермик, Эскишехир, Афьонкарахисар и Невшехир. Асбест, представляющий собой мягкое и пахучее вещество, часто используется в этих регионах для облицовки домов или изготовления патоки. Вдыхание асбеста может привести к раку легких.
Совместное проживание с человеком, подвергшимся воздействию асбеста, также может вызвать рак плевры. Люди, подвергшиеся воздействию асбеста, могут переносить его волокна на своей коже или одежде. Такое воздействие асбеста может увеличить риск развития рака плевры. Люди, работающие с большим количеством асбеста на производстве, могут снизить риск переноса асбестовых волокон домой, принимая душ и меняя одежду перед уходом с работы.
Физический контакт с асбестом не вызывает рака плевры. Для того чтобы асбест вызвал рак плевры, он должен быть вдыхаемым.
КАК ДИАГНОСТИРУЕТСЯ РАК ПЛЕВРЫ (МЕЗОТЕЛИОМА)?
“Как диагностируется рак плевры?” – один из наиболее часто задаваемых пациентами вопросов.
Если у пациента имеются симптомы рака плевральной полости и он длительное время находился в контакте с асбестом, то сначала проводится компьютерная томография. Для уточнения диагноза рака плевральной полости с помощью торакоскопии у пациента берется биопсия, которая направляется в лабораторию.
В ЧЕМ ЗАКЛЮЧАЕТСЯ ЛЕЧЕНИЕ РАКА ПЛЕВРЫ (МЕЗОТЕЛИОМЫ)?
“Существует ли лечение рака плевры?”, “Можно ли лечить рак плевры химиотерапией?”, “Как проводится лечение рака плевры?”, “Как применяется лечение рака плевры?”, “Как проводится лечение рака плевры?”, “Можно ли вылечить рак плевры?” – вопросы, которые часто задают пациенты.
При лечении мезотелиомы важно правильное планирование. В лечении мезотелиомы важны опыт, хорошее наблюдение и междисциплинарный подход. Хотя хирургические методы занимают ведущее место в лечении мезотелиомы, применяются также такие методы, как химиотерапия, радиотерапия и иммунотерапия.
В прошлом при операции по удалению мезотелиомы полностью удаляли легкое и плевру. Однако в результате исследований, проведенных в последние годы, стало понятно, что достаточно полностью удалить только оболочку легкого. После этого проводится химиотерапия и, при необходимости, лучевая терапия. У некоторых пациентов очередность применяемого лечения может меняться. В последние годы эффективно используется иммунотерапия, т.е. лечение, направленное на иммунную систему.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ О РАКЕ ЛЕГКОГО
Каковы типы рака плевры (мезотелиомы)?
Обычно выделяют 3 типа рака плевры;
- Эпителиоид
- Саркоматоид
- Тип смеси
При раке плевры не существует мелкоклеточных и крупноклеточных типов, как при раке легкого.
В чем разница между мезотелиомой и раком легкого?
Плеврит отличается от рака легкого не только местом возникновения. Клетки рака плевры отличаются от клеток рака легкого. По мере развития организма человека стволовые клетки, формирующие внутренние органы, отличаются друг от друга. Стволовые клетки, из которых состоят оболочки и нервные ткани, отличаются друг от друга.
В легочной ткани нет датчика боли, но есть датчик боли в легочной мембране.
Еще одним отличием рака плевры от рака легкого является способ его возникновения. Поскольку плевра покрывает всю грудную полость, она не возникает в одной точке, как при раке легкого. Поражается плевра во всей грудной полости и занимает очень большую площадь.
Каковы стадии рака плевры (мезотелиомы)?
Стадии рака плевральной полости не столь чувствительны, как при раке легкого, с точки зрения оценки шансов пациента на выздоровление. Это может отличаться от классического стадирования рака. Особенно стадии, отличные от 1-й и 4-й, могут отличаться по продолжительности жизни. Пациенты часто задают такие вопросы, как “Чем лечить рак плевры 3 стадии?”, “Каковы симптомы и лечение рака плевры 4 стадии?”, “Каковы стадии рака плевры?”, “Последняя стадия рака плевры”, “Существует ли лечение рака плевры 4 стадии?”, “Чем лечить рак плевры 1 стадии?”.
В целом рак плевры (мезотелиома) имеет 4 стадии,
- Рак плевральной полости 1 стадии: опухоль ограничена плеврой. Утолщение легочной оболочки очень незначительно.
- Рак плевральной полости 2 стадии: опухоль распространилась на грудную стенку, сердце и оболочку пищевода.
- Рак плевральной полости 3-й стадии: опухоль проникла в диафрагму и распространилась на брюшину. Могут быть вовлечены лимфатические узлы.
- Рак плевральной полости 4-й стадии: опухоль метастазирует в другие органы.
Какова продолжительность жизни при раке плевры (мезотелиоме)?
Продолжительность жизни пациентов с раком плевральной полости может варьироваться в зависимости от стадии заболевания, получаемого лечения и реакции пациента на него. Продолжительность жизни при раке плевральной полости может варьировать от пациента к пациенту. “Сколько живут при раке плевры?”, “Какова продолжительность жизни при раке плевры 4 стадии?”, “Сколько живет пациент с раком плевры?”, “Сколько живет пациент с раком плевры?”, “Убивает ли рак плевры?”, “Какова продолжительность жизни при раке плевры?”, “Какова продолжительность жизни при раке плевры?”, “Какова выживаемость при раке плевры?”, “Сколько лет живут при раке плевры?”, “Есть ли шанс выжить при раке плевры?” – одни из самых любопытных вопросов.
Пациент с раком плевральной полости;
- 8 месяцев, если он так и не примет лекарство,
- 12-18 месяцев при химиотерапевтическом лечении,
- Средняя продолжительность жизни при трехкратном лечении, включая хирургическое, составляет 24 месяца.
Однако результаты у каждого пациента различны, и особенно в последние годы значительное увеличение продолжительности жизни больных раком плевры наблюдается при лечении иммунотерапией, направленной на иммунную систему.
Продолжительность жизни может варьироваться в зависимости от реакции пациентов на лечение.
Существует множество вариантов лечения рака плевры (мезотелиомы). Поскольку риск рецидива мезотелиомы высок, важно поэтапно подбирать варианты лечения. Вместо того чтобы использовать все варианты лечения одновременно, необходимо применять постепенное лечение в зависимости от течения заболевания, что позволяет добиться наилучшего результата.
Как проводится операция по удалению рака плевры (мезотелиомы)?
При раке плевры (мезотелиоме) применяется хирургический метод, называемый открытой операцией.
- Пациента укладывают на бок на операционный стол, удаляют одно из ребер и проводят операцию по удалению рака плевры.
- Во время операции удаляется вся мембрана на легком и в грудной полости.
- При необходимости во время операции по удалению рака плевральной полости может быть удалена и мышца диафрагмы. При необходимости может быть удален и перикард.
- При операции по удалению плеврального рака нет необходимости полностью удалять легкое.
- Операция по удалению мезотелиомы занимает примерно 3-4 часа.
- После операции по удалению мезотелиомы пациент находится в больнице около 1 недели.
- Поскольку при операции по поводу рака плевральной полости затрагивается большая площадь, то в зависимости от состояния пациента и риска кровотечения проводится интенсивная терапия в течение 1-2 дней.
Что можно сделать для профилактики рака плевры (мезотелиомы)?
Поскольку плевра окружает все легкое и ребра, она возникает на очень большой площади. В отличие от других видов рака, он проявляется не в одной точке, а в виде опухолей на всей плевре в форме виноградных косточек.
До развития рака плевры у рискованных пациентов рассматривается возможность полного удаления плевры. Однако, поскольку полностью удалить оболочку легкого, распространяющуюся на очень большую площадь в миллиметрах, невозможно, рак плевры все равно может развиться у пациентов, у которых применяется этот метод.
Для профилактики рака плевры важно предотвратить воздействие асбеста. Проверьте, есть ли асбест на рабочем месте или в жилом помещении.
Важно, чтобы работники, занятые на работах, связанных с асбестом, соблюдали все меры предосторожности, например, использовали средства защиты. Кроме того, не следует пренебрегать принятием душа или сменой рабочей одежды перед обеденным перерывом или уходом домой, чтобы защитить контактирующих с ними людей.
Можно ли использовать “умные” препараты при раке плевры (мезотелиоме)?
Иммунотерапия, применяемая в последние годы в лечении рака плевральной полости, дает положительные результаты в увеличении продолжительности жизни больных. Лечение иммунотерапией более эффективно, особенно при саркоматоидном, смешанном типе рака плевральной полости.
Существует ли лечение рака плевры (мезотелиомы) травами?
Вопрос “Полезна ли фитотерапия при раке плевры?” часто задается пациентами. Согласно научным исследованиям, естественного или растительного лечения мезотелиомы не существует. Наиболее важной из мер, которые можно предпринять, является исключение воздействия асбеста. Однако нет никакого вреда от употребления продуктов, выращенных на асбестовой почве.
Каким должно быть питание при раке плевры (мезотелиоме)?
При раке плевральной полости, как и при всех других видах рака, важна диета с высоким содержанием белка и низким содержанием углеводов.
Метастазирует ли рак плевры (мезотелиома)?
Пациентов интересуют такие вопросы, как “Метастатический рак плевры”, “Метастазирует ли рак плевры?”, “Куда метастазирует рак плевры?”.
- Особенно часто саркоматоидный тип метастазирования встречается в раке плевры. Саркоматоидный тип рака плевры обычно метастазирует в кости, печень, мозг, сердце и брюшину.
- Эпителиоидный тип рака плевры обычно растет в месте возникновения и рецидивирует в том же месте. Возможно метастазирование в брюшную полость или противоположное легкое.
- Местами метастазирования рака плевры часто являются брюшина и перикард.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ РАК КОЖИ (МЕЛАНОМА)?
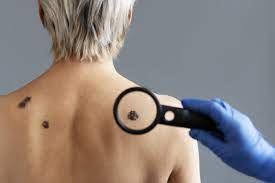
Кожа, самый большой орган в организме, выполняет множество функций. Покрывая внутренние органы, кожа защищает организм от возможных травм, предотвращает избыточную потерю воды и жидкости и помогает организму получать витамин D. Она также защищает от микробов, таких как бактерии, и вредных ультрафиолетовых (УФ) лучей и помогает регулировать температуру тела. Рак кожи, или рак кожи, – это злокачественное новообразование, возникающее в коже по многим причинам. Кожа состоит из 3 слоев: эпидермиса, дермы и подкожной клетчатки.
Эпидермис: Эпидермис – это верхний слой кожи. Эпидермис очень тонкий, его толщина составляет около 0,05-0,1 мм. Он защищает нижние слои кожи и органы от воздействия внешних факторов. Кератиноциты – основные типы клеток эпидермиса. Эти клетки вырабатывают важный белок – кератин, который помогает коже защищать организм. Наружная часть эпидермиса называется роговым слоем. В этой части отмершие кератиноциты заменяются новыми. Клетки этого слоя называются сквамозными из-за их плоской формы. Под хорионом (роговым слоем) находятся живые сквамозные клетки. Эти клетки переходят из наружной части эпидермиса в самую нижнюю – базальный слой. Клетки базального слоя называются базальными клетками. Их задача – деление с образованием новых кератинов. Таким образом, они заменяют на поверхности кожи старые кератиноциты, количество которых со временем уменьшается.
Меланоциты – это клетки эпидермиса, которые могут переродиться в меланому (рак кожи). Эти клетки кожи вырабатывают коричневые пигменты, называемые меланином, которые придают коже загорелый или коричневый цвет. Меланин защищает нижние слои кожи от некоторых вредных воздействий солнца. У многих людей под воздействием солнечных лучей меланоциты вырабатывают большее количество этих пигментов, в результате чего кожа загорает. Эпидермис отделен от нижних слоев кожи базальной мембраной. Это очень важная структура. Поскольку при прогрессировании рака кожи он развивается в направлении этого барьера и нижних слоев.
Дерма: Это средний слой кожи, который гораздо толще эпидермиса. В нем находятся волосяные фолликулы, потовые железы, сосуды и нервы, удерживаемые белком коллагеном, который придает коже прочность и эластичность.
Подкожная клетчатка Самый нижний слой кожи называется подкожной клетчаткой. Подкожная клетчатка и самая нижняя часть дермы образуют сеть из коллагена и жировых клеток. Подкожный слой помогает поддерживать температуру тела. Этот слой также обладает амортизирующим действием, защищая органы тела от повреждений.
КАКИЕ СУЩЕСТВУЮТ ВИДЫ РАКА КОЖИ?
Мелоном рака кожи
Меланома – это рак кожи, зарождающийся в клетках, называемых меланоцитами, которые придают коже цвет. Она называется злокачественной меланомой или кожной меланомой. Поскольку большинство клеток рака кожи при меланоме продолжают вырабатывать меланин, опухоль обычно имеет коричневый или черный цвет. Однако некоторые меланомы не вырабатывают меланин.
В этом случае раковая опухоль может иметь розовый, желтовато-коричневый или даже белый цвет. Рак кожи меланома может возникать на врожденных или приобретенных родинках на коже, а также на любом участке кожного покрова тела, включая волосистую часть головы и подошвы ног.
Рак кожи меланома чаще всего встречается на шее и спине у мужчин и на ногах, шее и лице у женщин. Однако рак может развиваться также на ладонях, подошвах ног и ногтях. Кроме того, в редких случаях он может возникать в области глаз, рта, половых органов или анального отверстия. Меланома, которая при ранней диагностике является излечимым видом рака, при быстром распространении может превратиться в вид рака, снижающий шансы на лечение.
Другие виды рака кожи
Базальноклеточный и плоскоклеточный рак возникает в основном на участках, подвергающихся воздействию солнечных лучей, таких как голова, шея и руки. Однако они встречаются и в других частях тела.
Базально-клеточная карцинома: Это наиболее распространенный вид рака кожи. Это рак с небольшими, бугристыми, розовыми или красными, прозрачными, блестящими, перламутровыми припухлостями, которые в основном плоские, твердые, бледного цвета или легко кровоточат даже при небольшой травме. Центр их запавший, а область синюшная, коричневая или черная. Большие базальноклеточные карциномы имеют корку или зону распространения.
Сквамозно-клеточная карцинома: Это второй по распространенности вид рака кожи. Она может выглядеть как растущая шишка. Часто она имеет твердую, шелушащуюся или покрытую коркой поверхность. Она также может иметь вид плоского красного пятна, которое развивается медленно. Оба этих вида рака кожи могут развиваться на плоском участке, мало отличающемся от нормальной кожи.
Акнитный кератоз также известен как солнечный кератоз. Иногда он может быть предраковым состоянием кожи и вызывается чрезмерным пребыванием на солнце. Акнитный кератоз – это небольшие, твердые или чешуйчатые пятна, обычно розово-красного или кожного цвета. Обычно он появляется на лице, ушах, верхней части кистей и рук. Однако он может появляться и на других участках тела, подвергающихся воздействию солнечных лучей. Акнитный кератоз обычно бывает множественным. Некоторые из них могут перерасти в плоскоклеточный рак. Другие остаются неизменными или прогрессируют самостоятельно.
КАКОВЫ СИМПТОМЫ РАКА КОЖИ?
Наиболее важным симптомом рака кожи является появление нового пятна на коже или изменение размера, формы или цвета пятна:
- Незаживающие и рецидивирующие раны
- Пигменты выступают за пределы пятна и распространяются на окружающую кожу
- Красные и синие родинки размером более 5 мм
- Увеличение числа и размера молей
- Образование бугорков, кровоизлияний или изменение внешнего вида узелков или шишек на поверхности родинки
- Покраснение или появление новой припухлости за пределами ее границы
- Повышенная чувствительность, зуд или боль
Иногда бывает трудно отличить обычную родинку от меланомы. В этом случае лучше как можно скорее обратиться к специалисту-дерматологу.
КАКОВЫ ФАКТОРЫ РИСКА РАЗВИТИЯ ЗЛОКАЧЕСТВЕННОЙ МЕЛАНОМЫ (РАКА КОЖИ)? ЧТО ВЫЗЫВАЕТ РАК КОЖИ?
- Воздействие ультрафиолетового (УФ) излучения: Ультрафиолетовое излучение является одним из основных факторов риска развития меланомы кожи. Они повреждают ДНК клеток кожи, что приводит к возникновению рака кожи. Основным источником ультрафиолетовых лучей является солнечный свет. Еще одним источником ультрафиолетового излучения является солярий. Риск развития многих видов рака кожи, в том числе и меланомы, повышается у людей, подвергающихся чрезмерному воздействию ультрафиолетового излучения из этих источников. Основные факторы риска развития рака кожи можно перечислить следующим образом;
- Ультрафиолетовые лучи: Вызывают старение клеток и могут повреждать их ДНК. Считается, что они вызывают долгосрочные повреждения кожи, такие как морщины, и играют роль в развитии некоторых видов рака кожи.
- UVB-лучи: Это основное излучение, вызывающее солнечный ожог и способное непосредственно повреждать ДНК клеток. Считается, что они вызывают большинство видов рака кожи.
- УФ-лучи: Не могут проходить через атмосферу. Поэтому они не содержатся в солнечном свете. По этой причине они не вызывают рак кожи.
- Солярий: Исследования показывают, что люди, часто посещающие солярии для загара, имеют повышенный риск развития меланомы кожи. Ультрафиолетовые лампы, используемые для загара в соляриях, должны быть “ультрафиолетовыми” и иметь маркировку с надписью “Постоянное воздействие ультрафиолетовых лучей может вызвать преждевременное старение кожи и рак кожи”. Кроме того, предполагается, что предупреждением для пользователей, постоянно подвергающихся воздействию этих лучей, могла бы стать еще одна маркировка с надписью “Необходимо регулярно проходить медицинские осмотры на предмет рака кожи”. Таким образом, предполагается снизить тенденцию к использованию ультрафиолетовых изделий (ламп черного света, ртутных ламп, ксеноновых и ксеноно-ртутных дуговых ламп высокого давления, плазменных резаков и дуговых источников и т.д.), особенно для молодых людей/детей до 18 лет, подверженных риску развития рака кожи, а также для людей с семейной историей рака кожи.
- Родинки Родинки на теле являются доброкачественными новообразованиями и появляются не только при рождении, но и в детском и подростковом возрасте. Большинство родинок не вызывают никаких проблем. Однако люди с большим количеством родинок имеют повышенный риск развития меланомы.
- Диспластический невус Диспластические невусы (невусы – множественное число от слова “невус”), также известные как необычные невусы, часто выглядят как обычные родинки, но имеют некоторые признаки меланомы. Они обычно крупнее других родинок, имеют необычную форму или цвет, и в большинстве случаев не перерастают в рак.
- Врожденный меланоцитарный невус: Родинки, появившиеся при рождении, называются врожденными меланоцитарными невусами. Считается, что риск развития меланомы в таких родинках, появившихся при рождении, составляет от 0 до 0% в зависимости от размера невуса. У людей с крупными врожденными меланоцитарными невусами риск развития меланомы выше. Например, если размер врожденного невуса меньше ладони, то риск развития меланомы ниже. Напротив, риск развития меланомы значительно повышается при наличии врожденных невусов больших размеров на спине или ягодицах.
- Светлая кожа, веснушки и светлый цвет волос: Риск развития меланомы у людей с белой кожей и светлым цветом волос в 10 раз выше, чем у людей с черной кожей. Риск развития рака кожи повышается у людей с рыжими и светлыми волосами, белой кожей, голубыми или зелеными глазами или веснушками.
- Возраст: Меланома чаще всего встречается у молодых людей в возрасте 15-29 лет, но наиболее часто – в возрастной группе 25-29 лет (особенно у молодых женщин). Однако она может встречаться и в более старшем возрасте.
- Пол: С учетом частоты встречаемости и биологических различий рак кожи подразделяется на злокачественную меяному и немеланому. Если у молодых людей, т.е. мужчин в возрасте 25-34 лет, рак кожи занимает 4-е место по распространенности, то у женщин он является самым распространенным видом рака после рака молочной железы и гинекологических заболеваний.
- Сварка и металлообработка: Доказано, что это повышает риск развития меланомы глаз
- Фототерапия (лечение светом): Воздействие ультрафиолетовых лучей в результате лечения, применяемого к людям с некоторыми кожными заболеваниями, такими как псориаз, повышает риск развития плоскоклеточного рака кожи.
КАКОВЫ ГЕНЕТИЧЕСКИЕ ФАКТОРЫ РАКА КОЖИ?
Люди, имеющие рак кожи меланома у одного или нескольких родственников первой степени родства (родителей, братьев, сестер или детей), подвергаются повышенному риску. Примерно у 10% людей с меланомой кожи в семье имеется такое же заболевание.
Одной из причин повышенного риска может быть частое пребывание на солнце в результате сходного образа жизни семьи, преобладание восприимчивых светлокожих членов семьи или оба этих фактора. Кроме того, фактором риска развития меланомы может быть генная мутация как результат изменения генов в семье. Генная мутация встречается примерно у 10-40% людей с высоким уровнем заболеваемости меланомой в семье.
Пигментная ксеродерма (Xeroderma Pigmentosum, XP): Наследственное заболевание, вызванное повреждением ферментов, которые в норме восстанавливают ДНК, встречается редко. У людей с XP могут развиваться многие виды рака кожи, включая меланому, на участках кожи, подвергающихся воздействию солнечных лучей, поскольку у них снижена способность к восстановлению повреждений ДНК, вызванных солнцем.
Необычные язвы, бугорки, пятна, царапины или изменения внешнего вида рассматриваемого участка кожи могут быть признаком меланомы или другого вида рака кожи или предупреждением о возможном возникновении рака.
Обычные родинки: Обычно это коричневые, загорелые или черные пятна на коже. Они могут быть плоскими или высокими и приподнятыми, круглыми или овальными и обычно не превышают 6 м. Родинки могут быть врожденными или развиваться в детском и подростковом возрасте. Новые родинки, появляющиеся на теле в зрелом возрасте, должны быть проверены врачом на предмет возможного рака кожи.
Когда на теле появляется родинка, она остается неизменной по размеру, форме и цвету в течение многих лет. Некоторые родинки со временем исчезают самопроизвольно. Родинки есть у многих людей, и большинство из них безвредны. Однако важно заметить любое изменение формы, размера или цвета родинки, чтобы предотвратить возможное развитие рака кожи.
ВАЖНОСТЬ РАННЕЙ ДИАГНОСТИКИ ПРИ МЕЛАНОМЕ
Раковые заболевания кожи – это видимые раковые заболевания. При раке кожи, как и при других видах рака, если изменения на коже замечены на ранней стадии, рак можно лечить, не допуская его распространения.
Кроме того, при лечении рака кожи на ранних стадиях минимизируются побочные эффекты, связанные с лечением.
ЯВЛЯЮТСЯ ЛИ РАННИЕ ПРИЗНАКИ СТАРЕНИЯ КОЖИ ПРИЗНАКОМ РАКА КОЖИ?
Длительное пребывание на солнце повышает риск развития рака кожи и преждевременного старения кожи. Данный продукт не защищает вас от рака кожи или преждевременного старения кожи, а только от солнечных ожогов”. Такое же предупреждение должно быть написано на солнцезащитных средствах, не имеющих “широкого спектра действия”.
На этикетках средств с низким солнцезащитным фактором должна быть размещена предупреждающая надпись. Солнцезащитные средства с фактором защиты от солнца ниже 15 должны иметь предупреждающую маркировку. “Водостойкий” не означает “водонепроницаемый”. Ни один солнцезащитный крем не является водостойким или “устойчивым к поту”. Производители больше не смогут заявлять об этом. Если на этикетке на лицевой стороне продукта указано, что он водостойкий, то на ней должно быть указано, что эффект сохраняется в течение 40 минут или 80 минут при плавании или потоотделении. Продукты не могут обещать больше, чем они есть на самом деле. Солнцезащитные средства не могут обещать мгновенную защиту или защиту более чем на 2 часа без повторного нанесения. Они не могут использовать фразу “защита от солнца”. Предотвратить преждевременное старение и рак кожи можно, защитив кожу от солнечного излучения.
Скрининг для ранней диагностики Рекомендуемый возрастной диапазон;
Не существует конкретного рекомендуемого возрастного диапазона. Раннее выявление рака кожи (Кожу мужчин, женщин, молодых людей, взрослых можно осматривать в любом возрасте.
КАК ДИАГНОСТИРУЕТСЯ РАК КОЖИ?
Наиболее важными симптомами рака кожи являются появление нового пятна на коже или изменение размера, формы или цвета пятна. Необычные и незаживающие раны, бугорки, пятна, царапины или изменения внешнего вида кожи, изменения на поверхности родинки (бугорки, кровоточивость или появление узелков или шишек), зуд, нежность и боль могут быть признаком меланомы или другого вида рака кожи или предупреждением о возможном возникновении рака. При появлении подобных симптомов незамедлительное обращение к врачу-специалисту обеспечит быстрое решение выявленной на ранней стадии проблемы со здоровьем.
Самообследование кожи при раке кожи: Очень важно осматривать кожу дважды в месяц. Важно знать характеристики родинок, пятен и веснушек, рассматривая фотографии пятен на коже, а также достаточно хорошо знать свое тело, чтобы заметить новую родинку или пятно. Самоосмотр кожи следует проводить в хорошо освещенном помещении перед зеркалом в полный рост, где можно наблюдать все тело. При использовании ручного зеркала легче увидеть в зеркале во весь рост такие “слепые” участки тела, как спина и бедра. У мужчин 1 из 3 меланом встречается на спине. Необходимо проверять все части тела, такие как спина, ладони, подошвы ног, кожа головы, глаза, ногти.
История болезни и физикальное обследование: Физикальное обследование на предмет рака кожи должен сначала проводить специалист-дерматолог. С помощью метода, называемого дерматоскопией (также известного как эпилюминесцентная микроскопия или поверхностная микроскопия), внимательно изучаются пятна или родинки на коже, при желании можно сделать снимки и проследить за возможным распространением в лимфатических узлах под кожей вблизи подозрительного участка. Некоторые виды рака кожи распространяются на лимфатические узлы. Когда это происходит, пораженные лимфатические узлы могут увеличиваться и становиться более твердыми, чем обычно. Это может быть очень эффективно для раннего выявления рака кожи. Важно, чтобы люди, страдающие синдромом диспластического невуса, или имеющие семейный анамнез меланомы, или имеющие семейный анамнез меланомы, регулярно проходили осмотр кожи.
Дерматоскопия в диагностике рака кожи
Дерматоскопия представляет собой микроскопию поверхности кожи и используется для диагностики родинок и других пигментных образований. При этом методе смазанную поверхность кожи осматривают с помощью дерматоскопа, который обеспечивает световое увеличение. Дерматоскоп аналогичен отоскопу, используемому при осмотре ушей, и широко применяется уже более 10 лет. Еще несколько лет назад наблюдение за родинками осуществлялось путем фотографирования дерматоскопических изображений. Затем к этому методу добавились компьютерные технологии, и была разработана цифровая дерматоскопия. При этом методе создается карта родинок на теле и определяется их точечная локализация. Затем для каждой родинки делается и записывается дерматоскопический снимок. Таким образом, обеспечивается сравнение с изображением, которое будет получено при следующем контроле.
Цифровой дерматоскоп также создает индекс, показывающий риск развития злокачественной меланомы, путем математического расчета наблюдаемых на мне подозрительных изменений. Этот индекс помогает в диагностике и планировании лечения. Если вероятность диагностики ранней стадии меланомы невооруженным глазом составляет 60%, то при цифровом дерматоскопическом исследовании она возрастает до 90%.
Биопсия кожи: Если предполагается, что подозрительный участок является раком кожи, с него берется образец и исследуется в лаборатории. Это называется биопсией кожи. Биопсия кожи может быть выполнена различными способами. Тип биопсии определяется в зависимости от расположения и размера подозрительного участка на теле и типа предполагаемого рака кожи. Если подозрительная родинка или пятно окажутся раковыми или предраковыми, врач, возможно, захочет провести дополнительные исследования или лечение. Если подозрительная родинка или пятно имеют небольшие размеры и локализованы, может быть проведена биопсия (удаление большего количества ткани) или хирургическое вмешательство. При диссеминированном раке кожи потребуется проведение визуализационных исследований и лечение иммунотерапией, таргетной терапией, химиотерапией и радиотерапией.
КАКОВЫ МЕТОДЫ ЛЕЧЕНИЯ РАКА КОЖИ (ЗЛОКАЧЕСТВЕННОЙ МЕЛАНОМЫ)?
При лечении рака кожи ставится задача удалить всю раковую ткань без остатка. При хирургическом лечении достигается очень высокий процент успеха. Удаление раковой ткани на достаточную глубину и ширину позволяет предотвратить повторное возникновение рака. При лечении рака кожи, помимо уничтожения раковых клеток, важно не оставить эстетических рубцов и не вызвать потерю функции. Для области отягощения, где рак кожи встречается наиболее часто, большое значение приобретают возраст пациента, его общее состояние, размер опухоли, особенности кожи и возможность распространения на лимфатические узлы.
При раке кожи предлагаются не унифицированные, а индивидуальные формы лечения. Что касается хирургического вмешательства и лучевой терапии, то при лечении небольших опухолей проблем обычно не возникает. Важным моментом является также то, что удаление опухоли при лечении рака кожи проводится опытными специалистами.
Радиотерапия может быть предпочтительна в качестве основного метода лечения, если после хирургического лечения остались рубцы и опухоль можно контролировать с помощью облучения без серьезных побочных эффектов. Не меланомный рак кожи на щеках, лбу или спинке носа, особенно если это базальноклеточный рак, очень успешно лечится радиотерапией. При лечении небольших опухолей предпочтение может быть отдано методу криохирургии. В ходе процедуры, когда на опухоль наносится жидкий азот, аномальные клетки погибают. После размораживания отмершие ткани отделяются от организма. При методе лечения, называемом кюретажем, раковая область выскабливается ложкообразной кюреткой, кровотечение останавливается электрическим током, подаваемым специальным прибором, и раковые клетки погибают. По окончании процедуры на коже остается плоский белый рубец. Местная химиотерапия в виде крема или лосьона также рассматривается как вариант при поверхностных раках кожи.
КАКИЕ СУЩЕСТВУЮТ СПОСОБЫ ПРОФИЛАКТИКИ РАКА КОЖИ?
Защититься можно, уменьшив факторы риска, вызывающие рак кожи и воздействие ультрафиолетовых лучей. Итак, какие меры предосторожности можно предпринять для защиты от солнца?
- Прикрывайтесь. Если вы не загораете, прикрывайтесь, носите широкополую шляпу и максимально защищайте кожу. Для защиты глаз можно носить солнцезащитные очки, которые блокируют не менее 99% ультрафиолетовых лучей.
- Сидите в тени. Не загорайте с 10:00 до 16:00, когда солнечные лучи наиболее сильны. Ограничьте пребывание под прямыми солнечными лучами до указанного специалистами времени.
- Избегайте загара в солярии. Это может способствовать возникновению рака кожи и нанести ей долгосрочный ущерб.
- Обращайте внимание на срок годности косметических средств.
- Используйте солнцезащитные кремы широкого спектра действия с фактором защиты не менее 30. Обязательно наносите солнцезащитный крем каждые 2 часа, после купания и потоотделения.
Управление по контролю за продуктами и лекарствами США (FDA) обязало выпускать солнцезащитные средства, защищающие не только от солнечных ожогов, но и от UVA-лучей, провоцирующих рак кожи и преждевременное старение. Кроме того, на этикетках увлажняющих кремов, бальзамов для губ и средств для макияжа, как и на солнцезащитных кремах, должна быть указана степень фактора защиты.
КАКИМ ДОЛЖНО БЫТЬ ПРАВИЛЬНОЕ ИСПОЛЬЗОВАНИЕ СОЛНЦЕЗАЩИТНОГО КРЕМА ДЛЯ ЗАЩИТЫ ОТ РАКА КОЖИ?
“Широкий спектр”, подтвержденный испытаниями: Новые правила позволят потребителю при покупке солнцезащитного средства убедиться в том, что оно имеет “широкий спектр”, защищая как от UVB, так и от UVA лучей. Все солнцезащитные средства защищают от UVB-лучей, которые вызывают солнечный ожог. Теперь они будут защищать и от UVA-излучения, которое способствует развитию рака кожи и преждевременному старению кожи. Только средства, прошедшие испытания, могут быть маркированы как “широкого спектра”.
ОПАСЕН ЛИ РАК КОЖИ? СМЕРТЕЛЕН ЛИ РАК КОЖИ?
Каждый человек должен осматривать все свое тело (от волосистой части головы до ступней перед зеркалом для плохо просматриваемых частей тела (например, спины)). За родинками на нашем теле следует внимательно следить, регулярно контролируя их, и обращаться к специалисту в случае их изменения или появления незаживающих, кровоточащих ранок на коже. При подозрительном поражении или ранее диагностированном раке кожи / рекомендуется обследование с помощью прибора для дерматоскопии (поверхностной микроскопии).
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
ЧТО ТАКОЕ РАК ГОРЛА?
Рак гортани, относящийся к онкологическим заболеваниям головы и шеи, возникает в области глотки между корнем языка и дыхательным горлом, где расположены голосовые связки. Рак гортани, также известный как рак гортани или рак гортаноглотки, является одним из наиболее распространенных видов рака среди онкологических заболеваний головы и шеи.
КАКОВЫ СИМПТОМЫ РАКА ГОРЛА?
- Осиплость, продолжающаяся более 3 недель: Охриплость – один из наиболее распространенных симптомов рака гортани. Однако рак гортани – не единственная причина охриплости. Острый ларингит, известный также как воспаление гортани, чрезмерный крик, курение, рефлюкс, насморк, аллергия, проблемы с щитовидной железой, пожилой возраст могут вызывать охриплость. Помимо охриплости, следует также обратить внимание на резкие изменения тембра голоса.
- Затруднения при глотании: Затруднения при глотании могут быть описаны по-разному. Ощущение застрявшей в горле крошки, невозможность полностью проглотить пищу, боль или жжение при глотании, ощущение, что пища прилипает к горлу, могут быть описаны как проблемы с глотанием.
Не всякое затруднение глотания является симптомом рака гортани. Безобидное сужение пищевода, называемое стриктурой, также может вызывать затруднения при глотании. Однако не следует забывать, что прогрессирующие опухоли гортани также могут вызывать затруднения при глотании.
- Потеря веса Неконтролируемая потеря веса может быть симптомом многих онкологических заболеваний, не только рака гортани. Чаще всего это происходит на поздних стадиях рака гортани. В случаях неконтролируемой потери веса на 4-5 кг за короткий промежуток времени рутинный контроль может оказаться спасительным.
- Одышка Одышка или хрипы также относятся к симптомам рака гортани. Особенно при прогрессирующих хрипах и одышке следует подумать о раке гортани.
- Ощущение комка или припухлости в горле
- Усталость
- Неприятный запах изо рта
- Боль в ухе
- Снижение веса
Многие из этих симптомов могут быть вызваны не только раком, но и другими заболеваниями. Подобные симптомы могут возникать, в частности, у людей, которые курят и употребляют алкоголь в течение многих лет.
Эти симптомы, являющиеся признаками рака гортани, могут быть вызваны и нераковыми причинами.
Хронический ларингит, курение, рефлюкс, напряжение голоса, незлокачественные доброкачественные опухоли, тканевые образования на голосовых связках, называемые гортанными узелками, бородавчатые образования в гортани, вызванные ВПЧ, можно спутать с симптомами рака гортани. Однако учет симптомов и проведение необходимого контроля могут спасти жизнь.
Каковы причины возникновения рака гортани?
Существуют факторы риска, которые могут привести к развитию рака гортани.
- Употребление табака и алкоголя: Употребление алкоголя и табака является одним из важнейших факторов риска, повышающих риск развития рака гортани. Чем больше количество употребляемых табачных изделий и алкоголя и чем больше стаж употребления, тем выше фактор риска. У людей, выкуривающих более 25 сигарет в день или курящих более 30 лет, риск развития рака гортани примерно в 40 раз выше, чем у некурящих. Аналогичным образом, риск развития рака гортани в 3 раза выше у лиц, длительно и регулярно употребляющих алкоголь, чем у непьющих. Курение является причиной большинства видов рака головы и шеи, в том числе и рака гортани. Люди, не употребляющие сигареты или табачные изделия и постоянно подвергающиеся воздействию дыма, подвержены повышенному риску развития рака гортани.
- Пол: Риск развития рака гортани у мужчин в 4-5 раз выше, чем у женщин. Однако широкое распространение сигарет среди женщин в последние годы приводит к тому, что рак гортани часто встречается у женщин.
- Генетические факторы: У людей, имеющих в семейном анамнезе рак головы и шеи или рак гортани, риск развития рака гортани выше, чем у тех, кто не имеет таких заболеваний.
- Возраст: Как и для многих других видов рака, преклонный возраст является одним из важнейших факторов риска развития рака гортани. В возрасте до 40 лет рак гортани встречается редко.
- Диета: Люди, потребляющие больше красного мяса, обработанных продуктов или жареной пищи, подвержены повышенному риску развития рака гортани. Существуют также исследования, показывающие, что диета с недостатком витаминов А и Е также является причиной развития рака гортани. Употребление в пищу свежих фруктов и овощей, известное как средиземноморская диета, и получение достаточного количества витаминов А и Е могут снизить риск развития рака гортани.
- Вирус ВПЧ: Существуют научные исследования, показывающие, что вирус ВПЧ (папиломавирусная инфекция человека), передающийся в основном половым путем и вызывающий у женщин генитальные бородавки, рак шейки матки и влагалища, может вызывать рак гортани. ВПЧ является распространенной инфекцией и может передаваться самостоятельно, не вызывая никаких проблем у большинства людей.
- Воздействие вредных веществ: Длительное профессиональное воздействие некоторых вредных или химических веществ может вызвать рак гортани.
- Опилки
- Сажа или угольная пыль
- Пары краски
- Формальдегид, используемый во многих отраслях промышленности, таких как производство красок и косметических средств
- Никель
- Изопропиловый спирт, используемый в качестве растворителя для очистки
- Сернокислотный туман
- Асбест
- Плохая гигиена полости рта и рефлюксная болезнь также могут стать причиной рака гортани.
КАК ДИАГНОСТИРУЕТСЯ РАК ГОРЛА?
Ранняя диагностика рака гортани дает значительные преимущества в лечении. Крайне важно, чтобы люди с одним или несколькими симптомами незамедлительно обратились к врачу-специалисту по лечению рака уха, носа и горла.
- Медицинское обследование: При диагностике рака гортани представление о заболевании может дать осмотр врача. Во время осмотра врач оценивает образ жизни и профессиональные факторы риска, такие как курение и употребление алкоголя. Поскольку при раке гортани может наблюдаться ком в горле, врач проводит физикальный осмотр. Во время физического обследования врач осматривает внутреннюю поверхность рта, включая щеки и губы, на предмет наличия припухлостей, дно рта, заднюю стенку глотки, нос и уши. Для уточнения диагноза рака гортани может быть использован ряд тестов и методов визуализации.
- Назендоскопия: Это разновидность эндоскопии, используемая врачом для лучшего обзора гортани и глотки. Через ноздри пациента вводится гибкая трубка со светом и небольшой камерой на конце, и проводится исследование на наличие аномальных структур в гортани. Предварительная подготовка перед назендоскопией не требуется.
- Ларингоскопия: Применяется в тех случаях, когда гортань не может быть достаточно осмотрена при назендоскопии или при обнаружении подозрительного образования. Эндоскоп, используемый при ларингоскопии, длиннее, и процедура проводится через рот. Перед ларингоскопией можно прекратить прием препаратов, разжижающих кровь. Процедура обычно проводится под общей анестезией.
- Видеоларингостробоскопия: Применяется у пациентов, не подходящих для общей анестезии, а также при диагностике опухолей голосовых связок. Эндоскоп оснащен камерой и оптоволоконной лампой-вспышкой на конце. Он также может быть использован для оценки состояния голосовых связок до, во время и после лечения. Процедура занимает около 30 минут и может проводиться под местной анестезией.
- Биопсия При обнаружении подозрительной структуры в областях, осмотренных во время назендоскопии или ларингоскопии, может быть взят образец ткани и отправлен в лабораторию. При биопсии часть или вся предполагаемая раковая ткань может быть удалена хирургическим путем. Тонкоигольная аспирационная биопсия также может быть выполнена в тех случаях, когда в области шеи ощущается припухлость.
- В диагностике рака гортани также могут использоваться методы визуализации. Такие методы визуализации, как рентгенография, УЗИ, компьютерная томография (КТ), магнитно-резонансная томография (МРТ) и ПЭТ, дают представление о точной локализации и размерах раковой опухоли.
В ЧЕМ ЗАКЛЮЧАЕТСЯ ЛЕЧЕНИЕ ЖЕЛЕЗИСТОГО РАКА?
Лечение рака гортани может различаться в зависимости от точного места расположения опухоли, ее стадии, степени и общего состояния здоровья пациента. В целом при лечении рака гортани применяются хирургическое вмешательство, лучевая терапия (радиотерапия) и химиотерапия. Иногда в лечении используется только один из этих вариантов, иногда может применяться комбинация методов лечения.
Хирургическое лечение рака гортани
Эндоскопическая резекция (частичное удаление гортани с помощью эндоскопической лазерной хирургии)
- Это хирургический метод, подходящий для пациентов с ранними стадиями рака гортани и местнораспространенным раком гортани.
- Эндоскопическая резекционная хирургия, известная как интраоральная лазерная хирургия, проводится через рот, поэтому разрез не применяется.
- Поскольку во время процедуры используется лазер, кровотечение меньше.
- Процедура проводится в операционной под общей анестезией.
- Через трубку, проложенную от рта к голосовым связкам, пропускаются необходимые хирургические инструменты и лазер. В ходе операции, проводимой под микроскопом, хирург четко видит раковую опухоль.
- В зависимости от состояния опухоли хирург может иссечь ее часть с помощью лазера или полностью разрушить с помощью высокоэнергетического лазера.
- Перед проведением эндоскопической лазерной хирургии необходимо определить, подходит ли пациент для этой операции. Поскольку лазерная хирургия проводится через рот, зубы и строение глотки пациента должны быть пригодны для этой процедуры.
- Продолжительность пребывания в стационаре после лазерной операции на полости рта может варьироваться в зависимости от расположения и размера опухоли.
- Опухоль после эндоскопической лазерной операции, которая обычно проводится при больших опухолях, может вызвать проблемы с дыханием или питанием.
- Интраоральная лазерная хирургия обычно не вызывает постоянных проблем с речью и глотанием. Речь может быть ограничена в течение нескольких дней после операции. При длительных проблемах с речью положительные результаты может дать работа с логопедом.
Операция ларингэктомии при раке гортани
- В зависимости от размера и расположения опухоли хирургическим путем удаляется пораженная часть гортани или вся гортань.
- Частичная ларингэктомия, при которой удаляется только часть гортани, может быть выполнена через небольшой разрез на шее или через рот без разреза.
- При операции частичной ларингэктомии в шее делается небольшое отверстие, чтобы пациент мог дышать. После операции это отверстие обычно закрывается.
- После операции частичной ларингэктомии возможны временные проблемы с речью. Однако после восстановительного периода проблемы с речью и дыханием обычно не наблюдаются.
- При операциях тотальной ларингэктомии, когда удаляется вся гортань, для вдоха и выдоха трахея соединяется с отверстием в горле.
- При тотальной ларингэктомии, т.е. операции, при которой удаляется вся гортань, отверстие в горле остается навсегда.
- После операций тотальной ларингэктомии пациент теряет голос. Для общения пациент может использовать речевые протезы, изготовленные в виде речевого или голосового аппарата.
- После операции тотальной ларингэктомии помимо проблем с голосом могут наблюдаться такие проблемы, как нарушение глотания, вкуса и обоняния.
Хирургия диссекции шеи
- Рак гортани иногда может распространяться на лимфатические узлы шеи. Обычно раковые клетки сначала распространяются в лимфатические узлы. При хирургическом лечении рака гортани иногда приходится удалять некоторые или все лимфатические узлы.
- При операциях по иссечению шеи, когда удаляются лимфатические узлы, также могут быть удалены мышцы, нервы и близлежащие ткани.
- Не все пациенты могут перенести операцию по иссечению шеи из-за побочных эффектов.
- Хотя удаление лимфатических узлов является одной из важнейших мер по предотвращению распространения рака, оно может вызвать такие побочные эффекты, как онемение уха, потеря подвижности нижней губы, потеря подвижности и чувствительности языка, потеря подвижности плеча, потеря подвижности шеи и руки в зависимости от удаленных лимфатических узлов.
- Лучевая терапия может применяться после операции иссечения шеи.
- При появлении отеков, чувства наполненности или давления, затрудненного глотания или изменения голоса необходимо обратиться к врачу.
Радиотерапевтическое лечение рака гортани
- Радиотерапия является методом первого выбора при лечении рака гортани на ранних стадиях. Радиотерапия, использующая высокую энергию для уничтожения раковых клеток, может применяться самостоятельно или в сочетании с хирургическим вмешательством и химиотерапией в зависимости от локализации и размера опухоли.
- Радиотерапевтическое лечение иногда может применяться после операции по поводу рака гортани. Для профилактики рецидивов рака гортани послеоперационная лучевая терапия может применяться в случаях, когда опухоль не может быть удалена целиком или при опухолях, растущих вдоль стенки гортани.
- Для достижения лучших результатов у пациентов с распространенным раком гортани лучевая терапия может применяться совместно с химиотерапией.
- Радиотерапия на поздних стадиях рака гортани может уменьшить такие проблемы, как затруднение глотания или дыхания.
- Во время радиотерапии могут возникнуть такие побочные эффекты, как усталость, покраснение или потемнение кожи, боль в горле, затрудненное глотание или отеки.
Химиотерапевтическое лечение при раке гортани
- Химиотерапевтическое лечение при раке гортани может проводиться как до, так и после операции. Обычно она применяется вместе с лучевой терапией.
- Для уменьшения размеров опухоли до уровня, позволяющего провести операцию, может применяться предоперационная химиотерапия.
- Для профилактики рецидивов рака гортани может применяться химиотерапия.
- В последние годы на первый план в химиотерапевтическом лечении выходят “умные” препараты целевого действия. Таргетные “умные” препараты снижают побочные эффекты химиотерапии и повышают эффективность лечения.
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ О ЖЕЛЕЗИСТОМ РАКЕ
К какому врачу обращаться при раке гортани?
Гортань является частью верхних дыхательных путей, а также голосовым органом. Первичную диагностику и лечение рака гортани, также известного как рак горла или рак гортани, проводят врачи-оториноларингологи. При выборе врача для лечения рака гортани важно выбрать врача, специализирующегося на хирургии головы и шеи, и больницу с достаточной инфраструктурой в этой области.
Каковы типы рака гортани?
Рак гортани подразделяется на типы в зависимости от типа клеток, на которых он начинается.
- Сквамозно-клеточный тип рака гортани: Почти 95% случаев рака гортани относится к этому типу. Он начинается в плоских клетках тонкой листовидной заслонки в верхней части гортани, называемой надгортанником, или в клетках такого же строения в других частях гортани.
Сквамозно-клеточный тип рака гортани также подразделяется на типы в зависимости от области распространения.
- Глоточный рак – начинается в голосовых связках
- Супраглоточный рак – начинается в верхней части голосовых связок
- Субглоточный рак – начинается под голосовыми связками
- Рак ротоглотки – начинается сразу за полостью рта
- Рак носоглотки – начинается в задней стенке глотки
- Аденокарцинома – это рак гортани: Несмотря на то что в последние годы частота ее возникновения возросла, она встречается гораздо реже, чем плоскоклеточный тип рака гортани. Зарождается она в аденоматозных клетках, продуцирующих слизь, рассеянных по поверхности гортани.
Существуют также очень редкие виды рака гортани. Существуют такие редкие виды рака гортани, как опухоли малых слюнных желез, саркомы, меланома, неходжкинская лимфома или экстрамедуллярная плазмацитома.
Каковы степени рака гортани?
Степень рака гортани связана с появлением раковых клеток. Обычно рак гортани подразделяется на низкозлокачественный и высокозлокачественный.
- Низкосортный рак гортани; раковые клетки внешне похожи на клетки, из которых они возникли. Клетки рака гортани низкой степени тяжести обычно растут медленно и с меньшей вероятностью распространяются.
- Рак гортани высокой степени; дифференцировка раковых клеток высокая. Клетки рака гортани высокой степени пролиферируют быстрее и имеют большую вероятность распространения, чем клетки рака низкой степени.
Каковы стадии рака гортани?
После диагностики рака гортани определение его стадии имеет большое значение для формирования лечения. Стадия рака гортани определяется по тому, насколько далеко распространился рак. Рак гортани подразделяется на стадии в зависимости от точного расположения опухоли, распространения в близлежащие лимфатические узлы и метастазирования в отдаленные органы.
В раке гортани выделяют 5 стадий.
- Стадия 0; это очень ранняя стадия, при которой аномальные раковые клетки не распространились на окружающие ткани. Раковые клетки находятся только во внутренней оболочке гортани.
- Стадия 1 и стадия 2; Ранняя стадия рака гортани. Опухоль имеет небольшие размеры и не выходит за пределы гортани.
- Стадия 3: Опухоль увеличивается в размерах и может поражать одну из голосовых связок. При раке гортани 3-й стадии опухоль может также прорастать в тонкий листовидный надгортанник, расположенный в верхней части гортани, или в щитовидную железу.
- Стадия 4 – последняя стадия рака гортани. Опухоль может распространиться на щитовидную железу, трахею или пищевод.
Является ли рак гортани смертельным?
Рак гортани – смертельно опасное заболевание. Продолжительность жизни зависит от типа, локализации, размера и распространения раковой опухоли гортани, а также от реакции пациента на лечение.
В общих исследованиях 5-летняя выживаемость после соответствующего лечения выглядит следующим образом.
Рак гортани 1 стадии 90%
Рак гортани 2 стадии 70%
Рак гортани 3 стадии 60
Рак гортани 4 стадии 40
По результатам статистики нельзя сказать о продолжительности жизни пациента.
В течение первых двух лет после лечения пациенты должны посещать своего врача каждые три-шесть месяцев. 80-90% раковых опухолей рецидивируют в течение первых 3 лет.
Куда метастазирует рак гортани?
Раковые клетки могут распространяться из очага в другие части тела. Рак гортани сначала дает метастазы в соседние ткани. На поздних стадиях метастазы могут распространяться и на отдаленные органы.
- Вдоль гортани
- Мягкие ткани шеи
- Щитовидная железа
- Голосовые связки
- Основание язычка
- Ласточка
- Трахея (трахея)
- Мышцы языка и мышцы шеи
- Пищевод
- Лимфатические узлы
- Он может метастазировать в легкие, печень и кости.
Смогу ли я говорить после операции по удалению рака гортани?
- При частичных операциях по удалению рака гортани голосовые связки могут быть сохранены. Хотя сразу после таких операций с сохранением голосовых связок возникают трудности с речью, через некоторое время голос может быть восстановлен.
- Однако пациент теряет голос после операций, при которых удаляется вся гортань.
- После этих операций в зависимости от состояния пациента могут использоваться различные речевые техники или устройства. Так называемая пищеводная речь может осуществляться путем перемещения воздуха по пищеводу с последующим возвращением его в рот. Это можно сделать с помощью логопедов.
- Пациент может издавать звуки, прижимая к шее небольшое устройство, называемое электронной гортанью.
- Пациент может говорить с помощью голосовых протезов, называемых также голосовыми микрофонами.
Каким должно быть питание после рака гортани?
В процессе лечения рака гортани после лучевой терапии или операции могут возникать такие проблемы, как затруднение глотания, боль, нарушение вкуса, потеря веса.
Поскольку сразу после операции по удалению рака гортани твердая пища не может быть подана, к желудку может быть подведена трубка через нос, отверстие в горле или через брюшную стенку. При этом пациент получает жидкие питательные вещества через эту трубку.
В период перехода к нормальному питанию следует избегать кислых и острых продуктов.
После некоторых операций пациенты могут ощущать потерю вкуса. Чтобы преодолеть потерю вкуса, в пищу можно добавлять сильные соусы или травы, чеснок, лимонный сок для придания вкуса.
Предпочтение следует отдавать продуктам, которые легче пережевывать и глотать. Если, несмотря на это, потеря веса происходит, можно дополнительно назначить витаминные добавки, проконсультировавшись с врачом.
Может ли курение вызвать рак гортани?
Курение является одним из основных факторов риска развития рака гортани. Рак гортани (гортаноглотки), который развивается примерно у одного из каждых 100 000 человек в обществе, встречается в основном у курящих мужчин, в то время как у женщин с ростом курения частота рака гортани в последнее время увеличилась. Наиболее важным симптомом рака гортани является охриплость голоса, поэтому при охриплости голоса более 2 недель следует обратиться к специалисту по лечению уха, носа и горла.
Что нужно делать, чтобы избежать рака гортани?
- Доказанного способа предотвращения рака гортани не существует. Однако можно принять меры против рака гортани, избегая факторов риска.
- Наиболее важным фактором риска развития рака гортани является курение. Отказ от курения значительно снижает риск развития рака гортани.
- Очень важна диета, основанная на фруктах и овощах. Убедитесь, что вы получаете необходимые витамины и антиоксиданты.
- Поскольку ВПЧ может вызывать рак гортани, при необходимости следует провести вакцинацию против ВПЧ.
*Содержание страницы носит исключительно информационный характер. Для диагностики и лечения обратитесь к своему врачу.
GÖĞÜS DUVARI TÜMÖRÜ NEDİR?
Göğüs duvarı; arkada omurlar, yan taraflarda kaburgalar ve kaburgaların arasını kapatan kas tabakası, önde halk arasında iman tahtası kemiği olarak bilinen sternum kemiği, aşağıda diyafram kası ve yukarıda klavikula (köprücük kemiği) ile komşuluğu olan yapıdır. Göğüs duvarı, göğüs kafesinin şekil ve dayanıklılığını sağlayan yapıdır. Göğüs kafesinde kas ve kemik yapısı, karın kaslarının da desteğiyle solunuma katkı sağlamaktadır. Göğüs duvarı; kas, iskelet sistemi ve bağ dokuyu ilgilendiren çok çeşitli tümörler içerir ve bu tümörlerin çoğu malign (kötü huylu) karakterdedir.
Göğüs duvarı tümörü sınıflaması şu şekilde yapılır
- Göğüs duvarı tümörleri primer ve sekonder tümörler olarak ikiye ayrılır.
- Sıklıkla sekonder olarak uzak organ metastazları (başka organlardan sıçrama) ve akciğer, plevra, mediasten, meme gibi komşu organ tümörlerinin bölgesel yayılımları ile oluşur.
- Primer dediğimiz göğüs duvarının kendisinden kaynaklanan kötü huylu (malign) tümörlerde en sık sarkomlar görülmektedir. Bu tümörler kemik, kıkırdak ve yumuşak dokuya yerleşebilir. Kemik ve kıkırdaklarda yerleşen göğüs duvarı tümörlerinin %50 si kostalarda (kaburga), %30 u skapulada (kürek kemiği), %20’si sternum (göğüs kafesi kemiği) ve klavikulada (köprücük kemiği) yerleşir.
GÖĞÜS DUVARI TÜMÖRLERİNİN BELİRTİ VE SEMPTOMLARI NELERDİR?
Göğüs duvarı tümörleri asemptomatik yani belirtisiz olabildikleri gibi, farklı şekillerde belirti vererek kendini gösterebilir.
- Ağrı
- Cilt altı şişlikleri
- Enfeksiyon gibi belirtiler göğüs duvarı tümörlerinde görülebilmektedir.
Yumuşak doku kökenli göğüs duvarı tümörleri genelde ağrısız olarak büyürken, kemik kaynaklı göğüs duvarı tümörlerinde ağrı ön planda olabilmektedir. Bu sebeple ağrılı şişlikler göğüs duvarı tümörünün ilk belirtisi olabilir. Vücutta normalin dışında bir şişlik, daha önceden olmayan ağrı belirtileri olması durumunda çok vakit kaybetmeden göğüs cerrahisi bölümüne başvurmakta fayda vardır.
GÖĞÜS DUVARI TÜMÖRLERİNİN TEŞHİSİ NASIL YAPILIR?
- Göğüs duvarı tümörü olduğundan şüphelenilen hasta grubunun teşhisinde hastadan detaylı öykü alınması ve fizik muayene ilk önemli yöntemdir.
- Görüntüleme olarak öncelikle akciğer grafisi değerlendirilmesi önemlidir.
- İhtiyaç halinde Bilgisayarlı Tomografi (BT) ve Manyetik Rezonans (MR) gibi ileri görüntüleme yöntemlerine başvurulabilir.
- Bilgisayarlı Tomografi (BT) kaburga yapılarını ve kemik içi hasarı daha iyi gösterirken, Manyetik Rezonans (MR) yumuşak doku tümörlerini, mediasten organlarla ve büyük damarlarla ilişkisini daha iyi ortaya koyar.
- Bilgisayarlı Tomografi veya Manyetik Rezonans ile tümör olduğu şüphelendikten sonra tüm vücudu tarama amaçlı PET-CT de kullanılan ileri görüntüleme yöntemlerinden birisidir.
Hangi görüntüleme yönteminin tercih edileceğine hastanın klinik durumuna göre karar verilir.
GÖĞÜS DUVARI TÜMÖRÜ TEDAVİSİ NASILDIR?
- Göğüs duvarı tümörlerinin çoğunda ameliyat ile tümörün negatif cerrahi sınırlarda (çıkartılan doku sınırlarında tümör olmaması durumu) geniş olarak çıkartılması en etkin tedavi şeklidir.
- Çıkartılan tümörün hücre tipine, tümörün tip olarak kötü huylu tümöre benzeme durumuna göre ameliyat ile çıkartılacak alanlar belirlenir.
- Hızlı farklılaşan (yüksek grade) tümörlerde kemoterapi ve radyoterapi uygulanır. Bazı durumlarda çıkartılan göğüs duvarında tümör kaldığından şüphe duyuluyorsa kemoterapi de bu bölgenin kontrolünü sağlamak için kullanılır.
- Geniş olarak çıkartılan göğüs duvarı tümörü ameliyatlarından sonra oluşan boşluğu kapatmak ve hastanın rahat nefes alabilmesi için bazı özel yöntemler uygulanır. Bunun için özel materyaller veya vücudun kas, omentum veya deri gibi diğer bölgelerinden yama (greft) kullanılabilir. Kullanılan özel materyaller genellikle vücudun esnekliğine uygun olarak ameliyatta şekil verilebilen malzemelerden oluşur. Hangi materyalin kullanılacağına hastanın, hastalığın durumuna göre ameliyat öncesinde karar verilir.
- Bazı ameliyatlardan sonra vücudun kas, deri vs. gibi organları kullanılabilir. Bu planlama da göğüs cerrahisinin yanı sıra plastik cerrahi, ortopedi gibi diğer branşlar ile birlikte yapılır.
GÖĞÜS DUVARI TÜMÖRÜ HAKKINDA SIK SORULAN SORULAR
Göğüs duvarı tümörü ameliyat süresi ne kadardır?
Göğüs duvarı ameliyatlarının süresi; tümörün tipine, çıkartılan parçanın büyüklüğüne ve oluşan boşluğun kapatılmasında oluşabilecek ek işlem durumlarına göre değişkenlik göstermektedir. Basit bir yumuşak doku eksizyonu ameliyatı 30 dakikada tamamlanabilirken, geniş göğüs duvarı tümörü çıkartılmasının gerektiren ameliyatlar 5-6 saat sürebilmektedir.
Göğüs duvarı tümörü ameliyatından sonraki süreç nasıldır?
Göğüs duvarı tümörü ameliyatlarından sonra sıklıkla akciğer boşluğuna, kas altı ve cilt altı ameliyat bölgelerine vücudun ürettiği ameliyat sonrası sıvıları boşaltacak drenaj tüpleri yerleştirilir ve bunların takipleri yapılır.
Hastalar direkt olarak yataklı servise alınabildiği gibi hastanın yaşına, genel durumuna, uzun dönem rahatsızlıklarına, aldığı anestezi süresine bağlı olarak ameliyattan sonra belli bir süre yoğun bakımda da takip edilebilir.
Yoğun bakım süreci sonrasında serviste akciğer filmleri ve laboratuar tetkikleri ile takip edilen hastalar ortalama 5-6 gün kadar yatarak tedavi edilir.
Göğüs duvarı tümörü ameliyatından sonra nelere dikkat edilmelidir?
Göğüs duvarı tümörü ameliyatından sonra, yapılan ameliyatın büyüklüğüne göre hastanın 1-2 hafta kadar istirahat etmesi gerekmektedir. Hastanın genel iyilik hali değerlendirilerek, 1-2 hafta sonrasında sosyal yaşantısına ve çalışma hayatına geri dönebilmesi beklenir.
Göğüs duvarı kanseri sık görülen bir kanser türü müdür?
Göğüs duvarı kanserleri bütün primer kanserler arasında %1-2, torasik (göğüs boşluğunu ilgilendiren) kanserler arasında %5’ lik bir grubu oluşturmaktadır.
Göğüs duvarı kanseri genetik bir hastalık mıdır?
Göğüs duvarı kanserinde genetik yatkınlık söz konusudur. Özellikle sarkom tipinde genetik faktörler çalışmalarda net şekilde ortaya koyulmuştur.
Kimler daha çok göğüs duvarı kanseri riski taşıyor?
Göğüs duvarı tümörlerinin çoğunu başka organlardan sıçramalar (metastaz) ve komşu organların bölgesel yayılımı oluşturduğu için, kanser öyküsü olan kişiler bu konuda daha dikkatli olmalıdır. Bununla birlikte göğüs duvarı kanserleri erkeklerde kadınlardan 2 kat daha fazla görülür.
*Sayfa içeriği sadece bilgilendirme amaçlıdır. Tanı ve tedavi için mutlaka doktorunuza başvurunuz.
GÖZ KANSERİ NEDİR?

Göz kanseri, gözün dış kısımlarını (göz kapağı gibi) veya göz küresinin içini (göz içi kanseri) etkileyebilen nadir görülen bir tümördür. Erişkinlerde en sık görülen göz içi kanserleri melanom ve lenfoma iken çocuklarda en sık görüleni retina hücrelerinde başlayan retinoblastomdur. Göz kanseri, gözdeki anormal hücreler kontrolsüz bir şekilde büyüdüğünde ve bölündüğünde gelişir. Düzenli göz muayeneleri, göz kanserini en erken, en iyileştirilebilir aşamasında saptama şansını sunar.
GÖZ KANSERİNE NE SEBEP OLUR? GÖZ KANSERİ İÇİN RİSK FAKTÖRLERİ NELERDİR?
Göz kanserinin tam olarak neden geliştiği bilinmemekte birlikte göz kanseri riskini artırabilen aşağıdaki gibi bazı faktörler mevcuttur.
- Daha açık renkli gözlere sahip olmak
- Yaşın ilerlemesi (50 yaş üstü kişiler)
- Ciltte çok fazla ben bulunması
- 1. Derece akrabaları arasında göz kanseri olan kişiler
- Zayıflamış bağışıklık sistemi
- Displastik nevus sendromu ve okülodermal melanositoz (ayrıca Ota nevusu olarak da adlandırılır) gibi pigment üreten hücrelerin kalıtsal koşulları
- Kafkas ırkı: Diğer ırklardan insanlara göre daha fazla göz melanomu riskine sahiptir.
Çocuklarda retinoblastom, retinoblastoma genindeki (RB1) bir mutasyona bağlı olarak vakaların yaklaşık yüzde 25 ila yüzde 30’unda kalıtsal veya genetik olarak bağlantılı bir durumdur. Kalıtsal retinoblastoma formu daha genç yaşta ortaya çıkma eğilimindedir ve kalıtsal olmayan forma kıyasla her iki gözü de etkileme olasılığı daha yüksektir.
Öte yandan güneş ışığından gelen ultraviyole (UV) ışını da göz melanomu için olası bir risk faktörü olarak öne sürülmüştür; ancak bu durum kanıtlanamamıştır. Güneşe maruz kalma ile melanom gelişimi arasında bilinen bir bağlantı vardır. Henüz kanıtlanmamış olsa da, buna göz içi melanomları da dahil olabilir. Bu nedenle Amerikan Kanser Derneği, dışarıdayken koruyucu güneş kremi ve giysilere ek olarak UV koruyucu güneş gözlüğü kullanmayı önerir.
GÖZ KANSERİ BELİRTİLERİ NELERDİR?
Göz kanseri olan kişilerde genellikle hiçbir semptom görülmez. Göz kanseri çoğunlukla rutin bir göz muayenesi sırasında bulunur. Semptomlar ortaya çıktığında, en yaygın olarak ağrısız görme kaybı meydana gelir.
Aşağıda listelenen semptomlardan herhangi biri diğer tıbbi durumlarla da ilişkilendirilebilir, bu nedenle görmedeki herhangi bir değişiklik veya diğer göz problemleri için sağlık uzmanına başvurmak gerekmektedir.
Göz kanserinin bazı belirtileri şunlardır:
- Glokom (Yüksek göz içi basıncı)
- Görüş alanının kaybı
- Görme kaybı
- Gözde şişkinlik: Bir gözün veya her ikisinin şişmesi (proptoz)
- Işık çakmalarını görmek
- İris renginde değişiklik
- Noktalar, dalgalı çizgiler veya yüzen nesneler görmek
- Gözün ön kısmında görünen kitle
Retinoblastomlu çocuklarda aşağıdaki belirtiler olabilir:
- Gözler farklı yönlere bakıyor gibi görünüyor
- Gözde ağrı veya kızarıklık
- Flaşlı fotoğraflarda göz bebeği kırmızı yerine beyaz görünür
Göz kanseri nadir görülmekle birlikte, özellikle teşhis ve tedavi edilmezse hayatı tehdit eden komplikasyonlara ve ölüme neden olabilir. Görme güçlüğü, görüş alanının bir kısmını kaybetme veya ışık parlamaları, irisin üzerinde koyu lekeler, noktalar, dalgalı çizgiler veya yüzen nesneler gibi görsel semptomları olanlar vakit kaybetmeden bir sağlık kuruluşuna başvurmalıdır.
GÖZ KANSERİ NASIL TEŞHİS EDİLİR?
Göz kanseri için yaygın olarak önerilen bir tarama yoktur, ancak yıllık göz muayeneleri (özellikle tanımlanmış risk faktörleri olanlar için) erken teşhiste önemli bir rol oynayabilir. Göz kanserleri çoğu zaman, rutin muayeneler sırasında tespit edilir. Kanserin gözde başladığı ve yayılmadığı birincil göz kanseri teşhisi konanların hayatta kalma oranı yüksektir.
Doktor göz kanserinden şüpheleniyorsa tanıya yardımcı olması için görüntüleme testleri veya göz ultrasonu isteyebilir.
Göz tomografisi olarak da adlandırılan optik koherens tomografi, tümör aktivitesinin bir işareti olan sıvının ince varlığını değerlendirmek için retina katmanlarını aydınlatan bir görüntüleme aracıdır. Manyetik rezonans görüntüleme (MRI) de teşhis için yardımcı olabilir. Bazı durumlarda, doktor tümör hücrelerinin küçük bir örneğini almak için ince bir iğne biyopsisi yapabilir. Sitopatolog, birkaç gün içinde tanıyı doğrulamak için numuneyi analiz edecektir.
Doktor ayrıca kanserin vücudun diğer bölgelerine yayılıp yayılmadığını görmek için başka testler de isteyebilir. İlgili testler şunları içerebilir:
- Karaciğer fonksiyonunu ölçmek için kan testleri
- Göğüs röntgeni
- Bilgisayarlı tomografi (CT) taraması
- Manyetik rezonans görüntüleme (MRI) taraması
- Karın ultrasonu
- Pozitron emisyon tomografisi (PET) taraması
GÖZ KANSERİ İÇİN TEDAVİ SEÇENEKLERİ NELERDİR?
Göz kanseri teşhisi konulduktan sonra doktor tedavi için en iyi seçenekleri tartışacaktır. Göz kanserinde en uygun tedavi seçenekleri şu faktörlere bağlıdır:
- Kanser türü
- Kanserin yeri ve boyutu
- Kanserin başka bölgelere yayılıp yayılmadığı (Metastaz)
- Hastanın yaşı ve genel sağlık durumu
Küçük bir göz melanomu acil tedavi gerektirmeyebilir. Radyoterapide kanser hücrelerini öldürmek için protonlar veya gama ışınları gibi yüksek güçlü enerji kullanır. Radyoterapi tipik olarak bazı küçük göz melonomlarında ve orta büyüklükteki göz melanomları için kullanılır. Melanom hücrelerini öldürmek için lazer kullanılan tedavi yöntemi bazı durumlarda bir seçenek olabilir. Termoterapi adı verilen bir tür lazer tedavisinde, kızılötesi lazer kullanır. (Bazı durumlarda radyasyon tedavisi ile birlikte kullanılır)
Bazı küçük göz melanomlarında melanom hücrelerini yok etmek için kriyoterapi kullanılabilir. Kemoterapi , göz melanomu için nadiren kullanılır; ancak retinoblastom ve belirli orbital lenfoma türleri için kemoterapi verilebilir.
Göz kanseri tedavisinde cerrahi prosedürler ise şöyledir:
Göz koruyucu cerrahi: Genellikle göz kapağı kanserleri, konjonktival kanserler ve orbital kanserler için uygulanabilir.
İridektomi: İris (gözün renkli kısmı) çıkarılır.
İridotrabekülektomi: İris ve göz küresinin dış bölümünün küçük bir kısmı çıkarılır.
Göz rekonstrüktif cerrahisi: Göz kapağı, konjonktiva veya yörünge kanserinin cerrahi olarak çıkarılmasından sonra genellikle işlevi eski haline getirebilir,
Enükleasyon: Bazı göz kanseri türlerini tedavi etmek için gözün tamamının alınması gerekir. Bu durum yalnızca ileri vakalarda, uveal melanom veya retinoblastom gibi intraoküler tümörler için yapılır.
Orbital ekzenterasyon: Bu cerrahi prosedür; gözün, göz kapaklarının, çevredeki cildin, yörünge kaslarının, yağların ve sinirlerin çıkarılmasını içerir. Yörünge veya sinüslerin agresif kanserleri, ileri veya tekrarlayan göz kapağı veya konjonktiva kanserleri için bazen gereklidir.
*Sayfa içeriği sadece bilgilendirme amaçlıdır. Tanı ve tedavi için mutlaka doktorunuza başvurunuz.
LENF KANSERİ (LENFOMA) NEDİR?
Kan kanserleri, kanın üretildiği yer olan kemik iliğinden kaynaklanan veya kan kaynaklı bütün kanserlerle eş anlamlı olarak kullanılan bir ifadedir. Lenfoma kan kanserlerinin yüzde 50’sini oluşturmaktadır. Lenfoma; Hodgkin Lenfoma ve Non Hodgkin Lenfoma adında ikiye ayrılır. Non Hodgkin Lenfomalar diğerine göre yaklaşık 8 kat daha fazla görülmektedir.
Lenfoma kanserinin iki önemli çeşidinin de alt tipleri bulunmaktadır. Non Hodgkin lenfomanın en az 40-50 alt tipi vardır. Hodgkin lenfomanın ise 6-8 alt tipinden söz edilebilir. Bunların hepsinin klinik seyirleri, tedaviye cevapları, tedavilerinde kullanılan ilaçlar birbirinden farklıdır. Bu nedenle lenfoma teşhisi konulduktan sonra hastalığın hangi alt tip olduğunun da doğru bir şekilde saptanması gerekir. Bu doğrultuda lenfoma tedavisinde en iyi hastane arayışı oldukça önemli hale gelir. Deneyimli ve uzman kadrolara sahip onkoloji merkezlerine sahip olan hastaneler tercih edilmelidir.
LENFOMA NEDEN OLUR?
“Lenfoma neden olur?’” sorusuna net bir cevap verilemese de, belirli risk faktörlerinden söz edilebilir. Her kanser türünde olduğu gibi sigara ve diğer tütün ürünlerinin kullanımı, en önemli nedenlerden biri olarak gösterilir. Bunun yanı sıra lenf kanseri nedeni olarak benzen, tarım ilacı gibi kimyasal maddelere maruz kalmak da söylenebilir. Ayrıca romatizmal rahatsızlıklar ve immün yetmezlik durumlarında hastalığa daha sık rastlanabilmektedir. İmmün sistemini önemli ölçüde etkileyen bazı virüs enfeksiyonları da önemli bir lenfoma nedendir. Örneğin hepatit C, HTLV 1, HIV, AIDS gibi bazı enfeksiyon hastalıklara bağlı olarak da lenfoma görülebilmektedir.
Günlük çevresel faktörler lenfoma nedenleri sıralamasında çok ön planda değildir. Ancak tarım işçileri özellikle de seracılık yapan kişilerde lenfoma biraz daha fazla görülmektedir. Kontrolsüz ilaçlama yapılması, ilaçlanmış seralar içinde maske ve kıyafet giymeden dolaşılması, sera içindeki ilaçlı havanın solunum yolu ile alınması gibi faktörlerin etkili olduğunu bilmek gerekir. Yoksa eve gelen sebzenin üzerindeki tarım ilacının bir etken olduğu düşünülmemelidir. Boya üreten sanayilerde çalışanlar da gerekli önlemlerin alınmaması durumunda aynı riski taşır. Bunun yanında; evdeki kimyasallardan çamaşır suyu, deterjan, deodorantların ya da cep telefonlarının bir neden olarak gösterilmesi şu anki bilgiler ile mümkün değildir. Kilo almadan hareketli bir yaşam süren herkes, birçok hastalığa karşı avantajlı durumdadır. Ancak obezitenin de direkt olarak lenfoma üzerinde etkili olduğuna dair bir bilgi bulunmamaktadır. Fazla kilonun tüm kanser türleri için bir risk faktörü olduğu ise unutulmamalıdır.
LENF KANSERİ (LENFOMA) BELİRTİLERİ
Lenfoma belirtisi deyince ilk akla gelen, genellikle hastanın vücudunda büyüyen bir kitleyi fark etmiş olmasıdır. Bu kitle bazı bölgelere basınç yapabilir. Lenf kanseri, kendini klinik belirti olarak daha çok “lenf bezi” denilen bezelerin patolojik olarak büyümesiyle gösterir. Çünkü tümör kitlesinin büyüdüğü yer, ağırlıklı olarak lenf bezleridir. Bu yüzden de hastaların çok büyük bir kısmı boyun, koltuk altı ve kasık bölgelerinde lenf bezlerinin büyüdüğünü fark ederek hastaneye gelir. Lenfoma belirtilerinden biri de hastanın bağışıklık sistemi yeterli çalışmadığı için grip benzeri bulgular gösterebilmesidir. Grip, başlangıcından itibaren en fazla bir hafta içinde iyileşmesi beklenen bir hastalıktır. Bunun yanı sıra sinüzit, akciğer enfeksiyonları oluştuğunda ise süre uzayabilir. Ancak haftalarca süren ve enfeksiyon tablosunun ağırlaşması gibi durumlar görülüyorsa mutlaka bir uzman görüşü alınmalıdır.
LENF KANSERİ (LENFOMA) ÇEŞİTLERİ
Hematolojik kanserlerde son yıllarda çok önemli ilerlemeler sağlanmıştır. Bu gelişmeler, kan kanserlerinin biyolojik özelliklerinin daha iyi anlaşılmasını, tanıdaki gelişmeleri ve tedavideki başarıyı kapsamaktadır. Hematolojide birçok hastalığın tedavisinde kullanılan çok sayıda ilaç yeni klinik çalışmalarda etkinliğini göstermiş, aralarında etki tarzı çok ilginç olan ve kanser hücresini hedef alan ilaçlar öne çıkmıştır.
Hematolojide en sık görülen kanserler, lenf düğümü kanseri olan lenfomalardır. Bu hastalıkları Hodgkin lenfoma ve Hodgkin dışı lenfomalar (ingilizce: Non-Hodgkin lymphoma) olarak iki büyük gruba ayırıyoruz. Hodgkin dışı lenfomalar, çok sayıda, değişik biyolojisi ve süreçleri olan, tedavileri günümüzde tamamen farklılaşmış, özellikler kazanmış hastalıkların toplandıkları bir sepet oluşturmaktadır.
Hodgkin Lenfoma
Hodgkin Lenfoma, lenf düğümlerindeki büyümeyle kendini gösterir. Bazı hastalarda Hodgkin Lenfoma belirtileri; kilo kaybı, geceleri terlemesi, tekrarlayan ateş yükselmesi şeklinde görülür. Hastalığın hangi evrede olduğunu saptamak için genellikle bilgisayarlı tomografi ve kemik iliği biyopsisi gerekir.
Hodgkin lenfoma, günümüzde tedavi başarısı yüksek olan kanser türlerinden biridir. Her evresinde, hastalığın tamamen yok edilmesi hedeflenerek tedavi gerçekleştirilir. Dünyada Hodgkin lenfoma hastalığının tedavisindeki gelişmeleri kaydetmek amacıyla çalışan ve büyük kapsamlı çalışmalar yapan bazı gruplar vardır, bunlardan biri de Alman Hodgkin Lenfoma Çalışma Grubu (GHSG)’dur. Hastalığın hastaya özel tedavisinde risk faktörleri denilen faktörleri önem taşır. Erken evre ve kötü risk faktörü olmayan hastalarda, kısa süreli ABVD adlı bir kemoterapi ve ışın tedavisi yeterli olur. Fakat hastalık ilerlemişse, hastalığı tamamen yok edebilmek ve nüks etmesini önlemek için çok daha etkili bir tedavi (escalated BEACOPP protokolü) gerekebilir. Şayet nüks olmuşsa, yüksek doz kemoterapi ve otolog kök hücre transplantasyonu, hastalığın tamamen yok edilmesi için genellikle en iyi tedavi seçeneğini oluşturur.
Non Hodgkin Lenfoma
Hodgkin dışı lenfomalar 3 büyük gruba ayrılmaktadır: İndolen (yavaş ilerleyen) lenfomalar, agresif (hızlı ilerleyen) ve çok agresif (çok hızlı ilerleyen) lenfomalar. Bu hastalıkların seyri de, tedavileri de büyük farklılıklar gösterirler. Hodgkin dışı lenfomalar, immunolojik hücre tipi açısından da 2 gruba ayrılır: B-hücreli ve T-hücreli lenfomalar. Genellikle T-hücreli lenfomalar, B-hücreli lenfomalara nazaran daha kötü prognozla seyreder. Bundan dolayı, T-hücreli lenfomaların modern tedavisinde daha intensif ve etkili tedavi yöntemleri seçilir. Eskiden Non Hodgkin lenfomalarının çoğuna CHOP adlı kemoterapi protokolü verilirken, günümüzde hastalığın alt grubuna göre değişen, hastalığa özel daha etkili tedaviler uygulanmaktadır. Hatta bazı lenfoma tiplerinin, kemoterapi kullanmaksızın antibiotik ajanlarla bile tedavisi mümkündür. Örneğin midede veya gözde oluşan lenfomaların bazı türleri ve evreleri, antibiyotik tedavi ile tamamen yok edilebilirler. Hastaya önerilecek en uygun tedaviyi seçebilmek için, lenfomanın alt grubunun, evresinin ve prognostik faktörlerinin tam olarak bilinmesi gerekir. Tam donanımlı bir onkoloji merkezi seçimi bu anlamda çok önemlidir.
Hodgkin Dışı Lenfomaların En Sık Görülen Çeşitleri
Yavaş ilerleyen lenfomalar | Hızlı ilerleyen lenfomalar | Çok hızlı ilerleyen lenfomalar |
Folliküler lenfoma | Diffuz büyük B hücreli lenfoma | Burkitt lenfoma |
Kronik lenfositik lösemi | T lenfomaların çoğunluğu | Lenfoblastik B lenfoma |
İmmunositoma | Mantle hücreli lenfoma | Lenfoblastik T lenfoma |
Yavaş İlerleyen (indolen) Lenfomalar: Hastalık genellikle evre III veya IV’de teşhis edilir. Hastalık şayet evre I veya II’de teşhis edilmişse, tedavi ışın tedavisi ile hastalığı yok etme hedefiyle yapılır. İleri evreler ise belli durumlarda kemoterapi uygulanır, buna gerek yoksa, hasta tedavi verilmeksizin izlenir (ingilizce “wait and see”), çünkü bu durumlarda gerektiğinden evvel tedaviye başlamak hastaya avantaj sağlamaz. B-hücreli indolen lenfomalarda Rituximab adlı, B-lenfoma hücrelerinin üzerindeki CD20 molekülünü hedef alan bir ilaç, kemoterapinin etkisini arttırarak yanıt oranlarını ve yanıt sürelerini de anlamlı bir şekilde etkiler.
Hızlı İlerleyen (agresif) Lenfomalar: Diffuz büyük B-hücreli lenfomalar, agresif lenfomaların önemli bir kısmını oluşturur. Tedavi hastalığı tamamen yok etme amacıyla uygulanır, Rituximab ve CHOP kemoterapisinden oluşur. T-hücreli agresif lenfomalarda ise, CHOP protokolüne Etoposid eklenmesi (CHOEP protokolü), Alman ve İskandinav çalışmalarının gösterdiği gibi, başarı oranını arttırır. T-hücreli agresif lenfomaların çoğunda prognoz kötü olduğundan, 6 kür kemoterapinin akabinde, yüksek doz kemoterapi ve otolog kök hücre transplantasyonu, hastalığın daimi kontrolünde önemli bir rol oynar.
Mantle hücreli lenfomalar ise, son yıllarda önemli aşamaların kaydedildiği agresif bir lenfoma eşitidir. Genç hastalarda öncelikle ilaç tedavisi öngörülür. Genç hastalarda bu tedavi sonrası hastadan kök hücre toplanıp, yüksek doz tedavi ve kök hücre nakli en iyi sonuçları verir. Yaşlı hastalarda ise kemoterapi sonrası yapılan idame tedavisi, yaşam süresini uzatır.
Çok Hızlı İlerleyen Lenfomalar: Diğer bir grup da çok agresif lenfomalardır. En önemlileri Burkitt lenfoma ve lenfoblastik lenfomalardır. Bu lenfoma tipleri çoğunlukla genç hastalarda görülür. Burkitt lenfoma insanda en hızlı ilerleyen kanser tipidir. Bu hastalıklarda tedavinin hedefi hastalığı yok etmektir. Ancak bu hedefe basit tedavilerle erişilemez. Çok sayıda ilaçtan oluşan ve lösemi tedavisini anımsatan kemoterapiler ile hastalık devamlı olarak yok edilebilir.
LENFOMA TANI VE TEDAVİSİ
Lenfoma tedavisine öncelikle lenfoma tanısı koyarak başlanır. Bunun için öncelikle biyopsi alınması gerekir. Mikroskop altında bu hücrelere bakarak lenfoma tanı konulabilir. Ancak bu morfolojik değerlendirme, hastalığın alt tiplemesini yapmak için yeterli değildir. Doğru tanı konulabilmesi için mutlaka farklı testler gerekir. Bunun yanında özel boyama teknikleri ile hangi tür lenfoma olduğunu belirleyen özel testler de bulunmaktadır.
Lenfoma Tedavisi İçin Genetik Testler
Lenfoma olduğu belirlenen hücrelerin genetik yapılarıyla ilgili de analizler yapılarak, alt tipinin doğru bir şekilde tanıması sağlanmaktadır. Bu sonuç, lenfoma tedavisinin başarısı açısından son derece önemlidir. Tanının kesin olarak konulmasının ardından hastalığın, vücuda yayılıp yayılmadığı araştırılmalıdır. Bunun için de en sık PET-CT kullanılır. Bu tetkik ile lenfomanın vücudun hangi bölgesinde tutulum olduğu gösterilmiş olur.
Lenfoma tedavisi için hastalar çok farklı evrelerde doktora başvurabilmektedir. Genelde yaygınlığa göre lenfoma 4 evreye ayrılmaktadır. Lenfoma evreleri evre 1 ve 2 erken, 3 ve 4 ise daha ileri olarak adlandırılır. Lenf kanserinin kesin tanısı konulduktan sonra özel bir değerlendirme yapılarak hangi aşamada olduğu belirlenmektedir. Yani hastanın hangi tedaviye ne ölçüde yanıt verebileceğini bu skorlama tekniği ile görmek mümkündür. Hastanın yaşı, kandaki LDH denilen değerin düzeyi, hastalığın ileri evre olup olmaması, lenf nodu dışında başka bir yerde tutulum olup olmaması gibi bir takım faktörler bir araya getirilir ve puanlama yapılır. Buna göre hastalar düşük veya yüksek risk grubuna girer. Eğer hastanın risk profili yüksekse standart lenfoma tedavilerinden fayda görme olasılığı daha düşüktür. Bu nedenle bu hasta grupları daha ağır tedaviler almak durumunda kalabilir. Risk profili düşükse daha standart tedaviler tercih edilmektedir.
Lenfoma Tedavisinde Kemoterapi
Lenfoma tedavisinde kemoterapi önemli bir yere sahiptir. Kemoterapinin nasıl ve ne şekilde uygulanacağı, hastalığın durumuna göre farklılık göstermektedir. Standart yani ayaktan uygulanabilecek ilaç yöntemlerinin yanı sıra; hızlı seyirli ve yüksek riskli hastalarda da yatarak takip gerçekleştirecek şekilde yüksek doz kemoterapi uygulanmaktadır. Lenfoma tedavisinde kemoterapi aralıkları genellikle 3- 4 haftadır ve 6 kür gerçekleştirildikten sonra tedaviden kesin sonuç alınması beklenir. Bu dönemde, ara değerlendirmeler ile alınan yanıt da gözlemlenmektedir. İkinci ya da üçüncü kürden sonra bu takipler yapılmaktadır.
Kemoterapi, kan kanserlerinde özellikle de lenfoma tedavisinde en çok başvurulan tedavi yöntemlerinden biridir. Her hastalığa göre farklı ilaç kombinasyonları kullanılmaktadır. İlaçların şiddetleri de standartların üzerine çıkıldığında ve yüksek doz uygulandığında artmaktadır. Bu ilaçların sağlıklı hücrelere de zararı olduğu için, klasik birçok kemoterapide görünen; tedaviden sonra saçların dökülmesi, mide bağırsak sistemindeki bozukluklar, ağız içinde yaralar, hastanın iştahının kaybolması, kilo kaybı, halsizlik, araya giren ciddi enfeksiyonlar nedeniyle problemler yaşanabilir. Bu tip tedavilerde olabilecek komplikasyonlar önceden öngörülebildiği için gereken tedbirler alınıp, hastanın tedavi dönemini en risksiz şekilde atlatması sağlanmaya çalışılmaktadır. Lenfoma tedavisinde kemoterapinin yanında bazen ışın tedavisi yani radyoterapi de destek olarak kullanılmaktadır. Hastalığın yaygın olduğu durumlarda herhangi bir alanda çok büyümüş olan lenflerin yapabileceği basıyı ortadan kaldırmak için hastalığı tedavi amaçlı olmasa da o bölgeyi rahatlatmak için radyoterapiden yararlanılabilir.
Immünoterapi Lenfoma Tedavisi Başarısını Artırıyor!
Lenf kanseri tedavisinde kemoterapi dışında sıklıkla başvurulan ya da birlikte uygulanan tedavilerden biri de immünoterapidir. Kanser hücresine yönelik geliştirilmiş bir takım “monoklonal antikor” denilen ilaçlar tedavide sıklıkla kullanılmaktadır. Bu ilaçların özelliği, lenfoma hücrelerine yapışması ve daha sonra da immün sistemini harekete geçirip onun aracılığıyla onu yok etmesidir. Lenfoma tedavisinde kemoterapiyle birlikte uygulanan ve her lenfomanın tipine göre farklılık gösteren “monoklonal antikor” tedaviler vardır. Bu tür tedaviler başarı şansını artırmaktadır.
Lenfoma İlaçları
Lenfomada son 10- 20 yıldır uygulanan tedaviler bulunmaktadır ancak bunların ivme kazanması ve bilinirliği son 10 yıldır artmaktadır. Hedefe yönelik tedaviler günümüzde yalnızca “monoklonal antikorlar” ile sınırlı değildir. Monoklonal antikor olmayan bir takım başka ilaçlar ve moleküller de geliştirilmiştir. Bunlar, “hedefe yönelik” ya da “akıllı ilaç” olarak adlandırılmaktadır. Akıllı ilaçlar sayesinde hedefe yönelik moleküller; kanserli hücrelerde olan, sağlıklı hücrelerde ise bulunmayan bir takım mekanizmaları bozmaktadır. Bu nedenle ilaçlar hastaya verildiğinde kanser hücresi çok yoğun bir şekilde, sağlıklı hücreler ise minimal düzeyde etkilenmektedir. Hedefe yönelik tedavilerde kullanılan ilaçların yan etkileri hiçbir zaman klasik kemoterapi ilaçlarının yan etkileri ile aynı değildir. Hastaların hemen hepsi, saç dökülmesi, bulantı, kusma, iştahsızlık gibi sorunlar yaşamamaktadır. Hafif ve çok rahatlıkla kontrol altına alınabilecek yan etkiler de hastalar tarafından tolere edilmektedir.
Lenfomada En Etkin Tedavi Seçeneği: Kemik İliği Nakli
Lenfoma tedavisinde kemik iliği veya kök hücre nakli sıklıkla kullanılmaktadır. İki tip kemik iliği bulunmakta ve bunların; otolog denilen kişinin kendi kök hücresinden yapılan ve allojenik yani bir başka kişinin kök hücresi kullanılarak yapılan nakillerin yapılmasını sağlamaktadır. İkisinin yapılış amaçları birbirinden farklıdır. Genel olarak kemik iliği veya kök hücre nakli yapılmasının temel amacı şudur; kemik iliği veya kök hücre nakli başlangıç tedavisi değildir. Hastaya tanı konur konmaz lenfoma tedavisi için kemik iliği nakli gerçekleştirilememektedir. Lenfoma tedavisinde önce kemoterapi, immünoterapi ve radyoterapi ile hastalığı yok etmek ya da baskılamak amaçlanır, ardından alınan yanıta göre gerekli görüldüğünde nakil yöntemine başvurulur. Bazı hastalıklarda daha başlangıç seviyesinde standart tedavi verilse ve bunda başarı sağlansa bile hastalık bir süre sonra büyük olasılıkla tekrarlayacaktır. Bu tip hastalarda tekrarlama riskini en aza indirebilmek için kök hücre nakli yapılmaktadır.
Lenf Kanseri Lenfoma Tedavisi: Otolog Kök Hücre Nakli
Standart bir tedavi ile hastalık yok edilse bile gözle görülmeyen mikroskobik düzeyde kanser hücreleri geride kalmakta ve bunların çok yüksek dozlarda kemoterapi ile yok edilmesi gerekmektedir. Bu tedavi nedeniyle kan hücrelerini yapıcı kemik iliği de etkilenmektedir. İşte bu sebeple lenfoma tedavisi öncesi hastanın kendi kök hücreleri çeşitli yöntemlerle alınır ve özel işlemlerden geçirdikten sonra dondurularak saklanır. Sonra hastaya çok yüksek dozda kemoterapi uygulanır. Tedavi bittikten sonra önceden saklanan hastanın kendi kemik iliği hücreleri yine hastaya nakledilir. Bu hücreler kemik iliğine yerleşir ve orada çoğalarak kan üretmeye başlar. Yani bypass yapılmış ve o hücreler kurtarılmış olur. Ancak otolog nakil her zaman yapılamayabilir. Kemik iliğinde tutulum olan hastaların kendi kemik ilikleri alınamadığından öncelikle %25 uyum şansı olan kardeş ya da anne baba ile gerekirse de kemik iliği bankasına başvurulmaktadır.
LENF KANSERİNDE MORAL ÇOK ÖNEMLİ
Hastanın olumlu bir bakış açısına sahip olması ve iyileşeceğine inanması, lenfoma tedavisine yardımcı olacağı için moral doktor açısından da önemlidir. Moral tek başına lenfomayı yenmede etkili olmasa da hastanın tedavi sürecine uyumunu sağlamaktadır. Hasta lenfoma tedavisine ne kadar uyarsa ve iyileşeceğine, hayatta kalacağına ne kadar inanırsa başarı şansı doğal olarak artmaktadır.
LENFOMA KANSERİ İLE İLGİLİ SIK SORULAN SORULAR
Kilo Kaybı ve Gece Terlemesi Lenf Kanseri Belirtisi mi?
Lenfoma belirtilerinden olan lenf bezleri şişliği, göğüs kafesi veya karın boşluğunda da görülebilir.
Buradaki kitlenin ne kadar büyüdüğü direkt olarak fark edilemeyebilir. Ancak bunun yarattığı basınç hastada şikayetler oluşturabilir. Göğüs kafesinde büyüyen lenf, göğüs ağrısı, kuru öksürük ve nefes darlığı gibi sıkıntılara yol açabilir. Karın bölgesinde büyüyen bir kitle ise mide ve bağırsak sisteminin çalışmasını olumsuz etkiler. Karın ağrısı, ishal, kabızlık ve sindirim bozuklukları da yine lenfoma belirtilerindendir. Bazı hastalarda ateş, kilo kaybı, gece terlemesi gibi kanserin sistemik etkilerine bağlı şikâyetler de olabilir. Hasta bu belirtiler ile geldiğinde klinik olarak lenfomadan şüpheleniliyorsa, büyüyen ve saptanabilecek bir kitlenin varlığını anlamak için muayene edilir. Beraberinde görüntüleme yöntemleriyle hastanın vücudunda herhangi kitle ya da lezyon olup olmadığına bakılmalıdır. Ancak lenfoma sadece lenf bezlerinin büyümesiyle ortaya çıkmaz. Karaciğer, dalak, mide bağırsak sistemi ve akciğeri de tutabilir. Organ tutulumları oluşabilir. Kemik iliği de bu hastalıklar tarafından tutulum gösterebilir. Çünkü vücuttaki her doku, lenfoma tarafından tutulabilecek potansiyele sahiptir.
Lenfomanın belirtileri; alerjik öksürük, astım atakları ve sinüzit şeklinde de ortaya çıkabilir. Çünkü lenfomadaki belirti ve bulguların hiçbiri, yalnızca hastalığa özgü değildir. Birçok başka hastalıkta da aynı belirtiler olabilir. Bazen lenf kanserinin belirtisi kendisini romatizmal hastalıklara benzer şekilde de gösterebilir. Hasta romatizmal hastalık şikayetleri hastaneye başvurabilir ve yapılan araştırmalar ile durum ortaya çıkabilir. Kısaca lenfoma, her hastalığı taklit edebilmektedir. Bu nedenle lenfoma belirtileri önemsenmelidir.
Lenf kanseri belirtilerinden biri de bademciklerin her ikisinin de şişmesinden çok ikisinden birinin büyümesidir. Asimetrik bir büyümenin lenfoma olma riski daha yüksektir. Bademcik aslında lenfoid bir dokudur. Lenf bezi gibi o da ağzın iç kısmında, boğaz bölümünde yer alan lenfoid doku ve bu sistemin bir organıdır. Orada o bölgeyi tutup büyümeye yol açabilir. Bademciklerin büyümesi öncelikle bir enfeksiyonu düşündürdüğü için hastaya enfeksiyon tedavisi verilmektedir. Beklenen, örneğin 10 günlük bir süreçte ilaç kullanıldığı halde herhangi bir iyileşme görülmüyorsa, o zaman altta yatan başka nedenler araştırılmalıdır.
Hastanın Vücudu Başkasının Kök hücrelerini Reddedebilir Mi?
Allojenik yani başkasından alınan kök hücrelerinin nakledilme işleminin ise bazı avantaj ve dezavantajları bulunmaktadır. Otolog nakle göre temel felsefe aynı gibi görünse de, yabancı bir kişinin hücreleri nakledildiğinde doku uyumları tam olsa da saptanamayan doku uyuşmazlıkları yüzünden, hastanın kendi dokularına ve organlarına zarar verebilir. Nakledilen bağışçı kaynaklı savunma hücreleri, hastanın dokularını yabancı gibi algılayıp organlarına zarar verebilir. Bu da hastanın yaşamını tehdit edebilir. Bunu engelleyebilmek için uzun süre bağışıklık sistemini baskılayan ilaçlar kullanmak gerekir. Hastalar bu ilaçların yan etkileriyle de mücadele etmek zorundadır. Başkasından alınan kemik iliği hücrelerinin iyi bir yanı da o lenfoid hücrelerin, hastadaki kanser hücrelerini de algılayıp onları yok edebilmesidir. O nedenle allojenik nakillerde o hücreler ve ilaçlarla bir takım ince ayarlar yapılarak, nakledilen hücrelerin hastanın kanser hücrelerini yok etmesini sağlamayı ama hastaya zarar verici etkisini de mümkün olduğunca engellemeye çalışılmaktadır. Bu dengenin iyi tutturulabilmesi, çok başarılı bir allojenik nakil ile hastalığın tekrarlama şansını son derece azaltmaktadır.
Lenfoma Yaşam Süresi Ne kadardır?
Lenfomaların klinik seyri hızlı ve yavaş olmak üzere ikiye ayrılmaktadır. Hızlı seyirli lenfomalar çok kısa sürede ortaya çıkmaktadır. Kitle çok kısa sürede büyüyerek, aylar hatta haftalar içinde kendini gösterebilir. Yavaş seyirli olanlarında ise kitlenin büyüme hızı oldukça yavaştır. Aylar hatta yıllar sürebilen bir süreci kapsayabilir. Lenfoma yaşam süresi de değişkendir. Hızlı seyirli lenfomalar tedavi edilmediğinde hasta aylar ya da haftalar içinde kaybedilebilir. Yavaş seyirli olanlarında ise hiç tedavi olmasa bile hasta uzun süre hatta 15-20 yıl yaşayabilir. Bu nedenle iki farklı lenfoma grubunda hastaya uygulanan tedavi yaklaşımı da farklı olmaktadır. Hızlı seyirli lenfomalarla birlikte bir yaşam mümkün olamayacağı için, hedef mutlaka hastalığı yok etmek ve tam iyileşme üzerine kurulmalıdır. Yavaş seyirli olanlarında ise çoğu zaman düzenli takip yeterli olmaktadır.
*Sayfa içeriği sadece bilgilendirme amaçlıdır. Tanı ve tedavi için mutlaka doktorunuza başvurunuz.
MEME KANSERİ NEDİR?
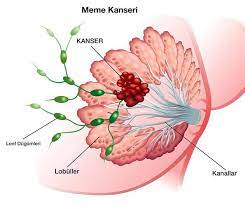
Meme kanseri, meme dokusundaki süt kanalını oluşturan ve süt yapıcı hücrelerin kontrolsüz olarak çoğalmasıyla ortaya çıkmaktadır. Meme kanseri kadınlarda görülen kanserlerin %33’ünü oluşturmaktadır. Tüm kanser hastalarının ise %20’sini tehdit etmektedir. Günümüzde her 8 kadından 1’i hayatı boyunca meme kanseriyle karşı karşıya kalma riskiyle yaşamaktadır.
Meme kanseri, meme dokusu içinde süt kanalları içerisinde oluşan kanser hücreleridir. Meme kanserlerinin yüzde 80’i invaziv duktal karsinomdur. Invaziv duktal karsinom, meme kanserinin süt kanallarında ortaya çıktığını gösterir. Meme kanserinin yüzde 20’si de invaziv lobüler karsinomdur. Bu türde ise meme kanseri süt kanallarında değil, süt bezlerinde gelişir. Meme kanserine neden olan hücrelerin çoğalması ve büyümesi oldukça zaman alır. Ancak çoğaldıktan sonra hücreler lenf ve kan yoluyla vücudun diğer organlarına yayılabilir. Meme kanserinde en önemlisi kanserin kan ve lenf yolu ile diğer organlara yayılmadan tanının konmasıdır. Bu aşamada konulan bir tanı ile tedavi oranı çok yüksektir. Bu nedenle meme kanserinde erken teşhis çok önemlidir.
Erken teşhisin sağlıklı bir yaşamın devamlılığını sağladığı meme kanserinde meme kanseri hücrelerinin lenf nodlarına yayılım gösterip göstermediğini tespit etmek oldukça önemlidir. Bu hastalığın seyrini etkileyen önemli bir kriter olan lenf nodları, memenin yapısında oluşan bir kanserli hücrenin sıçraması durumunu meydana getirir. Bu sıçrama kanserli hücrelerin farklı iç organlara yayılım göstermesi ve hastalığın şiddetinin olumsuz seğirmesine sonuç olabilir.
MEME KANSERİ NEDEN OLUR?
Meme kanseri kadınlara oranla erkeklerde çok nadir görülmektedir. Ancak hastalık geliştiğinde seyri kadınlarda görülen meme kanserine göre daha hızlı ve kötü olabilmektedir. Her 100 meme kanserinin 1’i erkeklerde görülmektedir. Meme kanserinin nedeni tam olarak bilinmese de; kalıtım, beslenme şekli, sosyoekonomik durum, regl durumu, doğumlar, doğum kontrol hapları gibi birçok faktörden bahsedilebilir.
Meme kanserinin görülme sıklığı yaş ilerledikçe artar. En çok 50-70 yaş aralığında görülen meme kanserinde risk, ailede meme kanseri öyküsü bulunduğunda artmaktadır. Anne ya da kardeşte meme kanseri görüldüğünde hastalık riski 3 kat artar. Bu nedenle aile hikayesinde meme kanseri olan kişilerin kontrollerini özellikle 40 yaş ile birlikte sık sık yaptırmaları gerekmektedir. BRCA1 ve BRCA2 genlerinde bozulma yani mutasyon var olan kişilerin hem meme hem de yumurtalık kanserine yakalanma ihtimali riski yüksektir. Menopoz sürecinde 5 yıldan fazla hormon ilacı kullanmak da meme kanseri riskini artıran faktörlerden biridir.
MEME KANSERİ RİSK FAKTÖRLERİ NELERDİR? KİMLERDE GÖRÜLÜR?
Meme kanseri risk faktörlerinin en önemlileri değiştiremeyeceğimiz risk faktörleridir. Özellikle aile hikayesinde meme kanserinin olması, meme kanseri risk faktörlerinin başında gelmektedir. Birinci derece bir akrabada 50 yaşından önce görülen meme kanseri, kişinin meme kanserine yakalanma ihtimalini 3 kat artırmaktadır. 2. derece akrabalarda görülen meme kanseri de önemli meme kanseri risk faktörlerindendir. Ayrıca ailede ne kadar fazla kişi meme kanserine yakalanmış ve ne kadar erken yaşta yakalanmışlar ise o kadar risk artar. Meme kanserinde bir diğer önemli risk faktörü ise meme dokusunun yoğun olmasıdır. Meme dokusu içerisinde yağ oranı daha az olan kişilerde meme kanseri riski daha çok artmaktadır. Meme dokusunun yoğunluğunu ise mamografk ve sonografik yöntemlerle ölçülebilir. Özellikle lenfoma hastalarında göğüs çevresine yakın uygulandığı için maruz kalınan radyoterapi de meme kanseri için sayılabilecek risk faktörleri arasındadır. Bu nedenle özellikle lenfoma hastaları olmak üzere radyoterapi tedavisi alan hastaların tedaviden sonra hayat boyu kontrollerini sıkça yaptırmaları önerilmektedir.
Kadınlarda meme kanseri oluşumunda risk faktörü sayılan erken adet görme de önemsenmelidir. Özellikle 11 yaşından önce adet görenler, geç menopoza girenler meme kanserine yakalanma konusunda daha riskli durumda kabul edilirler. Emzirmemek ya da ilk hamileliğini 30 yaşından sonra yaşamak, aşırı alkol tüketmek ve fazla kilolu olmak da meme kanseri risk faktörleri arasındadır. Ayrıca özellikle menopoza girdikten sonra, menopozun etkilerini azaltmak için kullanılan östrojen hormonu da meme kanseri riskini 1.5. kat artırmaktadır.
Diğer meme kanseri risk faktörleri şöyle sıralanabilir:
- Meme kanserinde kadın olmak birinci derece risk faktörüdür.
- Ailede meme kanseri öyküsü bulunan kişinin meme kanserine yakalanma riski diğer insanlara göre daha fazladır.
- Yaş ilerledikçe meme kanseri görülme riski artar.
- Beyaz tenli kadınlar, esmer tenli kadınlara göre %20 daha fazla risk altındadır.
- Meme kanseri vakalarının %5-10’u genetiktir. Aileden geçen bozuk genler (mutasyon) sonucu oluşmaktadır. Genetik meme kanserinin en sık rastlanan nedeni, BRCA1 ve BRCA2 genlerinde genetik mutasyondur. BRCA mutasyonuna sahip aile üyeleri için risk, %80 oranındadır.
- 15 yaşından önce radyoterapi tedavisi görmek, 40 yaşından sonra meme kanseri olma riskini %35’e çıkarmaktadır.
- 55 yaş ve üstü kadınların 3’te 2’sinde, yayılma gösteren meme kanseri bulunmaktadır.
- Yaşlanma veya yaşam şekli gibi faktörler, meme kanseri riskini zaman içinde değiştirebilir.
- Uzun süreli fazla sigara tüketiminin meme kanseri riskini artırdığı tespit edilmiştir.
- Fiziksel aktivite ve düzenli spordan uzak, hareketsiz bir yaşam meme kanseri oluşum riskini artırmaktadır.
- Şişmanlık, doğurganlık çağındaki kadınlarda meme kanseri riskini 2 katına çıkarır.
- Ailesinde meme kanseri olanlarda doğum kontrol hapı kullanımı, kanser riskini 3 kat artırabilmektedir.
MEME KANSERİNDEN KORUNMAK İÇİN NELER YAPILABİLİR?
Meme kanserinden tamamen korunmak söz konusu değil. Sigara ve alkolden uzak durmak, sağlıklı beslenmek, egzersiz yapmak gibi değiştirilebilir faktörler ile görünme sıklığı azaltılabilir.
MEME KANSERİ TÜRLERİ NELERDİR?
Meme kanseri türleri biyopsi ile alınan doku üzerinde yapılan patoloji incelemesi sonucunda belirlenir. Meme kanserinin birçok türü bulunmasına rağmen genel olarak iki ayrı başlık altında değerlendirilmektedir:
- Meme kanallarını oluşturan hücrelerde oluşan duktal karsinom
- Memenin süt bezlerinde oluşan lobüler karsinom
Duktal ve lobüler karsinomlar kendi içlerinde yayılma göstermeyen non-invaziv/in situ tümörler ve yayılma özelliği olan invaziv tümörler olarak ikiye ayrılmaktadır.
Noninvaziv ve invaziv kanser türlerinin farklılıklar nelerdir?
Kanser iki şekilde sınıflandırılmaktadır. İnvaziv ve noninvaziv olarak ayrılan kanserler kendi içlerinde farlılık göstermektedir. Başlangıç evresinde oluştuğu dokuda kalarak, vücutta yayılım göstermeyen kanser türleri noninvaziv kanser olarak tanımlanmaktadır. İnvaziv kanser ise noninvaziv kanserin tersine, başlangıç evresinde oluştuğu dokuda sabit kalmayarak yayılım göstermektedir. Meme kanseri sıklıkla süt üreten bezlerde ya da süt kanallarında gelişmektedir. Lobüllerde, süt bezlerinde veya süt kanallarında yayılım gözlenmediği takdirde kanserin invaziv olmadığı düşünülmektedir. Noinvaziv kanser başlangıç evresinde yayılım göstermese dahi, zaman içerisinde yayılım gösteren invaziv kansere dönüşebilmektedir. Aynı zamanda tekrarlama ihtimali yüksek olan noinvaziv kanser uzun dönemde kontrol ve gözlem gerektirmektedir. İnvaziv kanserlerin geliştiği dokuda kalmayarak geniş alanlara yayılması, kanserin metastaz yapmasına ve hayati tehlike riskinin artmasına neden olmaktadır. Kanser hücreleri yayıldıktan sonra orijinal tümör oluştuğu yerden başka bir yere yapışmakta ve ikincil bir tümör oluşumuyla sonuçlanabilmektedir. Her kanser türünde olduğu gibi, meme kanserlerinde de erken teşhis çok önemlidir. 20 yaşından itibaren tüm kadınların aylık olarak düzenli meme kontrollerini yapması, ilerleyen dönemlerde meme kanserinin olumsuz sonuçları ile ilgili riskleri azaltmaktadır. Erken teşhis sayesinde kanserin seyri belirlenerek tedavi şekilleri uzman hekimlerce kişiye özel olarak uygulanmaktadır. İmmünoterapi, kemoterapi, hormon tedavisi, radyasyon, ameliyat ve hedefe yönelik ilaç tedavisi gibi yöntemler ile noinvaziv ve invaziv kanser türlerine karşı seçenekler sunulmaktadır.
Duktal Karsinoma In Situ
Elle muayenede belirlenemeyen, mamografide düzensiz yapısı ve kireçlenmelerle kendini gösteren bir kanser türüdür. Bu hastalığa sahip olan kişide meme başı akıntısı da olabilir.
Lobüler Karsinoma In Situ
Her iki memede de kanser oluşma riskini 8-10 kat artıran önemli bir tablodur. Bu durumda olan hastalar düzenli olarak kontrol ve yakın takip altında tutulmaktadır. Aynı zamanda hastaya koruyucu ilaçlar da verilmektedir.
Bazı hastalarda koruyucu amaçlı olarak her iki memenin alınması ve meme dokusu içinin boşaltılması gibi işlemler yapılabilmektedir. Hastanın kozmetik açıdan herhangi bir sorun yaşamaması için uygulanan cerrahi yollarla protez ve meme rekonstrüksiyonu gibi işlemler de hastaların sosyal yaşamlarına olumlu katkı sağlamaktadır. 10 yıl öncesine kadar sadece 2 grupta sınıflandırılabilen meme kanseri günümüzde, 4 değişik alt grupta toplanmaktadır. Ayrıca farklı tedavi stratejileri ile bireyin tümörüne özgü tedavi yöntemleri geliştirilmiştir. 10 yıl öncesine kadar meme kanseri sadece 2 grupta sınıflandırılabilen meme kanseri günümüzde, 4 değişik alt grupta toplanmaktadır. Ayrıca farklı tedavi stratejileri ile birey ve bireyin tümörüne özgü tedavi yöntemleri geliştirilmiştir.
Invaziv (Yayılım Gösteren) Karsinoma
Kanser başlangıç yeri olan hücrenin üst katmanından daha ileri yayılma göstermesi ile invaziv kanser türü oluşur. Meme kanserlerinin çoğu, invaziv karsinomdur. Yayılma özelliği gösteren kanserler arasında, meme kanallarını oluşturan hücrelerden ortaya çıkan duktal karsinom en sık rastlanan meme kanseri tipidir.
Inflamatuvar Meme Kanseri
Meme kanserinin en hızlı ve kötü seyirli tipi olarak bilinmektedir. Memeyi tamamen saran iltihabi hastalıklarıyla belirtileri benzerlik göstermektedir. Kitle belirtisi vermez ve bazen de yalnızca kızarıklık ve sertlik gibi belirtilerle ortaya çıkabilir. Antibiyotik tedavisine rağmen iyileşmeyen meme hastalıklarında mutlaka altta yatan bir kanser olup olmadığı araştırılmalı, aksi ispatlanana kadar hastanın kanser olduğu düşünülerek gerekli tetkik ve incelemeler yapılmalıdır.
MEME KANSERİ BELİRTİLERİ NELERDİR?
Meme kanseri belirtilerini bilmek, meme kanserini erken evrede yakalamak ve tedavinin başarıya ulaşması için çok önemlidir. Meme kanseri belirtileri arasında en belirgini memede ele gelen kitledir. Ele gelen kitle meme dışında koltuk altında da olabilir. Eğer kitle büyümüş ise meme ucuunda çekilme de göğüs kanseri belirtilerindendir. Çok nadir görülse de, meme ucundan kanlı ya da kansız akıntı da meme kanserini işaret edebilir. Meme kanserine neden olan tümör çok büyürse, meme derisinde ödem oluşur ve şişme görülebilir. Aynı zamanda kızarıklık ve portakal görünümü de karşılaşılan göğüs kanseri belirtilerindendir. Eğer meme kanseri yayılmış ise yayıldığı bölge ile ilgili şikayetler de görülebilir. Meme kanseri belirtileri farkındalığı meme kanserinin ilerlemesine engel olabilmek adına çok önemlidir. Bu nedenle kişinin kendi meme yapısını tanıması ve risk faktörlerini bilmesi gerekir. Meme kanseri belirtilerini fark edebilmek için her kadın 20 yaşından sonra kendi meme muayenesini yapmaya başlamalıdır. Kendi kendine meme muayenesi adet bitiminden 5-7 gün sonra; adet görmeyen kadınlar ise ayda bir belirdikleri yapılmalıdır.
Meme kanseri belirtileri şöyle sıralanmaktadır:
- Memede; genellikle ağrısız, sert yapılı, hareket ettirilebilen veya yerinden oynamayan, zamanla büyüyebilen yapıda ve karakterde ele gelen şişlikler.
- Gözle görülebilir meme boyutunda veya şeklinde değişiklik, memede şekil bozukluğu,
- Meme cildinde kızarıklık, morluk, yara, damar genişlemesi, içeri doğru çöküntü, yaygın küçük şişlikler, portakal kabuğu görünüşü gibi noktasal çekintiler.
- Meme başı ve çevresinde, renk ve şeklinde değişiklik, meme başında genişleme, düzleşme, içe çökme, yön değiştirme, kabuklanma, çatlaklar ve yaralar.
- Meme başından kanlı veya kansız akıntı gelmesi, meme başı akıntısı,
- Koltuk altında görülebilen, elle fark edilen ağrılı ya da ağrısız şişlikler.
Ancak unutmayın ki; risk faktörüne sahip olmanız, o hastalığa yakalanacağınız anlamına gelmez.
MEME KANSERİ TEŞHİSİ
Meme kanserinin erken teşhisi çok önemlidir. Her kadın 20 yaşından itibaren memesini tanımalı, aylık düzenli kontrollerini ve 40 yaşından itibaren de mamografi takibini yapmalıdır. Memedeki her 10 kitleden 8’i iyi huyludur; yani kanser değildir
Erken teşhis edilen meme kanserinde hem tedavi çok kolay hem de başarı şansı çok yüksektir. Örneğin Evre 0’da yakalanan meme kanserinde başarı şansı ve hastalığın bir daha tekrar etmeme olasılığı %96’dır. Evre I’de başarı oranı % 93, Evre II’de % 85 şeklindedir. Ne kadar erken evrede teşhis edilirse başarı şansı da o kadar yükselmektedir. Erken teşhis için her kadının 20 yaşından itibaren ayna karşısında ayda bir kez, kendi kendine meme muayenesi yapması gerekmektedir. 35 ile 40 yaş arasında kadınlar ilk meme ultrasonunu çektirmeli, 40 yaşından sonra da yılda 1 kez mamografi yaptırmalıdır.
Meme kanseri teşhisinde görülen her 10 kitlenin 8’i iyi huyludur. Bunların çoğu genç yaşlarda görülen fibroadenom veya kist denilen kanser olmayan kitleler ve orta yaşlarda görülen fibrokistik kitlelerdir. Memedeki kitlenin ağrılı ya da ağrısız olması bunun kanser anlamına gelmez. Ancak memede ele gelen farklı bir yapı veya kitlenin ne olduğunun mutlaka aydınlatılması kitle fark edildiğinde mutlaka doktora başvurmak gerekir. Son yıllarda toplumda meme kanserine karşı farkındalık yaratmak amacıyla yapılan sosyal sorumluluk kampanyaları ve bilinçlendirme programları, meme kanserinde erken tanı için kişinin kendi kendine meme muayenesi yapmasının önemine işaret etmektedir.
MAMOGRAFİ VE TOMOSENTEZ MAMOGRAFİ: Meme kanseri teşhisinde ve tarama programlarında dijital mamografi ve tomosentez cihazları kullanılmaktadır. Tomosentez, düşük doz X ışınlarının kullanıldığı ve yüksek çözünürlüklü görüntülerin elde edildiği bir teknolojidir. Mamografi teknolojileri sayesinde meme kanseri erken dönemde teşhis edilebilmekte ve tedavi planlaması buna göre yapılabilmektedir.
USG: Meme de bulunan kanserli hücrelerin tespitinin sağlanması için ses dalgaları aracılığıyla meme dokusu incelemesini gerçekleştiren, gelişmiş teknolojik alt yapıya uygun görüntüleme sistemi olarak tanımlanmaktadır. Ultrason çekimi öncesi ön hazırlık gerektirmeyen bu sistem aynı zamanda radyasyon içermemektedir. Meme kanser tespiti için kullanılan bu sistem aynı zamanda oluşan kitlenin katı ya da sıvı şekilde olup olmadığını göstermektedir. Meme dokularında oluşan anomalilerin incelenmesinde her yaş aralığında sıklıkla kullanılan başvurulan görüntüleme sistemi olarak da bilinmektedir. Sonuçlar ise çekimden kısa süre sonra çıkmaktadır.
MR: Manyetik Rezonans ya da MR meme kanseri incelemelerinde tercih edilen görüntülüme tekniklerinden biridir. Yumuşak doku incelemelerinde ilaç eşliğinde görüntüleme yapılmaktadır. İlaç eşliği nedeni ile böbrek hastaları için bu görüntüleme tekniği kullanılmamaktadır. Cihaz ortasına yerleştirildikten sonra koil diye adlandırılan platinden yapılmış bir çeşit tel olarak tanımlanan alan içerisine memeler yerleştirilmektedir. Güçlü manyetik bir alt yapıya sahip olan bu cihaz MR çekim öncesi rahat kıyafet giyimi gereksinimi oluşturabilmektedir. Kolye, küpe, bilezik, saat vb. parçalar görüntüleme öncesi çıkarılmalıdır. Meme dokusu incelemelerinde kadınlar için ideal zaman dilimi regl döngüsüne 7 ila 10 gün kala olarak belirtilmektedir. Bu çekimler yaklaşık 40 dk veya 1 saat sürebilmektedir. Görüntüleme sonrasında, ilaç eşliğinde MR çekimi gerçekleştiği için bol su tüketimi önerilmektedir. Su tüketimi ile ilaç etkisinin kırılması ve bu maddelerin vücuttan atılması sağlanmalıdır. Sonuçlar ise sağlık kuruluşlarının yoğunluğuna göre kısa sürede verilebilmektedir. Memorial Sağlık Grubu hastanelerinde 1,5 Tesla MR ve 3 Tesla MR kullanılmaktadır.
PET – CT: Gelişmiş teknolojik görüntümle yöntemlerinden biri olan PET- CT kanser hücrelerinin saptanması, tedavi yöntemlerinin belirlenmesi gibi kanser evresinde kullanılan en kıymetli radyolojik yöntem olarak nitelendirilebilir. Kansere neden olan kitlenin iyi veya kötü huylu olduğunu tespit etmek içinde gereklidir. Tümör büyüklüğü kanserin vücuda yayılımını kolaylaştırmaktadır. Bu risk oranının saptanması ve hastalığın yaygınlığının saptanması açısından oldukça önemlidir.
PET-CT çekimi öncesi bir takım hazırlıklar gerekmektedir. Bu hazırlıkların başında ise çekim öncesi 6 ila 8 saatlik bir zaman dilimi kadar besin tüketiminin sonlandırılmış olması gerekmektedir.
Meme Sintigrafisi: Sintigrafi ağrısız, güvenilir, yan etki ve alerji oluşturması minimum seviyede bulunan inceleme yöntemleridir. Az miktarda radyoaktif maddeler oral yollardan, damardan vb. verilmektedir. Kanserli odakların farklı organlara yayılımını sintigrafik yöntemlerle değerlendirmek mümkündür. Meme kanserlerinde bekçi lenf düğümlerin tespit edilerek bu düğümlerin çıkarılmasına yol gösterici olmaktadır. Sintigrafi öncesi farklı hastalıklar için kullanılan ilaçlar doktor onayı ile kesilebilir. En az 6 saatlik açlık durumu ile çekim gerçekleştirilmelidir. Yaklaşık 30 dk sürecek bu çekimlerde hareketsiz kalmak önemlidir. Önlük, giysi vb. kıyafet değişikliği gerekmemektedir.
MEME KANSERİNDE ERKEN TEŞHİS YÖNTEMLERİ
- Kendi kendine meme kontrolleri
- Yıllık mamografi
- Doktor muayenesi
- Genetik testler
Meme kanserinden korunmak ve erken evrede meme kanserini yakalamak için meme muayenesi çok önemlidir. Göğüs kanseri, meme içinde küçük bir kitleyken müdahale edildiğinde %100’e yakın oranda başarı ile tedavi edilebilmektedir. Meme kanserini diğer kanserlerden ayıran bir başka özellik de “kanser tarama programları” içinde değerlendirilebilir oluşudur. Bu nedenle meme ile ilgili hiçbir şikayeti veya kitlesi olmayan kadınlar, tarama yöntemlerini önemsemelidir.
KENDİ KENDİNE MEME MUAYENESİ NASIL YAPILIR?
Kadınların düzenli olarak ayna karşısında her ay kendi memelerini muayene etmesi pratik bir yöntemdir. Meme muayenesi her ay adetin bitiminden 4-5 gün sonra yapılmalıdır. Menopoza girenler, rahim veya yumurtalık ameliyatı olan kadınların periyodik olarak ayda bir kez aynı günlere denk getirecek şekilde meme muayenesini yapmaları gerekmektedir. Meme muayenesinde, memesinin simetrisine, meme başında bir akıntı olup olmadığına, herhangi bir deformitenin varlığına, cilt değişikliklerine, ele bir kitlenin gelip gelmediğine dikkat edilmelidir.
3 ADIMDA MEME MUAYENESİ
Ayna Karşısında Muayene
Kollarınızı yukarı doğru kaldırın. Her iki memenizde herhangi bir düzensizlik, deri çekintisi veya çöküntüsü, meme ucunda yara, kabuklanma, meme ucunda çekilme, memede değişiklik olup olmadığını kontrol edin. Ellerinizi belinize koyarak kuvvetlice aşağı doğru bastırın. Aynı anda göğüs kaslarınızı iyice kasın. Aynadan meme derinizde çekilme olup olmadığını kontrol edin. Kontrolünüz sonucu memelerinizin birbirine eşit olmadığını görebilirsiniz. Bu, olağan bir durumdur ve hastalık belirtisi olarak görülmemelidir. Ancak şüphelendiğiniz bir oluşum varsa mutlaka doktora görünmelisiniz.
Duş Yaparken Muayene
Ayakta sol memenizi muayene ederken, sol elinizi başınızın üzerinde tutun. Sağ elinizle yukarıdan aşağıya doğru ve aşağıdan yukarıya doğru sol memenizi bastırarak muayene edin. Sağ elinizle sol memenizin dış tarafından meme başına doğru ışınsal veya daireler çizecek şekilde bastırarak muayene edin.
*Aynı işlemleri sağ memeniz için sol elinizi kullanarak yapın. Meme içinde fındık ya da ceviz büyüklüğünde farklı bir sertlik olması durumunda doktorunuza bildirin.
Sırtüstü Yatarken Muayene
Sağ memenizi muayene ederken, sağ omzunuzun altına yastık yerleştirin ve sağ elinizi başınızın arkasına koyun. Sol elinizle yukarıdan aşağıya doğru ve aşağıdan yukarıya doğru sağ memenizi bastırarak muayene edin. Sol elinizle sağ memenizin dış tarafından meme başına doğru ışınsal veya daireler çizecek şekilde bastırarak muayene edin.
*Aynı işlemleri, sol memeniz için sağ elinizi kullanarak yapın. Meme içinde fındık ya da ceviz büyüklüğünde farklı bir sertlik olması durumunda doktorunuza bildirin.
Her iki memenin, meme uçlarını nazikçe sıkın. Meme ucunda akıntı olup olmadığını; oluyorsa açık renkli mi kanlı mı olduğunu kontrol edin. Fark ettiğiniz herhangi bir şişliği, kalınlaşmayı veya akıntıyı doktorunuza bildirin.
Mamografi
Meme kanserinde erken teşhis için memesinde herhangi bir değişiklik fark etmeyen 40 yaş üzerindeki her kadın yıllık mamografi çektirmelidir. Böylece meme kanserinin ele gelen büyüklüğe ulaşmadan yakalanması mümkün olur. Bununla birlikte daha sonraki mamografi çekimlerine referans olması için 30’lu yaşlarda en az bir mamografi çektirilerek filmin saklanması önerilmektedir. Ailesinde hiç göğüs kanseri olmayanlar 35 yaşından sonra, ailesinde kanser öyküsü bulunanlar ve genetik meme kanseri riski altında olanlar ise 25 yaşından sonra ilk ultrasonografilerini yaptırmalıdır. Bu kişiler ilk ultrason yaptırdıkları yaştan itibaren her yıl düzenli olarak ultrason takibi altında olmalıdır.
Doktor Muayenesi
Meme kanserinin erken evrede fark edilmesi ve teşhisi için düzenli doktor takibi çok önemlidir. Hiçbir şikayeti olmasa bile 40 yaşından sonra tüm kadınların doktora başvurarak muayene olması gerekmektedir. “Meme kanseri teşhisi için hangi doktora gitmeliyim?” sorusu en sık araştırılan konulardandır. Meme kanseri tanı ve tedavi süreci meme kanseri konusunda uzman genel cerrahlar tarafından yürütülmektedir. Kadın sağlığı ve ya genel sağlığınız konusunda rutin takiplerinizi yürüten doktorunuz da meme kanserinin erken tanısı için gerekli tetkikleri isteyebilir.
MEME TARAMASI NE SIKLIKLA YAPILMALIDIR?
35-40 yaş arasında bir kez mamografi ve ultrasonografi yaptırmalısınız. Bu, “Temel mamografi” olarak adlandırılır. 40 yaşından sonra ise rutin mamografi taraması yaptırmanız gerekir.
MEME KANSERİ EVRELERİ
Meme kanseri yavaş ilerleyen bir kanser türüdür. 5-7 yıl içerisinde 1 cm büyüklüğe erişen tümör, önce lenf kanalları ile koltuk altı lenf bezlerine sonrasında ise kan yoluyla karaciğer ve kemik gibi uzak organlara yayılabilir. Tümörün hangi aşamada olduğu ve nerelere yayıldığını öğrenmek için evreleme yapılır ve tedaviye buna göre karar verilir. Meme kanserinde evreleme için TNM isimli bir sistem kullanılır. Buna göre T tümör çapını, N hastalıklı koltuk altı lenf bezi sayısını, M ise uzak yayılım (metastaz) durumunu belirtir. Meme kanserinde 4 evreden bahsedilebilir. Evre I, II ve bazı evre III tümörler erken evre göğüs kanseri kabul edilir. Evre III tümörlerinin bir kısmı ile evre IV tümörleri ise meme kanserinde ileri evre olarak adlandırılır. Göğüs kanserinde evreleme yaparken tümörün büyüklüğü, çevredeki lenf nodlarına yayılıp yayılmadığı göz önüne alınır. Buna göre meme kanseri evrelerini şu şekilde tanımlayabiliriz;
Evre 0 – DCIS
Evre I : Tümör 2 cm’den küçük ve henüz lenf nodlarına sıçramamış.
Evre II : Tümör 2- 5 cm arasında bir büyüklükte olup çevredeki lenf nodlarına sıçramış ya da sıçramamamış olabilir.
Evre III: Çevredeki lenf bezlerine daha fazla yayılmış demektir
Evre IV: Diğer organlara (kemik, karaciğer, beyin, akciğer) veya kemiğe, uzaktaki lenf nodlarına metastaz yapmış demektir.
MEME KANSERİ TANI VE TEDAVİSİ
Son yıllarda, meme kanserinin tedavisinde kaydedilen önemli gelişmeler ve yeni tedavi olanakları; hastalığın erken teşhisi ve tedavi ile tamamen yok edilebilmesini sağlamaktadır.
Günümüzde meme kanseri tedavisinde kaydedilen önemli gelişmeler ve yeni tedavi seçenekleri ile hastalığın teşhisi ve tedavisi daha kolay ve başarılı hale gelmiştir. Meme kanseri tedavisinde öncelik memenin korunmasına yönelik tedavisi ve uygulamalardır. Erken evrede yakalanan göğüs kanserinde meme kaybı olmadan, gelişmiş tekniklerle hastalık yayılımı önceden tespit edilerek önlem alınabiliyor ve tümöre direk olarak müdahale edilmektedir. İleri evre meme kanserinde memenin cerrahi ile alınması söz konusu olduğu durumlarda plastik cerrahi teknikleri ile meme rekonstrüksiyonu (yeni bir meme) yapılabilmektedir. Meme kanseri erken tanı sayesinde %100’e yakın bir oranda tedavi edilebiliyor.
Meme kanseri tedavisi hastanın hangi evrede olduğuna bağlı olarak değişir. Evre 0’da ameliyat sonrası kemoterapi tedavisine gerek duyulmamaktadır. Çoğu zaman radyoterapi de tedaviye eklenir. Evre I ve II ‘de kitle küçük olduğu için önce ameliyat ardından kemoterapi uygulanıp uygulanmayacağına karar verilir. Evre III’te önce kemoterapi tedavisi uygulanır ardından hasta ameliyata alınır. Evre IV’te ise eğer kanser vücudun çok fazla bölgesine yayılmadıysa cerrahi düşünülebilir. Ancak kanser yayılımı fazla ise sadece ameliyat kesinlikle önerilmez. Sadece kemoterapi ve bazen radyoterapi tedavisi uygulanır. Yakın dönemde meme kanserine özel aşıların da yakın dönemde tedavide kullanılması beklenmektedir.
Cerrahi Yöntemler
Meme kanseri cerrahisinde öncelikle amaç, tümörün geride kalmayacak şekilde çıkarılması ve koltuk altına yayılım gösteren vakalarda lenf bezlerinin tümüyle alınmasıdır.
Mastektomi
Basit mastektomi: Bu işlem, total mastektomi olarak da adlandırılır. Meme uçları dahil tüm meme alınır, ancak koltuk altı lenf bezleri veya memenin altındaki kas dokuları alınmaz. Günümüzde çok fazla tercih edilmeyen bir yöntemdir.
Cilt koruyucu mastektomi: Bazı kadın hastalarda meme, cerrahi sırasında yeniden yapılandırılabilir. Bu işleme, cilt koruyucu mastektomi olarak adlandırılmaktadır. Memenin üstündeki derinin çoğu (meme ucu çevresi (areola) ve meme ucu dahil) dokunulmadan bırakılır.
Radikal Mastektomi: Bu geniş çaplı operasyonda tüm meme, koltuk altı bezleri ve meme altındaki pektoral (göğüs duvarı) kaslar alınır. Radikal mastektomi, geçmişte oldukça sık kullanılmış olan bir yöntemdir.
Meme koruyucu cerrahi
Meme kanseri erken teşhis edildiğinde daha çok memenin etkilenmiş kısmı alınır. Ancak, alınacak kısım tümörün büyüklüğüne, yerine ve başka diğer faktörlere bağlıdır. Lumpektomide sadece memedeki kitle ve etrafındaki dokular alınır. Radyoterapi, lumpektomiden sonra uygulanan bir tedavi yöntemidir. Hastaya adjuvan kemoterapi de verilecekse, genellikle kemoterapi tedavisi tamamlanana kadar radyoterapi geciktirilir. Kadranektomide, memenin dörtte biri alınır. Cerrahi sonrası genellikle radyoterapi verilir. Yine bu yöntemde de, kemoterapi verilecekse radyoterapi geciktirilir.
Lenf bezi cerrahisi
Meme kanserinin koltuk altı lenf bezlerine yayılımını belirlemek için bir veya birden fazla lenf bezi alınarak mikroskop altında incelenir. Bu inceleme, kanserin evrelenmesi, tedavi şeklinin ve sonuçlarının belirlenmesi için önemlidir. Lenf bezlerinde kanser hücreleri bulunursa, kanserin kan dolaşımı yoluyla vücudun diğer bölgelerine yayılmış olma şansı yüksektir. Koltuk altındaki lenf bezlerinde kanser hücrelerinin varlığı, cerrahi sonrası eğer gerekli görülürse ne tür bir tedavi uygulanacağına karar verilmesinde önemli bir rol oynar.
Radyoterapi tedavisi
Meme kanserinde radyoterapi ile ameliyat sonrası koltukaltı ve meme bölgesine verilen ışınla, kalma olasılığı olan kanser hücrelerini yok etmeye hedeflenmektedir. Meme kanseri tedavisinde radyoterapi, memenin kalan dokusunu korumak amacı ile özellikle yenileme riski yüksek olan hastalarda ve meme koruyucu cerrahi yapılan hastalarda uygulanır. Meme kanseri ile mücadelede ışın teknolojisi olarak TrueBeam STx ve Elekta Versa cihazları önemli rol almaktadır.
Bu teknolojiler sayesinde göğüs kanseri alanındaki radyasyon onkolojisi uygulamalarında sadece kanserli hücrelere odaklanılmakta ve sağlıklı hücrelerin zarar görmesi önlenmektedir.
İlaç Tedavileri
Kemoterapi
Meme kanserinde kemoterapi çoğunlukla cerrahi sonrası uygulanır. Ameliyat sonrası herhangi bir kanserli hücre kalmamasına rağmen koruyucu bir önlem olarak bir süre daha kemoterapi tedavisi devam edebilir.
Hormonoterapi
Hormon tedavisinin amacı, kadın hormonlarına duyarlı meme kanseri vakalarında kanser hastasının hormon miktarını azaltmaktır. Östrojen hormonuna duyarlı olan bazı kanser hücreleri, daha hızlı büyür ve çoğalır. Bu tedavi yöntemi, östrojen etkisini ortadan kaldırarak kanserin gelişmesini önler.
Akıllı İlaçlar
Meme kanseri, farklı tedavi stratejileri ile bireye ve tümöre özgü tedavi gerektiren bir hastalıktır. Geçtiğimiz yıllarda klasik kemoterapi ilaçları ve hormon tedavileri dışında seçenekler bulunmazken, günümüzde daha yeni ve daha etkin kemoterapi ilaçları, damardan ve ağızdan hap şeklinde alınabilen hedefe yönelik akıllı ilaçlar ile yeni hormonal tedavi ilaçlarının birlikte kullanımı başarılı sonuçlar getirmektedir.
MEME KANSERİNE YAKALANMA RİSKİNİ AZALTMAK İÇİN NELER YAPILABİLİR?
Egzersiz şeklinde yapılan fiziksel aktivitenin, meme kanseri riskini azalttığına ilişkin kanıtlar artmaktadır. Haftada en az 1,25 – 2,5 saatlik hızlı yürüyüşler, kadındaki meme kanseri riskini %18 oranında azaltmaktadır. Eğer bu yürüyüş, haftada 10 saat olursa, risk oranı biraz daha azalmaktadır.
Bazı araştırmalarda, uzun süreli emzirmenin meme kanserini az da olsa azalttığını öne sürülmektedir. Araştırmalar, doğum kontrol hapı kullanan kadınların, kullanmayan kadınlara nazaran az da olsa meme kanseri riski taşıdığını göstermektedir. Hapların kullanımına son verildiğinde, risk oranı normale dönmektedir. Çok fazla hamilelik geçiren ve genç yaşta hamile kalan kadınlarda, meme kanseri riski azalır. Bunun nedeni ise, hamilelik döneminde duran adet döngüsüdür. Tedavi kararında meme kanserinin hangi alt grubu ile karşı karşıya olduğunuzu bilmek uygulanacak tedavinin başarısı açısından çok önemlidir.
MEME KANSERİ SONRASI YAŞAM
Hastaya, fiziksel yaşam kalitesi odaklı tedavi modelinin planlanması çok önemlidir. Hastaların çoğunda ameliyat (koltuk altı lenf bezleri alınması) sonrası omuz kısıtlılığı, bazen de lenf ödem ortaya çıkmaktadır. Doğru ve erken dönemde planlanan egzersiz ve rehabilitasyon programları sayesinde hastaların bu sorunları ortadan kaldırılmaktadır. Hastaların yaşam boyu süren takip programları sayesinde kalıcı omuz kısıtlılıkları ve lenf ödem ile karşılaşma ihtimalleri son derece azaltılabilmektedir.
Meme kanserini atlatan hastaların neredeyse %70’inde gözlenen cinsel ve psikolojik problemler, uzmanlar tarafından yönetilebilir ve hastalarda bu yönde gelişebilecek sorunlar ortadan kaldırılabilir. Hastalık boyunca devam edilen egzersizlere, ameliyattan kısa süre sonra tekrar başlanmalı ve düzenli olarak devam edilmelidir. Göğüs kanseri tekrarlarının çoğu ilk 3 yıl içinde görülmektedir. Bu nedenle tedavi sona erdikten sonraki 3 yıl boyunca hastaların, sağlık kontrollerini ayrıntılı bir şekilde takip etmeleri önemlidir. Meme kanserinin tekrarlama oranı %30 ameliyat alanında, %70 uzak organlarda olduğundan ihmal edilmemelidir. Hastalık boyunca devam edilen egzersizlere, ameliyattan kısa süre sonra tekrar başlanmalı ve düzenli olarak devam edilmelidir.
Kontrol muayenelerinde hastaların şikayetleri sorgulanır ve hasta ayrıntılı olarak muayene edilir. Yakınması veya şüpheli bir bulgusu olmayan hastalarda hiçbir incelemeye gerek görülmez. Ancak şüpheli bulgusu olanlarda bunları aydınlatmaya yönelik ayrıntılı tetkikler yapılır. Meme kanseri tedavisi ile birlikte hastalar öncelikle kendilerine yeni bir sayfa açmalı ve endişeden uzak yaşamalılardır. Meme kanseri tedavisi sürecinde koltuk altı lenf bezlerinin alınması ile omuz omuz kısıtlılığı, bazen de lenf ödem ortaya çıkmaktadır. Doğru ve erken dönemde planlanan egzersiz ve rehabilitasyon programları sayesinde hastaların bu sorunları ortadan kaldırılmaktadır.
Meme kanserinden kurtulan hastaların %70’nde görülen cinsel problemler için mutlaka uzman yardımı alınmalıdır. Meme kanseri ameliyatı sonrasında egzersiz, yoga, yürüyüş gibi sporlara devam edilmelidir. Meme kanserinin tekrar riski ilk 3 yıl içerisinde vardır. Bu nedenle hastalığı atlattıktan sonra sağlık kontrolleri aksatılmamalıdır. Meme kanserinin tekrarlama oranı %30 ameliyat alanında, %70 uzak organlarda olduğundan ihmal edilmemelidir.
MEME KANSERİ İLE İLGİLİ SIKÇA SORULAN SORULAR
Meme Kanseri İstatistikleri
- 2012 yılında dünyada 1.7 milyon yeni meme kanseri vakasına rastlanmıştır.
- Meme kanserinin en çok görüldüğü ilk 3 ülke Belçika, Danimarka ve Fransa şeklinde sıralanmaktadır.
- Türkiye meme kanserinin en çok görüldüğü ülkeler sıralamasında ilk 20’nin dışında yer alır.
- Meme kanseri tüm kanserlerin %12’sini oluşturmaktadır.
- Kadınlarda görülen kanserlerin %25’i meme kanseridir.
Memede Kitle ve Kist Nedir?
Memede ele gelen kitle, kist ya da solid bir kitle olabilir. Özellikle fibroadenom ve fibrokistler memede çok sık görülen kitlelerdir. Bozuk para şeklinde görülen memede kitleler kansere dönüşmeyen, iyi huylu tümörlerdir. Kadınlar kendi kendine meme kontrolü esnasında fark ettikleri bu kitlelerin meme kanseri ya da zararsız bir fibroadenom kitlesi olup olmadığını anlayamazlar. Özellikle 30 yaş altı kadınlarda hormonal değişikliklere bağlı olarak fibroadenomlar çok sık görülmektedir. Memede kitlenin karakteri meme ultrasonu ile anlaşılmaktadır. Bu nedenle kadınlar memelerinde bir değişiklik ya da kitle fark ettiklerinde en kısa zamanda uzman bir doktora görünmelidir. Meme ultrasonu ve gerek görülürse mamografi ile memedeki kitleye dair bir fikir elde edilebilir.
Memede ağrı neye işaret eder?
Memede ağrı özellikle her iki memede de hissediliyorsa öncelikle hormonal değişiklikleri ve adet döngüsünü işaret eder. Bunun yanı sıra fibroadenom ve fibro kister de memede ağrı yapabilir. Hamile kadınlarda hormonların değişimine bağlı olarak memede ağrı görülürken, emziren kadınlarda da emziremeye bağlı olarak memede ağrı gelişebilir. Meme kanserinin ileri evrelerinde tümörün büyümesine bağlı olarak ödem ve sonrasında memede ağrı oluşabilir. Ancak memede ağrı göğüs kanseri belirtisi olarak kabul edilmez.
Memede Kitle Saptandığında Neler Yapılır?
Kendi kendine meme muayesi sırasında memede farklılık ve değişiklik hissedildiğinde vakit kaybetmeden uzman doktora başvurmak gerekmektedir. Bu kitlenin ne olduğu araştırılarak teşhis konulması gerekmektedir.
Memede Saptanan Her Kitle Kanser midir?
Meme kanseri teşhisinde görülen her 10 kitlenin 8’i iyi huylu olabilir. Genç yaşlarda görülen kist denilen kanser olmayan kitleler, fibroadenom ve orta yaşlarda görülebilecek olan fibrokistik kitleler olabilir. Memedeki her kitlenin ağrılı ya da ağrısız olması kanser olduğu anlamına gelmemektedir.
Meme kanseri sürecinde besleme nasıl olmalıdır?
Meme kanseri sürecinde beslenme biçimi meme kanseri tedavisini olumlu yönde etkilemektedir. Meme kanseri hastaları meme kanseri tanısından sonra hekimden bir daha kansere yakalanmaması veya acilen iyileşmesi ve savunma sisteminin güçlenmesi için bir beslenme listesi bekler ve böyle bir liste verilmeyince de hayal kırıklığına uğrar. Hatalı haberler, alternatif tıp ürünü pazarlayan bazı özel kuruluşlar ve bireylerin hasta ve ailesinde oluşturduğu yanlış bilgi yönlendirmeleri altında; hastalar hekimlerden bazı bitkiler önermesini, yiyecekleri gıdaları tek tek oranlarına kadar yazmasını beklerler.
Yapılan araştırmalara göre kanser tanısından sonra beslenme için yapılacak özel takviyeler ancak hastanın iştahının azalması, yeterli beslenememesi ve kilo kaybetmesine neden olmaktadır. Bunun dışında beslenme uzmanları tarafından tüm bireylere önerilen “sebze ve meyve ağırlıklı, kırmızı etten fakir beyaz et oranını artıran beslenme modeli” genel durumu iyi olan ve beslenebilen birçok kanser hastası için yeterlidir. Çalışmalar göstermiştir ki, kanser tanısından sonra beslenme için yapılacak özel takviyeler ancak hastanın iştahının azalması, yeterli beslenememesi ve kilo kaybetmesine neden olmaktadır.
Meme kanseri tedavisi sürecinde tedaviye ve hastalığa bağlı devam eden kilo kaybı, ağızdan gıda alamama, ağız yaraları, uzun süren ishal, uzun süren bulantı kusma, vitamin eksikliği gibi durumlarında özel beslenme ekiplerince damardan veya ağız yolu ile özel gıdalar ve vitamin ile destekleri yapılmalıdır. Kanser hastaları, aşırı yemek ve tuzlu gıdadan kaçınmalı! Erken evre göğüs kanseri hastaları özellikle tedavileri sırasında aşırı yemek yemekten ve tuzlu gıdalardan kaçınmalı ve tedavi öncesi alerjik yan etkiyi azaltmak amacı ile kullanılan kortizonun iştahı artırıcı, kilo ve ödem yapıcı etkilerine karşı dikkatli olmalılar.
Ayrıca, bu dönemde halsiz ve güçsüz kalmama adına tüketilen bal ve pekmez gibi yüksek kalorili gıdalar hastalarda istenmeyen ve sonradan verilmesi son derece güç aşırı kilo alımlarına neden olabilmektedir. Gerek meme kanseri olsun gerekse diğer tüm kanserlerin tedavisinde bulantı kusma için Zencefil 0.5-1mg ağızdan hap şeklinde kullanımının kanıtlanmış yararı dışında onkoloji literatürüne bilimsel bir kanıt olarak girmeyi başaran bitkisel bir ürün yoktur. Bitkisel ürünler, hastalara zarar verebilir. Geçen 20 yılda popüler olan vitaminlerin kullanımı, antioksidan özellikleri ile “bizleri genç tutacak cildimizi pürüzsüz kılacak, kanser tedavileri sırasında yan etkilerden koruyacak” varsayımı ile yoğun bir kullanım alanı bulmuştur. Fakat son 5 yılda yapılan kapsamlı çalışmaların sonucunda gereksiz ve hekim önerisi dışında kullanılan vitaminlerin vücuda yarardan çok zarar verdiği hatta bazı kanser türlerinin artışına bile neden olduğu saptanmıştır. Bunun üzerine dünyada ve ülkemizde alternatif tıp pazarı ve pazarlayıcıları hedeflerini bitkisel ürünlere çevirmiştir. Ancak doğal gibi görünen bu ürünlerin de özellikle kemoterapi ve diğer tıbbi tedaviler ile istenmeyen etkileşimleri birçok hastayı ve tedavi sorumluluğunu alan hekimi zor durumda bırakmaktadır.
Fiziksel aktivite meme kanseri riskini azaltabilir mi?
Egzersiz bağışıklık sistemini güçlendirir ve kilonuzu kontrol altında tutmanıza yardımcı olur. Haftada üç saat veya günde yaklaşık 30 dakika kadar az bir egzersiz yapan bir kadında meme kanseri riskini azalabilir.
Çok şeker ve şekerli gıdalar tüketmek meme kanserine neden olur mu?
Şekerin direkt olarak meme kanseri ile bağlantısı yoktur. Meme kanserinden korunmak için ideal kilomuzda olmaya dikkat etmemiz yeterlidir.
Meme kanseri tedavisinde kalabalık ortamlardan uzak durmalı mıyım?
Meme kanseri tedavisi sürecinde kalabalık ortamlardan kaçınmak yerine daha çok sosyalleşme ve moral bulma olasılığı olan ortamlarda bulunulmalı. Tedavi sürecinde kalabalık ortamlardan mikrop kapmak gibi bir durum söz konusu değildir.
Parfüm, deodorant, lazer epilasyon, kalıcı makyaj meme kanserine neden olur mu?
Lazer epilasyon, kalıcı makyaj yaptırmak, parfüm, deodorant kullanmak meme kanserine neden olmaz.
Meme muayenesi için en doğru zaman nedir?
Meme muayenesini adet döneminin bitiminden 4-5 gün sonra yapmak gerekir.
Ailemde meme kanseri olanlar var. İlk kontrolünü ne zaman yaptırmalıyım?
25-26 yaşından sonra yıllık rutin ultrason takiplerinizi yaptırmalısınız. Genetik meme kanserlerinde ise ilk mamografi yaşı 26’dır. Ailesel göğüs kanseri riski altındaysanız 32-34 yaşlarından sonra mamografi ile takip edilmelisiniz.
Mamografinin kanser oluşumuna etkisi var mı?
Mamografinin yararı, zararının çok üzerindedir. Bu nedenle mamografinin verdiği radyasyon asla vücut için bir zarar olarak değerlendirilmemelidir. 1960’lı yıllarda çok yüksek radyasyon oranına sahip olan teknolojilerde 30 sene mamografi ile takip edilen hastalarda mamografinin zararının, yararının çok altında olduğu tespit edilmiştir. Mamografiler ise o dönem teknolojilerden 10 kat daha az radyasyon vermektedir. MR’da da radyasyon olmadığı için hastaya herhangi bir yan etkisi bulunmamaktadır.
Meme kanseri bulaşıcı mıdır?
Hiçbir kanser bulaşıcı değildir. Bir ailenin birçok bireyinde kanser görülmesi bu yanlış düşünceye sebep oluyor olabilir. Kişi kanser hastalığını başka bir kimseye bulaştıramaz. Ancak rahim ağzı (serviks), karaciğer kanseri gibi bazı kanserlerin nedenleri arasında virüsler vardır.
Sağlıklı ve dengeli beslenmek meme kanseri riskini azaltır mı?
Özellikle A ve C vitamininden zengin taze meyve ve sebze tüketmeye özen gösterilmeli, hayvansal yağlardan uzak durarak daha çok posalı gıdalar tercih edilmeli, tütsülenmiş tuzlu ve konserve yiyecekler tüketilmemeli, sigara ve alkolden uzak durulmalı, fazla kilo alınmamalıdır. Spor yapmak, meme kanseri riski yüksek kadınlarda koruyucu ilaç kullanımı, yine risk faktörü yüksek olanlarda her iki memenin içinin boşaltılması silikonla ya da kişinin kendi dokusundan meme yapılması, piyasada satılan ‘göğüs büyütücü’ adı altında satılan tablet, krem ve jellerin kullanılmaması gibi önlemlerle meme kanseri risklerini azaltmak mümkündür.
Meme kanserine yakalanma riskini azaltmak için spor yapmamın faydası olur mu?
Günlük yaşam içinde kendinize uygun sporu tercih etmelisiniz. Birçok insan için yapılabilecek spor; düzenli ve tempolu bir yürüyüştür. Bununla birlikte yüzme, bisiklete binme, pilates, yoga gibi grupla veya tek başınıza yapılabileceğiniz egzersizleri tercih edebilirsiniz.
*Sayfa içeriği sadece bilgilendirme amaçlıdır. Tanı ve tedavi için mutlaka doktorunuza başvurunuz.
NAZOFARENKS (GENİZ) NEDİR?
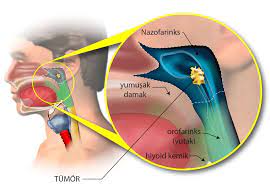
Burun boşluğu ve ağız boşluğunu birleştiren geçiş bölgesine nazofarenks ( geniz) denir. Östaki borusu ile her iki yandan da orta kulağa açılan boşluktur. Burnun içinden çıplak gözle görülen bir bölge olmadığı için burundan endoskop cihazıyla görüntülenmektedir. Ya da ağız içinden ayna denilen aletle görülebilmektedir. Çocuklarda sık görülen geniz eti de nazofarenks bölgesinde oluşmaktadır. Geniz eti vücudun savunma mekanizması olarak oluşan, iyi huylu, her çocukta sıklıkla olan lenfoid dokularıdır. Çocuklarda belli bir yaşa kadar görülen adenoid doku erişkin yaşta beklenmeyip, erişkin kişide nazofarinkste lenfoid doku izlenmişse mutlaka biyopsi alınıp patolojik incelemeye gönderilmelidir.
NAZOFARENKS KANSERİ NEDİR?
Nazofarensk bölgesinde oluşan kanserlere nazofarenks kanseri denmektedir. Sık görülen kanser türleri arasında yer almaktadır. Nazofarenks bölgesinde iyi huylu( benign) tömürler ve kötü huylu (malign) tömürler oluşabilmektedir. Eğer hasta bir erişkinse bu bölgede geniz eti oluşumu beklenmemektedir. Erişkin hastanın nazofarenks bölgesinde bir lezyon ya da kitle bulunuyorsa mutlaka bir inceleme yapılmalıdır. Erişkin grubunda sık olarak nazofarenks karsinomları görülmektedir. Ayrıca erişkinlerde lenfoma ve lösemi de bu bölgede sık olarak tutulum gösterebilmektedir. Çocuklarda erişkinlerden farklı olarak nazofarenks bölgesinde yumuşak doku (raptomiyosarkom) kanseri ya da iyi huylu olan anjiofibrom ya da plazmasitom de görülebilmektedir.
Nazofarenks kanserinin 3 tipi bulunmaktadır.
Tip 1 Skuamöz cell nazofarenks karsinom ( SCC)
Tip 2 Keratinize olmayan iyi diferansiye nazofarenks karsinom
Tip 3 İndiferansiye nazofarenks karsinom
Tedaviye en çabuk cevap veren nazofarenks kanseri tip 3’tür. Tedavi edildikten sonra tekrar görülme olasılığı düşüktür. Tip 1 skuamöz cell nazofarenks karsinom ise tedavi olduktan sonra tekrarlayabilmektedir.
Ayrıca lösemi ve lenfoma kanserleri de nazofarenks bölgesinde sık olarak tutulum gösterebilmektedir. Bu sebeple nazofarenks bölgesinde görülen şüpheli dokulardan mutlaka örnek alınıp patolojik incelenmesi yapılmalı ve dokunun iyi huylu mu yoksa kanser riski olan bir doku mu olduğu belirlenmelidir.
NAZOFARENKS KANSERİNİN NEDENLERİ NELERDİR?
Nazofarenks kanserlerinde birden fazla etken rol oynayabilmektedir. Çevresel faktörler( hava kirliliği, kimyasal buhara maruz kalmak) genetik yatkınlık ve virüsler bu etkenler arasında yer almaktadır.
En sık ergenlik döneminde ortalama 40-50’ li yaşlarda görülen nazofarenks kanseri erkekleri daha fazla etkilemektedir.
Kişinin ailesinde nazofarenks kanserinin görülmesi yine riskini artırmaktadır.
Epstein Barr virüs ( EBV) yakından nazofarenks kanseriyle ilişkilidir. EBV pozitif kişilere mutlaka bir nazofarenks muayenesi yapılmalıdır.
Sigara içen kişilerde yine nazofarensk kanseri görülme sıklığı daha fazladır.
Beslenme alışkanlıkları da nazofarenks kanseri nedenleri arasında yer almaktadır. Kötü beslenme alışkanlıkları, tütsülenmiş gıdaların fazla tüketimi, odun ateşinde yemek pişirilmesi bu hastalığın görülme olasılığını artırmaktadır.
NAZOFARENKS KANSERİNİN BELİRTİLERİ NELERDİR?
En yaygın belirtiler arasında boyunda kitleler gelir. Erişkinlerde yine en sık görülen belirtiler arasında tek taraflı orta kulak iltihapları bulunur. Östaki borusu her iki taraftan nazofarenkse açılmaktadır. Kitle bu bölgelerden herhangi birini kapattığında kulak havalanması bozulduğu için tek taraflı orta kulak iltihaplanmaları meydana gelebilmektedir. Erişkinlerde meydana gelen tek taraflı kulak enfeksiyonlarında mutlaka nazofarenks muayenesi yapılmalı ve bu bölgede bir kitle olup olmadığına bakılmalıdır. Genel olarak hastalar nazofarenks kanserinde;
Boyunda lenf bezi, kitle
Burun tıkanıklığı
Burun kanaması
Geçmeyen orta kulak enfeksiyonu
Kulak uğultusu ve kulak tıkanıklığı
Kranial sinir tutulumlarına bağlı görme sıkıntıları ve ağrı şikayetleri ile doktora başvurabilir.
NAZOFARENKS KANSERİNİN TANISI NASIL KONUR?
Nazofarensk bölgesinde var olan şüpheli bir durumda ilk olarak fizik muayene yapılmaktadır. Daha sonra gerekirse tomografi, MR ve Pet CT gibi görüntüleme tekniklerinden de yararlanılmaktadır.
Nazofarensk bölgesi burun içinden endoskop cihazıyla ya da ağız boşluğundan ayna ile görülebilmektedir. Normalde nazofarenks
bölgesi düz bir yapıdadır. Eğer bu bölgede bir kitle, kabarıklık ya da farklılık varsa kulak burun boğaz uzmanı bu bölgeden biyopsi almalıdır. Nazofarenks kanseri bazen de boyunda tutulumlar yapabilmektedir. Bu tutulumlar ilaçlı tomografi ya da PET CT sonucu net olarak belirlenebilmektedir. Nazofarenks kanserinde kesin tanı biyopsi ile konmaktadır. Yapılan biyopside kitlenin tipi belirlenmektedir. Nazofarenks kitlelerinde tedavi kitlenin tipine göre belirlenmektedir; iyi huylu tümörler cerrahi olarak çıkartılabilir yada takip edilebilir, eğer sonuç nazofarenks kanseri olarak geldi ise tedavi seçeneği öncelikli radyoterapi + kemoterapidir.
NAZOFARENKS KANSERİNİN TEDAVİSİ NASILDIR?
Yapılan biyopsi sonucunda tipi belirlenen kitlenin tedavisi de bu doğrultuda yapılmaktadır. Nazofarensk kanserinde tedavi genellikle radyoterapi + kemoterapi ile yapılmaktadır. Özellikle Tip 3 İndiferansiye karsinom radyoterapiye çabuk cevap veren bir türdür. Erken tanı ve düzenli takip ile tedavi başarılı sonuçlar vermektedir.
Lenfoma ve lösemi hastalıkları da nazofarensk bölgesinde tutulum yapabilmektedir. Bu hastalıkların tedavisinde de radyoterapi ve kemoterapi kullanılmaktadır.
Nazofarenks kanseri erken evrede yakalanamaz ve tedavi edilmezse, geç aşamalarda metastaz yapabilmektedir. Nazofarenks bölgesi beyne yakın bir bölge olduğu için kafa tabanı ve sinir tutulumları sık görülebilmektedir. Özellikle 6. 3. 4 ve 5. sinirleri tutabilmektedir. Kafanın arka tabanına ve sinirlere metastaz yaptığında hasta çift görmeler yaşayabilir ya da düşebilmektedir.
Hastanın yaşı ve cinsiyeti tedavinin gidişatını etkileyen faktörler arasında yer almaktadır. Erkekleri daha fazla etkileyen nazofarenks kanserinde ileri yaş, boyun bölgesinde lenf nodu tutulumları, kafa bölgesindeki sinir tutulumları ve Epstein Bar virüsün neden olmadığı kanser tipleri tedavinin seyrini olumsuz etkileyebilmektedir.
NAZOFARENKS KANSERİ HAKKINDA SIK SORULAN SORULAR
Nazofarenks tedavisi ne kadar sürmektedir?
Nazofarenks tedavisi kitlenin tipine göre, iyi huylu yada kötü huylu tümör olup olmadığına göre, cerrahi, ya da radyoterapi ya da kemoterapi ile tedavi edilmektedir. Tedaviye kulak burun boğaz uzmanları ve onkoloji uzmanları karar vermektedir. Bu tedavilerden sonra hasta kulak burun boğaz hastalıkları ve onkoloji uzmanı tarafından düzenli olarak takip edilmelidir. Tedaviden sonra ilk 5 yıl çok önemlidir.
Geniz ( nazofarenks) bölgesi neresidir?
Burun boşluğu ve ağız boşluğunu birleştiren geçiş bölgesine nazofarenks ( geniz) denir. Östaki borusu ile her iki yandan da orta kulağa açılan boşluktur.
Geniz eti nedir?
Geniz eti, nazofarenks bölgesinde oluşmaktadır ve çocuklarda sık görülmektedir. Vücudun savunma mekanizması olarak oluşan, iyi huylu, lenfoid dokulara geniz eti denmektedir. Çocuklarda belli bir yaşa kadar görülen bu dokular normal doku olarak kabul edilir.
*Sayfa içeriği sadece bilgilendirme amaçlıdır. Tanı ve tedavi için mutlaka doktorunuza başvurunuz.
OMURGA VE OMURİLİK TÜMÖRÜ NEDİR?
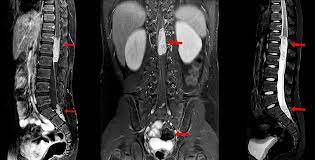
Omurilik kafatasından çıktıktan sonra belde kuyruk sokumuna kadar omurga kemiklerinin içerisinde ilerlemektedir. Omuriliğin kendisinde veya çevresini kaplayan zar yapıda iyi veya kötü huylu tümörler oluşabilmektedir. “Omurilikte tümör ne demek?”, “Omurilik soğanı tümörü nedir?”, “Omurilik sinirinde tümör ne demek?” gibi sorular hastalar tarafından merak edilen konular arasındadır. Omurilik soğanı tümörü omurga ve omurilik tümörlerinden farklı olarak beynin içinde gelişen tümörlerdir. Omurga ve omurilikte görülen tümörler iyi huylu olabildiği gibi kötü huylu tümörler de olabilmektedir. Omuriliği saran omurgada gözüken tümörlerin büyük bir çoğunluğu metastaz sonucu oluşan tümörlerdir. Meme kanseri, akciğer kanseri, prostat kanseri omurgaya en çok metastaz yapan kanserler olarak ön plana çıkmaktadır.
OMURGA VE OMURİLİK TÜMÖRÜ BELİRTİLERİ NELERDİR?
“Omurga ve omurilik kanseri belirtileri nelerdir?” , “Omurga ve omurilik tümörü etkileri nasıl ortaya çıkar?”, “Omurga ve omurilik tümörü ilk belirtileri nelerdir?”, “Omurga ve omurilik tümörü belirtileri nasıl anlaşılır?” , “Sırta tümör nasıl anlaşılır?”, “Belde tümör nasıl anlaşılır?” gibi sorular hastalar tarafından merak edilen konular arasındadır.
Omurga ve omurilik kaynaklı tümörlerde belirtiler ani başlangıçlı olabileceği gibi yavaş yavaş da ilerleyebilmektedir.
- Omurga ve omurilik tümörünün ilk belirtisi, bacaklarda güçsüzlük olarak ortaya çıkabilir. Omuriliğin kendi tümörü ya da metastaz şeklinde omurgada gelişen tümörlerde omuriliğin sıkışmasına bağlı olarak çok büyük oranda bacaklarda kuvvetsizlik ortaya çıkmaktadır. Tedavi edilmeyen hastalarda bu güçsüzlük ilerleyebilmektedir.
- Ani başlangıçlı omurga ve omurilik tümörü belirtisi birden bire yaşanan kuvvetsizlik hissidir. Felç, bacakların tutmaması gibi belirtiler çok hızlı bir şekilde ortaya çıkabilir.
- Hastanın idrar ve büyük abdestini kaçırması gibi tuvalet sorunları omurga ve omurilik tümörü belirtisi olabilmektedir. Omurga ve omurilik tümörünün ilk belirtileri genellikle bel fıtığı ile benzerlik gösterebildiği için gözden kaçırılabilmektedir.
- Omurga ve omurilik tümörlerini yavaş ilerleyen belirtilerinde ise ağrı ön plana çıkmaktadır. Hastanın belinde yaşanan ağrı gün geçtikçe ilerleyebilmektedir. İyi muayene edilmeyen bel ağrılarında omurga veya omurilik tümörü gözden kaçırabilir.
- Omurga ve omurilik tümörlerinde belirtileri yavaş ilerlediği durumlarda tümörün geçmişi 5 yıl öncesine bile dayanabilmektedir.
- Genellikle omurga üzerinde görülen metastaz kaynaklı tümörle bu belirtilerin yanı sıra kanserin ana odağına bağlı belirtiler de yaşanabilmektedir. Kilo kaybı, bulantı – kusma, iştahsızlık gibi belirtiler metastaza neden olan kansere göre farklılık gösterebilmektedir.
- Omurga tümörlerinde kemik tutulumu varlığında omurganın sağlamlığının bozulmasına bağlı olarak ağrı ve kuvvetsizlik gibi belirtiler ortaya çıkabilmektedir.
- Tümörün omurilik üzerinde oluşturduğu basıya bağlı olarak yaşanan uyuşukluk hissi, omurga ve omurilik tümörü belirtisi olabilir.
Çocuklarda omurga ve omurilik tümörü belirtileri genel olarak şu şekildedir:
Çocuklar yetişkinlere göre şikayetlerini daha belirgin dile getiremedikleri için ağrı, güçsüzlük gibi şikayetler dikkate alınmalıdır. Çocukların söyledikleri her ağrı veya güçsüzlüğü omurga veya omurilik tümörü olarak değerlendirmemekle birlikte;
- Tuvalet eğitimini almış bir çocuk tekrar altını ıslatmaya başlıyorsa omurga ve omurilik tümörü belirtisi olarak gerekli tetkiklerin yapılması önemlidir. .
- Normal bir şekilde yürüyen, koşan, oynayan bir çocuğun düşmeye başlaması yalpalayarak yürümesi de omurga ve omurilik tümörü belirtisi olabilmektedir.
Çocuklarda yaşanan ağrılar büyüme ağrıları ile karıştırılabilir.
OMURGA VE OMURİLİK TÜMÖRÜ NEDENLERİ NELERDİR?
“Omurga ve omurilik tümörü neden olur?”, “Omurga ve omurilik tümörü neden oluşur?”, “Omurga ve omurilik tümörü sebepleri nelerdir?”, “Omurga ve omurilik tümörü nasıl olur?” gibi sorular merak edilen konular arasındadır. Omurilik tümörlerini nedenleri tam olarak bilinmemektedir. Fizyopatolojileri tam olarak bilinmemekle birlikte genetik nedenlerden oluşabildiği düşünülmektedir. Omurga tümörlerinin büyük bir çoğunluğu ise metastazik tümörlerdir. Metastazların en çoğu akciğer ve meme kanseridir.
OMURGA VE OMURİLİK TÜMÖRÜ TEŞHİSİ NASIL YAPILIR?
“Omurga ve omurilik tümörü nasıl anlaşılır?” sorusu hastalar tarafından sorulan sorular arasındadır. Genel olarak omurga ve omurilik tümörü teşhisi radyolojik görüntülemeler ve biyokimyasal kan testleriyle konulmaktadır.
Omurga ve omurilik tümörü teşhisi için doktor muayenenin ardından bir takım radyolojik görüntülemeler isteyebilir,
- Radyografi yani röntgen
- Kemik taraması sintigrafi
- Bilgisayarlı Tomografi (BT)
- Manyetik Rezonans (MR)
- Tümörün yüzeye yakın olduğu durumlarda hangi dokulardan kaynaklandığı veya metastaz olup olmadığını belirleyebilmek için iğne aspirasyonuyapılabilir. Bu yöntemle alınan parça patolojiye gönderilerek tedavi şekillendirilebilir.
- Omurga ve omurilik tümörü belirtileri olan hastalarda başka bir tümör varlığını belirleyebilmek için kan testleri yapılmaktadır.
Radyolojik tetkiklerin kontrast madde denilen özel bir ilaçla yapılması tümörün hangi bölgede yerleştiğinin yanı sıra büyüklüğü ve bası yaptığı sinirleri de net olarak ortaya koyabilmektedir.
Çocuklarda omurga ve omurilik tümörünün teşhisinde sedasyon veya genel anestezi kullanılmalıdır. Çocukların Manyetik Rezonans (MR) veya Bilgisayarla Tomografi (BT ) içerisinde hareketsiz durması zor olduğu için bu yöntem tercih edilmektedir.
OMURGA VE OMURİLİK TÜMÖRÜ TEDAVİSİ NASIL YAPILIR?
“Omurga ve omurilik kanseri iyileşir mi?” , “Omurga ve omurilik tümörü tedavisi nasıldır?”, “Omurga ve omurilik tümörü tedavileri nelerdir?”, “Omurga ve omurilik kanseri tedavisi var mıdır?” gibi sorular merak edilen konular arasındadır.
- Omurga ve omurilik tümörlerinin tedavisinde genel olarak; cerrahi yöntem, radyoterapi ve kemoterapi tedavileri kullanılmaktadır. Uygulanacak tedavi seçenekleri ve sırası hastaya, tümörün cinsine, bulunduğu lokasyona göre farklılık gösterebilmektedir. Tedaviye başlamadan önce planlama çok önemlidir. Hastanın durumu, tümörün büyüklüğü ve bulunduğu bölgeye göre tedavi şekillenebilir. Bazı hastalarda önce radyoterapi ve kemoterapi uygulanırken bazı hastalarda cerrahi tedavi ön plana çıkmaktadır.
- Omurga ve omurilik tümörlerinin tedavisi; tıbbı onkoloji, radyasyon onkolojisi, beyin cerrahi, girişimsel radyoloji, nörocerrahi konusunda deneyimli anestezi uzmanlarının da bulunduğu farklı branşlardan oluşan multidisipliner bir yaklaşım içerisinde gerçekleştirilmektedir.
- Omurga ve omurilik tümörü tedavisine başlarken hastanın omurgasını sağlamlığıyla ilgili sorun olup olmadığı değerlendirilmelidir. Tümör nedeniyle omurgada kırıklar oluşabilir, hem tümör dokusu hem de oluşan kırık omuriliğe baskı uygulayabilir. Öncelikle hastanın omurga yapısının sağlamlığı sağlanmalıdır. Omurganın sağlamlaştırılması ve hastanın sosyal yaşamını mümkün olduğu kadar sorunsuz sürdürebilmesi için halk arasında platin olarak bilinen aslında titanyum olan vidalama ameliyatı uygulanabilir.
- Metastaz yoluyla oluşan omurga tümörlerinde hastanın primer kanserinin kontrol altında olup olmadığı değerlendirilmelidir. Hastanın beklenen yaşam süresi uzunsa omurga ve omurilikte ortaya çıkan tümör için daha etkili tedaviler gündeme gelebilmektedir.
- Genel olarak metastaz şeklinde ortaya çıkan omurga tümörlerinin küçük bir grubunda tümörün tamamı çıkartılabilmektedir. Tamamı çıkartılamayan metastatik omurga tümörlerinde hastanın sosyal yaşamını daha rahat sürdürebilmesini sağlayacak radyoterapi ve kemoterapi gibi yöntemler kullanılabilmektedir.
- Omuriliğin kendisinden kaynaklanan tümörlerde; tümörün ne kadar agresif olduğundan ziyade yerleşim yeri çok önemlidir. Boyunda yerleşmiş omurilik tümörünün ameliyatıyla kuyruk sokumundaki omurilik tümörünün cerrahisi arasında çok fark bulunmaktadır. Boyun bölgesine yakın ameliyatlar solunum felci gibi ciddi riskler bulunmaktadır.
- Omurga ve omurilik tümörlerinin tedavisinde, cerrahi öncesi veya sonrası ileri teknoloji radyoterapicihazları kullanılabilmektedir. Genellikle iyi huylu tümörlerin gelişmesini yavaşlatmak, büyümesini durdurmak ve geriletmek konusunda olumlu sonuçlar alınabilmektedir.
- Omurga ve omurilik tümörlerinin cerrahisi çok hassastır. Bütün vücudu çalıştıran sinirlerin bulunduğu bir bölge olduğu için omurilik tümörlerinin ameliyatında ileri teknoloji kullanılmalıdır. Bu tür riskli ameliyatlarda kullanılan Nöromonitörizasyon olası komplikasyonları minimuma indirebilmektedir.
- Omurga ve omurilik tümörleri ameliyatında tümörün tamamının çıkartılması her zaman mümkün olmayabilmektedir. Tümörün tamamının çıkartılması hastaya zarar verecekse tümörün tamamının çıkartılmasından kaçınılmalıdır. Maksimum düzeyle tümör çıkarılarak radyoterapi ve kemoterapi gibi seçenekler düşünülmelidir.
OMURGA VE OMURİLİK TÜMÖRLERİ HAKKINDA SIK SORULAN SORULAR
Omurga ve omurilik tümörü çeşitleri nelerdir?
Omurga ve omurilik tümörleri köken aldığı dokular göz önüne alınarak sınıflandırılabilir.
- Nöronlardan yani sinirlerden kaynaklanan tümörler omuriliğin kendisinden kaynaklanan tümörlerdir.
- Omuriliği çevreleyen doku ve zarlardan kaynaklanan tümörler.
- Omurgadan yani kemik yapıdan kaynaklanan tümörler olabilir.
Omuriliğin kendi içinden kaynaklanan tümörler ise genellikle ikiye ayrılmaktadır
- Astrositom
- Ependimom
Omurga ve omurilik tümörü nerede çıkar?
Omurilik beyinden çıktıktan sonra omurganın içerisinde kuyruk sokumuna kadar ilerlemektedir. Omurga ve omurilik tümörleri bu eksen üzerinde her yerde ortaya çıkabilmektedir. Boyun omurgası veya boyun omuriliğinde, göğüs kafesini çevreleyen omurlarda ve bu bölgedeki omurilik sinirleri üzerinde aynı zamanda bel bölgesinde kuyruk sokumuna olan kısımda omurga ve omurilik tümörleri görülebilir. Omurga üzerinde görülen tümörlerin büyük bir kısmı metastaz sonucu oluşan tümörlerdir. Omurilik tümörlerinin bir kısmı belirli bölgelerde daha çok görülebilmektedir. Erişkinlerde görülen omurilik içi tümörlerin bazı tipleri boyun bölgesinde daha sık görülürken çocuklarda göğüs ve bel bölgesindeki omurilikte görülebilmektedir.
Omurga ve omurilik tümörü ameliyatı nasıl yapılır?
- Omurga ve omurilik tümörü ameliyatları mikrocerrahiyöntemiyle açık cerrahi olarak yapılmaktadır. Omurga ve omurilik tümörü ameliyatında endoskopik yöntem tercih edilmemektedir. Endoskopik ameliyatlarda iki boyutlu görüntü elde edildiği ve çok küçük bir alana müdahale edildiği için omurga ve omurilik tümörü ameliyatlarında acık cerrahi daha başarılı sonuçlar vermektedir.
- Öncelikle omurga veya omurilik tümörü ulaşılabilirlik bakımından yakın bir bölgedeyse iğne aspirasyonyöntemiyle parça alınarak biyopsi yapılmaktadır. Bu sayede tümörün türü hakkında bilgi sahibi olunur.
- Omurga sağlamlığı kontrol edilir. Omurilik üzerinde baskı olup olmadığı değerlendirilir. Omurga sağlamlığını sağlamak için gerekirse omurga vidalama denilen yöntem kullanılmaktadır.
- Omurga tümörü metaztazlarında hastaların en büyük sorunu ağrıdır. Bazı hastalarda tümörü ameliyat etmek mümkün olmayabilmektedir. Bu durumlarda hastanın ağrısını kesmeye yönelik cerrahi yöntemler uygulanabilir.
- Omurilik kendisinden kaynaklanan tümörlerde mikrocerrahi yöntemler kullanarak açık cerrahi yöntemle tümör çıkartılır. Omurga ve omurilik tümörü ameliyatında mümkün olan en ileri teknoloji kullanılarak oluşabilecek riskler minimuma indirilmelidir. Bu ameliyatlarda kullanılan Nöromonitörizasyon cihazı ameliyat sırasında riskli bölgelr konusunda beyin cerrahını uyarmaktadır.
- Omurga ve omurilik tümörü ameliyatında çıkartılan dokular patolojiye gönderilerek tedavi şekillendirilir.
Omurga ve omurilik tümörü ameliyatı kaç saat sürer?
Omurilik tümörü ameliyatı yaklaşık 4-5 saat sürmektedir. Bazı tümörlerde omurganın çıkarılıp tekrar sağlamlaştırılması gibi cerrahi yöntemler uygulanabilmektedir. Tümörün bulunduğu lokasyon, büyüklüğü ve cinsine göre ameliyatın süresi 12-15 saate kadar çıkabilmektedir. Yine aynı şekilde tümörün bulunduğu lokasyon ve büyüklüğüne göre ameliyatta beyin cerrahına kalp cerrahı, genel cerrah ya da ürologlar da eşlik edebilmektedir.
Omurga ve omurilik tümörü ameliyatı riskleri nelerdir?
- Omurga ve omurilik tümörleri kanamaya eğilimli tümörlerdir. Bazı durumlarda cerrahi işlem sırasında kanamayı azaltmak için ameliyattan önce girişimsel radyoloji uzmanları damar için işlemler uygulayabilmektedir. .
- Bütün ameliyatlarda olduğu gibi omurga ve omurilik tümörü ameliyatlarında da enfeksiyon riskibulunmaktadır.
- Özellikle yaygın tümörlerde iç organ hasarı, büyük damarlarda hasarlanma, böbreklerde ya da idrar yollarında yaralanma riskler ortaya çıkabilir.
- Felç olma omurga ve omurilik tümörü ameliyatlarında yaşanabilen riskler arasındadır. Ancak ameliyatlarda kullanılan ileri teknoloji ile bu risk minimuma indirilmektedir.
- Sinirlerin etkilenmesi sonucu idrar kaçırma, büyük abdesti tutamamak gibi sorunlar görülebilmektedir.
Omura ve omurilik tümörü ameliyatı sonrası ağrılar yaşanır mı?
Omurga ve omurilik tümörü ameliyatlarından sonra hastalar şiddetli ağrılar yaşayabilmektedir. Ancak ameliyat öncesinde bu durum göz önüne alınarak kuvvetli ağrı kesicilerin kullanılması planlamaya alınır.
Omurga ve omurilik tümörü ameliyatı olunmazsa ne olur?
Omurga ve omurilik tümörü ameliyatı olmamak veya diğer tedavileri ertelemek tümörün ilerlemesine neden olur. Omurga ve omurilik tümörüne bağlı belirtiler gün geçtikçe ilerler. İlk başlarda bir bacakta ağrı şikayetiyleortaya çıkan tümör daha sonra diğer bacağı da etkileyebilir. Tümöre bağlı şikayetler ardışık olarak ortaya çıkmaya başlar ve süreç felç yaşanmasına kadar ilerleyebilir. Tümörün bulunduğu bölgeye göre felç boyundan veya belden aşağı kısımları etkileyebilir.
Omurga ve omurilik tümörü bitkisel tedavisi var mıdır?
Omurga ve omurilik tümörlerinin bilimsel anlamda kanıtlanan bitkisel yada doğal bir tedavisi bulunmamaktadır.
Omurga ve omurilik tümörü ameliyatı sonrası nelere dikkat edilmelidir?
- Omurga ve omurilik tümörün ameliyatından sonra yapılacak patolojik işlemle tümörün cinsi belirlenmeli ve hastaya buna göre bir tedavi protokolü uygulanmalıdır. Cerrahi işlemden sonra kontrollerin ihmal edilmemesi önemlidir.
- Kullanılması gereken ilaçlar ihmal edilmemelidir.
- Beslenme konusunda protein, karbonhidrat ve yağ bakımından dengeli bir beslenmeye özen gösterilmelidir.
- Yara bakımı ve yaranın temiz tutulması enfeksiyonriski bakımından önemlidir.
Omurga ve omurilik tümörü ameliyatı için hangi bölüme gidilmelidir?
Hastaların merak ettiği bir diğer konu ise omurga ve omurilik tümörü ameliyatları için hangi bölüme gidilmesidir. Omurga ve omurilik tümörü belirtileri genellikle bel fıtığı ile karıştırılabilir. Bu nedenle hastalar zaten ortaya çıkan belirtiler nedeniyle beyin, sinir ve omurilik cerrahi bölümüne gitmektedir. Omurga ve omurilik tümörü ameliyatı için de gidilmesi gereken bölüm aynıdır. Omura ve omurilik tümörü ameliyatlarında hem ameliyat sırasında hem de ameliyattan sonra yaşanabilecek sorunları minimuma indirebilmek için bu konuda donanımlı hastanelerin tercih edilmesi gerekir.
Omurilik tümörü ameliyatı sonrası iyileşme ne kadar sürer?
Omurga ve omurilik tümörü ameliyatlarından sonra iyileşme tümörün cinsi, bulunduğu bölge hastanın tedaviye verdiği yanıta göre değişkenlik gösterebilir. Genel anlamda omurga ve omurilik tümörü ameliyatlarından yaklaşık 3 hafta sonra hastalar sosyal yaşamlarına geri dönebilirler.
İyi huylu omurilik tümörü tedavisi nasıldır?
İyi huylu omurilik tümörün tedavisinde kemoterapi ve radyoterapi uygulanmamaktadır. İyi huylu omurilik tümörlerinin büyük bir kısmı cerrahi olarak tamamen çıkartılabilmektedir. Bu hastalarda ameliyattan sonra herhangi başka bir tedaviye gerek kalmadan hastalar normal yaşantılarına devam edebilirler. Ancak bazı genetik hastalıklardan kaynaklanan omurga ve omurilik tümörlerinde birden fazla tümör ortaya çıkabilir. Bu tür durumlarda tümör sayısı yıllar içinde artış gösterebilmektedir. Tümör cerrahi işlemle çıkartılma bile belli bir zaman sonra tekrar oluşabilmektedir.
Omurga ve omurilik tümörü tehlikeli midir?
“Omurga ve omurilik tümörü ölümcül müdür?”, “Omurga ve omurilik tümörü ölüm riski var mıdır?”, “Omurga ve omurilik kanseri kaç yıl yaşar?”, “Omurga ve omurilik tümörü öldürür mü?”, “Omurga ve omurilik kanseri ne kadar yaşar?”, “Omurga ve omurilik kanseri yaşam süresi ne kadardır?” gibi sorular hastalar tarafından merak edilen konular arasındadır.
Omurga tümörleri genellikle farklı bir kanserden kaynaklanan metastaz tümörleridir. Bu hastalarda tedaviye verilen yanıta bağlı olarak hastadan hastaya farklılık gösteren durumlar söz konusudur.
Beyin tümörlerinde hızlı yayılım gösterdiği durumlarda hastanın kaybedilmesi mümkündür ancak omurilik tümörleri bu bakından diğer tümörlerden farklılık gösterir. Omurilik tümörü beyne, kalbe ya da solunum merkezine yakın bir bölgeye yerleşmişse ölüm riski bulunabilmektedir. Ancak bunu dışında omurilik tümörleri hastanın ölümüne değil tedavi edilmezse zaman içerisinde felç geçirmesine neden olabilmektedir. Hasta omurilik tümörü olsa da hayatını devam ettirebilir ancak gerekli tedavileri almazsa zaman içerisinde uzuvlarını kullanamamak ve tümörün bulunduğu bölgeye göre boyundan ya da belden aşağı felç riskiyle karşı karşıyadır.
Omurilik tümörü metastaz yapar mı?
Omurilik içinde gelişen tümörler genellikle metastaz yapmazlar. Çocukluk çağı bazı beyin tümörleri beyin omurilik sıvısının dolanım yolu üzerindeyse omuriliğe doğru tümör akışı olabilir. Ancak omuriliğin kendinden kaynaklana tümörler genellikle metastaz yapmazlar.
Omurga ve omurilik tümörü bacak ağrısı yapar mı?
Omurga ve omurilik tümörünün ilk belirtisi genellikle bacak ağrısı veya bacaklarda kuvvetsizlik olarak ortaya çıkar. Gerekli tedavinin uygulanmadığı durumlarda zaman içerisinde sorun her iki bacağa da yayılabilir.
Omurga ve omurilik tümörü baş ağrısı yapar mı?
Omurga ve omurilik tümörlerinin yarattığı şikayetlergenellikle tutulum gösterdiği bölgeyle ilgilidir. Bu nedenle omurga ve omurilik tümörleri baş ağrısına neden olmazlar.
Omurilik kanseri evreleri nelerdir?
Omurga ve omurilik tümörlerinin evrelemesi diğer kanserlerde olduğu gibi genel olarak 4 evredir.
Omurga ve omurilik tümörü felç yapar mı?
Omurga ve omurilik tümörleri felce neden olabilmektedir. Özellikle tedavi edilmeyen veya tedavisinde geç kalınan omurga ve omurilik tümörleri zaman içerisinde felce neden olabildiği gibi aniden gelişerek de felç yapabilirler. Omurga ve omurilik tümörünü bulunduğu bölgeye göre felç boyundan aşağı ya da belden aşağı şekilde gelişebilir.
Omurga ve omurilik tümörü fizik tedavi uygulanır mı?
Omurga ve omurilik tümörlerinin tedavisinde destekleyici olması bakımından fizik tedavi uygulanabilir. Ameliyattan sonra hastalarda el veya ayaklarında fonksiyon kaybı yaşanmışsa fiziksel tedavi ile olumlu sonuçlar alınabilmektedir.
Omura ve omurilik tümörü ışın tedavisi uygulanır mı?
Omurga ve omurilik tümörü tedavisinde radyoterapi yani ışın tedavisi kullanılabilir. Bu hastanın ve tümörün durumuna göre farklılık gösterebilir. Bazı hastalarda cerrahi işlem öncesi radyoterapi kullanılırken bazı hastalarda ameliyat sonrası tercih edilebilir. İleri teknoloji radyoterapi cihazları ile olumlu sonuçlar alınabilmektedir.
Omurga ve omurilik tümörü ilaç tedavisi uygulanır mı?
Omurga ve omurilik tümörü tedavisinde iki şekilde ilaç kullanmak mümkündür. Tedavi planlamasında kemoterapi uygulanacaksa bu konuda uzman onkoloğunvereceği ilaçları yanı sıra yaşanan ağrılara yönelik de ilaç kullanılabilir.
Omurga ve omurilik tümörü kan tahlilinden belli olur mu?
Genellikle metastaz kaynaklı olan omurga tümörleri kan tahlilinden belli olabilir ancak omuriliğin kendisinden kaynaklanan tümörler kan tahliliyle belli olmamaktadır. Bu tümörlerde teşhis için Manyetik Rezonans (MR), Bilgisayarlı Tomografi (BT) gibi radyolojik yöntemler kullanılır.
Omurga ve omurilik tümörü tekrarlar mı?
Genetik yatkınlığı olan bazı iyi huylu omurilik tümörleri tekrarlar. Kötü huylu tümörler de bulunduğu bölgede tekrarlayabilir.
Omurga ve omurilik tümörü hastalarında ağrılar için neler yapılabilir?
Omurga ve omurilik tümörleri hem ameliyat öncesi hem de ameliyat sonrası kuvvetli ağrı kesicilerle ağrı kontrol altına alınmaya çalışılır. Ancak bazı hastalarda ağrı kesiciler ile giderilemeyen ağrılar için ağrıya neden olan sinirin kesilmesine dayanan cerrahi işlemler uygulanabilir. Hasta bu durumda normal hayatına devam edebilmekte ancak ağrıyı hissetmemektedir.
*Sayfa içeriği sadece bilgilendirme amaçlıdır. Tanı ve tedavi için mutlaka doktorunuza başvurunuz.
YEMEK BORUSU (ÖZOFAGUS) KANSERİ NEDİR?
Boyundan başlayıp mideye kadar uzanan yaklaşık 25-30 cm uzunluğundaki yemek borusunda meydana gelen kanserler yemek borusu kanseri veya özofagus kanseri alarak isimlendirilir.
YEMEK BORUSU KANSERİ (ÖZOFAGUS) BELİRTİLERİ NELERDİR?
Yemek borusu yani özofagus kanserinin en önemli belirtisi yutma güçlüğüdür. Yemek borusu kanseri belirtileri arasında takılma hissi yaşanması ve ağrılı yutmada görülebilmektedir. Tümör yemek borusunun %60-70’ini kapamadığı durumlarda genellikle belirti vermemektedir. Yemek borusu kanseri belirtileri çok geç ortaya çıktığı için hastaların birçoğunda tümör ileri evrelerde belirlenebilmektedir. Yaşlı kişilerde gece yastığa salya akması, yutarken acıma yemek borusu kanserinin ilk belirtileri olabilir.
Tümörün ortaya çıktığı bölgeye bağlı olarak yemek borusu kanseri belirtileri farklılık gösterebilir.
Yutma güçlüğü her bölgede çıkan yemek borusu kanserlerinin ortak belirtisidir.
- Boyun bölgesine yakın ortaya çıkan yemek borusu kanserinin bir başka belirtisi ses kısıklığı olabilmektedir.
- Göğsün orta bölgesinde ortaya çıkan yemek borusu kanserinin belirtisi ise öksürük olabilir.
- Altta mideye yakın bölgede ortaya çıkan yemek borusu kanseri belirtisi şiddetli reflü şeklinde olabilir.
Yemek borusu kanseri belirtileri arasında çok nadir de olsa bazen kanama görülebilmektedir. Bu kanama ağızdan kan gelmesinden ziyade bağırsak kanaması olarak görülür.
Yemek borusu kanseri evrelerine göre farklı belirtiler verebilmektedir.
- Evre 1 yemek borusu kanseri belirti vermeyebilir. Yemek borusu kanseri 1. Evrede belirlenmesi genellikle tesadüfen veya taramalar sonucundadır.
- Evre 2 yemek borusu kanseri belirtisi yutma güçlüğü olarak görülebilir. Bu evrede yemek borusu kanseri belirtileri arasında nadir olsa da takılma hissi ve bağırsak kanaması yaşanabilir.
- Evre 3 yemek borusu kanserinde belirti ciddi yutma güçlüğüdür. Hasta katı gıda yiyemez hale gelir. Salya akıntısı daha çok yaşlı kişilerde ortaya çıkabilir.
- Evre 4 yemek borusu kanseri belirtisi metastazın yaşandığı bölgeye göre farklılık gösterebilir. 4. Evre yemek borusu kanserlerinde ciddi kilo kaybı ilk belirtiler arasında yer almaktadır. Tümör soluk borusunu tutmuşsa öksürük yaşanabilir. Karaciğere sıçrama yapmışsa yan ağrıları görülebilir. Kemiklere sıçramışsa kemik ağrıları görülebilir.
YEMEK BORUSU KANSERİNİN NEDENLERİ NELERDİR?
Hücre tipine göre yemek borusunun nedenlerinde de değişiklik olmaktadır.
Yassı hücreli (Skuamoz) yemek borusu kanserinin nedenleri arasında;
- Alkol ve sigara kullanımı
- Aşırı sıcak içecek tüketmek
- Yanmış-tütsülenmiş gıda tüketimi sayılabilmektedir.
Adenokarsinom yemek borusu kanserleri ise genellikle reflüden kaynaklanmaktadır. Toplumun yaklaşık %20’sinde reflü görülmektedir, ancak her reflü hastası yemek borusu kanseri olacak demek değildir. Uzun süreli reflü (asit ve safra), alkol ve sigara kullanımı ile birleştiğinde Barrett özofagusa (BARRETT) neden olabilmektedir. Barrett özofagus yemek borusu kanseri için önemli bir risk nedenidir.
Yemek borusu kanseri nedenlerinin önemli bir kısmı engellenebilir etkenlerdir. Bunun dışında bir takım hastalıklar ve genetik etkenler çok nadir olarak görülmektedir.
Et ağırlıklı beslenmek, mangalda hazırlanmış yanmış gıdaları çok tüketmek mide ve kolon kanserinde olduğu gibi yemek borusu kanseri için de risk faktörleri arasındadır.
YEMEK BORUSU KANSERİ TEŞHİSİ
Yemek Borusu Kanseri Nasıl Anlaşılır?
Yemek borusu kanserinin teşhisi endoskopik kontrolle yapılır. Endoskopik görüntüleme ile doktorun yemek borusunun içini görmesi teşhis için yeterli olabilmektedir. Ancak yemek borusu kanseri teşhisini kesinleştirmek için alınan parçanın patolojik olarak incelenmesi gerekmektedir.
Yemek borusu kanserinin hangi evrede olduğunu yani yemek borusu duvarında ne kadar ilerlediğini belirleyebilmek için EUS denilen endoskopik ultrason görüntüleme yöntemi kullanılır. EUS yemek borusu kanserinin hangi evrede olduğunu belirlenebilmesinde önemli bilgiler vermektedir.
Ayrıca tedavi veya yemek borusu kanseri ameliyatı olacak her hastanın Bilgisayarlı Tomografi ve Pet CT tetkiki yaptırması gerektirmektedir.
YEMEK BORUSU KANSERİ TEDAVİSİ NEDİR?
Yemek borusu kanserinin tedavisi evresi ve bulunduğu bölgeye göre farklılık göstermektedir.
Adenokarsinom veya yassı hücreli (skuamöz) 3. evre yemek borusu kanserlerinde öncelikle kemoradyoterapi denilen çok yüksek olmayan radyoterapi dozuyla kemoterapi birleştirildiği bir tedavi uygulanmaktadır. Bu tedaviden ciddi yanıtlar alınmaktadır. Kemoradyoterapi tedavisiyle ameliyata uygun hale gelen hastalarda yemek borusu kanseri ameliyatı yapılmaktadır.
Evre 4 özofagus kanserlerinde genellikle ameliyat yapılamamaktadır. Bu hasta grubu kemoterapi ve radyoterapi tedavisi uygulanmaktadır.
Evre 1-2-3 yemek borusu kanserlerinde tedavi tümörün bulunduğu bölgeye planlanmaktadır.
Boyun bölgesi yemek borusu kanserleri tedavisi
Kanserin yemek borusunun boyun bölgesinde yerleştiği durumlarda hastalar genellikle ameliyatla tedavi edilmemektedir. Yapılan araştırmalar boyun bölgesi yemek borusu kanserlerinde ameliyat veya kemoradyoterapi tedavisinin arasında bir fark olmadığı ortaya koymaktadır. Boyun bölgesinde ortaya çıkan özofagus kanserlerinde kemoradyoterapi yöntemi ile hastaların önemli bir kısmında ciddi başarı elde edilmektedir.
Ancak kemoterapi ve radyoterapinin yeterli olmadığı durumlarda ameliyat tercih edilmektedir.
Yemek borusunun boyun bölgesinde oluşan tümörler ses bölgesinin arkasında olduğu için bu ameliyatlarda gırtlak, tiroit, yutak bölümünün bir kısmı ve soluk borusunun bir kısmı da çıkartıldığı için hastaların hayatının kalan bölümünde boynundan nefes alması gerekmektedir.
Hastanın ağzından beslenebilmesi için yemek borusu kanseri ameliyatında yemek borusunun sadece bir kısmı çıkartılıp ince veya kalın bağırsaktan yemek borusu yapılabilir. Bazen de yemek borusu komple çıkartılıp mideden dil köküne kadar yemek borusu yapılabilmektedir.
Göğüs bölgesi yemek borusu kanserleri tedavisi
Göğüs bölgesinde yani yemek borusunun ortasında ortaya çıkan tümörlerin tedavisinde tümörün soluk borusunun ikiye bölünme bölgesinin üzerinde veya altında olmasına göre tedavi değişmektedir. Tümör soluk borusunun üzerindeyse kemoradyoterapi tedavisi tercih edilmektedir. Tümör soluk borusunun altında oluğu durumlarda ameliyat tercih edilmektedir.
Göğüs bölgesi yemek borusu kanseri ameliyatında lenf bezleri (en az 16 adet) ile birlikte yemek borusu tamamın çıkartılmaktadır. Daha sonra mideden yemek borusu yapılarak hastanın ağzından beslenmesi sağlanabilmektedir.
Mideye yakın yemek borusu kanserleri tedavisi
Mideye yakın bölgelerde yani alt bölge yemek borusu kanserlerinde tedavi tümörün mideye sıçramasına göre planlanmaktadır.
Tümör midenin 2 cm ve daha fazlasına yayıldığı durumlarda yapılan ameliyatlarda yemek borusunun önemli bir bölümü ile birlikte midenin tamamının çıkartılması gerekmektedir. Bu hastalara ince veya kalın bağırsaktan yeni yemek borusu yapılması gerekmektedir. Bu hastaların özel bir beslenme rejimi uygulamaları ve az-sık gıda tüketmeleri gerekmektedir. Bununla beraber hemen hemen her şeyi yemeleri mümkün olmaktadır.
YEMEK BORUSU KANSERİ HAKKINDA SIK SORULAN SORULAR
Yemek Borusu Kanseri Kimlerde Daha Çok Görülür?
Yemek borusu kanseri en çok görülen kanserler arasında 7. sıradadır. En sık görülen akciğer kanserinde ülkemizde her yıl 30-40 bin yeni hasta ortaya çıkarken, yemek borusu (Özofagus) kanserinde yılda 4-5 bin yeni hasta görülmektedir.
Türkiye’de özellikle beslenme alışkanlıklarından dolayı yassı hücreli yemek borusu kanseri denilen skuamoz tipi yemek borusu kanserleri Erzurum, Ağrı, Kars, Van, Bitlis, Muş gibi Doğu bölgelerimizde daha sık görülmektedir. Çok sıcak çay içmek, sebzeden fakir et ağırlıklı beslenme bu bölgede yemek borusu kanserinin görülmesinde önemli rol oynamaktadır. Türkiye’nin doğusundan başlayan ve Türki Cumhuriyetler denilen bölgeyi de içine alarak Çin’e kadar uzanan bölgede yassı hücreli yemek borusu kanseri Dünya geneline göre daha sık görülmektedir. Bahsedilen bölgenin dağlık ve soğuk olması nedeniyle aşırı sıcak içeceklerin çok fazla tüketilmesi önemli bir etkendir. Sıcak içeceklerin tüketilmesine sigara ve alkolün de eklendiği durumlarda yemek borusu kanserinin görülme sıklığı artmaktadır.
Genellikle yemek borusu kanseri 60 yaş üstü hastalığıdır, bu yaş altında daha nadir görülür. Erkeklerde daha sık görülmesine rağmen Doğu illerimizde sıcak çay içimine bağlı olarak kadınlarda da neredeyse aynı oranda ortaya çıkabilmektedir. Genç nüfusta nadir görülen yemek borusu kanseri ailesinde özellikle yemek borusu kanseri, kolon kanseri olan kişilerde daha sık görülebilmektedir.
Yemek Borusu Kanserinin Çeşitleri Nelerdir?
Yemek borusu kanseri köken aldığı hücre tipine ve ortaya çıktığı bölgeye göre sınıflandırılır. Yemek borusu kanseri genel olarak yassı hücreli (skuamoz) ve Adenokarsinom yemek borusu kanseri olmak üzere ikiye ayrılır.
- Yassı hücreli (Skuamoz) yemek borusu kanseri: Yemek borusunun içini kaplayan yassı hücrelerden oluşmuş ince zar dokusundan kaynaklanan kanserdir. Türkiye’de yassı hücreli yemek borusu kanseri daha sık görülmektedir.
- Adenokarsinom yemek borusu kanseri: Yemek borusunun alt bölgesindeki mukoza (yani iç zar tabakası) mide asidine ve safraya maruz kaldığında şekil değiştirerek salgı bezlerine ve mide iç zarına benzemeye başlar. Bu şekle dönüşen hücrelerden kaynaklanan kanserdir. Batı ülkelerinde Adenokarsinom tipi yemek borusu kanseri yassı hücreli (Skuamoz) yemek borusu kanserine göre daha sık görülmektedir.
Bu iki tip yemek borusu kanserinin haricinde kas dokusundan kaynaklanan farklı tipleri çok nadir görülmektedir.
Yemek borusu kanserini köken aldığı hücrelere göre ayırmanın yanında yemek borusundaki yerine göre ayırmak da mümkündür.
- Boyunda
- Göğüs içi Yemek Borusunda
- Alt uç – Mide Girişi
Mide asidi ve safra reflüsünün hasarı mideye yakın olduğu için adenokarsinom yemek borusu kanseri genellikle midenin girişinde veya yemek borusunun alt bölümünde görülmektedir. Yassı hücreli (Skuamoz) yemek borusu kanseri ise üst bölge veya orta kısımda ortaya çıkmaktadır.
Yemek Borusu Kanseri Kan Tahliliyle Belli Olur Mu?
Yemek borusu kanseri kan tahliliyle belli olmamaktadır.
Yemek Borusu Kanserinin Erken Teşhisi için Neler Yapılmalıdır?
Türkiye’de yemek borusu kanserinin erken teşhisi için bir tarama programı bulunmamaktadır. Ancak kişisel olarak alınabilecek önlemlerin başında endoskopik kontrollerin yaptırılması gelmektedir.
Reflüye bağlı olarak gelişen Barrett özofagusu (BARRETT) hastalarında, gelişebilecek bir yemek borusu kanserini erken teşhis etmek için yıllık endoskopi ile takip edilmesi önemlidir.
Yassı hücreli (Skuamoz) yemek borusu kanserinin yaygın olarak görüldüğü Doğu illerinde rutin endoskopik kontroller erken teşhis için hayati önem taşımaktadır.
Yemek Borusu Kanserinin Evreleri Nelerdir?
Yemek borusu kanseri 4 evreden oluşmaktadır.
- Yemek borusu kanseri evre 1: Yemek borusu kanseri belirtileri çok geç ortaya çıktığı için evre 1 yemek borusu kanseri teşhisi çok zordur. Hastalık sadece yemek borusunun iç zarında bulunmaktadır. Kas yapısına ulaşmamıştır. Evre 1 yemek borusu kanserlerinin tedavisinde yemek borusunu tamamen çıkartmak yerine endoskopla ağızdan girilerek sadece hastalıklı zarı çıkartmak mümkündür.
- Yemek borusu kanseri evde 2: Yemek borusu kanseri 2. Evrede hastalık zarı aşarak kas dokusuna ulaşmıştır.
- Yemek borusu kanseri evre 3: Tümör çok küçük değildir. Hastalık yemek borusundadır ancak çevredeki lenf bezlerine de sıçramıştır. Evre 3 yemek borusu kanserleri tedavisinde önce kemoterapi radyoterapi uygulanmaktadır. Tümör ve lenf bezlerindeki hastalığın gerilemesi hedeflenmektedir. Gerileme sağlanırsa tümörün ameliyata çıkartılması gerekir.
- Yemek borusu kanseri evre 4: Evre 4 yemek borusu kanserlerinde tümör vücudun uzak bölgelerine metastaz yapmıştır. Yemek borusu kanseri en çok karaciğer, kemik, akciğer ve mide girişindeki lenf bezlerine sıçrama yapmaktadır. Bu aşamada ameliyat şansı pek kalmamaktadır. Kemoterapi ile tedavi uygulanmaktadır.
Yemek Borusu Kanseri İçin Hangi Bölüm ve Doktora Gidilmelidir?
Yemek borusunun kanseri hastalarının önemli bir kısmı birçok bölümün işbirliği halinde hareket ettiği bir tedavi sürecinden geçmektedir. Multidisipliner bir tedavi yaklaşımı gereken yemek borusu kanserlerinde göğüs ve yemek borusu cerrahisinin yanında; gastroenteroloji, medikal onkoloji, radyasyon onkolojisi ve genel cerrahi beraber çalışabilmektedir. Diyet ve beslenme bölümünün bu süreçteki desteği çok önemlidir. Özellikli mikrocerrahi gerektiren durumlarda (mesela ince bağırsaktan yemek borusu yapılması), Estetik, Plastik ve Rekonstrüktif Cerrahi Bölümünden de destek alınmaktadır. Yemek borusu kanserinin tedavisinde çok özellikli cerrahi yaklaşımlar bulunduğu için bu konuda deneyimli doktorların ve alt yapının yeterli olduğu hastanelerin tercih edilmesi önemlidir.
Yemek Borusu Kanseri Ameliyatı Nasıl Yapılır?
Bağırsak ameliyatlarında olduğu gibi yemek borusunun bir kısmı kesilip geri kalan kısmı ile birleştirilemez. Ameliyatla çıkartılan yemek borusunun yerine muhakkak yeni bir yemek borusu yapılmalıdır. Temel amaç bağırsak devamlılığını sağlamaktır. Yemek borusu çıkartıldığında mide, ince ve kalın bağırsak veya nadir de olsa ciltten yemek borusu kanseri yapılabilmektedir.
Çok nadiren tümörün çıkartılmadığı durumlarda yandan bağırsak devamlılığı sağlanıp hastanın ağzından yemek yiyebilmesi sağlanabilmektedir. Gelişen teknoloji sayesinde artık bu durum stent takılarak giderilebilmektedir.
Tam tıkalı tümör çıkmayacak ve stent konulamayacak durumlarda beslenmenin sağlanması için mideye tüp yerleştirilerek (gastrostomi) yiyecekler doğrudan mideye verilebilmektedir.
Kapalı Yemek Borusu Kanseri Ameliyatı Nasıl Yapılır?
Yemek Borusu Hastalıkları Merkezi’mizde yemek borusu kanseri ameliyatlarının büyük bir çoğunluğu (%80-90) kapalı olarak yapılmaktadır. Dünya genelinde kapalı yemek borusu kanseri ameliyatları göğüs bölgesine 6, karın bölgesine açılan 4 delikten gerçekleştirilmektedir. Memorial Ataşehir Hastanesi Yemek Borusu Hastalıkları Merkezi’nde kapalı yemek borusu kanseri ameliyatı karın bölgesine açılan 3 delikten, göğse ise açılan tek delikten yapılabilmektedir. Ameliyatın karın bölümü 45 dakika-1 saat, göğüs bölümü 1-1,5 saat sürmektedir. Kapalı yemek borusu kanseri ameliyatı kanama miktarı, ameliyat süresi ve travmayı da azaltarak gelişebilecek komplikasyonları azaltmaktadır.
Yemek Borusu Kanseri Ameliyatının Riskleri Nelerdir?
Yemek borusu kanseri ameliyatı vücudun en önemli ameliyatlarından biridir. En önemli riski yemek borusu ile mide veya yeni yemek borusu olan bağırsak arasındaki birleşme bölgesinde kaçak olmasıdır. Yemek borusu kanseri ameliyatlarında ses kısıklığı riski de bulunmaktadır. Ancak bu risk %10’dan azdır ve ses kısıklığı genellikle geçicidir. Uzun süreli ses kısıklıklarında küçük bir işlemle ses kısıklığı giderilebilmektedir. Büyük bir ameliyatın sonucu olarak zatürre, kalpte ritim bozuklukları ve lenf kaçakları görülebilir.
Yemek Borusu Kanseri Öldürür Mü?
Kanser insanların aklında ölümü çağrıştırmaktadır. Bu yüzden doktorlar “Yemek borusu kanseri öldürür mü?” sorusuyla çok sık karşılaşmaktadır. Yemek borusu kanserinin 1. Evre, 2. Evre ve ameliyat edilebilen bir kısım 3. Evre hastalarının önemli bir bölümü hastalıktan kurtulma şansına sahiptir. Ancak yemek borusu kanseri belirti vermeden ilerleyen bir hastalıktır. Belirtiler belirgin şekilde ancak 4. Evrede ortaya çıkmaktadır.
Yemek borusu kanseri öldürür mü sorusunun genel bir cevabı bulunmamaktadır. Her hastalık kişiye özel şartlar taşımaktadır. Tümörün tipi, tümörün evresi ve bulunduğu bölgenin yanında hastanın yaşı, eşlik eden rahatsızlıkların olup olmaması gibi çok sayıda kritere göre yaşam süresi değişmektedir.
Bunlardan bağımsız olarak yapılan araştırmalarda yemek borusu kanserinde 5 yıllık sağ kalım oranları şu şekildedir;
Evre 1 yemek borusu kanseri %80-90
Evre 2 yemek borusu kanseri %yüzde 50-60
Evre 3 yemek borusu kanseri %30-40
Evre 4 yemek borusu kanseri % 5
Hastalık ilk 2-3 yıl geri gelmezse genellikle bir daha tekrarlamamaktadır. Bu yüzden tedaviden sonraki ilk 2-3 yıl çok önemlidir.
Yemek Borusu Kanseri Bitkisel Tedavi var mıdır?
Yemek borusu kanserinin bitkisel tedavisi bulunmamaktadır. Ancak sebzeden ağırlıklı beslenmek çok önemlidir ve anti inflammatuar bitkiler olan soğan sarımsak, zerdeçal gibi yiyecekleri tüketilmesi kanserle mücadelede destek sağlayabilmektedir.
Şekerden ağırlıklı pekmez, bal, şekerli hoşaf, şerbeti tatlılar gibi yiyeceklerden uzak durulması gerekmektedir. Bunun yerine protein ve sebze ağırlıklı besinlerin tüketilmesi önemlidir.
Yemek Borusu Kanseri Ameliyatı Sonrası Dikkat Edilmesi Gerekenler
Yemek borusu kanseri ameliyatı sonrasında hastaların tükettikleri besinlere dikkat etmesi gerekmektedir. Anti inflammatuar besinler tüketip şekerden uzak dururken kaliteli uyku, egzersiz ve düzenli sağlık kontrolleri ihmal edilmemelidir.
Yemek borusu kanseri sonrasında asitli içeceklerden uzak durulmalıdır. Hastaların hayat boyu mide koruyucu ilaç kullanmaları gerekmektedir.
Ameliyat sonrası yiyecekler doğrudan mideye girdiği için emilimde yaşanan sorunlar nedeniyle hastalarda %10 kilo kaybı, bazen gıda çeşidine göre ani ishaller yaşanmaktadır. Sorun yaşamamak için bal pekmez, şerbetli tatlılar gibi gıdalardan uzak durmalıdır. Az az ve sık sık yemek gerekmektedir. Hastalarda genellikle yiyecek kısıtlamasına değil miktar kısıtlamasına gidilmektedir
*Sayfa içeriği sadece bilgilendirme amaçlıdır. Tanı ve tedavi için mutlaka doktorunuza başvurunuz.
PENİS KANSERİ NEDİR?
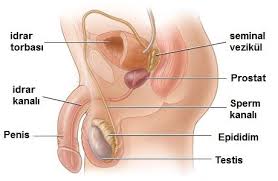
PENİS NEDİR VE NE İŞE YARAR?
Penis, erkek üreme sisteminin ve üriner sistemin bir parçasıdır. Erkek üreme sisteminin ana yapıları; testisler, epididim, seminal veziküller, prostat ve penistir. Erkek üreme sisteminin iç kısımları, kalça kemikleri arasındaki alt pelvik boşlukta bulunur. Penis, testislerin bulunduğu deri kesesinin (skrotum) önünde asılıdır. Penisin; kök, gövde (şaft) ve penisin koni şeklindeki ucu olan penisin başı (glans) olmak üzere üç ana bölümü vardır. Penis başı, sünnet derisi adı verilen bir deri tabakasıyla kaplıdır. Penis uyarıldığında penil arterler genişler ve kaslar kasılır. Bu durum cinsel ilişki için gerekli olan ereksiyona neden olur. Üretra da üriner sistemin bir parçasıdır. İdrarı mesaneden vücudun dışına taşır. Penisin kökünde, gevşediğinde idrarın üretradan ve vücuttan dışarı akmasına izin veren bir valf (sfinkter) vardır.
PENİS KANSERİ NEDİR?
Penisteki hücrelerde başlayan kansere penis kanseri adı verilmektedir. Penis kanseri vakalarının büyük çoğunluğu (yaklaşık yüzde 95’i) skuamöz hücreli karsinomdur. Bu durum kanserin penisin skuamöz hücrelerde başladığı anlamına gelir. Çoğu skuamöz hücreli penis kanseri, sünnet derisinde veya penisin ucunda (glans) başlar. Skuamöz hücreli penis kanseri tipik olarak yavaş büyür. Erken teşhiste tedavide başarı oranı yüksektir. Diğer penis kanseri türleri arasında bazal hücreli karsinomlar, sarkomlar, melanomlar veya üretral karsinom bulunur. Nadir görülen kanser türlerinden biri olan penis kanseri genellikle sünnet olmamış erkeklerde; daha çok Afrika, Güney Doğu Asya ve Güney Amerika’da görülür.
PENİS KANSERİ RİSK FAKTÖRLERİ NELERDİR?
Penis kanserleri ile ilişkili risk faktörleri arasında genel olarak şunlar bulunur:
- Sünnet olmamak: Penis kanseri sünnet olmayan erkeklerde sünnet olan erkeklere nazaran daha fazla görülür. Yenidoğan sünneti ile penis kanseri riski neredeyse tamamen ortadan kaldırılabilir.
- Yaş: Penis kanseri vakalarının çoğunluğu 50-70 yaş arası erkeklerde görülür. Yaklaşık üçte biri ise 50 yaşın altındaki erkeklerde görülür.
- Sigara içmek-Tütün kullanımı
- İnsan papilloma virüsü (HPV): HPV 16 ve HPV 18 penis kanseri ile bağlantılıdır.
- Fimosis: Fimosis sünnet derisini geri çekmeyi zorlaştıran bir faktördür. Yani sünnet derisinin penisin başına (glans) geri çekilememesidir. Bu durum vücut yağlarının, bakterilerin ve smegma olarak bilinen diğer kalıntıların birikmesine yol açabilir.
- Sedef hastalığında UV ışık tedavisi: Sedef hastalığı gibi bazı cilt hastalıklarında uygulanan UV ışık tedavisi penis kanserine yakalanma riskini artırabilir.
- AIDS (edinilmiş bağışıklık eksikliği sendromu)
PENİS KANSERİ BELİRTİLERİ NELERDİR?
Penis kanserinde en yaygın şekilde görülen semptomlar arasında cildin renginde veya kalınlığında değişiklikler, olağandışı akıntı, ülser, ağrı ve penisin ucunda şişlik bulunur. Penis kanseri belirtileri kişiden kişiye göre değişebilirken genel belirtiler özetle şunları içerir:
- Penis derisinde değişiklik, penis ucunda ağrı
- Ağrılı veya ağrısız siğil benzeri büyüme veya lezyon
- İyileşmeyen açık yara
- Sünnet derisi altında kanama görülmesi
- Kırmızımsı döküntü
- Küçük yumrular
- Düz, mavimsi-kahverengi büyüme
- Sünnet derisinin altında kalıcı, kokulu akıntı
- Kanser yayıldığı durumlarda kasıkta şişmiş lenf düğümleri
PENİS KANSERİ NASIL TEŞHİS EDİLİR?
Doktor penis kanserinden şüpheleniyorsa, biyopsi işlemi isteyecektir. Çünkü penis kanserinin kesin tanısı biyopsi işlemiyle konulur. Biyopsi, penisten veya lenf düğümlerinden bir miktar dokunun alınmasını ve bir laboratuvarda incelenmesini içerir.
Yapılabilecek üç tip biyopsi işlemi mevcuttur;
İnsizyonel biyopsi anormal dokunun sadece bir kısmının çıkarılmasını içerir. Genellikle daha büyük lezyonlar, yaralar, ülserasyonlar ve dokuda derinleşiyor gibi görünen lezyonlar için uygulanır.
Eksizyonel biyopsi tüm lezyonu veya anormal büyümeyi ortadan kaldırır. Eksizyonel biyopsi genellikle anormal alan küçük olduğunda yapılır.
Lenf nodu biyopsisi genellikle penis kanseri penis içindeki dokuları istila ettiğinde yapılır. Doktor kanserin penis dokusunun ötesine yayılıp yayılmadığını öğrenmesine yardımcı olacaktır. Genellikle, lenf nodu biyopsisi, doktorun lenf nod(lar)ına ince bir iğne soktuğu, lenf nod (lar)ında kanser olup olmadığını öğrenmek için hücreleri ve sıvıyı çektiği bir prosedür olan ince iğne aspirasyonu (FNA) ile yapılır. Bazı durumlarda kanseri kontrol etmek amacıyla tüm lenf düğümleri cerrahi olarak çıkarılır.
Ayrıca görüntüleme testleri doktorların penis kanserini teşhis etmesine ve evrelendirmesine yardımcı olabilir. Penis kanserini teşhis etmek ve kanserin evresini belirlemek için kullanılan görüntüleme testlerinden bazıları şunlardır:
- BT taraması (Bilgisayarlı tomografi taraması)
- MRI (Manyetik rezonans görüntüleme)
- Ultrason
PENİS KANSERİ EVRELEMESİ NASILDIR?
Penis kanseri evrelemesi şu şekildedir:
Evre 0
Penisin derisinin sadece üst tabakası kanser belirtileri gösterir. Yani yüzeyseldir ve herhangi bir yayılım göstermez.
Evre 1
Kanser, penis üzerindeki derinin üst tabakasının altındaki dokuya doğru büyümüştür. Ancak lenf ve kan damarlarında herhangi bir tutulum görülmez.
Evre 2
Kanser bu evrede penisin derisinin ve dokusunun ötesine yayılmaya devam eder. Sinirlerde, lenf damarlarında veya kan damarlarında mevcuttur.
Evre 3
Kanser 3. aşamada, penisin süngerimsi erektil dokusuna dönüşmüş olabilir. Kanser bununla birlikte kasıktaki lenf bezlerine de yayılmış olabilir.
Evre 4
Kanser bu aşamada kasıktaki skrotuma, prostata, kasık kemiğine ve diğer yapılara yayılmış olabilir. Kanser ayrıca lenf düğümlerinde de mevcut olabilir.
PENİS KANSERİ TEDAVİ YÖNTEMLERİ NELERDİR?
Penis kanseri için tedavi yöntemleri genellikle cerrahi prosedür, radyoterapi ve kemoterapi içerir. Söz konusu tedavi yöntemleri hastalığın evresine, kanserin türüne, hastanın genel sağlık durumuna göre tek başına ya da kombinasyon halinde uygulanabilir.
Cerrahi prosedür
Penis kanserinin ana tedavisi cerrahi yöntemdir. Cerrahi prosedürde tümör ve çevresindeki bazı sağlıklı dokular (marj) çıkaracaktır. Ameliyatın kapsamı ve türü, tümörün konumuna, türüne ve evresine bağlıdır. Çoğu durumda, cerrahi prosedürün ardından meydana gelen penisteki herhangi bir fiziksel değişiklik rekonstrüktif cerrahi ile düzeltilebilir.
Fotodinamik terapi (PDT)
Fotodinamik terapi, kanser hücrelerini öldürmek için ışıkla birlikte ışığa duyarlılaştırıcı ajanlar adı verilen özel ilaçlar kullanır. İlaçlar ancak ışıkla etkinleştirildikten veya açıldıktan sonra çalışır.
Kriyocerrahi
Kriyocerrahi işleminde, kanser hücrelerini dondurmak ve öldürmek için sıvı nitrojen kullanır.
Radyoterapi
Radyoterapide kanser hücrelerini yok etmek için yüksek enerjili x-ışınları kullanır. Radyoterapi uygulamasının avantajı penisin anatomik yapısını korumasıdır. Dezavantajı ise penis kanserlerinin radyoterapiye nispeten dirençli olması ve fistül, ödem, cilt nekrozu ve ağrı gibi birçok komplikasyona sebep olabilmesidir.
Kemoterapi
Kemoterapi kanser hücrelerini öldürmek veya büyümesini yavaşlatmak için ilaçların kullanılmasıdır. Kemoterapinin penis kanseri tedavisinde sınırlı bir rolü vardır: Kemoterapi daha çok kanser lenf düğümlerine ve diğer dokulara yayıldığı durumlarda uygulanır. Yaklaşık yüzde 50’si rezektabl yapılabilen sabit inguinal metastazlı hastalarda primer neoadjuvan kemoterapinin rolü olabilir.
Öte yandan çok küçük sünnet derisi lezyonları için sünnet ve lazer cerrahisi tedavi edici olabilir. Lazer tedavisi penisin korunması avantajını sunsa da lazer penetrasyonunun derinliği sığdır.
PENİS KANSERİ HAKKINDA SIK SORULAN SORULAR
Penis kanseri bir erkeğin cinselliğini nasıl etkiler?
Penis kanseri teşhisi konan bir erkekte kısmi (penisteki kanserli doku ile birlikte bir miktar sağlam penis dokusunun çıkarılması) veya tam penektomi (penisin tamamının çıkarılması işlemi) uygulanabilir. Penis kanserinde tedavi için uygulanan cerrahi prosedürün yan etkileriyle baş etmek zor olabilir. Bir erkeğin penisinin bir kısmının veya tamamının kaybıyla başa çıkmak için psikolojik destek yardımı alması gerekebilir.
Sünnet olmak penis kanserini önler mi?
Yenidoğan sünnetli erkeklerde penis kanseri neredeyse hiç görülmez. Sünnet ergenlik sonrasına ertelendiğinde penis kanseri insidansı daha yüksektir. Yetişkin sünneti ise penis kanserine karşı koruma sağlamaz.
*Sayfa içeriği sadece bilgilendirme amaçlıdır. Tanı ve tedavi için mutlaka doktorunuza başvurunuz.
TÜKÜRÜK VE TÜKÜRÜK BEZİ NEDİR?
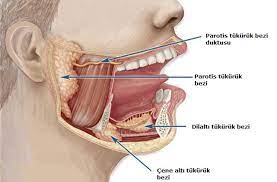
Tükürük, ağızda üretilen ve içinde ihtiva ettiği su, sodyum, klorür, kalsiyum, potasyum, bikarbonat, immün globulin A, albumin, ptiyalin ve musin gibi önemli görevleri olan maddeler nedeniyle vücudumuz için önemli olan bir tür sıvıdır. Tükürük ağız içini sürekli olarak nemli tutar, ağız içindeki besinlerin kayganlaşmasını ve besinlerin içindeki bazı molekülleri çözerek, bunların tat alma organcıklarına ulaşmalarını sağlar. Yutma işlemini kolaylaştırdığı gibi dil ve dudakların hareketlerini serbestleştirerek, konuşmayı da kolaylaştırır. Dişleri ve ağız içini sürekli yıkayarak, bunların temiz kalmasını sağlar.
Tükürük salgısı tükürük bezleri tarafından yapılır. Ağız boşluğu, burun, sinüsler, yutak, gırtlak, nefes borusu ve bronş mukozasında bulunan sayıları 400-600 arasında değişen minör tükürük bezlerinin yanı sıra yüzümüzün her bir tarafına yerleşmiş, küçük kanallarla ağız boşluğuna bağlanan büyük tükürük bezlerimiz de bulunmaktadır. Bunlar her iki kulağımızın önünde birer tane (Parotis bezi), her iki çene altında birer tane (Submandibuler bez), her iki dilaltında birer tane (Sublingual bez) olmak üzere toplam 6 adettir.
TÜKÜRÜK BEZİ NE İŞE YARAR?
Tükürük bezleri tükürük salgısını üretir. Sağlıklı bir insanın günlük olarak 1000–1500 cc kadar tükürük ürettiği bilinir. Tükürük bezleri, ağız içerisindeki temizliği, asidi ve besinlerin mideye gitmesini sağlar. Ağız kokusundan sindirime varıncaya kadar pek çok görevi olan tükürük, sağlık açısından çok önemlidir.
TÜKÜRÜK BEZİ KANSERİ NEDİR?
Tükürük bezi kanseri, ağzımızda tükürük salgısı yapan, büyük (üç çift) ve küçük ( bine yakın) dediğimiz tükürük bezlerinden birinin kanserleşmesi sonucu oluşan bir durumdur.
TÜKÜRÜK BEZİ TÜMÖR ÇEŞİTLERİ NELERDİR?
Tümörler, iyi huylu (benign) ve kötü huylu (malign) olarak ikiye ayrılır. İyi huylu tümörler daha yavaş büyür ve çevre ya da uzak bölge organlara metastaz (sıçrama) yapmazlar. Kötü huylu tümörler (malign) ise daha hızlı büyür, bölgesel lenf bezelerine ve uzak organlara (akciğer, karaciğer, beyin, kemik vb..) metastaz (sıçrama) yapma potansiyeline sahiptirler.
TÜKÜRÜK BEZİ KANSERİNİN BELİRTİLERİ NELERDİR?
Daha yavaş büyüyen iyi huylu tümörler çoğu kez kapsül adı verilen ince, zarımsı bir kılıfla çevrilidir ve çevre dokulara yayılma (invazyon) yapmaz. Genellikle etraf dokuları itip kendilerine yer açarak büyür. Bu büyüme aylar, hatta yıllar içerisinde oluşur. İyi huylu tümörler ağrıya neden olmaz, hastalar çok nadiren ağrıdan yakınır. Ağrı olma durumu da genellikle tümörün kendinden ziyade dolaylı nedenlere bağlı olmaktadır.
Kötü huylu tümörler (malign) daha hızlı büyür, bölgesel lenf bezelerine ve uzak organlara (akciğer, karaciğer, beyin, kemik vb..) metastaz (sıçrama) yapma potansiyeline sahiptirler. Çevre dokulara yayılma gösterirler ve onların fonksiyonlarını bozarak gelişirler. Örneğin, bulundukları yere komşu sinirlere ulaştıklarında onların fonksiyonlarını bozarlar. Ayrıca kötü huylu tümörler belli bir büyüklüğe ulaştıktan sonra ağrıya da neden olmaya başlarlar. Bu ağrı tümörün kemik, çene eklemi gibi yapıları işgal etmesine bağlı oluşabileceği gibi doğrudan baş, yüz bölgesinde de ya da ağrı duyusunu taşıyan sinirlere ulaşmasıyla da ortaya çıkabilir.
TÜKÜRÜK BEZİ KANSERİNİN NEDENLERİ NELERDİR?
Tükürük bezi kanserlerinin nedenleri bilinmemekle birlikte, bazı durumların bu riski arttırdığı düşünülmektedir. Bunların başında iyi huylu tümörlerin uzun süre tükürük bezi içerisinde kalmış olması gelir. Bu nedenle tümörün iyi huylu olduğu bilinse de, tükürük bezinden çıkarılıp alınması tercih edilmektedir. Radyasyon maruziyeti de tükürük kanseri ihtimalini arttıran sebeplerdendir. Sigara kullanımı çoğu kanserin görülme ihtimalini arttırdığı gibi tükürük bezi kanseri ihtimalini de arttırır.
TÜKÜRÜK BEZİ KANSERİNİN TANISI NASIL KONULUR?
Tükürük bezi kanserlerinin erken teşhisi genellikle hastada oluşturacağı şikayetler doğrultusunda olmaktadır. Kişide baş-boyun bölgesinde meydana gelecek şişlikler veya ağrı gibi şikayetlerle doktora başvurması sonucunda yapılan ayrıntılı incelemeler ile hastalık teşhis edilebilir.
Ayrıntılı alınan anamnezden sonra hasta muayene edilir. Fizik muayenede tükürük bezlerinde şişlik, büyüme olup olmadığına bakılır ve büyüme, şişlik varsa şişliğin boyutları, sınırları incelenir. Muayenelerde bilateral yani iki taraflı muayene ile mukayeseli gidilmesi gerekir.
Tükürük bezi kanserlerinde görüntüleme yöntemlerinden de faydalanılır. Özellikle Bilgisayarlı Tomografi (BT) ve Manyetik Rezonans görüntüleme (MR) ile tümör dokusu ve çevre dokuları incelenir. Tükürük bezi kanserlerinde kesin tanı için histopatolojik inceleme yapılır. Biyopsi yani dokudan örnek alınıp incelenmesi ile tanıya gidilir. Tükürük bezi kanseri teşhisi konulduktan sonra kanserin evrelemesinin yapılması için de MR faydalı olmaktadır.
TÜKÜRÜK BEZİ KANSERİNİN TEDAVİSİ NASIL UYGULANIR?
Tedavide hastalığın evresine göre tedavi planı çizilir. Hastalığın evrelemesinde de tümörün çapı, çevre dokulara yayılma yapıp yapmadığı, lenf nodu yayılımı, tümörün histolojik tipi gibi durumlar etkili olmaktadır. Bunların sonucunda belirlenen evreleme ile tedavi planı oluşturulur. Tedavide cerrahi, radyoterapi ve kemoterapi seçenekleri mevcuttur. Hastalarda çoğunlukla bu tedavi metodları bir araya getirilerek uygulanır.
TÜKÜRÜK BEZİ KANSERİ İLE İLGİLİ SIK SORULAN SORULAR
Tükürük bezi tümörleri tehlikeli midir?
Tükürük bezi tümörleri genellikle iyi huyludurlar. Tükürük bezlerindeki tümörler içerisinde en sık olarak parotis bezi tümörü görülür. Bu tümörler iyi huyludurlar. Agresif seyretmezler ve başka bölgeye yayılımı nadir görülür. İyi huylu tümörlerde tedavisiz vakalarda çok az bir ihtimal de olsa maligniteye yani kansere dönüşme ihtimali vardır. Bu nedenle tükürük bezindeki tümör oluşumlarının değerlendirilmesinin yapılması ve uygun tedavi seçeneği ile tedavisinin başlanması önemlidir. Kötü huylu seyreden malign tükürük bezi kanserlerinde de erken teşhis ve tedaviye erken sürede başlanması ile tedavinin başarısı fazlasıyla arttırılır. Bu nedenle özellikle kulak ön bölgesinde, çene altında şişlik, yutmada güçlük, yüzde hissizlik, uyuşma gibi şikayetlerde en erken dönemde hastaneye başvuru oldukça önemlidir.
Tükürük bezi kanseri öldürür mü?
Tükürük bezi tümörleri genellikle iyi huyludur. Bu tümörlerin tedavi sonucu hayatta kalma oranı yüzde 95’lerdedir. Kötü seyirli, tedavisine geç başlanmış veya tedavi edilmemiş malign tükürük bezi kanserlerinde başarı oranı yüzde 50’lerdedir.
En sık hangi tükürük bezlerinde kanser görülür?
Majör ve minör tükürük bezlerinin en sık benign tümörü pleomorfik adenom olup, tüm tükürük bezi tümörlerinin yüzde 50’sini ve tüm parotis tümörlerinin yüzde 65’ini oluşturmaktadır. Majör ve minör tükürük bezlerinin en sık malign tümörü mukoepidermoid karsinom olup, tüm tükürük bezi tümörlerinin yüzde 10’unu ve tüm malign tükürük bezi tümörlerinin yüzde 35’ini oluşturmaktadır. Bu tümör de en sık parotiste ortaya çıkar.
Tükürük bezlerindeki her tümör kanser midir?
Tükürük bezindeki her tümör kanser değildir. Her şişlik kötü huylu olmayabilir. Bunların azımsanamayacak bir bölümü, özellikle, kulak önü tükürük bezlerindekilerin (parotis bezi) büyük bir bölümü iyi huylu şişliklerdir. Bu nedenle üzerinde önemle durulan konu, şişliklerin iyi ya da kötü huylu olup olmadığıdır.
Tükürük bezi kanserinin risk faktörleri nelerdir?
İyonize radyasyona maruz kalma tükürük bezi kanserlerinde en çok suçlanan etiyolojik faktördür. Kauçuk sektörü çalışanlarında, asbeste maruz kalan madencilerde, tesisatçılar ve kereste işinde çalışan kişilerde de maruziyet sebebiyle ikincil risk artmaktadır.
Benign tükürük bezi tümörü ne anlama gelmektedir?
Tükürük bezi kaynaklı tümörler genellikle 50-70 yaşlarında yavaş büyüyen kitleler olarak ortaya çıkarlar. Tanıda muayene ve radyolojik tetkiklerin yanı sıra ince iğne biyopsisi önemli yer tutmaktadır. İğne biyopsisi ile tümörün iyi ya da kötü huylu olduğunun ayrımı yapılmakta tedavi planı bu doğrultuda şekillenmektedir.
İyi huylu tükürük bezi tümörlerin büyük kısmı 30-60 yaşları arasında ve kadınlarda daha fazla görülen mikst tümör ya da pleomorfik adenom adı verilen tümördür. Genel olarak bütün iyi huylu tümörlerde cerrahi tedavi uygulanmaktadır. Bu ameliyat sırasında tümörün bulunduğu tükürük bezi bütün olarak çıkartılmaktadır. İyi huylu parotis tümörlerinde derin lobun tümör tarafından tutulumu yoksa cerrahide sadece yüzeyel lob çıkartılmaktadır.
Maling tükürük bezi tümörü ne anlama gelmektedir?
Kötü huylu tümörler tümörün klinik davranışına, yayılma hızına ve yapısal değişiklik derecesine göre düşük, orta ve yüksek dereceli (grade) olarak gruplandırılmaktadır. Yüksek dereceli tümörler daha saldırgan, çevre dokulara ve boyun lenf bezlerine yayılma eğiliminde, uzak metastaz riski yüksek olan tümörlerdir. Malign tükürük bezi tümörlerinin tedavisinde ilk seçenek cerrahidir. Ameliyat sırasında tümörün çevresinde tümör yayılmamış normal doku içerecek şekilde geniş olarak çıkartılması gerekir. Tümör tarafından tutulum olmadığı sürece ameliyat bölgesinden geçen yüz siniri, dil duyusunu alan sinir gibi önemli sinirler korunmalıdır. Boyundaki lenf bezlerinde saptanmış tümör sıçraması saptanan ve belirgin tutulum saptanmamış olsa bile boyun lenf bezlerine metastaz yapma riski yüksek olan tümörlerde ameliyat sırasında komşu lenf bezleri de çıkartılır (boyun diseksiyonu ameliyatı). Radyoterapi küçük tümörlerde nadir olarak asıl tedavi olarak seçilebilir. Büyük ve yayılma riski yüksek tümörlerde ise cerrahi sonrasında ameliyat bölgesine radyoterapi verilerek aynı bölgede tümör tekrarının önlenmesi amaçlanmaktadır.
Diğer sağlık problemleri nedeni ile ameliyata uygun olmayan hastalarda ve tümörün ileri derecede bölgesel yayılım ve/veya uzak metastaz yapmış olduğu hastalarda ilaç tedavisi (kemoterapi) tercih edilebilmektedir.
Tükürük bezi kanserinin görülme sıklığı nedir?
Kötü huylu tükürük bezi tümörleri baş ve boyun bölgesinde görülen kötü huylu tümörlerin yüzde 3-4 ünü oluştururlar. Kötü huylu tükürük bezi tümörleri en sık yüzde 75-80 parotis bezinde, yüzde 20 oranında çene altı tükürük bezinde ve nadiren dilaltı ya da minör bezlerde izlenmektedir. Malign tükürük bezi tömörü olan hastaların çoğunluğu 60-70 yaş aralığındaki hastalardır. Erkeklerde daha sık görülür.
Tükürük bezi kanseri yüz felcine sebep olur mu?
Yüz kaslarımızı çalıştıran sinir olan fasiyal sinir büyük tükürük bezimiz olan parotis bezinin içinde seyretmektedir. Parotis bezinin maling tümörleri eğer serin loba doğru yayılıp, yüz sinirini tutarsa yüz felci görülebilir.
Tükürük bezi kanseri şüphesinde hangi doktora gidilmelidir?
Kulak burun boğaz hastalıkları uzmanına başvurması gerekir.
Tükürük bezi kanserinde biyopsi nasıl yapılır?
Bu işlem açık biyopsi, ince iğne aspirasyon biyopsisi (İİAB), kor biyopsi ve donuk kesit biyopsi ile yapılabilir. Günümüzde sıklıkla parotis ve submandibuler bezlerdeki kitleler için genellikle İİAB uygulanan biyopsi yöntemidir. Minör tükürük bezlerinde daha çok forseps yardımıyla açık biyopsi (insizyonel) tercih edilir.
Tükürük bezi kanserinde ince iğne aspirasyon biyopsisi, tümörün yayılmasına yol açar mı?
İğne biyopsisi, uzun yıllardır bütün dünyada milyonlarca hastaya uygulanmış ve halen de uygulanan bir teşhis yöntemidir. Şimdiye kadar tümörün yayılımına yol açtığına dair bilimsel bir kanıta rastlanmamıştır. Bu nedenle hekimler tarafından güvenle uygulanmaktadır.
Tükürük bezi kanseri önlenebilir mi?
Tükürük bezi kanserinin nedenleri ne yazık ki henüz bilinmemektedir. Dolayısıyla nasıl önlenebileceği konusunda herhangi bir şey söylenemez. Sigarayla gırtlak kanseri ya da akciğer kanseri arasında nasıl bir neden sonuç ilişkisi varsa, dolayısıyla önlem almak mümkünse de tükürük bezi kanseri için böyle bir ilişki söz konusu değildir. Tükürük bezi kanserleri için alınabilecek tek önlem, tükürük bezi içindeki tümörün çok gecikmeden müdahale ederek cerrahi bir işlem ile vücuttan çıkartılmasıdır.
Tükürük bezi kanseri erken teşhis edilebilir mi?
Kulak önünde, çene altında ya da ağız, boğaz gibi bölgelerde şişlik, kitle fark eden hasta bir süre sonra hekime başvurduğunda teşhis süreci başlayacaktır. Muayene ile tükürük bezi tümöründen şüphelenen hekim, genellikle ultrason, MR (manyetik rezonans) ya da BT (bilgisayarlı tomografi) gibi radyolojik görüntüleme araçlarına başvurur. Bu tümör tanısını güçlendirmede muayeneden sonra ikinci adım olacaktır. Ardından kimi zaman, iğne biyopsisi ile kitleden hücre ya da doku örneği almak, teşhisi kesinleştirmek ve tedavi öncesi planlamaları en doğru şekilde yapabilmek için gerekli olacaktır.
Tükürük bezi kanseri metastaz yapar mı?
Kötü huylu tümörler (malign, habis) daha hızlı büyürler, bölgesel lenf bezelerine ve uzak organlara (akciğer, karaciğer, beyin, kemik vb..) metastaz (sıçrama) yapma potansiyeline sahiptirler. Çevre dokulara yayılım (invazyon) gösterirler ve onların fonksiyonlarını bozarak gelişirler.
Tükürük bezi kanseri cerrahisinden sonra yüzde iz kalır mı?
Parotis bezi ameliyatlarında kulak önünden başlayıp çene arkasından çene altına doğru uzanan bir kesi yapılır. Ameliyat bitiminde bu kesi estetik dikiş diye tabir ettiğimiz cilt altı dikişle kapatılır ve minimal bir izle iyileşme gözlenir. Bu kesi kulağın arkasına denk getirilerek iz kalma olasılığı çok çok düşürülebilir. Yine benzer şekilde submandibular bez ameliyatlarında çene altına yaklaşık 3 cmlik bir kesi yapılır ve cilt altı dikiş ile kapatılır. İyileşme sonrası kalan iz önemsenmeyecek kadar azdır.
Tükürük bezi ameliyatından sonra tükürük bezlerinin alınması ne gibi sonuçlar doğurur?
Parotis ve submandibuler bezinin tek taraflı alınması, tükürük yetersizliği ve ağız kuruluğu gibi sorunlara yol açmaz. Yüzün diğer tarafındaki tükürük bezleri ve mikroskobik tükürük bezleri eksik olan bezin işlevini üstlenir. Tükürük bezi ameliyatlarının geç döneminde beslenme, konuşma gibi fonksiyonlar etkilenmez.
Tükürük bezi kanseri ameliyatı ne kadar sürer?
Tükürük bezi kanser ve tümörlerine yaklaşırken öncelikle kanserli dokunun nerede olduğuna bakılır. İkinci olarak ise bu tümör iyi huylu mu yoksa kötü huylu mudur, ayırt edilmeye çalışılır. Bu safhalardan sonra ise tedavi seçenekleri masaya yatırılarak hasta için en uygun ve en az kayba yol açacak tedavi şekli bulunur. Bu tedavi, hastaya en az organ, en az iş gücü kaybı ve en az sıkıntı yaşatacak, kısacası yaşam kalitesini minimum düzeyde etkileyecek bir tedavi şekli olmalıdır.
Daha sonra ele alınan işlemlerde ise, bu tümörün bulunduğu bölgede ne kadar yayıldığı, çevredeki bölgeye, özellikle boyun lenf düğümleri, vücutta herhangi başka bir bölgeye yayılıp yayılmadığı belirlenmeye çalışılır. Bu bilgiler elde edildikten sonra hastanın genel durumu da göz önüne alınarak tedavi planı ortaya çıkarılmaktadır.
Tükürük bezi kanseri ameliyatında hastanede yatış süresi ne kadardır?
Cerrahinin özelliğine bağlı olarak ortalama yatış süresi genellikle 2-4 gündür.
Ameliyattan sonra nelere dikkat edilmelidir?
Ameliyat sonrasında, ameliyat sahasındaki kan ve sıvı birikimini dışarıya almak için dren adı verilen bir borucuk yerleştirilir. Dren çoğu kez, 24 ile 48 saat arası bir sürenin sonunda çıkartılır. Ancak sahada birikim olmasını önlemek için sargılı bir pansuman 3-4 gün daha kalacaktır. Ciltte dikişiler var ise hekimin tercihine göre 5. ile 7. günlerde alınır.
Bu süre zarfında toplam 3 veya 4 kez pansuman yeterli olmaktadır. Eğer cilt kesisi kendinden eriyen özel ipliklerle gizli şekilde kapatıldıysa dikişlerin alınmasına gerek olmayacaktır. Hasta ameliyatın haftasında çoğu kez rahatlıkla banyo yapabilir hale gelir. Enfeksiyon ihtimaline karşı 3-4 gün kadar antibiyotik verilmesi uygun görülebilir.
Ameliyattan uyandıktan sonra hastaya, anestezi etkisini atlatana kadar 3-4 saatlik bir süre boyunca ağızdan gıda ya da sıvı verilmez. Ameliyat günü ilerleyen saatlerde genellikle yumuşak, sıvı gıdalarla beslenen hasta çoğu kez ertesi günden itibaren normal gıdalar ile beslenmeye geçer. Ancak özellikle kötü huylu tümörler nedeniyle yapılan çok kapsamlı cerrahilerden sonra hastanın kendine gelmesi ve eski beslenme düzenine geçmesi daha uzun sürebilir.
Genel olarak yüz ve boyun bölgesinde yapılan ameliyatlarda, kesinin planlanması ve ameliyat sonrası dikilerek kapatılması, kozmetik kaygılar göz önünde bulundurularak özel itina ile yapılmaktadır. Buna karşın, geç dönemde oluşabilecek yara izinden (nedbe dokusu) kaçınmak için hastalardan kesi bölgesini bir yıl kadar güneşe göstermemeleri istenir. Açık havalarda dışarı çıktıklarında yüksek koruma faktörlü kremler ile veya eşarp, fular gibi aksesuarlarla korumaları önerilmektedir. Ayrıca, bazı krem ve jel şeklindeki ilaçların, yara dokusunu daha az belirgin hale getirebilmesi mümkündür.
*Sayfa içeriği sadece bilgilendirme amaçlıdır. Tanı ve tedavi için mutlaka doktorunuza başvurunuz.
Gastrointestinal Onkolojik Cerrahi
- Özefagus ( yemek borusu ) hastalıkları (özefagus kanseri, reflü, hiatal herni, akalazya, ösefagus divertikül hastalıkları…)
- Mide ve duodenum hastalıkları (mide ve duodenum kanseri, morbid obezite, metabolik obezite cerrahisi, tümörleri… ),ince ve kalın bağırsak hastalıkları (ülseratif kolit, Crohn hastalığı, kolon kanserleri…)
- Anüs ve anal kanal hastalıkları ( anal fissür, anal fistül, hemoroid, anal polip, anal inkontinans, anal prolapsus, anal apse ve anal kanserler… )
- Karaciğer hastalıkları (kanser, dev hemanjiyom, kist hidatik, metastazlar… )
- Pankreas hastalıkları (kanser, pankreas psödokisti ve kistleri),
- Safra kesesi ve safra yolları hastalıkları (safra kesesi ve safra yolları taşı, safra kesesi kanserleri)
- Periton kanseri ve metastazları ( periton cerrahisi )
İleri Laparoskopik – Robotik uygulamaları
- Laparoskopik- Robotik obezite ameliyatları
Obezitenin hızlı bir şekilde tedavisini sağlamaya yönelik cerrahi operasyonlar; tüp mide (sleeve gastrektomi), gastrik bypass ( mini gastrik by-pass ve Roux n Y gastrik by-pass) , transit bipartisyon, SADI-S, SAGI-S, duodenal switch, biliopankreatik diversiyon, ileai interpozisyon, jejunoileal by-pass gibi metabolik ve diyabet cerrahisi ameliyatlarıdır. Bu cerrahi girişimler, laparoskopik ve robotik yöntemlerle uygulanmakta, bu sayede hem cerrah hem de hasta için konforlu bir ameliyat süreci sağlanmaktadır. Hasta bu ameliyatların sonrasında kısa sürece iş ve sosyal yaşamına dönebilmektedir.
- Laparoskopik – Robotik gastroözefajeal reflü, akalazya ve hiatal herni ameliyatları
Sindirim sisteminde özefagus ile mide arasındaki yapının bozulması ile mide içeriğinin yemek borusuna kaçması sonucu gelişen reflü, besinlerin yemek borusunda takılıp kalmasına yol açan akalazya ve diyafragma kasında oluşabilen fıtıklar (hiatal herni) gastroenteroloji cerrahisinin ileri laparoskopik- robotik uygulamaları ile tedavi edilmektedir.
- Laparoskopik- Robotik kalın bağırsak kanserlerinde kolektomi – TKME, rektum kanserlerinde anterior ve low anterior – Ta-TME – intersfinkterik – Cecil ameliyatları- NOSE gibi doğal yollar ile yapılan ameliyat teknikleri
İltihabi bağırsak hastalıklarında (Crohn hastalığı ya da ülseratif kolit) komplikasyon geliştiği ya da tedaviye cevap alınamadığı durumlarda bağırsakların cerrahi olarak çıkarılması gerekebilir. Bu durumlarda Laparoskopik- Robotik yapılan ince bağırsak – kalın bağırsak rezeksiyonu, total proktokolektomi ve diğer ameliyatlar açık cerrahi işlemlere oranla çok daha hızlı bir şekilde iyileşme imkanı sağlar.
- Laparoskopik- Robotik splenektomi (dalak hastalıkları ameliyatı)
Hematolojik hastalıklar veya yaralanmalar sonucunda dalağın alınması, splenektomi olarak adlandırılır. İleri Laparoskopik- Robotik uygulamalar ile yapılan splenektomilerde açık operasyonlara oranla çok daha küçük bir kesi uygulanır ve hastanede yatış süresi kısalır.
- Laparoskopik apandektomi
Sık görülen ve akut bir hastalık olan apandisit, acil ameliyat gerektiren bir durumdur. Önceleri açık ameliyat şeklinde yapılan apandektomi işlemi, günümüzde laparoskopi ile kapalı yöntemle gerçekleştirilmekte, hastalar 1-2 gün içerisinde günlük hayatına dönebilmektedir.
- Laparoskopik-Robotik adrenalektomi (Böbrek üstü bezi hastalıkları ameliyatı)
Adrenal bezler, böbrek üstünde yerleşik salgı bezleridir. Adrenal bezlerde oluşan iyi ve kötü huylu tümörler ile hormon salgılayan tümöral lezyonlar, laparoskopik adrenalektomi adı verilen operasyon ile kapalı yöntemle alınabilmektedir.
- Laparoskopik – Robotik kolesistektomi ( Safra kesesi hastalıkları ameliyatı)
Safra kesesinde oluşan kum ve taşlar ile bunlara bağlı olarak ortaya çıkan iltihaplanma, tıkanıklık ve sarılık gibi durumlarda tek ve kesin çözüm, yapılacak kolesistektomi operasyonudur. Safra kesesinin çıkarıldığı kolesistektomi, günümüzde Laparoskopik-Robotik yöntemle küçük kesiler açılarak hızlı bir şekilde gerçekleştirilebilmektedir.
Multidisipliner uygulamalar
Memorial Bahçelievler Hastanesi İleri Onkolojik Cerrahi Bölümü’nde, tüm sindirim sistemi organları hastalıklarının tanı ve tedavileri multidisipliner yaklaşımlarla yürütülmektedir.
GASTROİNTESTİNAL ONKOLOJİK CERRAHİ
- Gastroenteroloji cerrahisi birimi
- Kadın hastalıkları -Onkolojik Cerrahi bölümü
- Radyoloji, Girişimsel radyoloji bölümü
- Gastroenteroloji bölümü ve İleri Gastroenteroloji girişimleri birimi
- Patoloji -Sitoloji merkezi
- Tıbbi onkoloji bölümü
- Radyasyon onkolojisi bölümü
- Nükleer tıp merkezi
- Endokrinoloji bölümü
- Psikiyatri bölümü
- Diyetisyen birimi
- Psikoloji tedavi birimi
- Nutrisyonel destek birimi
Uzmanları ve ekipleri ile işbirliği içinde hizmet verilmektedir. Deneyimli ve alanında uzmanlaşmış akademik kadromuz, özefagus ve mide cerrahisi, hepato-pankreato-biliyer cerrahi, kolon ve rektum cerrahisi, obezite ve metabolik cerrahi alanlarında açık, laparoskopik ve robotik cerrahiler uygulamaktadır. Bunların yanında; mide, kalın bağırsak (kolon), rektum, pankreas, karaciğer, özefagus, safra kesesi, ince bağırsak, periton ile karın içi kanserleri gibi tüm kanser türlerinin tedavileri de uygulanmaktadır.
Gastrointestinal Onkolojik Cerrahi Merkezi’nde tedavisi gerçekleştirilen hastalıklar:
- Yemek borusunun iyi ve kötü huylu tümörleri
Özefagusta oluşan tümörler iyi veya kötü huylu olabilirken, tehlike arz etmeleri nedeniyle çoğu durumda cerrahi operasyonlar yardımıyla alınması gerekir. Bu işlem İleri Onkolojik Cerrahi Bölümümüzde uzman hekimler tarafından uygulanır.
- Midenin iyi ve kötü huylu tümörleri
Mide mukozasında oluşan tümörler, iyi veya kötü huylu olabilir. Türü, boyutu ve kanserleşme eğilimi bulunup bulunmadığı araştırıldıktan sonra mide tümörleri, İleri Onkolojik Cerrahi Bölümü’nde ekibimiz tarafından alınmaktadır.
- Diyafram hernisi ve reflü hastalığına yönelik cerrahi işlemler
Tüm yaş gruplarında gözlenebilen diyafram hernileri ve gastroözefageal reflü hastalıkları, cerrahi operasyonlar yardımı ile tamamen ortadan kaldırılabilmekte veya etkileri minimuma indirilebilmektedir.
- İnce bağırsağın cerrahi hastalıkları
İnce bağırsaklarda oluşan tıkanıklık, yapışıklık, ülser oluşumu, tümör, fistül, divertikül ve fıtıkların tedavisinde cerrahi ameliyatlar yer almaktadır. Bu hastalıkların cerrahisi, İleri Onkolojik Cerrahi Bölümü doktorlarınca gerçekleştirilir.
- Kolon ve rektum kanserlerinin Robotik – Laparoskopik ve açık ameliyatları
Kalın bağırsak ve rektumda tespit edilen iyi huylu tümörler, boyutları da göz önünde bulundurularak hekim önerisine göre genellikle cerrahi operasyonla alınır. Kötü huylu tümörler ise boyutuna bakılmaksızın cerrahi girişimler yardımıyla çıkarılır. İşlem sonrası herhangi farklı bir dokuya yayılım gösterip göstermediği de incelenerek, gerekirse ek tedaviler uygulanır.
- İltihabi bağırsak hastalıklarına (Crohn hastalığı ve Ülseratif kolit) yönelik cerrahi işlemler
Crohn hastalığı ve ülseratif kolit gibi iltihabi bağırsak hastalıklarında; tedavinin ne şekilde yönlendirileceği, hastalığın yerleşimi, hastanın semptomları ve hastanın yaşı gibi pek çok faktör bir arada değerlendirilerek kararlaştırılır. Kimi olgularda ince bağırsağın bir kısmının ve kalın bağırsağın tamamının çıkarılması gerekebilir. Buna yönelik cerrahi işlemlerde laparoskopik ve robotik yöntemler uygulanmaktadır.
- Hemoroid, anal fissür, anal fistül ve pilonidal sinüsün tedavisi
Kıl dönmesi olarak da bilinen pilonidal sinüs, kalın bağırsağın son kısmı ile cilt arasında gelişen anal fistül, makatta çatlak olarak tanımlanan anal fissür ve halk arasında basur hastalığı olarak da adlandırılan hemoroid hastalıkları, İleri Onkolojik Cerrahi Bölümü’nün alanına giren ve cerrahi operasyonlar yardımıyla tedavi edilebilen hastalıklardır.
- Pankreas kist ve tümörleri cerrahisi
Pankreasta çok çeşitli kist ve tümörler meydana gelebilmektedir. Bu kistler kimi durumlarda hastalar için herhangi bir tehlike arz etmiyorsa takip altında tutulabilir. Ancak bu kist ve tümörlerin büyük çoğunluğu cerrahi olarak çıkarılması gereken lezyonlardır.
- Akut – kronik pankreatit ve komplikasyonlarının tedavisi
Akut ve kronik pankreatitlerde hastalığın ve yol açtığı komplikasyonların tedavisinde endoskopik yöntemlere ek olarak cerrahi operasyonlara da ihtiyaç duyulabilmektedir.
- Karaciğerin her türlü tümöründe cerrahi tedavi
Karaciğer tümörleri sık görülebilen, bazı durumlarda hastada herhangi bir soruna neden olmayan ancak bazı durumlarda kanserleşme eğilimine girerek ciddi sorunlara yol açabilen oluşumlardır. Bu tümörler boyutu ve kötü huylu olup olmadığı göz önünde bulundurularak gerekli görüldüğünde cerrahi operasyon yardımıyla çıkarılır.
- Karaciğerin kistik hastalıklarında cerrahi işlemler
Karaciğerde oluşan paraziter (enfeksiyon kaynaklı) kistler ve paraziter olmayan (yapısal veya kansere bağlı) kistler tehlike arz etmeleri veya hekim tarafından gerekli görülmesi durumunda cerrahi ameliyatlar yardımıyla çıkarılır.
- Safra kesesi ve yollarının taş ve tümörlerinin cerrahi tedavisi
Safra kesesinde oluşan taşlar, safra kesesinde ve safra yollarında iltihaba sebep olabilmekte, safra yollarının tıkanmasına neden olarak enfeksiyonlara yol açabilmektedir. Ayrıca safra kesesi ve safra yollarında tümör gelişebilmektedir. Safra kesesi veya safra yollarında oluşan tümörler ile taşın neden olduğu hastalıklarda, İleri Onkolojik Cerrahi Bölümü uzmanları tarafından cerrahi operasyonlar uygulanmaktadır.
- Dalağın hematolojik, kistik ve tümöral hastalıklarında cerrahi tedavi
Hematolojik hastalıklar, kistik ve tümöral problemler dalakta görülebilen hastalıklar arasında yer alır. Bu hastalıklarda, gerekli görüldüğü takdirde İleri Onkolojik Cerrahi Bölümü’nde cerrahi işlemler uygulanmaktadır. Bu işlemlerden en yaygını splenektomi adı verilen dalağın çıkarılması işlemidir.
- Karın duvarı ve ameliyat yeri fıtıklarında Robotik- Laparoskopik cerrahisi
Karın duvarında oluşan yapışıklık ve benzeri sorunlar ile ameliyat yeri fıtıklarının tedavisinde gastroenteroloji cerrahisi uygulamalarından yararlanılır. Bu işlemler için hastanın sağlık durumunun ve hastalığın imkan vermesi durumunda robotik cerrahi ve laparoskopi tekniğinden faydalanılabilmektedir.
ENDOSKOPİ UYGULAMALARI
- Tanısal gastroskopi ve kolonoskopi
Bazı hastalıkların tanı ve tedavisinde gastroskopi ve kolonoskopi uygulamalarına ihtiyaç duyulur. Mide hastalıklarının incelenmesinde gastroskopi, kolorektal hastalıkların incelenmesinde ise kolonoskopi adı verilen endoskopik uygulamalar tercih edilmektedir.
- Perkütan endoskopik gastrostomi (PEG), jejunostomi ( PEJ)
Yemek yiyemeyen ve ağızdan beslenmemesi gereken hastaların sağlıklı ve yeterli beslenebilmesinin sağlanması amacıyla Gastroenteroloji Cerrahisi Bölümü’nde yapılacak işlem ile perkütan endoskopik gastrostomi (PEG) veya peruktan endoskopik jejunostomi ( PEJ) uygulanarak mideye direkt ulaşan bir beslenme tüpü yerleştirilir.
- Endoskopik stent yerleştirmesi
Gastrointestinal sisteme ilişkin darlıkların söz konusu olduğu hastalıklarda ilgili bölgeye endoskopik yöntemler yardımıyla stent yerleştirilerek darlık ortadan kaldırılabilir. Bu işlem uygun koşullar altında İleri Onkolojik Cerrahi Bölümü’nde gerçekleştirilebilmektedir.
HIPEC( SICAK KEMOTERAPİ ) VE PIPAC ( AEROSOL BASINÇLI KEMOTERAPİ )
HIPEC ( Hipertermik karın içi kemoterapi —Karin içi sıcak kemoterapi) “Hyperthermic Intraperitoneal Chemotherapy” adı verilen ve kanser tedavisinde son yıllarda adından sıkça söz edilen bir tedavi şeklidir.
Günümüze kanser tedavisinde pek çok farklı yöntem kullanılmakta ve önemli başarılar elde edilmektedir. HIPEC olarak adlandırılan karın içi sıcak kemoterapi uygulaması, hem hastanın yaşam süresinin uzatılması hem de hayat kalitesinin yükseltilmesi yönünden bu alanda atılan en önemli adımlardan biridir.
Karın içi organlardan kaynaklanan bazı kanserlerde, cerrahi tedavi öncesi (neoadjuvan tedavi) veya sonrası (adjuvan tedavi ) ya da hem öncesi hem de sonrası damar yoluyla verilen sistemik kemoterapi beklenen yanıtı vermeyebilir. Bu durumda, uygulanan tedavilere istenen yanıt alınamadığında, hastalık giderek ilerler ve sonunda hastanın yaşamı tehlikeye girebilir.
İleri evre karın içi kanserlerde tedavi seçeneği: HIPEC
Kanser tedavisinden istenilen yanıtın alınamadığı noktada, hem hastanın hayat beklentisini uzatacak hem de konforunu iyileştirecek bir yöntem olan ” karın içi sıcak kemoterapi- HIPEC” tedavi seçeneği gündeme gelir. Karın içine kemoterapi uygulama ile şu amaçlanır: Karın içi organları ve karın, “periton-karın zarı ” adı verilen bir tabaka ile kaplıdır. Bu yapı hem karın içi organların yüzeyini örter hem de karın duvarının iç yüzeyini kaplar. Karın içini kaplayan bu ince tabaka, salgıladığı az miktardaki sıvı ile organların kayganlığını sağlar. Kanser, ortaya çıktığı organda gelişimini sürdürürken hastalığın ilerlemesiyle birlikte başka organ ve alanlara da yayılım gösterir.
HIPEC tedavisi nasıl uygulanır?
Kanser; kan, lenf bezleri ve karın boşluğuna dökülme yoluyla yayılabilmektedir. Bu nedenle karın içi kanserlerde, hastalığın ileri evresinde tümör, peritona da sıçrayabilir. Kanserin son evresinde ortaya çıkan bu durumda, hastaya damar yoluyla uygulanan ilaçlar peritona istenilen düzeyde ulaşamayabilir ve tedavi yetersiz kalır. Oysa yoğun tümörle kaplı olan periton felsefik olarak bir organ gibi değerlendirilmeli, periton ile birlikte tutulmuş organ veya organlar da yıkanarak, karın içi mikroskopik olarak mümkün olduğunca tümörsüz hale getirilmeye çalışılır. Bu işleme, ” SRC (sitoredüktif cerrahi+peritonektomi) ” adı verilmektedir. Yapılan bu işlemleri takiben 42-43 derece sıcaklığa sahip olan tümör yok edici ilaçlar özel bir aparat ile karın içine verilir. Karın içi yıkama işlemi 60 ila 90 dk arasında tamamlanır. Bu süre içinde tümör hücrelerinin mikroskobik düzeyde yok edilmesi amaçlanır.
Kemoterapi ilaçları neden ısıtılarak verilir?
Antikanser ilaçlarının karın içine ısıtılarak verilmesi;
- Isı, ilacın doku içine nüfus etmesini kolaylaştırır ve seçilmiş kemoterapik ajanın kanser hücresini öldürme etkisini artırır.
- Isının kendisi anti-tümör etkisine sahiptir ve ısı karın içindeki tüm yüzeylere ilacın karın içindeki tüm yüzeylere ilacın eşit dağılımına katkı sağlar.
- HIPEC sürecince tümör hücreleri ince bağırsak yüzeylerinden ve pıhtı-fibrin tabakaları içinden mekanik olarak temizlenir.
HIPEC hangi hastalıklarda uygulanır?
Kanserin ileri evresinde periton tutulumu olan hastalarda karın içinde sıvı (assit) toplanmaya başlar. Bu sıvı, hastanın karnının giderek şişmesine, oluşturduğu bası ve gerginlik ile solunum ve dolaşımın sorunlu hale gelmesine neden olabilir. Bazen o kadar yaygın hale gelir ki hastanın yatış pozisyonunu bile engeller. Bunun yanında kanser hücrelerinin karın içi diğer alanlara yayılımına da neden olur. Hastanın rahatlaması için kanül yoluyla sıvının boşaltılması mümkün olsa da patoloji devam ettiğinden yeniden sıvı toplanması söz konusu olacaktır. Kanserin ileri düzeyde olduğu hasta grubu, tüm tedavi seçeneklerini geride bırakmış kişilerdir ve böyle durumda da hastanın yaşam süresini uzatacak ve yaşam konforu sağlayacak HIPEC tedavisi gündeme gelir. Bu işlem ile peritonun kendi kanserleri, apendiks kanseri ile kadınlarda Over (yumurtalık) kanserinde başarılı sonuçlar alınmaktadır. Bunların yanı sıra kalın bağırsak, mide ve son zamanlarda da pankreas kanserlerinde de uygulanmaya başlamıştır.
Bu tür tedaviler yapılırken bazı komponentler de göz ardı edilmemelidir. Tedavinin tüm evreleri bir arada gerçekleştirildiği zaman bir anlam ifade etmektedir.
HIPEC tedavisi hangi durumlarda uygulanmaz?
HIPEC uygulaması karın dışında tutulumların olduğu durumlarda yapılmaz. Beyin, kemikler, akciğer metastazları…). Karaciğerde üç veya daha az metastatik odak varsa bunlar çıkarılarak HIPEC uygulanabilir. Ancak yaygın karaciğer metastazlarının olduğu durumlarda da HIPEC endikasyonu yoktur. Bir diğer önemli organ ince bağırsaklardır. İnce bağırsaklar sindirim sisteminde besin emiliminin yapıldığı organlar olduğundan geniş ince barsak rezeksiyonları hayat ile bağdaşmamaktadır. Bu nedenle yaygın ince barsak tutulumu olan hastalarda HIPEC uygulamak çok anlam ifade etmez. Uygulama sonrası sağ kalım süreleri bu hastaların büyük bir çoğunluğu ileri evre kanser hastası olması nedeniyle yaşam beklentileri aylarla sınırlı olan hastalardır. Bu önemli detay göz ardı edilmemeli, hastalığın tamamen tedavi edilerek yok edilemeyeceği ancak hayat konforu ve yaşam beklentisinin uzatılabileceği dikkate alınmalıdır.
PIPAC –BASINÇLI AEROSOL KEMOTERAPİ
Karın için kanserlerin tedavisinde PIPAC dönemi
PIPAC yöntemi karın zarı kanserlerinde kullanılan ve damar yoluyla verilen kemoterapi ilaçlarının, vücudun doğal kıvrımlarına ulaşamama sorununu ortadan kaldıran “basınçlı aerosol kemoterapi” uygulamasıdır. Bu yöntem ile ideal hasta grubunda tümör kontrol altına alınarak hastanın yaşam süresi ve kalitesi artırılmaktadır.
Karın içi kanser tanımı nedir?
Karın duvarını tamamen saran, aynı zamanda karın içi organların üzerini örten “periton tabakası”, başlı başına bir organ olarak kabul edilmektedir. Bu bölgede görülen kanserler peritonun kendisinden kaynaklanan tümörlerin yanı sıra; kalın bağırsak ve rektum, yumurtalık, rahim ve mide kanserlerinin metastazlarıdır. Mevcut bu kanserlerin ilerlemesi sonucu, kanserli hücreler bulunduğu ortamda kan veya lenf yoluyla metastaz yapabilir ve karın içi organları yaygın olarak tutan bir hastalık ortaya çıkabilir. Karın içi metastazı sonrasında da yine bu bölgede asit olarak tanımlanan sıvı toplanması olur. Hastanın herhangi bir tedaviden fayda göremez hale geldiğini gösteren bir tablo, ileri evre kanser vakaları grubunu oluşturmaktadır. Bu gibi durumlarda, hastaya sistemik kemoterapi olarak tanımlanan, damar yolundan kemoterapi verilmektedir. Radyoterapi de uygulanabilir ancak bazen kemoterapi belli bir noktadan öteye gitmez. İlaç peritona kadar gelir, içine nüfuz edemez. Çünkü kendi damarı olmayan bu zar, diffüzyon yoluyla beslenmektedir. Dolayısıyla peritondaki saçılmalar tedaviyle ortadan kaldırılamaz. Tümör adeta bir avuç bulgurun serpilmesine benzer şekilde yayılım gösterir.
PIPAC yöntemi karın içi kanserlerde nasıl uygulanır?
Tümörü metastaz yapan hastalarda yapılan SRC (peritonektomi ve sitoredüktif cerrahi ) , redüksiyonu azaltmak anlamına gelmektedir. Bu tedavinin uygulanacağı hasta grubu seçilirken belli başlı kriterler de göz önünde tutulur. Kalın bağırsak kanseri olan bir hastanın tümör yayılımı karaciğere ulaşmasa da peritona yaygın olarak dağılım söz konusu olduğunda, periton zarı tamamen soyulup çıkarılır. Cerrah, ulaşılabilen tüm tümörleri cerrahi yolla veya koterizasyonla yok eder. Yapılan temizliğin ardından, PIPAC adı verilen basınçlı sıcak kemoterapi yöntemiyle, ilaç karın içine 1/10 doz düzeyinde verilir. Yani sistemik kemoterapide hastaya damardan 10 gram ilaç veriliyorsa, PIPAC’te 1 gram ilaçla aynı başarı elde edebilir. Bu sayede hem hastanın sağlıklı hücreleri üzerinde kanser öldürücü ilaçların sitotoksik etkisi azaltılır ve üst düzeyde etkinlik sağlanır.
İşlem hangi hasta grubu için uygundur?
PIPAC uygulaması sonrası hastaların taburculuğu bir gün içinde yapılabilir. Hastanın tedavisinden olumlu sonuç alındığında, uygulama dört hafta sonra tekrarlanabilir. Bu özelliğiyle önemli bir avantaj sağlayan işlem, “herhangi bir şey yapılamayacak” denilen hastalara umut olmaktadır.
PIPAC işleminin hastanın yaşam süresi ve kalitesine katkısı nedir?
Laparoskopik yolla yapılan PIPAC tedavisi ile biri 1 cm, diğeri 0,5 cm’lik iki kesiden karın içine girilir. Verilecek ilaç, tümörün kaynaklandığı organın türüne göre seçilir. Karın içine giren trokarlardan, kalem benzeri bir aparatla verilen yüksek basınçlı ısıtılmış kemoterapik ilaç her tarafa yayılır. Bu yöntemle ilaç, tüm alanlara ulaşılabilir. İşlem sırasında belli yerlere nirengi noktası olacak işaretler koyulmaktadır ve böylece gerekli hallerde dört hafta sonra tedavi tekrar edilebilir. Gerekli hallerde dört hafta sonra tekrarlanabilen bu tedavi, yedi-sekiz hatta 10 kereye kadar yapılabilir. Tedavinin üçüncü ya da dördüncü uygulanışında işaret koyulan noktalarda tümörün neredeyse tamamına yakınının kaybolduğu görülebilir. Bir-iki aylık yaşam beklentisi bazen 10 katına çıkarılabilir. Ama bunun için hastanın genel sağlık durumu, hücre yapısı, tümörün tipi ile genetik yapısı büyük önem taşımaktadır.
*Sayfa içeriği sadece bilgilendirme amaçlıdır. Tanı ve tedavi için mutlaka doktorunuza başvurunuz.
Girişimsel Nöroradyoloji
Girişimsel Nöroradyolojinin kullanıldığı alanlar nelerdir?
Beyin ve spinal anjiografisi;
Beyin ve boyun damarlarının anjiyo ile gösterilmesi altın standart bir işlemdir. Kan damarına radyoopak bir kontrast madde enjekte ederek gerçekleştirilir. Kontrast madde verilmesi sırasında görüntüyü görmek ve kaydetmek için floroskopi (anjiyografi) cihazını kullanılır. İşlem uygun damarın giriş bölgesine lokal anestezi verilmesi ile başlar. Damar içine kılıf yerleştirilir. Girilmesi istenen damarlara katater yerleştirilerek o damarın anatomisi ve patolojileri görüntülenir. Özellikle damarsal baloncuk ve yumakların görüntülenmesi sağlanır, tedavi planlaması yapılır.
Anevrizma (Baloncuk) Embolizasyonu;
Anevrizma, bir kan damarı duvarının iç kas tabakasının (intima) zayıflamasından kaynaklanan bir atardamarda anormal bir fokal genişlemesidir. En çok 35-45 yaş arasında görülür. Bu genişleme uyarı vermeden incelebilir ve yırtılabilir. Yırtılma durumunda, kan akışı azaldığından veya tamamen bloke olduğundan, inme riski vardır. Ayrıca yırtılan baloncuk beyin etrafındaki zarlar arasındaki (subaracnaoid) kanamaya yol açar. Anevrizmaların çoğunluğu 2,5cm altındadır, bunun üstündekiler dev olarak adlandırılır. Dev anevrizmaların yırtılma olasılığı daha yüksektir, tedavisi daha zordur.
Risk faktörleri: Beyin anevrizmalarının oluşumuna; hipertansiyon, sigara, genetik hatalıklar(Ehler-danlos, tuberoskleroz, FMD, Kleinfelter, alfa 1 antitirpsin eksikliği) alkol tüketimi, uyuşturucu kullanımı travma ve enfeksiyonlar neden olabilir. Aile öyküsü varlığı, kadın cinsiyette ve ileri yaşta daha sık görülür.
Tipleri: Sakküler (baloncuk) tip damarın dallanma bölgelerinde ortaya çıkan kubbe şeklinde çıkıntılardır. Dar ya da geniş boyunlu olabilir. Fuziform anevrizmalar; damarın kısa bir segmentinde genişleme şeklinde olur. Blister tip Gül dikeni şeklinde olan anevrizmalardır.
Bir beyin anevrizması yırtılmadığı sürece nadiren belirti verir. Çok büyük olanlar bası semptomları oluşturabilir. Görme kaybı, çift görme, göz üstünde ağrı, yüzde tek taraflı uyuşma basıya bağlı gelişebilir. Bir anevrizma yırtıldığında ciddi baş ağrısı (daha önce hiç yaşanmamış şiddette tariflenen bir baş ağrısı), bulantı kusma, ışığa bakamama, görülür, bilinç kaybı gelişir, nöbetler görülebilir, ayrıca inme bulgusu olan tek taraflı güçsüzlük gelişebilir. Bu bulguların en önemli özelliği ani gelişmesidir.
Tanı: beyin anevrizmaları genellikle yırtıldıktan sonra çekilen tomografi yada MR da saptanır. Anevrizma düşünülen kişilerde tanıda altın standart olan anjiyografi çekilir. Burada anevrizmanın yapısı değerlendirilir, tedavi planı yapılır. Tomografide yeni gelişmelerle birlikte anjiyoya yakın görüntüler alınmaktadır. Ayrıca anjiyoda gelişebilecek sorunlar görülmez. MR’ da, bir anevrizmanın yerini belirlemeye ve teşhis etmeye yardımcı olur.
Tedavi: Endovasküler anevrizma tedavisi serebral anevrizmalar için geçerli bir seçenektir. Artık anevrizmaların tedavisinde ilk olarak endovasküler tedavi düşünülmektedir. Kanayan ya da kanamayan anevrizmalarda tedaviler değişmektedir. Tedavi işlemi ile baloncuğunun içinin sarmallarla doldurulması, stentler web kullanılmaktadır..
AVM Embolizasyonu
Beyinde ya da omurilikte meydana gelmiş anormal kan damarı yumaklarıdır. AVM’lerinin nedeni net değildir. Çoğu insan onlarla doğar, ancak daha sonra yaşamda da oluşabilirler. AVM’ler, Osler-Weber-Rendu sendromu olarak da bilinen kalıtsal hemorajik telenjiektaziye (HHT) sahip bazı kişilerde görülür. HHT, beyin de dahil olmak üzere vücudun çeşitli bölgelerinde kan damarlarının oluşma şeklini etkiler.
AVM varlığında ne olur? Kalp, atardamarlar yoluyla beyin ve omuriliğe, oksijen bakımından zengin kanı gönderirler. Atardamarlar, en küçük kan damarlarına (kılcal damarlar) kadar incelerek akım hızları yavaşlar. Oksijenli kanı beyin hücrelerine bırakırlar. AVM’de yapı ise kılcal damarlardan yoksun AVM, gelen kan hızla kalbe geri döner buda beyinin oradaki beslenmesini bozar.
Beyin AVM’si olan kişilerde baş ağrısı veya nöbetler görülebilir. Bazı kişilerde ise diğer nedenle beyin taramasında ya da kanama sonrası beyin görüntülemesinde saptanmaktadır. Bir beyin AVM’si teşhis edildikten sonra beyin hasarı veya inme gibi komplikasyonları önlemek için tedavi edilmelidir. Beyin AVM kanaması riski her yıl yaklaşık %2 ila %3 arasında değişmektedir. Bazı AVM tipleri için ya da daha önce AVM rüptürü olan kişilerde kanama riski daha yüksek olabilir. Beyin kanaması; etkilenen arterlerin ve ince damarların aşırı basınca bağlı duvarlarının incelmesi yırtılmasına sebep olur. Bu kanamalar bazen beyin hasarına ve belirti veya semptomlara neden olmadıkları için tespit edilememektedir. Bu hastalarda potansiyel olarak yaşamı tehdit eden kanama atakları meydana getirir.
Tedavi; AVM’nin kanama yapıp yapmamasına, kanama riski yüksekliğine, önemli yapılarına yakınlığına ve büyüklüğüne bağlı olarak planlanmaktadır. İşlem sırasında bu damar yumaklarına girilerek tıkayıcı ilaçlar verilir.
AVF Embolizasyonu
Bir arteriyovenöz fistül (AVF), bir arter (atardamar) ve bir ven (toplardar) arasındaki anormal bir bağlantıdır. Yüksek basınçlı bir arter ile düşük basınçlı bir ven arasındaki bağlantı, genellikle hem arteri hem de veni genişleten bölgedeki kan akışını artırabilir. AVF’ler bazen doğumda bulunur (doğuştan) veya doğumdan sonra gelişir ve bazen de bir yaralanmanın (kazanılmış) sonucudur.
Yüz veya boyundaki arteriovenöz fistüller şişmeye ve anormal nabız atımına ya da üfürüme neden olur. Bebekler arasındaki aşırı durumlarda, kalbi aşırı yükleyebilir. Nadiren beyin gelişiminde ciddi sorunlara neden olurlar. Bazen semptomları doğumda görürüz, bazen de durum çocukluğun sonlarına kadar belirginleşmez. Büyük fistüller doğumda kalp yetmezliğine neden olabilir. Daha küçük olanlar başın içindeki damarlardaki basıncın artmasına neden olarak hidrosefali veya serebral ventriküllerin (beyin içinde sıvı tutan boşluklar) genişlemesine neden olur. Omurilikte gelişen fistüller; omuriliği sıkıştırarak uyuşma ve/veya güçsüzlüğe yol açabilir.
Tanı: fistül tanısı için ilk basamak MR ve MRA’dır. Şüphe varlığında BTA ya da klasik anjiyo işlemleri yapılır.
Tedavi: Endovasküler embolizasyon, bir AVF için en yaygın tedavi şeklidir. Bu işlemi genellikle besleyici artere ya da fistulize vene bir kateter yerleştirerek gerçekleştirilir. Bu kan akışını durdurmak için koiller (sarmallar), ayrılabilir balonlar, embolizasyon yapıştırıcısı, embolizasyon partikülleri, embolizasyon materyali (Onyx olarak adlandırılır) gibi damar tıkaçları çeşitli tipte cihazlar kullanılır. Arter ve ven arasındaki bağlantıyı kapattıktan sonra AVF iyileşir ve genellikle tekrar etmez. Diğer bir tedavi seçeneği de fistülü cerrahi olarak kapatmaktır.
Karotis arter stentleme: Şah damarı daralmaları inmeye neden olan ciddi bir durumdur. Şikayeti olmayan %70 üzerindeki darlıklar ve tekrarlayan inme geçiren %50’nin üstündeki darlıklar tedavi gerektirir. Özellikle cerrahi şah damarı tedavi riskleri yüksek olan, cerrahi sonrası darlığı devam eden durumlarda stent işlemleri uygulanmaktadır. İşlemler genelde uyanık ve hafif sakinleştirici ilaçlar kullanılarak yapılır. Kasığa yapılan lokal anestezi sonrası, iğne ile atardamar delinir ve buradan yerleştirilen ince borularla(katater) karotis (şah) atardamarına ulaşılır. İşlemi yönlendirmek için floroskopi (anjiyo) kullanılır, damar içine kontrast madde verilerek görüntüler alınır. Şah damarındaki darlık, ince tellerle geçilir, işlemler sırasında pıhtıyı engellemek için darlığın ilerisine filtre yerleştirilir. Filtre teli üzerinden balon yapılarak, darlık genişletilir. Darlığa stent konarak, balon ile stent duvara yapıştırılır. Kontroller alınarak işlem sonlandırılır. İşlem riskleri; kasıkta gelişen kanama, yalancı anevrizma ya da beyin damarında gelişen pıhtıdır. Bunlar vakaların %5 inden az kısımda görülür.
İnme tedavisi: İnme dünyadaki yaygın ölüm ve sakatlık nedenlerinden biridir. Beynin herhangi bir kısmına kan akışının ani kesilmesi olarak adlandırılır. İnmenin endovasküler tedavisi, inme sonrası ilk 6 saat içinde damar içinde gelişen pıhtının çıkarılmasıdır (trombektomi). Kan pıhtısı çıkarılamazsa eritici ilaçlar verilir (tromboliz). Eğer damarlarda darlık varsa stent de yerleştirilebilir.
*Sayfa içeriği sadece bilgilendirme amaçlıdır. Tanı ve tedavi için mutlaka doktorunuza başvurunuz.
Tıbbi Onkoloji

KEMOTERAPİ
Kemoterapi Nedir?
Kemoterapi, tümörün ilaçla tedavi edilmesi demektir. Cerrahi ve ışın tedavisi ile birlikte tümör tedavisinin çok önemli bir parçasıdır. Kemoterapi ile tümör hücreleri öldürülür veya tümörün büyümesi durdurulmaya çalışılır. Bazen tek, bazen birkaç ilaç çeşitli yollarla verilerek uygulanır.
Kemoterapi Kim Tarafından Uygulanır?
Kemoterapi ile ilgilenen bilim dalına “Medikal Onkoloji” veya “Tıbbi Onkoloji”, bu alanda çalışan doktora “Medikal Onkolog (Tıbbi Onkolog)” denir. Medikal onkoloji ayrı bir uzmanlık dalıdır; medikal onkolog tümör tedavisi konusunda uzmanlaşmış bir iç hastalıkları uzmanıdır. Tümör tedavisi bir ekip işidir ve mutlaka bu ekibin tüm üyelerinin bulunduğu merkezlerde uygulanmalıdır. Bu ekipte tümör cerrahisi ile ilgili uzman cerrah, ışın tedavisi (radyoterapi) ile ilgili radyasyon onkoloğu, kemoterapi ve hasta bakımı (destek tedavisi) ile ilgili medikal onkolog bulunmalıdır.
Kemoterapi Uygulamasında Amaç Nedir?
Tümörün cinsine ve hastanın özellikleri gibi değişik nedenlerle kemoterapi uygulanabilir.
- Tümörü tamamen yok etmek ve hastayı iyileştirmek için,
- Tümörün yayılmasını engellemek için,
- Tümörün büyümesini durdurmak veya yavaşlatmak için,
- Tümörün sebep olduğu belirtileri yok etmek için kemoterapi uygulanır.
Etkili bir tedavi yöntemi olmasına rağmen bazı durumlarda tümörü tamamen yok edemeyip sadece belirtilerini düzelterek rahat yaşamayı sağlayabilir. Bazı tümörlerde tek tedavi yöntemi kemoterapidir. Diğerlerinde ise kemoterapi diğer tedavilerle (cerrahi ve radyoterapi) art arda veya eş zamanlı olarak uygulanır. Örneğin; ameliyat öncesinde tümörü küçültmek amacıyla, ameliyattan sonra yayılmasını önlemek için kemoterapi yapılabilir. Aynı uygulamalar radyoterapi öncesinde ve sonrasında yapılabildiği gibi, radyoterapi ile aynı anda çeşitli yöntemlerle de kemoterapi uygulanabilir.
Kemoterapi Uygulama Sıklığı Ve Süresi Ne Kadardır?
Tedavi uygulama süresi ve sıklığı, hastalığın ve hastanın durumunuza göre özel olarak seçilen kemoterapi şemasına bağlıdır. Tedavi ile elde edilen cevaba ve oluşan yan etkilere göre süre ve sıklık doktor tarafından değiştirilebilir. Genellikle en sık kullanılan aralar 3 veya 4 hafta olmakla birlikte bazı tedavi şemalarına ek olarak haftada bir veya iki haftada bir uygulamalar da vardır. Kemoterapinin zamanlaması konusunda en önemli, hatta hayati önem taşıyan nokta, tedavinin mümkün olduğu kadar düzenli ve yan etkilerin izin verdiği ölçüde zamanında yapılmasıdır. Tedavi aralıkları gereksiz uzatıldığında, tümöre kendini toparlama ve ilaçlara direnç kazanarak daha da güçlenme riski kazandırılmış olur. Bu şekilde tümör büyümeye ve yayılmaya devam eder, tedavi başarı şansı azalır. Hastaların, kemoterapi randevuları konusunda kesinlikle doktorunun önerileri dışına çıkmaması gerekir.
Herhangi bir nedenle tedaviyi bırakmadan önce mutlaka doktorunuzla konuşarak sorunlarınızı anlatınız ve yardım isteyiniz.
Tedavi günlerine mutlaka uyunuz. Kendinizi iyi hissetmediğiniz gerekçesi ile asla kendi inisiyatifiniz ile tedavi gününüzü değiştirmeyin.
Evde kullanmak zorunda olduğunuz ilaçları mutlaka alın.
Aksi halde eksik tedaviden kaynaklanan tedavi başarısızlıkları ile karşı karşıya kalmak söz korusu olabilir.
Kemoterapi Nerede Uygulanır?
Kemoterapi mutlaka bu konuda eğitimli kişilerin çalıştığı merkezlerde uygulanmalıdır. Doktorun bilgi ve izni olmadan, kesinlikle herhangi bir hastanede veya evde, kemoterapi tecrübesi olmayan herhangi bir sağlık görevlisi tarafından uygulanmamalıdır.
*Sayfa içeriği sadece bilgilendirme amaçlıdır. Tanı ve tedavi için mutlaka doktorunuza başvurunuz.
LÖSEMİ (KAN KANSERİ) NEDİR? LEUKEMİA NEDİR?
Toplumda kan kanserinin türlerinden biri olarak bilinen lösemi, kemik iliğinden kaynağını alan ve kan üreten kök hücrelerinden birinin, çeşitli etkenlerin bir araya gelmesi ile gelişiminin bir basamağında duraklaması ve kontrolsüz aşırı çoğalmaya başlamasıdır. Leukemia olarak da bilinen lösemi (kan kanseri) öncelikle kemik iliğini, sonrasında da tüm organları ele geçirir. Vücudun kan üretim sistemi olan kemik iliği ve lenfatik sistemi etkileyen kan kanseri, tedavi edilmezse ilerleyici seyir gösteren kötü huylu kanserlerdendir. Lösemi; olgunlaşmış akyuvarların kontrolsüz artışına bağlı oluşursa kronik ve yavaş seyirlidir. Olgunlaşmamış akyuvarların kontrolsüz artışına bağlı gelişenler ise akut yani hızlı seyirli olarak tanımlanır. Hızlı seyirli olan kan kanserleri sıklıkla ani başlangıç gösterip özellikle 1-2 ay içerisinde klinik bulgu ve belirti verir. Bu nedenle kısa sürede tanı konulmalı ve en kısa sürede tedaviye başlanmalıdır.
Löseminin tam olarak nedeni bilinmese de özellikle radyasyon, benzen gibi kimyasallara ve tarım ilaçlarına maruz kalmanın lösemi riskini artırdığı bilinmektedir. Kan kanserlerinin en bilinenlerinden biri olan lösemi, hedefe yönelik akıllı ilaçların yanı sıra hastaya özel kök hücre nakil seçenekleri sayesinde başarıyla tedavi edilebilmektedir.
LÖSEMİ (KAN KANSERİ) ÇEŞİTLERİ NELERDİR?
Lösemi akut (aniden ortaya çıkan, hızlı ilerleyen) ve kronik (yavaş seyirli, müzmin) olarak iki grupta değerlendirilir. Akut lösemiler de akut lenfoblastik lösemi (ALL) ve akut miyeloblastik lösemi (AML) olmak üzere ikiye ayrılır. Kronik lösemiler de Kronik Lenfositik Lösemi (KLL) ve Kronik Miyeloid Lösemi (KML) olmak üzere alt gruplara ayrılmaktadır.
Lösemi çeşitleri arasında akut lösemiler son derece agresif ve hızla ilerleyen bir hastalık türüdür. Akut lösemi zamanında tanı konulup tedaviye başlanmazsa, günler veya haftalar içinde hastanın kaybedilmesine neden olabilir. Kronik lösemi ise çok yavaş seyirde uzun süre sessizce kalabilir ve yıllar içinde ilerleme gösterebilir.
AKUT LÖSEMİ NEDİR?
Kan kanserleri içerisinde akut löseminin görülme oranı % 15-20’dir. Akut lösemi, çocuklarda en çok görülen kanser tipi olup, çok hızlı ilerler. Her yaşta görülebilen akut löseminin ilerleyen yaşlarda görülme oranı da artar. Belirti ve bulgularıyla kendini çok kısa sürede belli eden akut lösemi kemik iliğinde bulunan ve kan hücrelerinin üretiminden sorumlu olan kök hücrelerin kanserleşerek kontrolsüz ve hızla çoğalması sonucu oluşur. Akut lösemide kanser hücreleri çok hızlı şekilde önce kemik iliğine ardından da tüm vücuda yayılır. Akut lösemi hastalarında lökosit adı verilen beyaz kan hücreleri yapılamadığından sık sık ağır enfeksiyon durumları görülebilir. Kan pıhtılaşmasından sorumlu olan trombosit hücreleri de üretilemediği için cilt kanamaları, mide bağırsak sisteminden olan kanamalar ya da hayati organlarda ciddi seyirli kanamalarla karşılaşılabilir. Akut lösemide en büyük belirti olan kansızlık, hastaların en kolay fark ettiği belirtilerden biridir. Ayrıca vücuttaki diğer organlara yayılma gösterdiğinden herhangi bir organda oluşan bozukluk olarak da karşımıza çıkabilir.
Akut lösemi kendi içerisinde birçok alt tipe sahip akut miyeloblastik lösemi (AML) ve akut lenfoblastik lösemi (ALL) olarak iki ana gruba ayrılır. Her biri çok hızlı ilerleyen bu tümör tiplerine karşı erken tanı, tiplendirme ve hızlıca tedaviye başlamak çok önemlidir. Belirtiler görüldüğünde uzman onkoloji merkezlerinde uzman doktorlar tarafından tanı koyulup, kişiye uygun tedavi yapılması planlanmalıdır.
KRONİK LÖSEMİ NEDİR?
Kronik lösemi ise akut lösemiye göre daha yavaş ilerleyen lösemi türüdür. Ancak kronik lösemi daha iyi sonuç verir. Olgun hücrelerin yapması gereken görevleri yerine getirmemesi ve anormal çoğalması ile ortaya çıkan kronik löseminin kronik lenfositik lösemi (KLL) ve kronik myelositer lösemi (KML) olmak üzere iki temel alt grubu bulunmaktadır.
LENFOSİTİK LÖSEMİ (KLL) NEDİR?
Lenfositik Lösemi (KLL), olgunlaşmış normal lenfositlere benzeyen ve enfeksiyonlara karşı vücudu koruyan, fakat işlevlerini yerine getiremeyen lösemik hücrelerin kemik iliğinde çoğalması ile ortaya çıkar. KLL hücreleri, kemik iliği, lenf nodları ve kana yerleşir, bunun neticesinde de lenf düğümleri şişer ve dalak büyür. Daha çok 60-70 yaş aralığında görülen KLL, tüm lösemilerin %30’nu oluşturur. Hastalık çok yavaş ilerlediği için hastalar tanı konulmadan uzun süre yaşayabilir. Tanı sonrasında ise bazı hastalarda KLL problem yaratmadığı sürece tedaviye gerek duyulmaz. KLL tanısı hastalığa özel olan genetik bir değişikliğin özel yöntemlerle tespit edilmesi ile konulur. Geçmişte kemoterapi ve kemik iliği nakli ile oldukça zor tedavi edilen bu hastalık günümüzde çok basit şekilde tedavi edilebilmektedir.
LÖSEMİ (KAN KANSERİ) NEDENLERİ NELERDİR?
Löseminin kesin olarak nedeni bilinmese de bilim adamları viral, genetik, çevresel veya immünolojik faktörlerin rol aldığını düşünmektedir. Bunlardan bazıları şunlardır;
- Yüksek düzeyde radyasyona maruz kalma
- Benzen ve formaldehit gibi sanayide kullanılan kimyasallara maruz kalma
- Kemoterapi ilaçlarının bir kısmı
- Bazı genetik hastalıklar (down sendromu vb.)
- Virüsler
Ancak bu risk faktörleri löseminin çok küçük bir kısmının nedenlerini açıklar. Lösemiye yakalanan hastaların çoğunluğunda hiçbir risk faktörü gösterilememiştir.
Lösemiye yol açan diğer nedenler;
- Tablet ve cep telefonu gibi teknolojik cihazların uzun saatler çocuklar tarafından kullanılması
- Hava kirliliği
- Gıda maddelerindeki katkılar
- Kimyasal maddeler
- Çürümüş gıdalar
LÖSEMİ (KAN KANSERİ) BELİRTİLERİ NELERDİR?
Lösemi belirtileri çeşidine bağlı olarak değişmektedir. Kan kanseri belirtileri diğer kan kanserlerinde gözlenen bazı bulgularla ortak özellikler gösterebilir. Kansızlığa bağlı olarak;
- Solukluk,
- Halsizlik,
- Çabuk yorulma,
- Efor sırasında nefes darlığı gibi belirtiler gözlemlenir.
Lösemi (kan kanseri) belirtileri arasında bağışıklık sisteminin zayıflaması nedeniyle gelişen enfeksiyonlar sonucu diş etleri, burun, diş etleri ve cilt altında beklenmeyen kanamalara, morarmalar ve toplu iğne başı büyüklüğünde, basmakla solmayan kırmızı döküntülere rastlanır. Akut lösemi belirtilerinde ise bu bulgular dikkat çeker;
- Solukluk, halsizlik,
- İştahsızlık, kilo kaybı,
- Gece terlemesi,
- Uygun tedavi ile kontrol altına alınamayan, sık tekrarlayan ateş, enfeksiyonlar,
- Kemik ağrıları,
- Cilt altında kanama (toplu iğne başı kadar küçük kırmızı döküntüler, kolay ortaya çıkan morarmalar)
- Burun ve diş eti kanamaları, boyun ve koltuk altı lenf bezlerinde, karında şişlik, diş etlerinde kabarma.
Kan kanseri belirtileri pek çok hastalığın belirtileri ile aynı seyredebilir. Vücudun tüm organlarına yayılabilen lösemi özellikle romatizmal hastalıklar, enfeksiyon hastalıkları, kanamalı hastalıklar, lenfoma, myeloma ve diğer kan kanserleri belirtileri ile benzer belirtilere sahip olabilir.
ÇOCUKLARDA LÖSEMİ BELİRTİLERİ NELERDİR?
Tüm çocukluk kanserleri göz önüne alındığında yaklaşık yüzde 30’unun lösemi olduğu görülmektedir. Çocukluk çağı kanserleri ve lösemi sıklıkla 2-5 yaş ya da 5-10 yaş aralığında görülmektedir. Çocuklarda löseminin çok kapsamlı klinik bulguları olsa da bazı belirtilerden şüphelenmek gerekir. Bunları şöyle sıralayabiliriz;
- Hızlı kilo kaybı
- İştahsızlık
- Renkte solukluk
- Vücutta morluklar ya da beklenmedik bezelerin uzun süre devam etmesi veya giderek Büyümesi
- Karında şişlik
- Eklem ağrıları
- Uzun süre devam eden ve 5 günün üzerinde süren inatçı ateş
Yeni doğan bebekler 6-8 ay kadar anneden aldığı bağışıklık sistemini sürdürebilir. Sonrasında ise 2 yaşına kadar kendi bağışıklık sistemini kurar. Bu döneme kadar yılda 5 kez enfeksiyon geçirebilir. Viral enfeksiyonlar lösemi kanserlerini tetikleyebileceği unutulmamalıdır.
Çocuklarda löseminin nedenlerinden biri de D vitamini eksikliğidir. Erken yaşta görülen raşitizm ve buna bağlı olarak ortaya çıkan D vitamini eksikliğinin kanser üzerinde etkili olduğunu gösteren çok sayıda çalışma bulunmaktadır. Bu nedenle çocukların uygun hava şartlarında ve uzmanların önerdiği saatlerde güneş görmesi çok önemlidir. Lösemide genetik faktörlerin önemi de göz ardı edilememelidir.
LÖSEMİ (KAN KANSERİ) TANISI NASIL KONULUR? TANI YÖNTEMLERİ NELERDİR?
Lösemide erken tanı çok önemlidir. Kan hücrelerinin üremesini ve fonksiyonunu etkileyen lösemi, kemik iliğinde bulunan hücreleri olgunlaştırarak eritrosit, lökosit veya trombosite dönüştürür. Lösemide lösemik hücreler (blastlar) kontrolsüz bir şekilde çoğalır ve normal kan hücrelerinin gelişimini baskılar. Kan üretilememesiyle ortaya çıkan enfeksiyon, kanama gibi ciddi şikayetler doğrultusunda tanı için kan ve kemik iliği dokusu örneği alınıp, incelenir. Genellikle basit bir kan sayımı ve kandaki hücrelerin mikroskop altında incelenmesi de tanı için yeterlidir. Ancak kesin tanı kemik iliği biyopsisi ile konulmaktadır.
Lösemilerin yaklaşık %95’ini akut lösemiler oluşturur. Akut lösemilerin %85’i akut lenfoblastik ve %15’i de myeloblastik lösemidir. Bunlar içerisinde akut lenfoblastik lösemilere tedavi açısından daha olumlu cevap alınır. Çocuklarda beklenen yaşam süresi daha uzun olduğu için erişkin kanserleri ile kıyaslandığında başarı oranlarının daha yüksek olması nedeniyle erken tanı ve tedavi büyük önem taşımaktadır.
Lösemi (kan kanseri) tanısını koyabilmek için hastanın öyküsü dinlenmeli. Muayenenin yanı sıra ileri tanı yöntemleri ile incelemelerin yapılması gerekmektedir.
Muayene:
Lösemi (kan kanseri) şüphesi olan kişiye öncelikle iyi bir fizik muayene yapılmalıdır (lenf bezlerinde şişlik, karaciğer, dalak büyüklüğü yönünden değerlendirilmelidir.)
Uygun kan incelemeleri:
Kan sayımı ve gerekli biyokimyasal incelemeler
Kemik iliği biyopsisi:
Kalça kemiğinden alınan kemik iliği incelenmelidir. Kemik iliği biyopsisi ve kemik iliği sıvısının cam üzerine yayılarak patolojik incelenmesi.
Genetik incelemeler:
Kemik iliği veya kandan alınan numunelerden lösemi hücrelerinin genetik incelemeleri
AKUT LÖSEMİ TANISI NASIL KONULUR?
Akut lösemi tanısını koymak çok da zor değildir. Basit bir tam kan sayımı ile akut lösemi teşhisi konabilmektedir. Tam kan sayımında; normal kan hücre sayılarının azalması ve “blast” adını verilen kanser hücrelerinin sayısında artış olduğu saptanarak, lösemi tanısı rahatlıkla konulabilir. Kemik iliğinden alınan biyopsi ile de kanser hücreleri tarafından kemik iliğinin tutulduğu görülebilir. Lösemi tanısında zor olan kısım ise kanser türünün tipini belirlemektir. “İmmun fenotipik” yöntemi, çeşitli sitogenetik ve moleküler testler ile farklı tiplerdeki akut lösemileri birbirinden ayırabilir.
Löseminin alt türünün belirlenmesi tedavi sürecini doğrudan ilgilendirdiği için çok önemlidir. Çünkü löseminin tüm alt tipleri için farklı tedavi yöntemleri bulunur. Eğer hastaya akut lösemi teşhisi konulduysa risk durumları saptanmaya çalışılır. Yetişkinlerde akut lösemi tanısı konulduğunda, hastaların % 70-80’ninden fazlasının yüksek risk grubuna girdiği bilinmekte. Bu da lösemi kontrol altına alınsa bile çok kısa sürede tekrarlayabilir anlamına gelmektedir.
LÖSEMİ (KAN KANSERİ) TEDAVİSİ NASILDIR?
Lösemi tedavisi birçok disiplini ilgilendirir. Tam donanımlı hastanelerde yetişkin ve çocuk hematoloji uzmanları tarafından tedavi edilir. Lösemi tedavi edilen onkoloji merkezi, kemoterapi uygulaması amacı ile iyi yetişmiş bir hemşire ekibi, 24 saat hizmet veren teşekküllü bir kan bankası, enfeksiyon hastalıkları uzmanı, gereğinde ışın tedavisi vermek açısından radyasyon onkolojisi uzmanı ve sofistike laboratuvar alt yapısı bulunması gerekmektedir.
Lösemi tedavi edilebilen bir hastalık olup, son yıllarda keşfedilen pek çok yeni yöntem ile tedavinin başarı oranı da her geçen gün artmaktadır. Yeni kemoterapötik ajanların keşfi, hedefe yönelik moleküler ilaçlar ve biyolojik ilaç tedavilerinin günlük kullanıma girmesi, gelişmiş radyoterapi cihazlarının geliştirilmesi, kemik iliği nakliyle ilişkili gelişmeler, hastaların yaşam sürelerinin uzatılmasında ve hastalığın tam olarak tedavi edilmesinde büyük aşamalar kat edilmesine sebep olmuştur.
Lösemi tedavisi için akla gelen ilk tedavi yöntemi kemoterapidir. Kemoterapi ilaçlarının tipi, dozu, uygulama yolu löseminin tipine göre farklılık gösterebilir. Yaklaşık 24 ay süren kemoterapi tedavisi dışında kemik nakli de bazı lösemi türlerinin tedavisinde akla gelen bir diğer yöntemdir. Ülkemizde lösemi tedavisinde ulaşılan başarı oranları, gerek kemoterapi gerekse kemik iliği nakliyle dünya standartlarındadır.
Kronik miyeloid lösemiler 2000 yılından itibaren büyük oranda tedavi edilebilmektedir. Hastalık iyi tanındığından mekanizmayı bozan ilaçlar kullanılmaktadır. Hedefe yönelik tedavi adı verilen bu tedavi ile kemik iliğinde sürekli çoğalan miyeloid kökenli hücrelerin olgunlaşmadan ya da olgunlaşarak kana karışmasını engellemektedir. İlaçlarla kontrol altına alınamayan hastalarda ise en etkin tedavi yöntemi “allojenik kök hücre nakli”dir. Kök hücre nakli, doku uyumlu kardeş, yakın akraba veya akraba dışı gönüllü bağışçıdan alınan kök hücreler yardımı ile yapılmaktadır. Yavaş seyreden lösemi türü olan kronik lenfositik lösemiler (KLL) için erken evrelerde sadece destek amaçlı tedaviler verilir. İleri evrelerde veya yüksek riskli hastalarda ilaçlar veya hedefe yönelik antikorlar (immünoterapi) uygulanabilir. Kronik lenfositik lösemi, ileri yaş hastalığı olmasına rağmen 50 yaş öncesinde de görülebilmektedir. Yüksek riskli bu hastalarda da allojenik kök hücre nakli tedavi seçeneklerinden biridir.
LÖSEMİ İLE İLGİLİ BİLMENİZ GEREKENLER
- Lösemi kadınlara oranla erkeklerde daha sık görülür.
- Özellikle beyaz ırkta, siyah ve sarı ırka göre daha fazla rastlanır.
- Yetişkinlerde lösemi tanısı sıklığı, çocukların 10 katından fazladır ve yaş ilerledikçe risk de artar.
- Çocukluk çağında lösemi 4 yaşın altında daha sıktır.
- Bazı lösemilerde genetik yatkınlık önemlidir.
- Down sendromu gibi genetik hastalıklarda akut lösemi türlerinin daha sık görüldüğü bilinmektedir.
- KML oluşumunda radyasyon ve benzen gibi kimyasallara maruz kalmaktan da söz edilebilir.
- Başka bir kanser için kemoterapi tedavisi görmüş olmak, sigara kullanmak ve bazı kan hastalıklarının varlığı da lösemi nedenleri arasında gösterilmektedir.
- ABD’de her 4 dakikada bir 1 kişi kan kanserine yakalanmaktadır.
- 2016 yılında sadece ABD’de yeni lösemi tanısı konan hasta sayısı 60 bindir.
- Akut lösemi %35’lik oranı ile çocukluk çağında en sık görülen kanser türüdür.
- Bir kadın veya erkeğe tüm yaşamı süresince lösemi tanısı konulma olasılığı % 1.5 olarak tahmin edilmektedir.
- Günümüzde lösemi teşhisi konan hastaların 10 yıldan uzun yaşama oranı 70’li yıllara göre 4 kat artmıştır.
- 2006-2012 yılları arasında lösemi hastalarının 5 yıllık yaşam oranı % 60 olarak saptanmıştır.
- Lösemi teşhisi konan 10 çocuktan 8’i tamamen tedavi olabilmektedir.
AKUT LENFOBLASTİK LÖSEMİ NEDİR?
Akut lenfoblastik lösemi (ALL), kan ve kemik iliğini etkileyen bir kanser türüdür. Hızlı ve agresif bir şekilde ilerler ve acil tedavi gerektirir. ALL, lenfoblastlar veya lösemik patlamalar olarak adlandırılan olgunlaşmamış beyaz kan hücrelerinin aşırı üretimi ile karakterize edilir. Kemik iliği, kırmızı kan hücreleri, beyaz kan hücreleri ve trombosit olmak üzere üç önemli kan hücresi türüne dönüşme yeteneğine sahip kök hücreler üretir. Kemik iliği, tamamen gelişmiş kan hücreleri haline gelene kadar kök hücreleri genellikle kana salmaz. Ancak akut lenfoblastik lösemide, çok sayıda beyaz kan hücresi daha hazır olmadan salınır. Bunlar patlama hücreleri olarak bilinir. Blast hücrelerinin sayısı arttıkça kırmızı kan hücrelerinin ve trombosit hücrelerinin sayısı azalır. Kemik iliği yeterli sayıda alyuvar, normal beyaz küre ve trombosit üretemediği için ALL’li kişiler anemiye, tekrarlayan enfeksiyonlara ve kolayca morarma ve kanamaya karşı daha duyarlı hale gelir. Patlama hücreleri daha sonra kemik iliğinden kan dolaşımına dökülebilir ve lenf düğümleri (bezler), dalak, karaciğer ve merkezi sinir sistemi (beyin ve omurilik) dahil olmak üzere çeşitli organlarda birikebilir.
ALL her yaşta ortaya çıkabilir, ancak tüm vakaların yaklaşık yüzde 60’ını oluşturan küçük çocuklarda (0-14 yaş) daha sık görülür. ALL, en yaygın çocukluk çağı lösemisi türüdür ve en yaygın çocukluk çağı kanseridir. Erkek çocukları, kız çocuklarından biraz daha fazla etkilenir. Tedavi ile bu günlerde, ALL’li çocukların çoğunun hastalığı iyileşirken, yetişkinlerde kür oranları daha değişken olmaktadır.
LÖSEMİ (KAN KANSERİ) HAKKINDA SIK SORULAN SORULAR
Lösemide kök hücre nakli nasıl yapılır?
Lösemi tedavisinde ilaç tedavisi ile erken dönemde hastalığı kontrol altına alınanlarda, hastalığın tekrarlama riski yüksekse, kök hücre nakli tercih edilir. Kök hücre nakli; kişinin kendisinden (otolog) veya doku uyumlu kardeş, diğer yakın akraba veya akraba dışı gönüllü bağışçılardan alınan kök hücrelerle (allojenik) yapılmaktadır. Kök hücre nakli için kök hücreler, vericiye anestezi uygulayarak kalça kemiğinden veya kök hücreleri uyarıcı ilaçlar kullanıldıktan sonra özel cihazlarla damardan çekilerek toplanır. Kök hücre nakli öncesi hastaya yüksek dozda ilaç ve/veya ışın (radyoterapi) tedavisi uygulanır. Bu aşamanın amacı hastanın vücudunda kalma ihtimali olan kanser hücrelerini yok etmek ve hastanın kemik iliğindeki hücreleri boşaltmaktır. Sonrasında nakil gerçekleştirilir. Uygun kök hücre vericisi bulunamayan hastalarda “otolog nakil” yapılabilir, ancak asıl etkili tedavi allojenik kök hücre naklidir. Nakil sonrası hastaların ciddi problemlerle karşılaşmaması için uzun yıllar takip edilmeleri gerekebilir.
Son dönemlerde uygun kök hücre vericisi bulunamayan ve yüksek tekrarlama riskine sahip hastalara kısmen uygun (%50-80 uyumlu) akrabalardan, “haploidentik” olarak isimlendirilen kök hücre nakli de yapılabilmektedir. Haploidentik nakil ile hastalığın riskine bağlı olarak hastaların yaklaşık yarısında bir yıldan daha uzun süreli hastalık kontrolü ve yaşam sağlanabilmektedir. Ancak bu gruptaki hastaların doku uyumsuzluğu sonucu bağışıklık sistemleri baskılandığında, tam donanımlı ve deneyimli merkezlerde sıkı takibinin yapılması gerekmektedir.
Kök hücre nakli kimlere yapılmalı?
Kök hücre nakli yapılırken bazı noktalara dikkat etmek gerekir. Hastanın yaşı, ilave sağlık sorunu olup olmadığı, hastanın orta ve yüksek riskli grupta mı yer aldığına ilişkin kriterler göz önüne alınarak gerekli değerlendirme yapılmaktadır. Bazı hastalar tedaviye daha geç cevap vermekte ya da hastalıkları daha çabuk tekrarlamaktadır. Bu tip hastalarda, hastalığın tekrarlama riski bazı gen değişikliklerinin varlığı ile belirlenebilir. Gen değişikliklerinin incelenmesi sonucunda yüksek riskli olarak adlandırılan grupta yer alan hastalara (yaşı gençse ve ilave hastalığı yoksa) allojenik nakil yapılmalıdır. Tekrarlama riski düşük olan hastalarda; kök hücre nakli, yan etkilerin fazla olması ve bazen yaşamı tehdit eden yan etkiler gelişmesi nedeniyle ilk aşamada önerilmez. Ancak hastalığın tekrarlaması halinde kök hücre nakli uygulanır. Başlangıç tedavisi ile cevap alınamayan kan kanserlerinde ise allojenik nakil bir tedavi seçeneği olarak uygulanabilir.
Akut lösemi tedavisi nasıldır?
Akut kan kanserlerinin tedavisinde ilk aşama kimyasal tedavi tedavisidir. Tedavi hastalığın türüne göre iki veya üç aşamada uygulanır. Tedavinin başlangıcında kanser hücrelerinin sayısının azaltılması, normal hücrelerin sayısının artırılması ve hastalığın belirtilerinin yok edilmesi hedeflenir. Bu en önemli aşamadır. Bu aşama başarıyla tamamlansa bile hastaların büyük bir kısmında kanser hücreleri tekrar çoğalmaya başlayabilir ve hastalık tekrarlar. Kontrol sağlandıktan sonra hastalığın tekrarlamasını önlemek amacıyla pekiştirme olarak isimlendirilen tedaviler uygulanır. Pekiştirme tedavisi yine kemoterapötik ilaçlar veya kök hücre nakli ile yapılır. Ayrıca akut lenfoblastik lösemili (ALL) hastaların tedavisinde, hastalığın tekrarını önlemek için 2-3 yıl sürebilen idame tedavi dönemi vardır. Bu aşamalarda hastaların mutlaka yakın takibi gerekir. Hasta takibi tam donanımlı kliniklerde ve steril odalarda uzman bir ekip tarafından yapılmalıdır.
Akut lösemi tekrarlar mı?
Akut lösemi bazı durumlarda tekrarlayabilir. Akut lösemi tedavisinde verilen yüksek doz kemoterapi ile hastalık baskı altına alınır. Ancak hastaların büyük bir bölümünde yüksek risk grubuna girdiği için genellikle ilk bir yıl içerisinde lösemi tekrarlayabilir. Lösemide tekrarı önleyebilmek için de kök hücreler ile allojenik kemik iliği nakli yapılması önerilir. Öncelikle hastanın kardeşleri değerlendirilir ve uyumlu iseler kök hücreleri nakledilir. Uyumlu kardeş bulunamaz ise kemik iliği bankalarına başvurulur ve verici araştırılır. Allojenik kök hücre naklinin amacı hastalığın ilerde tekrar etme riskini düşürmektir. Günümüzde tam uyumlu kök hücre vericisi bulunamasa da uyumlu nakiller yapılmaktadır. Ayrıca ileri yaştaki hastalar için düşük doz ilaçların kullanıldığı mini nakiller yapılıp, kök hücre nakli şansı tanınabilmektedir.
Kronik lösemi (KLL tedavisi) nasıl yapılır?
KLL tanısı konulan her hastaya hemen tedavi başlamak gerekli olmayabilir. Çünkü KLL hastalarının çoğu uzun yıllar tedaviye ihtiyaç duymaz. Kalan kısımda ise hastalık birkaç yıl ilerleyici özellik göstermekte ve tedavi ihtiyacı doğmaktadır. Tedaviye başlarken hastalığın ilerleyici, çeşitli bulgulara göstermesi ve organ etkilenmesinin olmaması önemli kriterlerdir. Hastalık belirtileri tedavinin de önemli bir etkisi olmamaktadır. Bazı özel laboratuvar değerlendirmeleri ile hastalığın risk faktörleri belirlenir ve kişiye özel tedavi planlanır. Kronik lösemi tedavisinde amaç hastalığı baskı altına alıp hastaya zarar vermesini engellemektir. Kemoterapi dışında akıllı ilaçlar ile sadece kanser hücreleri hedef alındığı için günümüzde sıklıkla tercih edilmektedir. Akıllı ilaçlar sağlıklı hücreleri çok az etkiledikleri için kemoterapi tedavisine göre yan etkileri çok daha azdır. İleri yaşta daha çok görülen KLL için akıllı ilaçlar çok daha faydalı olmaktadır.
KML nasıl tedavi edilir?
Kronik löseminin en çok görülen ikinci türü olan KML tedavisinde 2000’li yılların başında çığır açacak gelişmeler yaşanmıştır. KLM hastalarında lösemiye kök hücrelerde sonradan ortaya çıkan BCR/ABL mutasyonu adı verilen genetik bir değişiklik neden olmaktadır. Bu değişikliğin saptanabilmesi KML tanısını çok basitleştirmiş hem de bu bozulmuş olan sisteme karşı ilaç geliştirilmesini sağlamıştır. Bununla beraber trozin kinaz inhibitörlerinin (TKI) kullanılması da hastalığa karşı geliştirilen etkili bir tedavi yöntemi olmuştur. Günümüzde ağız yoluyla aldıkları TKI kullanımı sayesinde KML hastalarının çoğu normal yaşam sürelerine yakın bir ömür sürebilmektedir.
*Sayfa içeriği sadece bilgilendirme amaçlıdır. Tanı ve tedavi için mutlaka doktorunuza başvurunuz.
MULTİPL MİYELOM NEDİR?
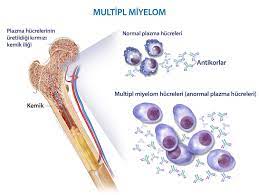
Multipl miyelom, vücudun enfeksiyonlarla savaşmasına yardımcı olan kemik iliğinde protein üreten plazma hücrelerini etkileyen bir kanser türüdür. Hastalık genellikle omurga, kafatası, pelvis (leğen kemiği), göğüs kafesi, omuzlar ve kalçalar çevrelerini tuttuğu için multiple miyelom olarak adlandırılmıştır. Plazma hücreleri, kan hücreleri üreten kemik iliğinde bulunan bir tür beyaz kan hücresidir. Sağlıklı plazma hücreleri antikor üreterek vücudumuzu hastalıklar ve enfeksiyonlara karşı korur. Kemik iliğindeki anormal bir plazma hücresinin gelişmesi ve hızlı bir şekilde çoğalması ise multipl miyelom kanserine neden olur. Sağlıklı kan hücreleri gibi kanserli hücreler de antikor üretmeye çalışır. Bununla birlikte, yalnızca monoklonal proteinler veya M proteinleri adı verilen anormal antikorlar üretebilirler. Bu zararlı antikorlar vücutta biriktiğinde böbrek hasarına ve diğer ciddi sorunlara yol açabilir.
MULTİPL MİYELOMUN NEDENLERİ NEDİR?
Multipl miyelom kanserinin neden oluştuğu henüz kesin olarak bilinmemektedir. Ancak kanserin kemik iliğinde olması gerekenden çok daha fazla hızla çoğalan bir anormal plazma hücresiyle oluştuğu bilinmektedir. Normal bir yaşam döngüsü olmayan miyelom hücreleri süresiz olarak bölünmeye devam ederler. Bu durumda sağlıklı hücrelerin üretimini bozabilir.
MULTİPL MİYELOM KİMLERDE GÖRÜLÜR?
Multipl miyelom kanserinin kesin nedeni bilinmemektedir. Ancak kimlerin risk altında olduğu bilinmektedir. İlerleyen yaş multipl miyelom geliştirme riskini artırmaktadır. Multipl miyelom genellikle 60 yaş üzerindeki kişilerde görülürken 35 yaşın altında nadir de olsa görülmektedir. Multipl miyelom riski taşıyan şunlardır:
- Yaş: Multipl miyelom çoğunlukla 60 yaş üzerindeki kişilerde görülür. Bu nedenle ilerleyen yaş multipl miyelom riskini artırmaktadır.
- Irk: Multipl miyelom riski siyah ırklarda diğer ırklara göre daha yüksektir. Irklar arasındaki bu farklılığın nedeni ise bilinmemektedir.
- Erkek olanlar: Erkeklerin multipl miyelom kanserine yakalanma riski kadınlara göre daha yüksektir. Bu hastalığın erkeklerde neden daha fazla görüldüğü henüz bilinmemektedir.
- Kişide anlamı belirsiz monoklonal gamopati (MGUS) öyküsü: MGUS, anormal plazma hücrelerinin M proteinlerini ürettiği benign (iyicil) bir durumdur. Genellikle semptom yoktur ve anormal M protein seviyesi kan testi ile bulunur. Bazen MGUS’si olan kişilerde multipl miyelom gibi belirli kanserler gelişir. Bir tedavisi yoktur ancak MGUS’si olan kişilere M protein seviyesindeki artışı kontrol etmek için düzenli laboratuar testleri (her 1 veya 2 yılda bir) yapılır. Semptom gelişimini kontrol etmek için de düzenli muayeneler yapılır.
- Ailede multipl miyelom öyküsü: Multipl miyelom genetik bir hastalık değildir. Ancak yapılan araştırmalar yakın akrabasında multipl miyelom hastalığı olan kişilerin hastalığa yakalanma riskinin daha yüksek olduğunu göstermiştir.
MULTİPL MİYELOM BELİRTİLERİ NELERDİR?
Multipl miyelomun herhangi bir belirti vermeden ilerleyebilir. Hastalığın belirtileri kişiye göre değişiklik gösterebilir. Multipl miyelomun belirtileri şöyle sıralanabilir:
- Kemik ağrısı( Genellikle sırt ve kaburgalarda)
- Kemik kırıkları( Genellikle omurgada)
- Halsiz ve çok yorgun hissetmek
- Çok susamış hissetmek
- Sık enfeksiyon geçirme
- Ateş
- İştah kaybı
- Kilo kaybı
- Bulantı
- Kabızlık
- Sık idrara çıkma
MULTİPL MİYELOMUN EVRE BELİRTİLERİ NELERDİR?
Multipl miyelom şüphesiyle gelen hastaya çeşitli tetkikler yapılmaktadır. Biyopsisinde multipl miyelom çıkan hastanın doktoruyla birlikte tedavi planlaması yapması gerekmektedir. Hastalığın yayılım derecesi(evre) ekstra tetkikler yapılması gerekmektedir. Multipl miyelom kanserinin kesin tanısı için yapılan tetkikler şunlardır:
- Kan testleri: Multipl miyelom kanseri evrelerinin belirlenmesi için albümin ve beta-2-mikroglobulin gibi kan testlerinin yapılması gerekir.
- BT taraması: Kemiklerin detaylı resimleri bilgisayara bağlı x-ray cihazı ile çekilir.
- MRI: Kemiklerinizin detaylı resimlerini oluşturmak için bilgisayara bağlı güçlü bir mıknatıs kullanılır.
Doktorlar multipl miyelomu asemptomatik, Evre I, Evre II veya Evre III olarak tarif edebilir. Evrelemede kanserin kemik veya böbreklerinizde probleme neden olup olmadığı dikkate alınmaktadır. Asemptomatik multipl miyelom, herhangi bir semptomun olmadığı hastalığın erken aşamasıdır. Örneğin, kemik hasarı yoktur. Semptomun olduğu (kemik hasarı gibi) erken hastalık aşaması Evre I’dir. Evre II veya III daha ileri aşamalardır ve vücutta daha fazla miyelom hücresi bulunmaktadır.
MULTİPL MİYELOM HASTALIĞI TANISI NASIL KONULUR?
Multipl miyelom bazen rutin kan testi ile teşhis edilebilir. Sıklıkla kemik kırığı nedeniyle çekilen bir x-ray filmi sonrası doktorlar multipl miyelomdan şüphelenir. Genellikle hastalar başka semptomları olduğu için doktora gider. Bu tür problemlerin multipl miyelomdan mı yoksa başka durumlardan mı kaynaklandığını bulmak için doktorunuz aile hikayesi ve fizik muayeden sonra şu tetkikleri ister:
- Kan testleri: Laboratuvarda bazı kan testleri yapılmaktadır:
- Multipl miyelom proteinlerin kanda yüksek seviyede olmasına neden olur. Laboratuar testinde M proteini ve diğer immünoglobulinleri (antikorlar), albümin ve beta-2-mikroglobulini içeren birçok farklı proteinin seviyesi kontrol edilir.
- Miyelom ayrıca anemiye, beyaz kan hücreleri ve trombosit seviyelerinin düşük olmasına neden olabilir. Beyaz kan hücrelerinin, kırmızı kan hücrelerinin ve trombositlerin sayısını ölçmek için laboratuarda tam kan sayımı yapılır.
- Laboratuarda ayrıca kalsiyum seviyesinin yüksek olup olmadığı kontrol edilir.
- Böbreklerin iyi çalışıp çalışmadığını anlamak için kreatinin ölçümü yapılır.
- İdrar testleri: İdrarda M proteininin bir tipi olan Bence Jones proteini aranır. 24-saatlik idrarda Bence Jones protein miktarı ölçülür. Eğer idrar örneğinizde Bence Jones protein seviyesi yüksek bulunursa doktorunuz böbreklerinizi takip edecektir. Bence Jones proteini böbrekleri tıkayıp hasara neden olabilir.
- X-ray: Kırık veya incelmiş kemiklerinizi kontrol etmek için film çekilebilir. Miyelomun kaç tane kemiğe zarar verdiğini görmek için tüm vücudunuzun filmi çekilebilir.
- Biyopsi: Doktorunuz kanser hücrelerini aramak için doku örneği alır. Kemik iliğinizde miyelom hücrelerinin olup olmadığını bilmenin tek kesin yolu biyopsidir. Örnek alınmadan önce, bölgenin uyuşturulması için lokal anestezi kullanılır. Bu ağrının azalmasına yardım eder. Doktorunuz kalça kemiğinizden veya başka bir büyük kemiğinizden bir miktar kemik iliği çıkarır. Patolog dokuyu miyelom hücreleri açısından araştırmak için mikroskop kullanır.
- Doktorunuzun kemik iliği alabilmesi için iki yol vardır. Bazı kişilere aynı seansta her iki işlem de uygulanır:
- Kemik iliği aspirasyonu: Doktor kemik iliği örneği almak için kalın, içi delik bir iğne kullanır.
- Kemik iliği biyopsisi: Doktor ufak bir kemik parçası ve kemik iliği çıkarmak için daha kalın, içi delik bir iğne kullanır.
MULTİPL MİYELOMUN TEDAVİ YÖNTEMLERİ NELERDİR?
Multipl miyelom hastasıysanız ve herhangi bir belirti yaşamıyorsanız, doktorunuz tedavi başlatmadan önce hastalığın ilerleyip ilerlemediğini yakından takip eder. Düzenli bir şekilde kan ve idrar testleri yapılarak hastalığın seyri takip edilerek tedavi sürecine karar verilir.
Hastanın ağrılarını hafifletmek, komplikasyonları azaltmak ve hastalığın ilerlemesini yavaşlatmak için yardımcı olabilecek tedavileri vardır. Bu tedaviler de hastalığın ilerlemesi durumunda kullanılmaktadır. Multipl miyelom tedavisinde yaygın olarak kullanılan tedavi seçenekleri şunlardır:
Hedefe yönelik tedavi: Multipl miyelom tedavisinde kullanılan hedefe yönelik tedavi ile hastaya damardan ya da hap şeklinde verilen ilaçlarla miyelom hücrelerindeki proteinleri yok ederek kanser hücrelerinin ölmesi sağlanır.
Kemoterapi: Damardan ya da hap şeklinde verilen kemoterapi, genellikle kök hücre naklinden önce yüksek dozlarda verilir. Agresif bir ilaç tedavisi olan kemoterapi ile miyelom ve diğer hızlı büyüyen hücrelerin yok olması sağlanır.
Kortikosteroidler: Vücuttaki iltihabı azaltarak bağışıklık sistemini dengelemek ve miyelom hücrelerini tedavi etmek için hap şeklinde ya da damardan verilen bir tedavi türüdür.
Radyasyon tedavisi: Miyelom hücrelerinin büyümelerini durdurmak, küçültmek ve yok etmek için güçlü radyasyon enerji ve ışınları kullanılır.
Otolog kemik iliği nakli: Hastalıklı kemik iliği tedavi edildikten sonra hastanın kendisinden kök hücre toplanıp.Ardından da yüksek doz kemoterapi verilip hastaya toplanan kök hücresi geri verilir. Böylece kök hücreler vücudunuza aşılanabilir, burada kemiklere taşınırlar ve kemik iliğini yeniden oluşturmaya başlarlar.Buna Otolog Kemik iliği nakli adı verilir.
MULTİPL MİYELOMDAN KORUNMAK İÇİN NELER YAPMAK GEREKİR?
Multipl miyelom kanserinin kesin nedeni bilinmediği için hastalıktan korunma şeklide bilinmemektedir.
MULTİPL MİYELOM HAKKINDA SIK SORULAN SORULAR
Multipl miyelom hastalığı erken teşhis edilebilir mi?
Multipl miyelom kanseri ilerleyen tıbbı teknolojik imkanlarla günümüzde erken teşhis edilebilmektedir.
Multipl miyelom ölüm riski nedir?
Her Kanserden olduğu gibi multipl miyolem de tedavi edilmezse ölüm riski yüksektir.
Multipl miyelom hastası ne kadar yasar?
Multipl miyelom hastaları yeni geliştirilen kemoterapik ilaçlar sayesinde daha uzun yaşayabilir.
Multipl miyelom genetik bir hastalık mıdır?
Ailesinde multipl miyelom hastalığı olan kişi bu hastalık konusunda daha fazla risk altındadır. Ancak bu hastalığın genetik bir hastalık olmadığı düşünülmektedir.
Multipl miyelom hastası nasıl beslenmeli?
Multipl miyelon hastaları beslenme programlarını tedaviyi yürüten doktor kontrolünde yapmalıdır. Doktorunun önereceği şekilde protein ağırlıklı beslenmelidir.
Multipl miyelom kanser mi?
Multipl miyelom olarak da bilinen miyelom, plazma hücrelerinden kaynaklanan bir kemik iliği kanseridir.
Multipl miyelom hastalığının bitkisel tedavisi var mı?
Bilimsel makalelerde zencefilin kemoterapi tedavisi gören multipl miyelom hastalarına iyi geldiğini belirten yazılar mevcuttur.
Multipl miyelom kemoterapi görür mü?
Diğer kanser türlerinde olduğu gibi multipl miyelom kanserinde de damardan ya da hap şeklinde verilen kemoterapi tedavisi uygulanır.
Multipl miyelom hastasının tedavi şansı nedir?
Multipl miyelom kanserinin ilerlemesi ve hastalığın yayılmaması için uygulanan tedavi yöntemlerinden başarılı bir şekilde sonuçlar alınabilmektedir
Multipl miyelom kemik iliği nakli yapılır mı?
Multipl miyelom hastalarına otolog kemik iliği nakli yapılmaktadır.
Multipl miyelom kemik iliği nakli sonrası yaşamı nasıldır?
Multipl miyelom hastalarına Otolog kemik iliği nakli yapıldıktan yaklaşık 6 ay sonra normal hayatına dönebilir.
Multipl miyelom hastasına kök hücre nakli yapılır mı?
Multipl miyelom hastalarına Otolog kemik iliği nakli yapılmaktadır.
Multipl miyelom metastaz yapar mı?
Multipl miyelom daha çok kemiklere metastaz yapar.
Multipl miyelom hastalığı erkeklerde mi yoksa kadınlarda mı çok görülür?
Multipl miyelom erkeklerde kadınlara göre daha sık görülür.
Multipl miyelom hastası bir kadın hamile kalabilir mi, kalırsa kendisi ve bebek için risk var mı?
Multipl miyelom hastası bir kadın hamile kalabilir. Ancak hastalığının kontrol altında olması ve kemoterapi almıyor olması gerekir.
Multipl miyelom hastalığı ülkemizde en sık nerelerde görülür?
Multipl miyelomun ülkemizde ne kadar görüldüğünü gösteren bir istatistik bilgi mevcut değil.
Multipl miyelom hastalığı daha çok hangi yaşta ortaya çıkar?
Multipl miyelom nadir görülen bir kanser türüdür. Genellikle 60 yaş üzerinde görülen hastalık 35 yaş altındaki kişilerde de nadir olarak görülebilir.
Multipl miyelom hastalığı bulaşıcı bir hastalık mıdır?
Multipl miyelom bulaşıcı bir hastalık değildir.
Multipl miyelom hastalığı hangi doktor tarafından tedavi edilir?
Multipl miyelom hastaları hematoloji uzmanları tarafından tedavi edilir.
Multipl miyelom hastalığı d vitamini alınarak önlenebilir mi?
Multipl miyelom hastalığı d vitamini alınarak önlenemez.
Multipl miyelom böbrek yetmezliğine neden olur mu?
Multipl miyelom Evre III’de böbrek yetmezliğine neden olabilir.
Multipl miyelom tahlil sonuçları ne zaman çıkar?
Multipl miyelom tahlil çeşitleri fazladır. Bu nedenle her tahlilinin sonuçlanması farklı sürelerde olur.
Multipl Miyelom kan ve idrar testinde belli olur mu?
Multipl miyelom hastalığı bazen rutin bir kan ve idrar tahlilinde belli olur.
Multipl miyelom kemik iliği kanseri midir?
Multipl miyelom sıklığı giderek artan bir kemik iliği kanseri türüdür.
*Sayfa içeriği sadece bilgilendirme amaçlıdır. Tanı ve tedavi için mutlaka doktorunuza başvurunuz.
Kemik iliği nakli nedir?
İnsan organizmasında kan yapımından sorumlu hücreler kemik iliğindeki kök hücrelerdir. Bu son derece özel fonksiyonlara sahip hücrelerin nakline genel olarak ‘kemik iliği nakli’ adı verilmektedir.
Kemik iliği nakli nasıl yapılır?
Kemik iliği, kan hücreleri üretir. Kök hücreler, kemik iliğinde bulunan ve tüm farklı kan hücrelerini oluşturan olgunlaşmamış hücrelerdir. Nakillerde hematopoietik kök hücreler kullanılır. Kök hücreler hastaya (alıcı) damar yolu vasıtasıyla aktarılır. Bunun için çoğunlukla santral venöz kateter adı verilen, damar içi yerleştirilen aparatlar kullanılır. Nakil sonrası olgunlaşmamış hücreler kemik iliğinde yaşamaya başlar ve aşağıdakiler de dahil olmak üzere çeşitli olgun kan hücrelerine dönüşür:
- Oksijen taşıyan kırmızı kan hücreleri
- Kan pıhtılaşmasına yardımcı olan trombositler
- Enfeksiyonla savaşmaya yardımcı olan beyaz kan hücreleri
Kemik iliği nakli ile birlikte hasarlı kök hücreleri, sağlıklı hücrelerle değiştirilir. Bu durum da vücudun enfeksiyonlardan, kanama bozukluklarından veya anemiden kaçınmak için yeterince beyaz kan hücresi, trombosit veya kırmızı kan hücresi yapmasına yardımcı olur.
Farklı kan kök hücre nakli türleri vardır. Nakil türü, kan kök hücre kaynağına göre değişir.
- Kemik iliği nakillerinde (BMT), kemik iliğinden toplanan kan kök hücreleri kullanılır.
- Periferik kan kök hücre nakillerinde (PBSCT), kan dolaşımından toplanan kan kök hücrelerini kullanılır.
- Kordon kanı nakillerinde (CBT), yeni doğmuş bir bebeğin plasenta ve göbek kordonundan toplanan kan kök hücreler kullanılır.
Kemik iliği nakli hangi hastalıklarda yapılır?
Kemik iliği nakli, hastanın iliği düzgün çalışacak kadar sağlıklı olmadığında yapılır. Bunun nedeni kronik enfeksiyonlar, çeşitli hastalıklar veya kanser tedavileri olabilir. Kemik iliği nakilleri, aşağıdakileri hastalıklara sahip kişilere fayda sağlayabilir:
- Akut lösemi
- Adrenolökodistrofi
- Aplastik anemi
- Kemik iliği yetmezliği sendromları
- Kronik lösemi
- Hemoglobinopatiler
- Hodgkin lenfoma
- Bağışıklık yetersizlikleri
- Doğuştan metabolizma hataları
- Multipl myeloma
- Miyelodisplastik sendromlar
- Nöroblastom
- Non-Hodgkin lenfoma
- Plazma hücre bozuklukları
- POEMS sendromu
- Birincil amiloidoz
- Tedaviye refrakter veya relaps solid organ tümörleri
Kemik iliğinde üretilen hücreler nelerdir?
Toplama işlemi sonrası 24 saat süre ile gözlem altında tutulduktan sonra verici taburcu edilebilir. Toplanan ilik içine karışmış olabilecek yağ ve küçük kemik parçalarının ayrılması için özel filtrelerden geçirilir. Hemen kullanılmayacaksa özel sıvıların içine konularak dondurulur. Kullanılacağı zaman çözdürülür ve kan nakline benzer şekilde hastaya verilir. Hastanın vücuduna giren bu kan kök hücreleri, kemik iliğine yerleşmekte ve genellikle 2-4 hafta içerisinde kan hücrelerinin üretimine başlamaktadır.
Kemik iliği çeşitleri nelerdir?
Otolog veya allojeneik olmak üzere iki tür kemik iliği nakli (kök hücre nakli) mevcuttur.
Otolog kök hücre nakli nedir?
Otolog transplantasyonda amaçlanan şey yüksek doz terapi sonrası hematolojik düzelmeye fırsat vermektir. Hücreler kemoterapi öncesi hastanın kendi kemik iliğinden alınır ve kanser tedavisi sonrasında yenisiyle değiştirilir. Yani bazı durumlarda kanser tedavisinde yüksek doz, yoğun kemoterapi veya radyoterapi uygulanır. Nitekim kanser tedavisi kök hücrelerimize ve bağışıklık sistemimize zarar verebilir. Doktorlar kanser tedavisi başlamadan önce kişinin kendi kök hücrelerinin toplanıp dondurulurak saklanması sağlar. Kanser tedavisi sonrası saklanan bu kök hücreler kişiye geri verilir. Bu süreç kök hücre kurtarma olarak adlandırılmaktadır. Otolog kök hücre nakli çoğunlukla lenfoma, çocuklarda solid tümörler ve erişkinde multiple miyelom gibi hastalıkları tedavi etmek için kullanılır. Otolog kök hücre naklinde alıcının verilen kök hücreleri reddetme olasılığı, doku reddi hastalığı (GVHD) riski çok azdır. Bu nedenle Otolog kök hücre nakli, allojenik nakillerden daha güvenlidir.
Allojenik kök hücre nakli nedir?
Hastanın, yani kök hücre nakli yapılacak olan kişinin kardeşinden, akrabalarından veya akraba dışı bir vericiden yapılan kök hücre nakli işlemine allojeneik kök hücre nakli denilmektedir. Allojenik nakiller, otolog nakillerin aksine, kanserle savaşmak için yeni bir bağışıklık sistemi tepkisi oluşturur. Yani nakil işlemi sırasında bağışçının kök hücreleri ile birlikte immün sistem (bağışıklık sistemi) hücreleri de nakledilir. Allojenik nakil sırasında hastaya aktarılan bağışçının lenfositleri eğer hastada farklı gördüğü bazı hücreleri yabancı olarak algılarsa onlara karşı savaş başlatır ve bu durum alıcının organlarında ağır hasarlar oluşturan ‘graft versus host’ hastalığına neden olabilir. Allojenik kök hücre naklinin yol açabildiği riski azaltmak için nakilden hemen sonra hastaya bağışıklık sistemini baskılayan ilaçlar verilerek bağışçının lenfositlerinin savaşçı kapasiteleri baskılanmaya çalışılır. Allojenik kök hücre naklinden sonra doku farklılıkları nedeni ile savaş başlamaması için hasta ile bağışçı arasında mümkün olduğunca tama yakın doku uyumu olması istenir.
Kemik iliği nakli riskleri nelerdir?
Kemik iliği (kök hücre) nakli, bağışıklık sisteminin düzene girmesi ve sağlıklı yeni kan hücreleri üretilmeye başlanması uzun sürebilir. Nakil sonrası immün düzelmesi birçok değişkene bağlıdır. Örneğin kullanılan kök hücre kaynağı, yapılan immün baskılayıcı müdahaleler, gelişen çeşitli sorunlara, farklı zamanlarda iyileşme gösterebilen hücre alt tiplerine göre immün düzelme beş yıla kadar dahi uzayabilmektedir. Kemik iliği nakli olan hastalar bu süre zarfında enfeksiyon riski altındadır ve önlem almalıdır. Ayrıca kan hücrelerinin sayısının azalması; anemiye, aşırı kanamaya, vücutta morarmalara ve enfeksiyon riskinde artışa neden olabilir Bazı hastalara bir süre kan transfüzyonu gerekebilir.
Kemik iliği nakli ile ilişkili olası komplikasyonlar nelerdir?
- Graft-versus-host hastalığı (sadece allojenik nakil)
- Kök hücre (greft) hatası
- Organ hasarı
- Enfeksiyonlar
- Katarakt
- Kısırlık
- Yeni kanserler
Graft versus host hastalığı (GVHD): Graft versus host hastalığı allojenik nakillerde, nakledilen hücreler vücudunuzdaki diğer hücrelere saldırmaya başladığında ortaya çıkar. Donörden alınıp hastaya kök hücrelerle birlikte verilen sağlıklı T-lenfositlerin aracılık ettiği şiddetli immünolojik reaksiyon sonucu organ fonksiyon bozukluğu ile giden kompleks bir klinik sendrom olup allojenik kök hücre naklinden (KHN) sonra en önemli mortalite ve morbidite sebebi olarak kabul edilir. GVHD, nakilden hemen sonra veya bir yıldan fazla bir süre sonra ortaya çıkabilir.
İki tür GVHD vardır: akut ve kronik. Akut GVHD genellikle nakilden sonraki ilk aylarda daha erken gerçekleşir. Genellikle cildinizi, sindirim sisteminizi veya karaciğeri etkiler. Kronik GVHD birçok organda ağır hasarlar bırakabilir.
Kronik GVHD belirti ve semptomları şunları içerir:
- Eklem veya kas ağrısı
- Nefes darlığı
- Kalıcı öksürük
- Görme değişiklikleri
- Deri altında yara izi veya cilt sertliği dahil cilt değişiklikleri
- Cilt döküntüleri
- Cildinize veya gözlerinizin beyazlarına sarı renk (sarılık)
- Ağız yaraları
- İshal
- Mide bulantısı, kusma
Kemik iliği nakli öncesi neler yapılır?
Genel sağlığınızı ve durumunuzun durumunu değerlendirmek ve nakil için fiziksel olarak hazır olduğunuzdan emin olmak için bir dizi test ve prosedürden geçeceksiniz. Değerlendirme birkaç gün veya daha uzun sürebilir. Bunlara ek olarak, bir cerrah veya radyolog, göğsünüzdeki veya boynunuzdaki büyük bir damara uzun ince bir tüp (intravenöz kateter) yerleştirir. Genellikle merkezi hat olarak adlandırılan kateter, çoğu durumda tedaviniz süresince yerinde kalır. Nakil ekibiniz, nakledilen kök hücreleri, ilaçları ve kan ürünlerini vücudunuza aşılamak için merkez hattı kullanacaktır.
Kemik iliği (Kök hücre) nakline dair sık sorulan sorular
Çocuklarda kemik iliği nakli nedir?
Kan hastalıkları ve kanserleri, çocukluk çağında yaşamı tehdit eden hastalıklar arasında ilk sıralarda yer almaktadır. Çocukluk çağında görülen kan hastalıklarının tedavisinde ve çocuk kemik iliği naklinde başarı için merkezlerin alt yapı ve hizmet kalitesinin tam donanımlı olmasını gerektirir. Bu amaçla kurulan Memorial Şişli, Bahçelievler ve Ankara Hastanelerimizde bulunan Çocuk Kemik İliği Nakli Merkezlerimiz, çocuklarımıza üst düzey tanı ve tedavi olanakları ile hizmet vermektedir. Çocukluk çağında Talasemi, aplastik anemiler, immün yetmezlikler, metabolik hastalıklar, lösemiler, lenfoma ve bazı solid tümörlerin tedavisinde kemik iliği nakli önemli bir yer tutmaktadır. Kemik iliği nakli için deneyimli bir hekim-hemşire-personel ve bu iş için özel kurgulanmış bir servisler, merkezlerimizde bulunmaktadır.
Pediatrik Kök Hücre Nakli ünitelerimizde, çocuk hastalarımıza dış ortamdan bulaşabilecek enfeksiyonları önlemek amacıyla çeşitli önlemler alınmaktadır.
Bu önlemler;
- Her hasta odasının girişinde, oda ile koridor arasında özel bir bölüm yer almakta ve gerek nakil personelinin gerekse refakatçilerin bu bölümde dışarıdan taşıyabilecekleri enfeksiyonlardan arınmaları sağlanmaktadır.
- Nakil süresince hastaların arzu ettikleri yiyecekler özel koşullarda hazırlanmaktadır.
- Enfeksiyonlardan korunmalarını sağlamak amacıyla nakil ünitesinin tamamında havada bulunan partikülleri temizleyen hepafiltre sistemleri kullanılmaktadır.
Nakil ünitesinde 0-18 yaş arasındaki hastalara otolog, allojeneik (akraba ve akraba dışı) ve haploidentik olmak üzere her türlü kemik iliği nakli yapılabilmektedir. Her hastanın kendi içinde özel olduğu ve nakil sürecinin bu esas çerçevesinde yürütülmesi gerektiğinin unutulmaması gerekmektedir.
Çocukluk çağında en sık hangi hastalıklar için allojenik kök hücre nakli yapılmaktadır?
Çocukluk çağında malign veya çoğunlukla kalıtsal olan non-malign hastalıklara allojenik nakil yapılmaktadır. Bu hastalıkların içerisinde en sık nakil yapılanları şu şekilde sıralanabilir:
- Lösemiler
- Myelodisplastik Sendrom
- Aplastik Annemi
- Paroksismal Noktürnal Hemoglobinüri
- Fanconi Aplastik Anemisi
- Talasemi
- Orak Hücre Anemisi
- Ağır Kombine İmmün Yetmezlikler
- Wiskott-Aldrich Sendromu
- Hemofagositik Lenfohistiositozis
- Kostmann Hastalığı
- Kronik Granülomatöz Hastalık
- Osteopetrozis
- Mukopolisakkaridoz
- Adrenolökodistrofi
- Metakromatik Lökodistrofi(MLD)
- Globoid hücre lökodistrofi(Krabbe)
- Wolman hastalığı
- Mannosidoz
- Yapısal Aplastik Anemilerden ;Diskeratosis Konjenita, Scwachman-Diamond Sendromu, Amegakaryositik trombositopeni
- Diamond-Blackfan Anemisi
Bu hastalıklara ayrıntılı öykü ve fizik muayenenin yanında kemik iliği aspirasyonu ve/veya biyopsisi ile tanı konulmaktadır.
Çocukluk çağında en sık hangi hastalıklar için otolog kök hücre nakli yapılmaktadır?
Otolog kemik iliği nakli uygulanan hastalıklar şu şekilde sıralanabilir:
- Akut myeloid lösemi
- Hodgkin-dışı lenfoma
- Hodgkin lenfoma
- Nöroblastom
- Ewing sarkomu
- Medulloblastom (beyin tümörlerinden)
- Yumuşak doku tümörleri
- Germ hücreli tümörler
- Wilm’s tümörü (böbrek tümörü)
- Retinoblastom (göz tümörü)
- Bazı otoimmün hastalıklar
Nakledilen kemik iliği ne zaman çalışmaya başlar?
Kemik iliği (kök hücre) transplantasyonu yani nakli sonrasında, kök hücrelerin tekrar kan hücresi üretmeye başlaması genellikle 10-15 günlük bir süre alır. Bu süre içerisinde hastaya dışarıdan kan hücresi takviyesi yapılır. Zira kemik iliği sağlıklı hücreleri kendi başına yeteri kadar üretmeye başlayıncaya kadar geçen süre boyunca kırmızı kan hücreleri ve trombosit transfüzyonuna ihtiyaç duyacaktır. Hastaların grefte tepkisini değerlendirmek için kan testlerinin yapıldığı takip ziyaretlerine gelmeleri gerekmektedir. Nakil sonrası hastaların ciddi problemlerle karşılaşmamaları için uzun yıllar takip edilmeleri gerekebilir.
Yarı uyumlu kök hücre nakli başarı sağlar mı?
Tam uyumlu kardeş ve kemik iliği bankalarından verici bulunamaması halinde başvurulan günümüzdeki en önemli seçenek yarı eşlenik (haploidentik) akrabalardan ve kord kanından yapılan nakillerdir. Yarı-eşlenik, akrabalardan yapılan nakiller son on yılda tüm dünyada kullanım sıklığı artan önemli tedavi bir tedavi seçeneğidir. Yarı eşlenik akraba vericilerin HLA genlerinin %50 ile %80’i hasta ile uyumludur. Bir kardeşin yarı eşlenik olma ihtimali %50 iken, hastanın tüm çocukları, anne ve babası hasta ile yarı-eşleniktir. Kemik iliği bankasından verici bulunması, sonrasında vericinin HLA’sının yüksek çözünürlükte teyit edilmesi, kök hücrelerinin toplanması iki, üç ay sürebilmektedir. Nüks etmiş kan kanserli hastaların ise bekleyecek bu kadar zamanları olmayabilir. Bunun yanında, yarı-eşlenik akrabalardan kök hücre temini, erişimleri kolay olduğundan, fazla zaman almaz. Hastalığın alojenik nakil sonrası nüks etmesi durumunda hastaya aynı vericiden lenfosit verilerek hastalık tedavi edilebilse de, kord kanı kullanılması halinde böyle bir imkan olmamaktadır. Yabancıdan yapılan nakillerde ise tekrar hücre toplamak zaman alabilir. Yarı-eşlenik nakillerde ise verici hala sağlıklıysa tekrar hücre toplamak çok kolaydır. Çin’deki akut lösemili hastalarda yapılan yarı-eşlenik ile yabancı tam uyumlu nakiller arasında tedavi sonuçları açısından anlamlı bir fark bulunamamıştır.
Kemik iliğinden kök hücre nasıl elde edilir?
Kemik iliği, kemiklerin içindeki süngerimsi kemiğin içerisinde yer almaktadır. Kemik iliğinin en fazla bulunduğu yer insan vücudunun pelvis (leğen) kemiğidir. Nakil için gereken kemik iliğini vericiden toplama işlemi genel anestezi altında ve steril bir ortamda yapılır.
Periferik kandan kök hücre nasıl elde edilir?
Normalde damarlarda dolaşan kanda bulunan kök hücre miktarı azdır. Bu nedenle, toplama işlemi yapılmadan önce vericiler, kök hücre miktarını arttırıcı ilaçlar (G-CSF) kullanmaktadır. Bu ilaçlar büyüme faktörü olarak adlandırılır. Periferik kök hücreler vericinin kanından özel cihazlar ile ayrıştırılır. Ayrıştırılan kök hücreler dışında kalan kan kişiye geri verilir. Bu işlem 4-6 saat kadar sürer. Hastaya gereken kök hücrenin miktarına göre işlemin üst üste birkaç gün tekrar edilmesi gerekebilir. Otolog nakil olarak adlandırılan durumda periferik kök hücre vericisi hastanın kendisidir. Hastanın vücuduna giren bu kan kök hücreleri kemik iliğine yerleşir. Bu tip nakilde yamanma(engraftment) kan üretimi kemik iliğine göre daha erken dönemde başlamakta, 10-20 gün gibi bir sürede gerçekleşmektedir.
Kordon kanı kök hücreleri nasıl elde edilir?
Göbek kordon kanı, bebek doğduktan sonra göbek kordonundan veya plasentadan toplanmaktadır. Bu kan, kan yapıcı hücreler açısından zengindir. Bağışlanan kan çeşitli açılardan test edilmekte ve ilerde ihtiyaç duyulduğunda kullanılmak üzere saklanmaktadır. Bu amaçla oluşturulan saklama birimlerine “kordon kanı bankası” adı verilmektedir. Doktorlar ihtiyaç olduğunda bu bankalara başvurarak uygun bir doku grubu eşleşmesi aramaktadır. Eğer bu koşullara uygun bir kordon kanı bulunursa, nakil işlemi diğerlerine benzer şekilde gerçekleştirilir.
Kimler kordon kanı ile nakil olabilir?
Kordon kanı sınırlı sayıda kök hücre içermesi nedeni ile daha çok çocuklar için kullanılır. Vücut ağırlığı fazla olan kişilerde bazen iki ya da daha fazla kordon kanı birleştirilerek nakil yapılır. İdeal kök hücre kaynağı doku grupları açısından uyumlu olandır. Ancak kordon kanı ile yapılan nakillerde daha az uyumlu olmasına rağmen nakil gerçekleştirilebilir. Kordon kanları depolanmış olarak hazır tutulmakta ve acilen nakil yapılması gerekiyor ise kordon kanı tercih edilmektedir. Hangi kök hücre kaynağının en uygun seçenek olduğuna nakil ekibinin karar vermesi gerekir.
Otolog kemik iliği nakli için kök hücre nasıl toplanır?
Kendi kök hücrelerinizi (otolog nakil) kullanarak bir nakil planlanıyorsa, kan kök hücrelerini toplamak için aferez (af-uh-REE-sis) adı verilen bir prosedür uygulanacaktır. Aferezden önce, kök hücre üretimini artırmak ve kök hücrelerin toplanabilmeleri için dolaşımdaki kanınıza taşımak için günlük büyüme faktörü enjeksiyonları alacaksınız. Aferez sırasında kan damardan çekilerek bir makinede dolaştırılır. Makine, kanınızı kök hücreler dahil olmak üzere farklı parçalara ayırır. Bu kök hücreler, nakil işleminde ileride kullanılmak üzere toplanır ve dondurulur.
Allojenik kemik iliği nakli için kök hücre nasıl topanır?
Kök hücreler, donörünüz kanından veya kemik iliğinden gelebilir. Nakil ekibiniz, durumunuza göre hangisinin sizin için daha iyi olduğuna karar verir. Bu hücreler ayrıca doğumdan sonra plasentadan alınan ve ileride kullanılmak üzere özel kordon kanı bankalarında saklanan göbek kordonu kanından da gelebilir. Bu kordonlardan alınan kan dondurulur ve kemik iliği nakli için gerekene kadar bir kordon kanı bankasında saklanır.
Kemik iliği vericisinin sağlığı için herhangi bir risk durumu var mı?
Kök hücre bağışının bağışçının sağlığına herhangi bir şekilde zarar vermez. Bağışçıya kök hücrelerin kan dolaşımına geçmesi için 5 gün süreyle belirli bir ilaç verilir. Kandaki kök hücre sayısı istenilen düzeye ulaştığı an koldaki bir damardan kan örneklemesi gibi alınır.
Kemik iliği bağışçısı için herhangi bir yaş sınır var mıdır?
Kök hücre bağışçısı şayet alıcının yakını ise herhangi bir yaş aralığı dikkate alınmaz. Ancak doku bankasına kök hücre bağışı yapmak isteyen kişilerin 18-55 yaş aralığında olması gerekmektedir.
Kök hücre tedavisi eklem ağrıları için uygulanabilir mi?
Kök hücre tedavisi, ortopedi alanında farklı bir şekilde kullanılmaktadır. Kıkırdak hasarı olan, ağrılı ekleme sahip ancak cerrahi tedavi için erken dönemde olan ya da ameliyat olmayı istemeyen hastalarda kıkırdak yaralanmasına maruz kalmış omuz, kalça, diz gibi eklemlerde uygulanabilmektedir. Ancak kök hücre tedavisi eklem kıkırdak kapasitesinin tamamına yakın kayıplarında tedavi seçeneği olarak uygulanmamaktadır.
Kemik iliği naklinden sonra egzersiz yapmam uygun mudur?
Kemik iliği nakli süreci başarılı şekilde tamamlanırsa, egzersiz yapmaya başlayabilirsiniz. Egzersizin yoğunluğunu kademe kademe artırılmalı, egzersiz esnasında bir anda aşırı şekilde efor sarf edilmemelidir. Doktorunuz, ihtiyaçlarınıza ve gereksinimlerinize göre uyarlanmış bir egzersiz planı oluşturmanıza yardımcı olacaktır.
Kemik iliği ne işe yarar?
Kemik iliği, kan hücreleri üretir. Kök hücreler, kemik iliğinde bulunan ve tüm farklı kan hücrelerini oluşturan olgunlaşmamış hücrelerdir.
Kemik iliği çalışmazsa ne olur?
Kemik iliğinin herhangi bir hastalık nedeniyle çalışmaması hayati öneme sahip olan kan yapımında eksikliklere neden olur.
Kemik iliği testi neden yapılır?
Kemik iliği testi, kan hücrelerinin tipi, miktarı ve olgunlaşma düzeyleri, kemik iliğinin yapısı ve var olan hastalıkların belirlenmesi için yapılır.
Kemik iliği kendini yeniler mi?
Kemik iliği yani kök hücreler sürekli kendini yenileyebilme özelliğine sahiptir.
Kemik iliği sonucu kaç günde çıkar?
Kemik iliğinin en fazla bulunduğu yer insan vücudunun pelvis (leğen) kemiğidir. Nakil için gereken kemik iliğini vericiden toplama işlemi genel anestezi altında ve steril bir ortamda gerçekleştirilmektedir. Toplama işlemi sonrası 24 saat süre ile gözlem altında tutulduktan sonra verici taburcu edilebilir. İliğin toplanabilmesi için özel iğneler kullanılmaktadır. Bu iğneler yoğun kıvamlı iliğin çekilebilmesine olanak sağlar.
Kemik iliği alınırken acı olur mu?
Kemik iliğini genel anestezi altında ve steril bir ortamda gerçekleştirilmektedir. İliğin toplanabilmesi için özel iğneler kullanılmaktadır. Bu iğneler yoğun kıvamlı iliğin çekilebilmesine olanak sağlar. Verici herhangi bir acı hissetmez.
Kemik iliği kanseri lösemi midir?
Lösemi halk arasında genellikle kemik iliği ya da kan kanseri olarak bilinir.
*Sayfa içeriği sadece bilgilendirme amaçlıdır. Tanı ve tedavi için mutlaka doktorunuza başvurunuz.
Contact
- 3111 West Allegheny Avenue Pennsylvania 19132
-
1-982-782-5297
1-982-125-6378 - support@consultio.com

