WAS IST KREBS?

Krebs ist das abnorme Wachstum von Zellen. Krebszellen vermehren sich schnell, obwohl der Raum begrenzt ist, andere Zellen Nährstoffe mit ihnen teilen oder der Körper ihnen signalisiert, dass sie ihre Vermehrung einstellen sollen. Krebszellen sind oft anders geformt als gesunde Zellen, funktionieren nicht richtig und können sich auf viele Teile des Körpers ausbreiten. Tumore sind abnormes Gewebewachstum, Zellhaufen, die unkontrolliert wachsen und sich teilen können.
Krebs, der sich zuerst in einem Gewebe oder Organ entwickelt, wird als Primärkrebs bezeichnet. Ein bösartiger Tumor wird gewöhnlich nach dem betroffenen Organ oder Zelltyp benannt. Ein bösartiger Tumor, der sich nicht auf andere Teile des Körpers ausgebreitet hat, wird als örtlich begrenzter Krebs bezeichnet. Ein Tumor kann tiefer in das umliegende Gewebe eindringen und eigene Blutgefäße bilden. Dieser Vorgang wird auch als Angiogenese bezeichnet. Wenn Krebszellen wachsen und an einer neuen Stelle einen weiteren Tumor bilden, spricht man von sekundärem Krebs oder einer Metastase. Eine Metastase behält den Namen des ursprünglichen Krebses bei. So wird beispielsweise Darmkrebs, der sich in die Leber ausgebreitet hat, als metastasierender Darmkrebs bezeichnet, auch wenn der Betroffene unter Symptomen leidet, die durch Probleme in der Leber verursacht werden.
Krebstumore lassen sich in drei Gruppen einteilen: gutartige, bösartige und präkanzeröse (prämaligne) Tumore.
Gutartige Tumore sind nicht krebsartig und selten lebensbedrohlich. Gutartige Tumore wachsen in der Regel sehr langsam, breiten sich nicht auf andere Teile des Körpers aus und bestehen in der Regel aus Zellen, die normalen oder gesunden Zellen recht ähnlich sind. Gutartige Tumore können Probleme verursachen, wenn sie zu groß werden und Druck auf andere Organe ausüben (z. B. ein Hirntumor im Inneren des Schädels).
Bösartige Tumore wachsen schneller als gutartige Tumore und haben die Fähigkeit, sich auszubreiten und benachbartes Gewebe zu zerstören. Bösartige Tumorzellen können sich vom Haupttumor (Primärtumor) lösen und sich in andere Teile des Körpers ausbreiten (Metastasierung). Nachdem sie in gesundes Gewebe an der neuen Stelle eingedrungen sind, teilen sie sich weiter und wachsen. Diese Sekundärherde werden als Metastasen bezeichnet, und der Zustand wird als metastasierender Krebs bezeichnet.
Präkanzerose (oder prämaligne) bezieht sich auf einen Zustand mit abnormen Zellen, die sich zu Krebs entwickeln können (oder werden).
WAS IST ONKOLOGIE?
Onkologie ist die Lehre von Krebs und Tumoren. Das Wort “onko” bedeutet Masse oder Tumor und “logy” bedeutet Studium auf irgendeinem Gebiet. Onkologen sind Ärzte, die sich auf die Diagnose und Behandlung von Krebs spezialisiert haben. Es gibt drei Haupttypen von Onkologen.
Medizinische Onkologen, die Krebs mit Chemotherapie und anderen Medikamenten behandeln,
Chirurgische Onkologen, die Krebserkrankungen durch Operationen behandeln,
Strahlenonkologen, die Krebs mit Strahlen behandeln,
Die Krebsbehandlung ist eine multidisziplinäre Teamarbeit. Die oben genannten medizinischen Onkologen arbeiten in der Tat in einem multidisziplinären Team, zu dem auch Fachleute wie Pathologen, Molekularpathologen, Psychoonkologen, Radiologen, interventionelle Radiologen, Hausärzte, Genetiker, Hämatologen, Palliativmediziner und onkologische Krankenschwestern gehören können.
Der Tätigkeitsbereich eines Onkologen wird weitgehend durch das Stadium der Bösartigkeit (Krebs) bestimmt. So kann die Behandlung von Krebs im Frühstadium einen chirurgischen Eingriff oder eine Strahlentherapie beinhalten, während die Behandlung von Krebs im fortgeschrittenen Stadium eine Chemotherapie erfordern kann.
WELCHE ARTEN VON KREBS GIBT ES?
Krebs kann nach dem Zelltyp klassifiziert werden, in dem er entsteht. Einige Krebsarten, die in bestimmten Zelltypen entstehen, sind:
Es handelt sich dabei um eine Krebsart, die von Epithelzellen ausgeht (die Auskleidung von Zellen, die zum Schutz oder zur Abdeckung von Organen beitragen). Karzinome können in umliegendes Gewebe und Organe eindringen und in Lymphknoten und andere Teile des Körpers metastasieren. Die häufigsten Krebsarten in dieser Gruppe sind Brustkrebs, Prostatakrebs, Lungenkrebs und Darmkrebs.
Es handelt sich um eine Art bösartiger Tumor des Knochens oder des Weichgewebes (Fett, Muskeln, Blutgefäße, Nerven und andere Bindegewebe, die Organe stützen und umgeben). Die häufigsten Formen von Sarkomen sind Leiomyosarkom, Liposarkom und Osteosarkom.
Lymphome und Myelome sind Krebsarten, die in den Zellen des Immunsystems entstehen. Das Lymphom ist ein Krebs des Lymphsystems, das im ganzen Körper zirkuliert und daher überall auftreten kann. Das Myelom (oder multiple Myelom) beginnt in den Plasmazellen, einer Art von weißen Blutkörperchen, die Antikörper zur Bekämpfung von Infektionen produzieren. Diese Art von Krebs kann die Fähigkeit der Zelle beeinträchtigen, Antikörper wirksam zu produzieren.
Leukämie ist eine Krebserkrankung der weißen Blutkörperchen und des Knochenmarks, des Gewebes, aus dem die Blutzellen bestehen. Es gibt mehrere Unterformen; die häufigsten sind die lymphatische Leukämie und die chronische lymphatische Leukämie.
Krebserkrankungen des Gehirns und des Rückenmarks
Krebserkrankungen des Gehirns und des Rückenmarks werden als Krebserkrankungen des zentralen Nervensystems bezeichnet. Einige sind gutartig, während andere wachsen und sich ausbreiten können.
Andere Tumorarten
Keimzelltumore sind eine Art von Tumor, der in den Zellen entsteht, aus denen Spermien oder Eizellen hervorgehen. Diese Tumore können fast überall im Körper auftreten und gut- oder bösartig sein.
Neuroendokrine Tumore bestehen aus Zellen, die als Reaktion auf ein Signal des Nervensystems Hormone ins Blut abgeben. Diese Tumore, die mehr Hormone als normal produzieren können, können viele verschiedene Symptome verursachen. Neuroendokrine Tumore können gutartig oder bösartig sein.
Karzinoide Tumore sind eine Art neuroendokriner Tumor. Es handelt sich um langsam wachsende Tumore, die in der Regel im Magen-Darm-Trakt (meist im Rektum und Dünndarm) vorkommen. Karzinoidtumore können sich auf die Leber oder andere Körperteile ausbreiten, Substanzen wie Serotonin oder Prostaglandine freisetzen und das Karzinoidsyndrom verursachen.
WAS SIND DIE RISIKOFAKTOREN FÜR KREBS?

Krebserkrankungen können durch viele Faktoren verursacht werden. Tatsächlich entwickeln sich die meisten Krebsarten als Folge einer Exposition gegenüber vielen ursächlichen Faktoren. Risikofaktoren für Krebs sind:
Alter:
Viele Krebsarten treten mit zunehmendem Alter häufiger auf. Je länger Menschen leben, desto mehr sind sie Karzinogenen ausgesetzt und desto mehr genetische Veränderungen oder Mutationen können in ihren Zellen auftreten.
Krebserregende Stoffe (Karzinogene)
Karzinogene sind Stoffe, die das Verhalten einer Zelle verändern und die Wahrscheinlichkeit der Entstehung von Krebs erhöhen
Genetik
Manche Menschen werden mit einem vererbten hohen Krebsrisiko geboren (“genetische Veranlagung”). Dies bedeutet zwar nicht, dass Krebs definitiv auftritt, aber es macht die Krankheit wahrscheinlicher. So haben beispielsweise Frauen, die Trägerinnen der Brustkrebsgene BRCA 1 und BRCA 2 sind, eine höhere Veranlagung, an dieser Krebsart zu erkranken, als Frauen mit einem normalen Brustkrebsrisiko. Es ist jedoch bekannt, dass weniger als 5 % aller Brustkrebsfälle durch die Gene verursacht werden. Obwohl also Frauen mit einem dieser Gene ein individuell höheres Risiko haben, an Brustkrebs zu erkranken, sind die meisten Fälle nicht auf einen vererbten Hochrisiko-Genfehler zurückzuführen.
Immunsystem
Menschen mit einem schwachen Immunsystem haben ein erhöhtes Risiko, an bestimmten Krebsarten zu erkranken. Menschen, die eine Organtransplantation hinter sich haben und Medikamente zur Unterdrückung ihres Immunsystems einnehmen, um eine Abstoßung des Organs zu verhindern, sowie Menschen, deren Immunsystem aufgrund von Krankheiten wie HIV geschwächt ist, können einem Krebsrisiko ausgesetzt sein.
Alkoholkonsum
Übermäßiger Alkoholkonsum kann das Risiko für sechs Krebsarten erhöhen, darunter Darmkrebs (kolorektaler Krebs), Brustkrebs, Mundkrebs, Rachen- und Kehlkopfkrebs, Speiseröhrenkrebs, Leberkrebs und Magenkrebs.
Übergewicht oder Fettleibigkeit
Fettleibigkeit kann das Risiko erhöhen, an 12 verschiedenen Krebsarten zu erkranken, darunter Blasenkrebs und Bauchspeicheldrüsenkrebs.
Fehler in der Diät und Ernährung
Experten vermuten, dass ein hoher Verzehr von rotem Fleisch, verarbeiteten Fleischsorten, salzigen Lebensmitteln und eine Ernährung, die kein Obst und Gemüse enthält, besonders wirksam bei Darm-, Nasen-Rachen- und Magenkrebs sind.
Mangelnde körperliche Aktivität
Regelmäßige körperliche Betätigung trägt nicht nur dazu bei, überschüssiges Körperfett und die damit verbundenen Krebsrisiken zu reduzieren, sondern auch das Risiko, an Dickdarm-, Brust- und Gebärmutterkrebs zu erkranken.
Rauchen
Zigarettenrauch enthält mindestens 80 verschiedene krebserregende Stoffe (Karzinogene). Wenn der Rauch eingeatmet wird, gelangen die Chemikalien in die Lunge, gehen in den Blutkreislauf über und werden im ganzen Körper verteilt. Das Rauchen oder Kauen von Tabak verursacht daher nicht nur Lungen- und Mundkrebs, sondern wird auch mit vielen anderen Krebsarten in Verbindung gebracht.
Ionisierende Strahlung
Radon, Röntgenstrahlen, Gammastrahlen und andere Formen hochenergetischer Strahlung können das Krebsrisiko erhöhen. Längerer und ungeschützter Kontakt mit ultravioletter Strahlung aus der Sonne, Sonnenlicht und Solarien kann ebenfalls zu Melanomen und bösartigen Hauterkrankungen führen. Menschen mit heller Haut, vielen Leberflecken am Körper und einer familiären Vorgeschichte von Melanomen oder nicht-melanomem Hautkrebs sind durch ionisierende Strahlung gefährdet.
Gefährdungen an einigen Arbeitsplätzen
Manche Menschen sind durch ihre Arbeit einem Risiko ausgesetzt, einem krebserregenden Stoff ausgesetzt zu sein. So wurde zum Beispiel festgestellt, dass Arbeiter in der chemischen Farbenindustrie überdurchschnittlich häufig an Blasenkrebs erkranken.
Infektionen
Infektionserreger sind für etwa 2,2 Millionen Krebstodesfälle pro Jahr verantwortlich. So werden beispielsweise etwa 70 Prozent der Gebärmutterhalskrebsfälle durch Infektionen mit dem humanen Papillomavirus (HPV) verursacht, während Leberkrebs und Non-Hodgkin-Lymphome durch das Hepatitis-B- und -C-Virus verursacht werden können und Lymphome auch mit Epstein-Barr in Verbindung gebracht werden. Bakterielle Infektionen wurden in der Vergangenheit nicht als krebserregend angesehen; neuere Studien haben jedoch gezeigt, dass Menschen mit einer Helicobacter-pylori-Infektion im Magen eine Entzündung der Magenschleimhaut entwickeln, die das Risiko für Magenkrebs erhöht.
WIE BREITET SICH DER KREBS AUS?
Krebs unterscheidet sich von gutartigen Tumoren dadurch, dass er sich von seinem Ursprungsort aus auf andere Teile des Körpers ausbreiten kann. Die Krebszellen beginnen dann, in diesem Bereich zu wachsen. Ein bösartiger Tumor, der seine Zellen auf nahe gelegenes Gewebe ausbreitet, wird als invasiver Krebs bezeichnet. Wenn sich der Krebs von einem Teil des Körpers auf einen anderen Teil ausbreitet, spricht man von sekundärem Krebs oder “Metastasen”. Damit sich der Krebs ausbreiten kann, muss er seine eigene Blutversorgung erhöhen. Dies wird als Angiogenese bezeichnet. Ohne diese Blutversorgung sterben die Zellen am Rande des Tumors aufgrund von Sauerstoffmangel ab.
Krebszellen produzieren Stoffe, die es ihnen ermöglichen, sich viel leichter im Körper zu bewegen als normale Zellen. Krebszellen kleben auch nicht so gut zusammen wie normale Zellen.
Krebs kann sich auf folgende Weise ausbreiten:
- Lokal, im und in der Nähe des Gewebes, das den Primärkrebs umgibt
- Durch das Lymphsystem
- Durch den Blutkreislauf
WAS SIND DIE SYMPTOME VON KREBS?
Die Symptome von Krebs sind je nach Art der Erkrankung sehr unterschiedlich. So kann ein bösartiger Tumor in Strukturen in der Nähe der Krebswachstumsstelle eindringen, deren Funktion beeinträchtigen oder auf Nerven drücken (Eierstockkrebs kann beispielsweise auf den Dickdarm drücken und Verstopfung verursachen; Lungenkrebs kann auf einen Nerv drücken, wenn er durch den Brustkorb verläuft, was Heiserkeit verursacht). Krebs kann in vielen Geweben und Organen auftreten und sich durch viele verschiedene Symptome bemerkbar machen. Krebs verursacht häufig Stoffwechselveränderungen, die sich in allgemeinen Symptomen wie Müdigkeit, Gewichtsverlust und allgemeinem Unwohlsein äußern.
Das Wissen um die Anzeichen und Symptome von Krebs ist für eine frühzeitige Diagnose und eine wirksame Behandlung von großer Bedeutung. Es ist jedoch auch wichtig, Krebsvorsorgeuntersuchungen durchzuführen, um Krebs in einem frühen Stadium zu diagnostizieren und eine korrekte Behandlung durchzuführen. Auch wenn eine Person keine Beschwerden hat, sollte sie sich in einem bestimmten Alter mit Krebsvorsorgeuntersuchungen schützen. Die häufigsten Krebssymptome lassen sich wie folgt aufzählen:
- Ungeklärter Gewichtsverlust
- Klumpen, Beulen oder vergrößerte Lymphknoten
- Nächtliche Schweißausbrüche
- Blutungen (abnorme vaginale Blutungen, Blut im Stuhl oder rektale Blutungen, Blut im Urin)
- Veränderungen des Stuhlgangs (Veränderung der Stuhlgang- oder Uriniergewohnheiten)
- Anhaltender und hartnäckiger Husten
- Kurzatmigkeit
- Schmerzen in einem beliebigen Körperteil,
- Anhaltende, starke Müdigkeit
- Hautveränderungen
- Gefühl von Blähungen im Unterleib
- Schwierigkeiten beim Schlucken
Einige dieser Anzeichen und Symptome können spezifisch für bestimmte Krebsarten sein, während andere bei mehreren Krebsarten auftreten können.
Ungeklärter Gewichtsverlust
Das erste Symptom vieler Krebsarten, insbesondere von Magen-, Bauchspeicheldrüsen-, Speiseröhren- und Lungenkrebs, ist ein unerklärlicher Gewichtsverlust. Dies entspricht einer 130 kg schweren Frau, die 6 oder 7 kg verliert, oder einem 200 kg schweren Mann, der etwa 10 kg verliert. Es ist wichtig, dass Menschen, die unerwartet Gewicht verlieren, einen Arzt aufsuchen. Obwohl ein Gewichtsverlust bei fortgeschrittenen Krebserkrankungen wahrscheinlicher ist, kann er auch bei Krebserkrankungen im Frühstadium auftreten.
Das Kachexie-Syndrom, das sowohl Gewichtsverlust als auch Muskelabbau beinhaltet, ist nicht nur ein Symptom von Krebs, sondern gilt bei etwa 20 Prozent der Krebspatienten als direkte Todesursache.
Schwellungen, Klumpen und Beulen am Körper
Beulen und Klumpen an verschiedenen Stellen des Körpers können ein Symptom für viele Krebsarten sein. Knoten in der Brust können eines der Krebssymptome sein. Zu den weniger häufigen Symptomen von Brustkrebs gehören Rötung, Verdickung oder Orangenhaut in der Brust. Hodenknoten können ein Anzeichen für Hodenkrebs sein. Ebenso wie Frauen wird auch Männern eine monatliche Selbstuntersuchung der Brust empfohlen.
Vergrößerte Lymphknoten können das erste Anzeichen für Krebs sein, insbesondere für Lymphome, und können an vielen Stellen des Körpers auftreten. Andererseits darf nicht vergessen werden, dass die festgestellten Knoten sowohl ein Anzeichen für das erste Krebsstadium als auch ein Indikator für das letzte Stadium sein können.
Nächtliche Schweißausbrüche
Nächtliches Schwitzen ist ein häufiges Symptom von Krebs, insbesondere von Leukämien und Lymphomen. Nächtliche Schweißausbrüche, die durch Krebs verursacht werden, sind nicht nur “Hitzewallungen”. Bei krebsbedingtem Nachtschweiß können die Betroffenen so nass werden, dass sie aus dem Bett aufstehen und ihren Schlafanzug wechseln müssen. Nächtliches Schwitzen tritt häufiger während des Schlafs auf.
Hämorrhagien
Ungewöhnliche Blutungen können bei vielen Krebsarten früh oder spät auftreten. Blut im Auswurf kann auf Lungenkrebs hindeuten, Blut im Stuhl auf Darmkrebs, Blut im Urin auf Blasenkrebs und vorzeitige Blutungen aus der Scheide auf Gebärmutter- oder Gebärmutterhalskrebs. Die Farbe des Blutes kann manchmal ein wichtiger Hinweis darauf sein, woher das Blut kommt. Blutungen aus dem unteren Dickdarm (linker Dickdarm) und dem Enddarm sind in der Regel hellrot. Blutungen aus dem oberen Dickdarm (rechter Dickdarm) und dem Dünndarm sind in der Regel dunkelrot, braun oder schwarz. Blut, das von weiter oben kommt, z. B. aus der Speiseröhre oder dem Magen, sieht oft aus wie Kaffeesatz. Andere Ursachen für rektale Blutungen sind Hämorrhoiden, Analfissuren und Kolitis. Andererseits sind einige Arten von Dickdarmentzündungen ein Risikofaktor für Dickdarmkrebs.
Anhaltender und hartnäckiger Husten
Ein hartnäckiger Husten, der nicht verschwindet, kann eines der ersten Anzeichen für Lungenkrebs sein. Anhaltender Husten kann auch ein Zeichen für Krebs sein, der sich auf die Lunge ausgebreitet hat, wie Brustkrebs, Darmkrebs, Nierenkrebs oder Prostatakrebs.
Kurzatmigkeit
Kurzatmigkeit ist eines der wichtigsten Frühsymptome von Lungenkrebs. Obwohl Lungenkrebs mit chronischem Husten einhergehen kann, haben sich die häufigsten Symptome von Lungenkrebs im Laufe der Zeit verändert. Früher wuchsen die häufigsten Formen der Krankheit eher in der Nähe der großen Atemwege in der Lunge, was zu häufigem (blutigem) Husten führen konnte. Heute wächst die häufigste Form von Lungenkrebs, das Adenokarzinom der Lunge, in der Regel in den äußeren Regionen der Lunge. Diese Tumore können recht groß werden, bevor sie entdeckt werden, und verursachen häufig Atemnot.
Brust-, Unterleibs-, Becken-, Rücken- oder Kopfschmerzen
Schmerzen in jedem Teil des Körpers können ein mögliches Anzeichen für Krebs sein.
Kopfschmerzen
Kopfschmerzen sind das häufigste Symptom von Hirntumoren oder Tumoren, die sich im Gehirn ausgebreitet (metastasiert) haben; die meisten Kopfschmerzen sind jedoch nicht auf Krebs zurückzuführen.
Der klassische Kopfschmerz, der mit einem Hirntumor einhergeht, ist morgens besonders stark und nimmt mit der Zeit zu. Diese Kopfschmerzen können sich bei Aktivitäten wie Husten oder Pressen beim Stuhlgang verschlimmern und können nur auf einer Seite des Kopfes auftreten. Menschen mit Kopfschmerzen aufgrund eines Hirntumors haben oft auch andere Symptome wie Übelkeit und Erbrechen, Schwäche auf einer Körperseite oder neu auftretende Krampfanfälle. Hirntumore können aber auch Kopfschmerzen verursachen, die nicht von Spannungskopfschmerzen zu unterscheiden sind, was das einzige Anzeichen für einen Tumor sein kann.
Krebs, der sich auf das Gehirn ausgebreitet hat (Hirnmetastasen), ist siebenmal häufiger als primäre Hirntumore und verursacht ähnliche Symptome. Zu den Krebsarten, die am ehesten auf das Gehirn übergreifen, gehören Brustkrebs, Lungenkrebs, Blasenkrebs und Melanome. Es ist nicht ungewöhnlich, dass Menschen mit Hirnmetastasen, insbesondere solche mit kleinzelligem Lungenkrebs, Symptome im Zusammenhang mit einem Tumor im Gehirn haben, bevor Symptome im Zusammenhang mit dem Primärkrebs auftreten.
Rückenschmerzen
Die häufigste Ursache für Rückenschmerzen sind Verspannungen im Rücken, aber anhaltende Rückenschmerzen ohne offensichtliche Ursache können auch ein Anzeichen für Krebs sein. Krebsbedingte Rückenschmerzen sind oft (aber nicht immer) nachts schlimmer, der Schmerz lässt nicht nach, wenn man sich hinlegt, und er kann sich beim tiefen Einatmen verschlimmern. Rückenschmerzen können durch Tumore in der Brust, im Unterleib oder im Becken oder durch Metastasen anderer Krebsarten in der Wirbelsäule verursacht werden.
Schmerzen in der Schulter
Schmerzen in den Schultern oder im Schulterblatt sind häufig auf eine Muskelzerrung zurückzuführen, können aber in seltenen Fällen auch ein wichtiges Frühsymptom von Krebs sein. Schmerzen bei Lungenkrebs, Brustkrebs und Lymphomen sowie Metastasen von anderen Krebsarten können Schmerzen in den Schultern oder im Schulterblatt verursachen.
Schmerzen in der Brust
Ungeklärte Herzerkrankungen oder Schmerzen in der Brust können ebenfalls ein Zeichen für Krebs sein. Obwohl die Lunge keine Nervenenden hat, haben viele Menschen, bei denen Lungenkrebs diagnostiziert wurde, Schmerzen, die sich wie “Lungenschmerzen” anfühlen.
Schmerzen im Unterleib oder im Beckenbereich
Wie bei Schmerzen in anderen Körperteilen sind Unterleibs- und Beckenschmerzen zwar meist auf andere Erkrankungen als Krebs zurückzuführen, aber gerade diese beiden Schmerzarten (Gebärmutterkrebs, Eierstockkrebs, Gebärmutterhalskrebs, Eileiterkrebs, Eierstockkrebs) sollten nicht vernachlässigt werden, da sie zu den Symptomen von Krebs gehören, und sollten von einem Arzt untersucht werden.
Sich müde fühlen
Im Gegensatz zu gewöhnlicher Müdigkeit ist die durch Krebs verursachte Müdigkeit oft sehr viel anhaltender. Manche Menschen beschreiben diese Müdigkeit als “Ganzkörper-Müdigkeit” oder Erschöpfung. Kennzeichnend für diese Art von Müdigkeit ist, dass sie die Lebensqualität erheblich einschränkt.
Krebs kann auf vielerlei Weise zu Müdigkeit führen. Im Allgemeinen kann das Wachstum eines Tumors eine Herausforderung für den Körper darstellen. Andere Krebssymptome wie Kurzatmigkeit, Blutarmut, Schmerzen oder ein verminderter Sauerstoffgehalt im Blut (Hypoxie) können ebenfalls Müdigkeit verursachen.
Hautveränderungen
Hautveränderungen können sowohl bei Tumoren der inneren Organe als auch bei Hauttumoren auftreten. Einige Krebsarten können Gelbsucht, Hautverdunkelung oder Hautrötung verursachen. Obwohl Hautkrebsarten wie das Basalzellkarzinom und das Plattenepithelkarzinom am häufigsten vorkommen, ist das Melanom für die meisten Todesfälle durch Hautkrebs verantwortlich. Es ist erwähnenswert, dass Melanome in der Regel zuerst von einer anderen Person entdeckt werden. Eine verdächtige Hautstelle am Körper sollte nicht vernachlässigt werden, und es sollte eine Gesundheitseinrichtung konsultiert werden.
Blähungen (abdominale Distension)
Blähungen können das erste Anzeichen vieler Krebsarten sein, darunter Eierstockkrebs, Bauchspeicheldrüsenkrebs und Dickdarmkrebs. Eierstockkrebs-Symptome werden oft als “stiller Killer” bezeichnet, weil sie oft erst spät in der Krankheit auftreten. Blähungen sind nachweislich ein häufiges Symptom von Eierstockkrebs; Frauen führen dieses Symptom jedoch häufig auf eine Gewichtszunahme oder andere Ursachen zurück. Auch Verstopfung, Schmerzen beim Geschlechtsverkehr und häufiges Wasserlassen können Symptome von Eierstockkrebs sein. Wenn eines dieser Symptome auftritt, sollte ein Arzt aufgesucht werden. Es sollte nicht vergessen werden, dass eine frühzeitige Diagnose von Eierstockkrebs den Erfolg der Behandlung erhöht.
Blut im Urin
Blut im Urin kann ein Symptom für Blasenkrebs sein.
Schwierigkeiten beim Schlucken
Schluckbeschwerden, auch bekannt als Dysphagie, können ein Symptom von Krebs sein. Schluckbeschwerden sind in der Regel das erste Symptom von Speiseröhrenkrebs aufgrund einer Verengung der Speiseröhre. Da die Speiseröhre jedoch durch die Region zwischen den Lungen verläuft, können Tumore wie Lungenkrebs und Lymphome in dieser Region häufig dieses Symptom verursachen.
WAS SIND DIE SELTENEN SYMPTOME VON KREBS?
Einige der seltenen Symptome von Krebs sind die folgenden:
Blutgerinnsel
Es gibt viele Risikofaktoren für Blutgerinnsel in den Beinen, die als tiefe Venenthrombose (TVT) bezeichnet werden. In den letzten Jahren hat man festgestellt, dass einer dieser Faktoren eine zuvor nicht diagnostizierte Krebserkrankung sein kann. 20 Nicht nur deshalb ist es wichtig, die Symptome einer tiefen Venenthrombose zu kennen, sondern auch, weil sie sich häufig ablösen und in die Lunge wandern, was als Lungenembolie bezeichnet wird.
Veränderungen im Urin
Veränderungen beim Wasserlassen können ein frühes Anzeichen für Krebs sein.
Sodbrennen oder Verdauungsstörungen
Chronisches Sodbrennen aufgrund der gastroösophagealen Refluxkrankheit (GERD) kann eine der Ursachen für Speiseröhrenkrebs sein.
Zona
In seltenen Fällen kann Gürtelrose, eine Erkrankung, die durch die Reaktivierung des Windpockenvirus verursacht wird, ein Symptom für Krebs sein.
Depression
Eine neu auftretende Depression kann auch ein Frühsymptom von Krebs sein.
Minimal traumatisierte Frakturen
Wenn der Krebs auf die Knochen übergreift, kann er diese schwächen, so dass schon bei geringem Trauma Knochenbrüche auftreten. Eine Fraktur, die in einem durch Krebs geschwächten Knochen auftritt, wird als pathologische Fraktur bezeichnet.
Leichte Blutergüsse
Auch Blutergüsse, die nicht durch Verletzungen verursacht wurden, können vom Arzt beurteilt werden. Krebszellen, die das Knochenmark infiltrieren, können die Zahl der Blutplättchen im Blut verringern. Eine Verminderung der Blutplättchen kann auch zu leichten Blutergüssen führen. Einige Leukämien, Lymphknotentumore oder Knochenmarkskrebs können Blutergüsse verursachen. Neben leichten Blutergüssen auf der Haut können bei diesen Erkrankungen auch Zahnfleischbluten, Nasenbluten oder Blutungen an anderen Stellen auftreten. Wenn Sie ohne ersichtlichen Grund Nasenbluten, starkes Zahnfleischbluten nach dem Zähneputzen, sehr starkes und lang anhaltendes Bluten aus kleinen Schnitt- oder Schürfwunden haben, sollten Sie sofort einen Arzt aufsuchen.
Weiße Flecken im Mund
Weiße Flecken auf dem Zahnfleisch oder der Zunge (Leukoplakie) können ein frühes Anzeichen für Mundhöhlenkrebs sein.
Andere Ursachen
Einige Krebsarten verursachen je nach den Substanzen, die sie produzieren und absondern, unterschiedliche Symptome. Zum Beispiel produzieren einige Lungenkrebsarten eine hormonähnliche Substanz, die den Kalziumspiegel im Blut erhöht.
WIE WIRD KREBS DIAGNOSTIZIERT?
Die zur Krebsdiagnose eingesetzten Instrumente sind umfangreich und umfassen Labortests, bildgebende Untersuchungen und andere invasive oder nicht-invasive Verfahren
Körperliche Untersuchungen
Sie wird verwendet, um Knoten, Massen, Läsionen oder Veränderungen der Hautfarbe zu beurteilen, die auf Krebs hinweisen.
Vollständiges Blutbild (CBC)
Während der Behandlung können Anomalien in der Blutchemie, die auf Leukämie hindeuten, festgestellt werden, während die Entwicklung von Anämie, Infektionen oder anderen Komplikationen überwacht wird.
Tumormarker-Tests
Tumormarker-Tests sind Bluttests zur Messung von Substanzen im Blut, die bei Vorliegen von Krebs ansteigen. Dazu gehören der Prostata-spezifische Antigen-Test (PSA) zur Erkennung von Prostatakrebs, die BRCA1- und BRCA2-Tests, die sowohl für Brust- als auch für Eierstockkrebs verwendet werden, und der CA-125-Test zur Erkennung eines Tumors, der mit einer Reihe von Krebsarten in Verbindung steht
Durchflusszytometrie
Die Durchflusszytometrie wertet in Flüssigkeit suspendierte Zellen aus und ist nützlich für die Diagnose von Leukämie oder Lymphomen aus einer Blut- oder Knochenmarksprobe.
Biopsie
Eine Biopsie ist die Entnahme einer Gewebe- oder Flüssigkeitsprobe aus dem Körper zur Untersuchung unter dem Mikroskop. Sie kann durch Feinnadelaspiration (FNA), Kernnadelbiopsie, Kegelbiopsie oder chirurgisch gewonnen werden.
Bildgebende Tests
Bildgebende Untersuchungen werden zur Diagnose von Krebs eingesetzt. Zu diesen Tests gehören Röntgenaufnahmen, Computertomographie (CT) und Magnetresonanztomographie (MRT). Die nuklearmedizinische Bildgebung mit radioaktiven Tracern kann bestimmte Krebsarten diagnostizieren, während mit der Positronen-Emissions-Tomographie Veränderungen im Stoffwechsel nachgewiesen werden können.
Genomische Tests
Genomische Tests können dazu beitragen, die chromosomalen Merkmale eines Tumors zu ermitteln und dem Onkologen zu helfen, die Auslöser der Krankheit zu verstehen und die am besten geeignete medikamentöse Behandlung zu wählen.
WAS IST EIN KREBS-STAGING?
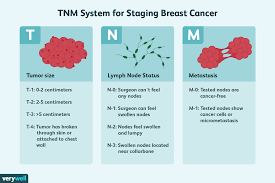
Die Klassifizierung von Krebs nach der anatomischen Ausdehnung der Krankheit, d. h. nach dem Stadium, ist für die Patientenversorgung, die Forschung und die Krebsbekämpfung von wesentlicher Bedeutung. Das TNM-Stadiensystem der UICC ist die gemeinsame Sprache, die von den Angehörigen der Gesundheitsberufe in der Onkologie verwendet wird, um über das Ausmaß der Krebserkrankung jedes einzelnen Patienten zu kommunizieren. Sobald das Krebsstadium bekannt und verstanden ist, dient es häufig als Grundlage für die Entscheidung über eine geeignete Behandlung und die individuelle Prognose. Es kann auch zur Information und Bewertung von Behandlungsrichtlinien verwendet werden und stellt eine wichtige Information für politische Entscheidungsträger dar, die Pläne zur Krebsbekämpfung, Prävention und Forschung entwickeln oder umsetzen.
Die TNM-Klassifikation konzentriert sich auf die anatomische Größe des Tumors und wird anhand der folgenden Kategorien bestimmt
T definiert die Größe des Haupttumors (Primärtumors)
N beschreibt, ob sich der Krebs auf nahe gelegene Lymphknoten ausgebreitet hat
M beschreibt, ob der Krebs Metastasen gebildet hat (sich vom Primärtumor auf einen anderen Teil des Körpers ausgebreitet hat)
WAS IST EINE METASTASE?
Unter Metastasierung versteht man die Ausbreitung von Krebs in einen anderen Teil des Körpers als den, in dem er entstanden ist. Das bedeutet, dass sich Krebszellen in einem anderen Teil des Körpers ansiedeln und vermehren und neue Tumore bilden können. Krebszellen metastasieren über das Lymphsystem und den Blutkreislauf in andere Körperteile. Krebszellen aus dem ursprünglichen oder primären Tumor können in andere Bereiche wie die Lunge, die Knochen, die Leber, das Gehirn und andere Bereiche wandern. Diese metastasierenden Tumore sind “sekundäre Krebsarten”, da sie aus dem Primärtumor hervorgegangen sind. Die Metastasierung ist wichtig, weil sie bei der Festlegung des Stadiums und der Behandlung hilft.
WAS IST EINE KREBSBEHANDLUNG?

Die Krebsbehandlung richtet sich nach der Art des Krebses, dem Stadium zum Zeitpunkt der Diagnose und dem allgemeinen Gesundheitszustand der Person.
Für die Krebsbehandlung gibt es folgende Ansätze:
Bei der Chemotherapie werden Medikamente eingesetzt, die auf sich schnell teilende Zellen abzielen. Das Ziel dieser Medikamente ist es, Krebszellen zu zerstören. Die Medikamente können auch dazu beitragen, dass Tumore schrumpfen. Einige Nebenwirkungen der Chemotherapie können schwerwiegend sein.
Bei der Hormontherapie werden Medikamente eingenommen, die die Wirkungsweise bestimmter Hormone verändern oder die körpereigene Hormonproduktion stören. Die Hormontherapie wird zur Behandlung von Brustkrebs, Prostatakrebs und Krebserkrankungen des Fortpflanzungssystems eingesetzt, indem die Menge der Hormone im Körper verändert wird.
Die Immuntherapie, einer der Behandlungsansätze der neuen Generation bei Krebserkrankungen, zielt darauf ab, den Körper in die Lage zu versetzen, den Krebs aus eigener Kraft zu besiegen, indem das Immunsystem aktiviert wird. Die Immuntherapie, die weitaus weniger Nebenwirkungen hat als Chemotherapie und gezielte intelligente Therapien, schafft ein Gedächtnis in den Immunzellen, was zu besseren, langfristigen und dauerhaften Reaktionen führt.
Bei der Strahlentherapie werden hohe Strahlendosen eingesetzt, um Krebszellen zu zerstören. Der Arzt kann auch eine Strahlentherapie vor einem chirurgischen Eingriff empfehlen, um den Tumor zu verkleinern oder tumorbedingte Symptome zu lindern.
Eine Stammzelltransplantation kann insbesondere für Menschen mit blutbezogenen Krebserkrankungen wie Leukämie oder Lymphomen von Vorteil sein.
Bei der Krebsbehandlung ist ein chirurgischer Eingriff Teil des Behandlungsplans. So kann der Chirurg beispielsweise Lymphknoten entfernen, um die Ausbreitung der Krankheit einzudämmen oder zu verhindern.
Zielgerichtete Therapien sollen die Vermehrung von Krebszellen verhindern. Sie können auch das Immunsystem stärken. Zwei Beispiele für diese Therapien sind niedermolekulare Medikamente und monoklonale Antikörper.
Diese Behandlungsmethoden werden einzeln oder gemeinsam angewandt. Die erste Behandlung wird in der Regel als Erstlinienbehandlung bezeichnet. Die Behandlung, die nach der Erstlinienbehandlung erfolgt, wird als adjuvante Behandlung bezeichnet. Eine nach dem chirurgischen Eingriff durchgeführte Chemotherapie ist in der Tat eine adjuvante Behandlung. Die Behandlung, die vor der Erstlinienbehandlung erfolgt, wird als neoadjuvante Behandlung bezeichnet.
HÄUFIG GESTELLTE FRAGEN ZU KREBS
Was ist eine palliative Behandlung bei Krebs?
Ziel der Palliativpflege ist es, dass sich der Patient so gut wie möglich fühlt und die Lebensqualität verbessert wird, unabhängig vom Stadium der Krebserkrankung. Die Palliativpflege kann auf die körperlichen, geistigen, psychologischen und sozialen Bedürfnisse des Krebspatienten eingehen. Die palliative Behandlung kann gleichzeitig mit der kurativen Behandlung fortgesetzt werden. Das bedeutet, dass Patienten, die palliativmedizinisch versorgt werden, weiterhin aktiv behandelt werden können, um das Wachstum des Krebses zu verringern oder zu stoppen. Das Palliativteam arbeitet mit Krebsspezialisten zusammen, um die Nebenwirkungen der Behandlung zu behandeln und die Lebensqualität des Patienten zu erhalten. Krebsbehandlungen wie Operationen, Chemotherapie, Immuntherapie, zielgerichtete Therapien und Strahlentherapie können auch im Rahmen der Palliativversorgung eingesetzt werden. In diesem Fall besteht das Ziel in der Linderung der Symptome, nicht in der Bekämpfung des Krebses.
Was sind die Ziele der Krebsbehandlung?
Krebsbehandlungen haben unterschiedliche Ziele;
Endgültige Heilung (Cure): Das Ziel der Behandlung ist es, den Krebs vollständig zu heilen, damit Sie ein normales Leben führen können. Je nach Ihrer besonderen Situation kann dies möglich sein oder auch nicht.
Primäre Behandlung Ziel der Primärbehandlung ist es, den Krebs vollständig aus dem Körper zu entfernen oder die Krebszellen abzutöten. Jede Krebsbehandlung kann als Primärbehandlung eingesetzt werden, aber die häufigste primäre Krebsbehandlung für die meisten Krebsarten ist die Operation. Wenn der Krebs besonders empfindlich auf eine Strahlen- oder Chemotherapie reagiert, kann eine dieser Behandlungen als Erstbehandlung eingesetzt werden.
Adjuvante Behandlung: Ziel der adjuvanten Therapie ist es, Krebszellen abzutöten, die nach der primären Behandlung verbleiben können, um die Wahrscheinlichkeit eines erneuten Auftretens des Krebses zu verringern. Jede Krebsbehandlung kann als adjuvante Therapie eingesetzt werden. Zu den gängigen adjuvanten Behandlungen gehören Chemotherapie, Strahlentherapie und Hormontherapie.
Palliative Behandlung: Palliative Behandlungen können dazu beitragen, die Nebenwirkungen der Behandlung oder die durch den Krebs verursachten Anzeichen und Symptome zu lindern. Chirurgie, Strahlentherapie, Chemotherapie und Hormontherapie können eingesetzt werden, um Anzeichen und Symptome zu lindern. Medikamente können Symptome wie Schmerzen und Kurzatmigkeit lindern.
Was sollte zur Krebsprävention getan werden?

Krebs ist eine der häufigsten Todesursachen in unserem Land und in der Welt. Die Exposition gegenüber chemischen Substanzen, Rauchen und Alkoholkonsum, Stress und ungesunde Ernährung führen zu einem Anstieg der Krebsfälle. Kann das Krebsrisiko durch Vermeidung dieser äußeren Faktoren verringert werden? Experten sagen, dass eine Änderung des Lebensstils das Krebsrisiko verringert. Insbesondere durch eine Änderung der Ernährungsgewohnheiten, die Vermeidung von Gewohnheiten wie Rauchen und Alkohol und ein aktives Leben kann die Krebsrate gesenkt werden. Die beiden wichtigsten Punkte bei der Krebsprävention sind die Auswahl gesunder Lebensmittel und der Verzicht auf krebserregende Stoffe wie Rauchen. Jüngste Studien zeigen, dass eine gemüse- und obstreiche Ernährung, ein Leben ohne Rauchen, regelmäßige körperliche Betätigung und die Beibehaltung eines gesunden Körpergewichts die Entstehung von Krebs um bis zu 40 Prozent reduzieren können. Dies bedeutet, dass jedes Jahr weltweit 3-4 Millionen neue Krebsfälle verhindert werden können. Lebensmittel enthalten Vitamine, Mineralien und Ballaststoffe, die für ein gutes und gesundes Leben unerlässlich sind, sowie bioaktive Moleküle, die als Antioxidantien bekannt sind und eine schützende Wirkung haben. Diese schützen den Körper vor vielen schweren Krankheiten, einschließlich Krebs.
Statistiken zufolge sind Lungen-, Brust- und Dickdarmkrebs die am häufigsten diagnostizierten Krebsarten, während Lungen-, Leber- und Magenkrebs die häufigsten Ursachen für Todesfälle sind. Krebsfrüherkennungsuntersuchungen sollten einen hohen Stellenwert einnehmen, um Krebs in einem frühen Stadium zu diagnostizieren und eine korrekte Behandlung durchzuführen. Auch wenn eine Person keine Beschwerden hat, sollte sie sich in einem bestimmten Alter durch Krebsvorsorgeuntersuchungen schützen.
Es wird empfohlen, die folgenden Empfehlungen zur Krebsprävention zu berücksichtigen:
- Die Person sollte versuchen, ihr Idealgewicht zu halten.
- Eine einseitige Ernährung sollte vermieden werden. Alle Lebensmittelgruppen, einschließlich Fleisch, Milch, Getreide, Obst, Gemüse und Fette, sollten in angemessenen Mengen über den Tag verteilt verzehrt werden.
- Es sollte darauf geachtet werden, täglich 5 Portionen Obst und 2 Portionen Gemüse zu essen.
- Der Verzehr von Fruchtfleisch ist für die Krebsprävention sehr wichtig. Aus diesem Grund sollte Roggen-, Vollkorn- oder Vollweizenbrot gegenüber Weißbrot bevorzugt werden. Früchte, die mit der Schale gegessen werden können, sollten ungeschält verzehrt werden.
- Um das Idealgewicht zu halten, sollte ein übermäßiger Zuckerkonsum vermieden werden.
- Das Backen oder Kochen sollte als Kochmethode bevorzugt werden. Braten sollte vermieden werden, und das Essen sollte ohne zu starkes Anbraten gegart werden.
- Es ist wichtig, nicht zu rauchen und sich nicht in Raucherumgebungen aufzuhalten.
- Inaktivität sollte vermieden und die täglichen körperlichen Aktivitäten sollten gesteigert werden. Mindestens 2 Tage pro Woche Sport zu treiben, ist eine wichtige Voraussetzung für ein gesundes Leben.
- Täglich sollten 2-2,5 Liter Wasser getrunken werden.
- Der Konsum von Tee und Kaffee sollte reduziert werden. Beim Kaffeetrinken kann anstelle von Milchpulver halbfette Milch verwendet werden. Anstelle von Getränken mit hohem Zuckergehalt wie sauren Getränken und fertigen Fruchtsäften können Sie zuckerarme Kompotte, Bonbons, frisch gepresste Fruchtsäfte trinken.
- Übermäßiger Alkoholkonsum sollte vermieden werden.
- Es ist wichtig, 2 bis 3 Mal pro Woche Fisch zu verzehren, um von den positiven Auswirkungen der darin enthaltenen Omega-3-Fettsäure zu profitieren.
- Der Verzehr von Lebensmitteln mit einem hohen Gehalt an Antioxidantien wie Brokkoli, Blumenkohl und Kohl sollte erhöht werden.
- Es sollte darauf geachtet werden, alle Arten von Lebensmitteln gut gewaschen und sauber zuzubereiten, und es sollte sauberes Wasser verwendet werden.
- Frittierfett sollte nicht wiederholt verwendet werden.
- Direkt auf dem Feuer gekochte Speisen sollten nicht mehr als einen Tag pro Woche verzehrt werden.
- Der tägliche Salzkonsum sollte unter 5 Gramm liegen. Der Verzehr von Lebensmitteln mit hohem Salzgehalt wie Pickles und Essiggurken sollte eingeschränkt werden.
- Salami, Wurst und geräucherte Lebensmittel sollten so weit wie möglich vermieden werden.
- Es ist wichtig, 2 Gläser Milch oder Joghurt am Tag zu trinken.
- Direkte Sonneneinstrahlung sollte vor allem im Sommer vermieden werden.
Worauf sollten Krebspatienten achten?
Im Allgemeinen sollten Krebspatienten auf folgende Punkte achten.
- Natürliche und gesunde Lebensmittel, frisches Gemüse und Obst sollten täglich zu den Haupt- und Zwischenmahlzeiten verzehrt werden, je nach Jahreszeit.
- Falsche Ernährung während Kemorterapi führt zu Übergewicht und Magenbeschwerden. Zuckerhaltige und mehlige Lebensmittel sind der wichtigste Grund dafür. Brauner Zucker sollte bevorzugt werden und Roggenbrot aus Vollkornmehl sollte anstelle von Weißbrot verzehrt werden. Feste oder innere Fette und Margarine sollten nicht verwendet werden.
- Ein geringer Anteil an Sonnenblumen- oder Olivenöl sollte bevorzugt werden.
- Es ist wichtig, viel Wasser zu trinken.
- Wenn Patienten Medikamente gegen Blutdruck, Cholesterin, Diabetes oder andere chronische Krankheiten einnehmen, die sie vor Beginn der Chemotherapie eingenommen haben, sollten sie diese Medikamente auf keinen Fall absetzen.
- Die Medikation von Patienten, die Blutverdünner einnehmen, wird ebenfalls durch den Onkologen geregelt.
- Orthopädische Matratze und Kopfkissen sollten bevorzugt werden und 8 Stunden Schlaf sollten erforderlich sein.
- Geschirr sollte in der Maschine gewaschen werden, nicht mit der Hand.
- Krebspatienten sollten sie meiden!
- Ein Übermaß an Milch (mehr als 1-2 Gläser pro Tag) wird nicht empfohlen, da dies zu einem plötzlichen Blutzuckerabfall und -anstieg führen kann. Stattdessen können Sie 250 g bis 500 g Joghurt oder Hüttenkäse mit Buttermilch zu sich nehmen.
- Die Menge an rotem Fleisch sollte reduziert werden. Eiweiß sollte aus anderen Eiweißquellen wie weißem Fleisch, Käse und Hülsenfrüchten zugeführt werden.
- Übermäßig fette und schwere Mahlzeiten sollten vermieden werden.
- Lebensmittel mit hohem Zuckergehalt sollten nicht bevorzugt werden.
- Von den Zitrusfrüchten sollte die Grapefruit bei Patienten, die eine Chemotherapie erhalten, nicht verwendet werden, da sie mit den Medikamenten in Wechselwirkung tritt; Orangen und Mandarinen sind vorzuziehen.
- Hohe Dosen von Vitaminen sollten nicht eingenommen werden, und vor der Einnahme von Vitaminen sollte ein Arzt konsultiert werden.
- Mischungen mit unbekannten Inhaltsstoffen sollten nicht konsumiert werden.
- Patientinnen mit Brusttumoren sollten vor der Einnahme von Soja und Leinsamen ihren Arzt befragen.
- Krebspatienten sollten Sportarten bevorzugen, die den Körper nicht übermäßig belasten und die ihnen Spaß machen.
- Gegen die Hauttrockenheit sollte viel Wasser getrunken werden. Patienten, denen der Geschmack von Wasser unangenehm ist, können Kräutertees trinken.
- Das Telefon sollte für Krebspatienten kein Gesprächswerkzeug sein. Es sollten kurze Gespräche geführt und Kopfhörer benutzt werden.
- Bei der Benutzung des Laptops sollte darauf geachtet werden, dass der Computer auf dem Tisch steht.
- Das Fernsehgerät sollte sowohl am Schalter als auch an der Fernbedienung ausgeschaltet werden. Dadurch wird die Emission von Strahlung verhindert.
- Krebspatienten können sich einer Kernspintomographie und einer Tomographie unterziehen. Es schadet den Patienten nicht, durch das Röntgengerät zu gehen.
Kann Krebs eine Gewichtszunahme verursachen?
Obwohl Gewichtsverlust ein häufigeres Anzeichen von Krebs ist, können manche Menschen mit Krebs auch an Gewicht zunehmen. Studien zeigen, dass mehr als die Hälfte der Frauen mit Brustkrebs während der Behandlung an Gewicht zunimmt und dass diese zusätzlichen Pfunde mit schlechteren Behandlungsergebnissen verbunden sind. Übermäßiges Gewicht kann eine Nebenwirkung von Medikamenten wie Steroiden oder Hormonen sein. Außerdem können einige Chemotherapeutika zusätzliche Flüssigkeitseinlagerungen, so genannte Ödeme, verursachen. Dies kann ebenfalls zu einer Gewichtszunahme führen. Darüber hinaus stellen viele Krebspatienten fest, dass ihr Energieniveau sinkt, was zu Inaktivität und Gewichtszunahme führen kann.
Wirkt sich Krebs auf den Blutdruck aus?
Einige Krebsmedikamente, wie z. B. Anti-VEGF-Medikamente, können einen Anstieg des Blutdrucks verursachen. Diese Behandlungen helfen, den Blutfluss zu Tumoren zu blockieren, können aber auch andere Blutgefäße im Körper beeinträchtigen, was den Blutdruck erhöhen kann. Hoher Blutdruck kann auch ein Anzeichen für bestimmte Krebsarten sein, wie z. B. Nebennierenkrebs. Eine Chemotherapie und bestimmte zielgerichtete Medikamente, die zur Behandlung von Krebs eingesetzt werden, können ebenfalls einen niedrigen Blutdruck verursachen.
Welcher Zusammenhang besteht zwischen Rauchen und Krebs?
Ein Teil der krebsbedingten Todesfälle ist auf das Rauchen und andere Tabakerzeugnisse zurückzuführen. Das Rauchen von 1-10 Zigaretten pro Tag erhöht das Lungenkrebsrisiko im Vergleich zu Nichtrauchern um 20 Prozent, während das Rauchen von zwei Schachteln das Risiko um 80 Prozent erhöht. Aber auch wenn man nicht raucht, erhöht der Aufenthalt in einer rauchenden Umgebung (Passivrauchen) das Lungenkrebsrisiko um etwa das 1,5-fache. Das Risiko, an Lungenkrebs zu erkranken, halbiert sich bei jemandem, der etwa 20 Jahre lang eine Schachtel Zigaretten pro Tag geraucht hat, innerhalb von 10 Jahren nach dem Rauchstopp. Der Rauchstopp ist die wichtigste Vorbeugung, um das Risiko von Krebs und anderen Herz-Kreislauf- und Lungenkrankheiten zu verringern. Zu diesem Zweck wird Ihnen Ihr Arzt die psychologische und medikamentöse (Nikotinpflaster, Kaugummis) Unterstützung bieten, die Sie bei der Raucherentwöhnung benötigen. Rauchen spielt eine sehr wichtige Rolle bei der Entstehung von Lungen-, Rachen-, Speiseröhren-, Blasen-, Bauchspeicheldrüsen-, Nieren-, Gebärmutterhals- und Brustkrebs. Neben dem Nikotin im Tabak verursachen viele krebserregende Stoffe wie Nickel, Kadmium, Teer, Monoxid, Arsen und Radon Krebs, indem sie das Tumorsuppressorgen p53 mutieren lassen. Auch Passivraucher sind gefährdet. Die wichtigste Ursache für Krebserkrankungen bei Kindern ist das Rauchen der Eltern. Tatsächlich ist Rauchen während der Schwangerschaft die wichtigste Ursache für pädiatrische Leukämie.
Welcher Zusammenhang besteht zwischen Krebs und Fettleibigkeit?
Verminderte körperliche Aktivität und Fettleibigkeit führen zu einer Zunahme der Krebsarten. Wissenschaftliche Studien zeigen, dass Fettleibigkeit ein Risikofaktor für Brust-, Gebärmutter-, Darm-, Speiseröhren- und Nierenkrebs ist. Es wird vermutet, dass dieses erhöhte Risiko mit einem Anstieg des Östrogenspiegels aufgrund von Fettleibigkeit zusammenhängt. Daher gelten die Vermeidung von Fettleibigkeit und die Steigerung der körperlichen Aktivität als wichtige Faktoren für die Krebsprävention.
Kann Krebs Blutgerinnsel verursachen?
Menschen mit Krebs haben ein höheres Risiko, eine tiefe Venenthrombose (DVT: ein Blutgerinnsel, das sich in einer tiefen Vene bildet) zu entwickeln. Auch viele Chemotherapeutika können das Risiko einer TVT erhöhen.
Erhöht die Umweltverschmutzung die Zahl der Krebsfälle?
Ein wichtiger Grund für das Auftreten von Krebs ist die zunehmende Umweltverschmutzung. Die Menschheit gräbt die Erde um und fördert viele Mineralien zutage, zeigt aber nicht die gleiche Sensibilität bei der Neutralisierung der Abfälle dieser Mineralien, die nicht in der Erde vorkommen sollten. “Batterien”, die jeden Tag benutzt und weggeworfen werden, sind das einfachste Beispiel dafür. Der Beitrag der Umweltverschmutzung zur Krebsentstehung erreicht etwa 10 Prozent, wenn man den Ozonabbau und berufliche Faktoren einbezieht. Der Rückgang des stratosphärischen Ozons hat die schädlichen Auswirkungen der ultravioletten Strahlen verstärkt, und die Wirkung der ultravioletten Strahlen auf Hautkrebs ist sicher.
Welche Bedeutung hat die psychologische Unterstützung bei Krebs?
Die Gefühle des Schocks, der Verleugnung, der Wut, der Traurigkeit, der Angst und der Schuld, die manchmal mit den Gefühlen eines Patienten einhergehen, der erfährt, dass er “Krebs” hat, wenn er wegen eines kleinen Knotens in der Brust, einer Blutung im Urin, eines nicht abklingenden Hustens oder eines Leberflecks, der seine Form verändert hat, einen Arzt aufsucht, können sowohl beim Patienten als auch bei seinen Angehörigen psychische Probleme hervorrufen. Diese Emotionen können zu einer Krisensituation führen, indem sie das gesamte Leben der Person beeinträchtigen, einschließlich der Arbeit und des sozialen Lebens. Im Kampf gegen den Krebs ist es von großer Bedeutung, neben dem Körper auch die Seele zu behandeln und zu unterstützen, damit die Behandlung erfolgreich ist. Auch die psychologische Unterstützung verbessert die Lebensqualität des Patienten. Die unterstützenden Therapien, die von den spezialisierten Ärzten für Krebspsychologie für jeden Patienten individuell festgelegt werden, helfen den Patienten und ihren Angehörigen, diesen schwierigen Prozess leichter zu bewältigen. Die Verbesserung des psychischen Zustands der Patienten und die positive Perspektive, die sie gewinnen, erhöhen auch ihre Lebensqualität und die Erfolgsaussichten ihrer Behandlung. Mit diesen unterstützenden Therapien ist es möglich, sich an den Krankheitsprozess anzupassen, der plötzlich aus einem gesunden Leben auftaucht, sich körperlich und geistig wohl zu fühlen und die Kampfkraft zu steigern. Darüber hinaus ist es sehr wichtig, psychiatrische Unterstützung zu leisten, um die Fähigkeit zur Bewältigung körperlicher und seelischer Beschwerden wie Angst, Unruhe, Depression, Schlaflosigkeit, Schwäche, Übelkeit und Schmerzen zu verbessern, Familienmitglieder, die eine ähnliche Krise erlebt haben, auf gesunde Weise in das Unterstützungssystem des Patienten einzubeziehen, die Ordnung in Bezug auf das soziale Leben, das Teilen von Verantwortlichkeiten, die Arbeit und das wirtschaftliche Leben, das unterbrochen wurde, wiederherzustellen.
Verursacht der Konsum von Salz Krebs?
Obwohl Salz selbst keinen Krebs verursacht, stört es die Struktur der Magenoberfläche und bereitet das Umfeld für die Wirkung krebserregender Stoffe vor. Auch in Essiggurken, in denen viel Salz verwendet wird, spielen so genannte Nitrosamine eine wichtige Rolle bei der Krebsentstehung.
Warum kann Krebs Rückenschmerzen verursachen?
Die meisten Fälle von Rückenschmerzen werden nicht durch Krebs verursacht, aber Rückenschmerzen können ein Indikator sein. Rückenschmerzen sind ein Symptom vieler Krebsarten, einschließlich primärem Knochenkrebs und Krebs, der aus der Brust, dem Dickdarm, den Hoden oder der Lunge metastasiert hat. Häufig drücken Tumore auf die Wirbelsäule, beeinträchtigen die umliegenden Nerven und verursachen Rückenschmerzen.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
Die gynäkologischen Krebsarten, die als weibliche Krebsarten bezeichnet werden, sind wie folgt aufgelistet:
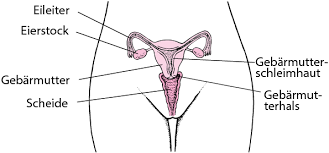
Was ist gynäkologische Onkologie?
Der Wissenschaftszweig, der sich mit Krebserkrankungen der weiblichen Geschlechtsorgane befasst, wird als gynäkologische Onkologie bezeichnet.
Worauf wird in der gynäkologischen Onkologie geachtet?
Die Eierstöcke, die Gebärmutter, die Eileiter, die Vagina und die Vulva, die den Eingang zur Vagina begrenzt, sind die weiblichen Fortpflanzungsorgane. Die gynäkologische Onkologie spielt eine Rolle bei der Vorbeugung, Diagnose und Behandlung von Krebserkrankungen in diesen Organen. Die gynäkologische Onkologie ist eine Abteilung, in der die besten Ärzte arbeiten. Die gynäkologisch-onkologische Chirurgie ist ebenfalls ein Teilbereich der gynäkologischen Onkologie. Die gynäkologische Onkologie wird von vielen Menschen auch als gynäkologische Onkologie, gynäkologische Onkologie, gynäkologische Krebschirurgie, gynäkologische Onkologie bezeichnet.
Was sind die Symptome von Krebserkrankungen bei Frauen?
Krebserkrankungen der Frau verursachen je nach Art und Stadium der Erkrankung unterschiedliche Symptome. Die Symptome von Krebs bei Frauen lassen sich im Allgemeinen wie folgt auflisten:
- Blutungen oder Ausfluss bei Frauen in den Wechseljahren
- Unregelmäßigkeit der Menstruation
- Blutungen außerhalb der Menstruation
- Schmerzen nach dem Geschlechtsverkehr, Unterleibsschmerzen
- Schwellung des Abdomens
- Wunden im Vaginalbereich, Juckreiz
- Probleme beim Essen und Trinken
Faktoren, die für Krebs prädisponieren
Viele chemische Produkte wie die Industrialisierung, die zunehmende Umwelt- und Luftverschmutzung, die Ernährung mit Fertignahrungsmitteln und das Rauchen bereiten den Boden für die Entwicklung von Krebszellen, indem sie die Struktur von hemmenden Genen stören, die Krebs und Tumorbildung im menschlichen Organismus verhindern. Es ist unwahrscheinlich, dass diese negativen Faktoren verhindert und reduziert werden können. Daher muss die Realität des Krebses akzeptiert und Maßnahmen ergriffen werden.
Fortschritte in der Gesundheitsinformatik sorgen für ein Lächeln bei Krebs
Trotz des rasanten Anstiegs der Zahl der Krebserkrankungen ist eine frühzeitige Krebsdiagnose dank wichtiger Fortschritte im Bereich der Gesundheitstechnologie möglich. Darüber hinaus wird die Behandlung durch den Zuwachs an medizinischem Wissen und chirurgischer Erfahrung effektiver. In den letzten 10 Jahren haben klinische und molekulare Studien über Krebserkrankungen des Fortpflanzungssystems viele Unbekannte geklärt, und die Faktoren, die Krebs verursachen, sind besser verstanden worden. Die Einführung von Behandlungen wie der direkten, auf Krebszellen ausgerichteten Therapie, von Impfstoffen und der Immuntherapie tragen ebenfalls zu den Überlebensraten bei.
Die medizinische Onkologie befasst sich mit Chemotherapieanwendungen, d. h. mit der medikamentösen Behandlung von Krebs. In den Zentren für medizinische Onkologie in unserem Land werden Chemotherapien, zielgerichtete intelligente Medikamente und Moleküle, Hormontherapien, Immuntherapien und biologische Therapien, die vom onkologischen Arzt empfohlen werden, zur Krebsbehandlung eingesetzt.
Pädiatrische Krebserkrankungen und Frauenkrebs
Die Zunahme der Krebserkrankungen, die Erhöhung des Heiratsalters und die Verschiebung der Empfängnis in ein höheres Alter aufgrund der Berufstätigkeit der Frauen bringen bei durchschnittlich 10 % der Frauen Krebs und Kinderwunsch zusammen. Bei Frauen, die keine Kinder haben, kann, wenn der Krebs in einem frühen Stadium erkannt wird, die Fortpflanzungsfähigkeit erhalten werden, indem je nach Art der Erkrankung nur der krebsbefallene Bereich mit einer hormonellen oder chirurgischen Behandlung entfernt wird. Nach der Geburt eines Kindes kann die chirurgische Behandlung abgeschlossen werden, wenn eine Behandlung erforderlich ist.
Gebärmutterhalskrebs und reproduktionserhaltende Operationen werden weltweit seit mehr als 20 Jahren durchgeführt, und die Ergebnisse sind in Bezug auf eine Schwangerschaft nach der Behandlung zufriedenstellend. Bei Gebärmutterkrebs im Frühstadium wird nur der Krebsbereich entfernt und die Gebärmutter und die Scheide werden verbunden.
Zwanzig Prozent der Gebärmutterkrebserkrankungen treten unter 45 Jahren und 5 Prozent unter 40 Jahren auf. Daher ist die Zahl der Patientinnen mit Gebärmutterkrebs und Kinderwunsch recht hoch. Befindet sich die Krankheit in einem frühen Stadium, d. h. hat sie sich noch nicht über die Innenwand der Gebärmutter hinaus ausgebreitet und ist der Zelltyp nicht sehr schlimm, kann sie mit Medikamenten behandelt werden, und nach Rückbildung der Krankheit ist eine Empfängnis möglich. In diesem Fall kann mit einer Progesteronbehandlung ein Erfolg von bis zu 70 Prozent erzielt werden.
In den letzten Jahren ist die Erhaltung der Fruchtbarkeit bei Eierstockkrebs immer häufiger geworden. Insbesondere bei Keimzellen-Ovarialkarzinomen und Ovarialkarzinomen des Borderline-Typs, die in einem frühen Alter auftreten, ist es möglich, schwanger zu werden, indem nur das Krebsgewebe oder der krebsbefallene Eierstock entfernt und die Gebärmutter und der gegenüberliegende Eierstock erhalten werden.
Höhere Erfolgsquoten bei der Behandlung mit fortgeschrittenen chirurgischen Techniken
Die sich rasch entwickelnden chirurgischen Techniken und der weit verbreitete Einsatz der laparoskopischen Chirurgie in der Welt und in der Türkei ermöglichen eine rasche Genesung und verringern die Risiken der offenen Chirurgie. All dies trägt wesentlich zur Früherkennung und wirksamen Behandlung von Krebs bei.
Die laparoskopische und die robotergestützte Chirurgie sind zunehmend wirksame Behandlungsmethoden für Gebärmutterkrebs, Gebärmutterhalskrebs und Eierstockkrebs im Frühstadium. Dank dieser Methoden werden der Krankenhausaufenthalt, die Genesung, die Rückkehr zur Arbeit und das soziale Leben der Patientin verkürzt, und die Patientin hat keine kosmetisch bedeutsamen Hautschäden.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST ENDOMETRIOSE?
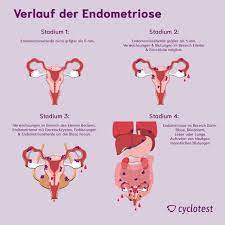
Unter Endometriose versteht man das Vorhandensein der Gebärmutterschleimhaut, die normalerweise den inneren Teil der Gebärmutter bildet, außerhalb der Gebärmutter. Diese Krankheit tritt in der Regel in den unteren Teilen des Bauches auf, die wir als Becken bezeichnen. Seltener kann sie aber auch am ganzen Körper auftreten. Die Endometriose, die schätzungsweise bei etwa 5-10 % der Frauen im gebärfähigen Alter auftritt, gehört zu den wichtigsten Ursachen für Unfruchtbarkeit.
WAS SIND DIE SYMPTOME DER ENDOMETRIOSE?
Die Symptome der Endometriose lassen sich wie folgt auflisten:
- Die wichtigsten Symptome sind Schmerzen während der Menstruation
- Ständige starke Schmerzen im Unterbauch
- Starke Schmerzen beim Geschlechtsverkehr
- Schwierigkeiten und Schmerzen beim Aufsuchen der großen Toilette, manchmal Durchfall
- Häufiges Wasserlassen und Blut im Urin
- Seitenschmerzen, Rückenschmerzen
WAS VERURSACHT ENDOMETRIOSE?
Die genaue Ursache der Endometriose ist nicht eindeutig bekannt. Es gibt zwar mehrere Theorien, aber keine dieser Theorien allein kann alle Fälle von Endometriose erklären. Sie tritt häufiger bei schlanken, großen, rothaarigen Frauen mit farbigen Augen auf. Einige der Theorien, die versuchen, die Endometriose zu erklären, lauten wie folgt:
- Wenn bei Frauen die Menstruation einsetzt, wird der oberflächliche Teil der Gebärmutterschleimhaut, d. h. die innere Schicht der Gebärmutter, ausgestoßen, während dieselbe Schicht aus den Eileitern in die Bauchhöhle überlaufen kann. Bei Frauen mit einem gesunden Immunsystem werden diese in die Bauchhöhle geschwemmten Blut- und Gebärmutterschleimhautgewebe wieder ausgeschieden, während sie bei einigen Frauen nicht ausgeschieden werden können und sich in den Eileitern, Eierstöcken, dem Darm, der Blase oder anderen Organen in der Bauchhöhle festsetzen. In diesen Bereichen kommt es zu einer Wanderung von Abwehrzellen, die als Entzündung bezeichnet wird. In den späteren Stadien der Krankheit kann es zu Blutungen, Gewebeeinheilungen und Verwachsungen im Unterleib kommen. Endometrioseherde, die sich in den Eierstöcken bilden, bluten unter dem Einfluss der Hormone während jeder Menstruation in die Eierstöcke und verursachen Läsionen, die als Endometriom bezeichnet werden. Das im Eierstock angesammelte Blut färbt sich mit der Zeit braun, und diese Zysten werden im Volksmund Schokoladenzysten genannt, weil sie an Schokolade erinnern.
- Eine andere Theorie besagt, dass die Zellen in der inneren Schicht der Gebärmutter über die Blutgefäße zu anderen Organen des Körpers gelangen. In der Literatur wird über seltene Endometrioseherde berichtet, die bei jeder Regelblutung Blutungen im Auge der Patientin oder bei jeder Regelblutung eine Blutansammlung in der Brusthöhle verursachen. Diese Herde können durch diese Theorie erklärt werden.
Es sind auch einige Bedingungen bekannt, die eine Endometriose verhindern. Dazu gehören Schwangerschaft, mehr als eine Geburt und Stillen. Bei übergewichtigen Frauen mit einem hohen Body-Mass-Index und einem hohen Verhältnis von Taille zu Hüfte tritt Endometriose seltener auf.
WIE WIRD DIE ENDOMETRIOSE DIAGNOSTIZIERT?
Die endgültige Diagnose der Endometriose wird gestellt, wenn das Endometriumgewebe, das normalerweise nur in der inneren Schicht der Gebärmutter zu finden ist, in anderen Teilen des Körpers zu finden ist, diese Gewebe chirurgisch entfernt und von Spezialisten für Pathologie mikroskopisch untersucht werden.
Eine ausführliche Anamnese und die Symptome der Patientin sind für die vorläufige Diagnose sehr wichtig. Anamnestische Befunde wie später einsetzende Menstruationsschmerzen, Schmerzen im Unterbauch, Schmerzen beim Geschlechtsverkehr, Unfähigkeit, spontan Kinder zu bekommen, Schmerzen beim großen Toilettengang, blutiger Urin oder blutiger Stuhl sind für die Erkennung der Krankheit wichtig.
In der Vagina befindliche endometriotische Knoten können, falls vorhanden, bei der Untersuchung gesehen werden. Schokoladenzysten können ertastet werden. Die Diagnose von Schokoladenzysten kann durch eine gynäkologische Ultraschalluntersuchung, die zusammen mit der Untersuchung durchgeführt wird, genauer gestellt werden. Endometriotische Knötchen am Rektum, dem letzten Teil des Dickdarms, können gesehen werden. Eine vorläufige Diagnose kann in 70 Prozent der schweren Endometriosefälle durch eine gynäkologische Untersuchung gestellt werden.
Manchmal können auch zusätzliche Untersuchungen erforderlich sein. Bei Patientinnen mit blutigem Urin können endometriotische Läsionen in der Blase oder den Harnwegen mit Hilfe einer dünnen Kamera bei einer so genannten Zystoureteroskopie gesehen werden. Bei Patientinnen mit blutigem Stuhl können endometriotische Knötchen auch durch eine Koloskopie sichtbar gemacht werden. Darüber hinaus ist die Magnetresonanztomographie (MR) eine wertvolle Methode zur Diagnose und Operationsplanung der tief infiltrierenden Endometriose.
Es sei jedoch nochmals darauf hingewiesen, dass die endgültige Diagnose der Endometriose durch die mikroskopische Untersuchung der durch die Laparoskopie entfernten Läsionen gestellt wird.
WIE WIRD DIE ENDOMETRIOSE BEHANDELT?
Die Endometriose ist ein behandelbares Problem. Die Behandlung sollte individuell auf die Beschwerden der Patientin, ihren Kinderwunsch und den Untersuchungsbefund abgestimmt werden. Es gibt eine breite Palette von Behandlungsmöglichkeiten, die von einer abwartenden Beobachtungstherapie über medikamentöse Behandlung und assistierte Reproduktionstechniken bis hin zur Operation reichen.
Während Frauen mit Endometriose, bei denen die Schmerzen im Vordergrund stehen, von einer medikamentösen Behandlung profitieren können, kann in fortgeschrittenen Fällen eine chirurgische Behandlung in Betracht gezogen werden, wenn ein Kinderwunsch besteht und assistierte Reproduktionstechniken versagen.
Wenn eine Person über einen bestimmten Zeitraum hinweg nicht schwanger werden konnte, werden in der ersten Phase assistierte Reproduktionstechniken wie Impfung und In-vitro-Fertilisation eingesetzt. Einige der Patienten, die sich assistierten Reproduktionsmethoden wie der IVF-Behandlung unterziehen, können schwanger werden. Wenn diese Behandlungen nicht ansprechen, kann eine chirurgische Entfernung der Krankheit durchgeführt werden. Bei der chirurgischen Methode werden Schokoladenzysten laparoskopisch entfernt, Verwachsungen gelöst, die Eileiter in ihre normale Anatomie zurückversetzt oder Knötchen entfernt, wenn die Endometriose tief infiltriert ist und trotz Behandlung starke Schmerzen verursacht. Schokoladenzysten sollten sorgfältiger überwacht werden, insbesondere bei Patientinnen über 40 Jahren. Denn bei Schokoladenzysten besteht das Risiko, dass sich Eierstockkrebs entwickelt. Wenn im Ultraschall oder MRT ein verdächtiges Erscheinungsbild festgestellt wird, kann die Entfernung des Eierstocks und der Eileiter in Betracht gezogen werden. Ich möchte jedoch noch einmal betonen, dass es bei diesen Patientinnen keinen Standardansatz gibt und die Behandlung individuell auf die jeweilige Patientin abgestimmt werden sollte.
HÄUFIG GESTELLTE FRAGEN ZUR ENDOMETRIOSE
Was sind die Risikofaktoren bei Endometriose?
Einige der Risikofaktoren, die für eine Endometriose-Erkrankung ermittelt wurden, sind neben den Fällen, in denen die Menstruation in einem frühen Alter einsetzt, die Menstruation häufiger als 21 Tage auftritt, nie ein Kind geboren wurde, eine große Menge an Menstruationsblutungen auftritt, groß ist, rote Haare hat, blau-grüne Augen hat und Sommersprossen hat, folgende:
- Unfruchtbarkeit
- Angeborene strukturelle Defekte der weiblichen Fortpflanzungsorgane
- Alkohol, Koffein
- Ernährung mit viel Fett und rotem Fleisch
- Niedriger Body-Mass-Index
- Endometriose bei einem Verwandten ersten Grades
- Die Endometriose, die keine Beschwerden verursacht, ist bei Schwarzen seltener, bei Asiatinnen aber häufiger als bei Weißen anzutreffen.
Verhindert die Endometriose eine Empfängnis?
Endometriose tritt bei 5-10 % aller Frauen im gebärfähigen Alter in unserem Land auf. Bei Frauen, die Probleme mit der Empfängnis haben, kann dieser Anteil jedoch bis zu 25-30 % betragen. Endometriose kann die Empfängnis aus verschiedenen Gründen verhindern. Die Endometriose kann verhindern, dass die Eizelle in die Eileiter gelangt, indem sie Verwachsungen in den Fortpflanzungsorganen bildet. Manchmal kann sie auch eine Schwangerschaft verhindern, indem sie das Ende der Eileiter blockiert, d. h. eine “Eileiterobstruktion” verursacht. Die Endometriose kann auch Schokoladenzysten, so genannte Endometriome, verursachen. Diese Zysten können sich in den Eierstöcken festsetzen und einen gesunden Eisprung verhindern sowie die Chance auf eine Schwangerschaft verringern, indem sie die Eizellreserve reduzieren. Zytokine und humorale Faktoren, die von Endometrioseherden abgesondert werden, können die Entwicklung und Einnistung des Embryos beeinträchtigen. Nach der Behandlung steigt die Schwangerschaftsrate nach zwei Jahren Wartezeit um 40 Prozent. Ist die Patientin dennoch nicht in der Lage, auf normalem Wege schwanger zu werden, kann eine In-vitro-Fertilisation versucht werden.
Was ist eine tiefe Endometriose?
Die “tief infiltrierende Endometriose”, eine besondere Form der Endometriose, die bei Frauen im gebärfähigen Alter häufig vorkommt, äußert sich manchmal durch starke Schmerzen, manchmal kann sie aber auch stillschweigend und ohne jegliche Symptome verlaufen. Patientinnen, die keine Symptome zeigen, suchen in der Regel einen Arzt auf und klagen über ihre Unfähigkeit, schwanger zu werden. Die “tief infiltrierende Endometriose”, d. h. die Ausbreitung der Endometriose tief in die Gebärmutterbänder zwischen Vagina und Rektum, Darm, Blase, Harnwege und Bauchfell, ist eine Erkrankung, die einen multidisziplinären Ansatz erfordert, der nicht nur die Gynäkologie, sondern auch die allgemeine Chirurgie, Urologie und Gastroenterologie betrifft.
Diese Gewebe, die bis zu einem fortgeschrittenen Stadium keine Symptome zeigen, können die Ausführungsgänge in der Darmregion verstopfen, wenn sie eine sehr große Größe erreichen. In diesem Fall, der “tief infiltrierenden Endometriose”, ist es wichtig, dass die Operation von erfahrenen Händen und erfahrenen Personen durchgeführt wird. Denn bei der Operation müssen der Bereich zwischen Gebärmutter und Darm und die Harnleiter, also die Harnröhren, sehr gut freigelegt werden. Bei der Operation ist es sehr wichtig, den Teil des Darms zu entfernen, der häufig betroffen ist, und die verbleibenden Teile zusammenzuführen. Um eine tiefe Endometriose zu diagnostizieren, die das soziale Leben der Patientinnen stark beeinträchtigt, und um zu verhindern, dass die Endometriose ernsthafte Verwachsungen zwischen den Geweben verursacht, ist es wichtig, dass die Diagnose und die Behandlung von erfahrenen Händen und in Zentren mit der erforderlichen Ausrüstung durchgeführt werden.
Ist Endometriose eine Krankheit mit pflanzlicher Behandlung?
Endometriose kann nicht mit pflanzlicher Behandlung gelöst werden. Produkte, die im Internet unter dem Namen “Kräuter für Endometriose” verkauft werden, können mehr schaden als nützen. Die Behandlung von Endometriose sollte mit einem Facharzt für Gynäkologie und Geburtshilfe geplant werden.
Wann wird die Endometriose am häufigsten diagnostiziert?
Die Endometriose wird im Durchschnitt im Alter von 25-35 Jahren diagnostiziert. Zwischen dem Ausbruch der Krankheit und der Diagnose liegt eine Zeitspanne von etwa 7 Jahren.
Wird Endometriose nach der Menopause beobachtet?
Die Endometriose ist eine hormonabhängige Erkrankung. Da die Hormone Östrogen und Progesteron, die von den Eierstöcken produziert werden, in den Wechseljahren wegfallen, wird erwartet, dass sich die Endometriose zurückbildet. Die Inzidenz der Endometriose in der Postmenopause beträgt weniger als 5 Prozent, und diese Frauen haben in der Regel eine Hormonersatztherapie zur Linderung der Wechseljahrsbeschwerden hinter sich.
Hängt Endometriose mit Übergewicht zusammen?
Neben den Risikofaktoren, die Endometriose verursachen, gibt es auch Faktoren, die vor dieser Krankheit schützen. Schwangerschaft, Mehrlingsgeburten und Stillen gehören zu den wichtigsten Schutzfaktoren, während Endometriose bei übergewichtigen Frauen mit hohem Body-Mass-Index und besonders hohem Taille-Hüft-Verhältnis seltener auftritt.
Sind Menstruationsschmerzen ein Zeichen für Endometriose?
Ja, starke Menstruationsschmerzen können ein Zeichen für Endometriose sein. Allerdings beginnen die Menstruationsschmerzen nicht mit der ersten Regelblutung, sondern in jeder späteren Periode. Menstruationsschmerzen ab der ersten Regelblutung werden als primäre Dysmenorrhoe bezeichnet, und die Ursachen sind in der Regel unterschiedlich. Leider nehmen viele Frauen Menstruationsschmerzen als selbstverständlich hin und haben das Gefühl, dass sie mit diesen Schmerzen leben müssen. Die meisten Frauen denken, dass diese Schmerzen normal sind, und gehen nicht zum Arzt. Dieses Problem beeinträchtigt jedoch die Lebensqualität der Frauen und kann sich in späteren Stadien negativ auf die Fortpflanzung auswirken.
Was ist eine Schokoladenzyste?
Eine Schokoladenzyste ist eine Zystenart in den Eierstöcken, Eileitern und der Gebärmutter von Frauen, die bei jeder Menstruationsblutung durch Einblutung in sich selbst wächst. Der Grund, warum Schokoladenzysten diesen Namen erhalten, ist, dass das darin angesammelte Menstruationsblut etwas flüssiger wird und sich nach einer Weile braun verfärbt, genau wie Schokolade. Die eigentliche Bezeichnung für diese Zysten lautet Endometriom. Die Diagnose wird meist per Ultraschall gestellt. In der Regel wird auch der Ca125-Spiegel im Blut untersucht, der jedoch bei der Unterscheidung von Eierstocktumoren nicht sehr hilfreich ist.
Die Behandlung von Schokoladenzysten ist von Fall zu Fall unterschiedlich. Bei jungen, kinderlosen Frauen kann das Wachstum von Schokoladenzysten mit der Antibabypille unterdrückt werden. Bei Frauen mit Kinderwunsch können, wenn sie nicht spontan schwanger werden können, assistierte Reproduktionstechniken wie Impfung und In-vitro-Fertilisation erforderlich sein. Bei Frauen, die trotz dieser Behandlungen nicht schwanger werden können, kann ein chirurgischer Eingriff erforderlich sein, wenn die Zysten groß sind und daher ein erhöhtes Risiko einer Torsion oder Ruptur besteht. Die Goldstandardbehandlung für diese Patientinnen ist die vollständige Entfernung der Zystenwand mit einem laparoskopischen Eingriff. Kann die Zyste nicht vollständig entfernt werden, erhöht sich die Wahrscheinlichkeit eines Rückfalls. Da das Risiko einer Krebsentstehung auf der Grundlage eines Endometrioms vor allem ab einem Alter von 40 Jahren ansteigt, sind gegebenenfalls genauere Untersuchungen und bildgebende Verfahren wie eine MRT erforderlich. Bei Vorliegen einer verdächtigen Läsion kann es erforderlich sein, Eierstock und Eileiter zu entfernen.
Gibt es einen Zusammenhang zwischen Endometriose und Unfruchtbarkeit?
Einer der Gründe für Frauen, die nicht schwanger werden können, kann Endometriose sein. Bei einigen dieser Frauen führt das durch die Endometriose verursachte Narbengewebe zu einer Verstopfung der Eileiter der Frau. Die Gründe, warum Endometriose die Fruchtbarkeit der meisten Frauen beeinträchtigt, sind jedoch noch nicht eindeutig bekannt.
Die Endometriose kann kurzzeitig Folgendes verursachen:
- Sie reduziert die Anzahl der Eizellen in den Eierstöcken, die wir als Eierstockreserve bezeichnen.
- Es beeinträchtigt die Funktion des Eisprungs.
- Es kann zu einer Verstopfung der Eileiter führen und die Vereinigung von Spermien und Eizellen verhindern.
- Sie produziert natürliche Giftstoffe, die Spermien abtöten.
- Sie verhindert, dass sich der Embryo in der Gebärmutter festsetzt.
- Es hat eine nachteilige Wirkung auf die Entwicklung des Embryos.
Können Patientinnen mit Endometriose durch IVF schwanger werden?
Mit einer IVF-Behandlung kann bei Frauen mit Endometriose im Verhältnis zu ihrem Alter eine Schwangerschaft in einem einzigen Versuch bis zu 60 % erreicht werden. Natürlich ist es notwendig, die IVF-Behandlung bei Frauen zu wiederholen, die im ersten Versuch nicht schwanger werden können. Mit wiederholten Versuchen kann die Chance auf eine Schwangerschaft in hohem Maße erreicht werden.
Hat das Immunsystem einen Einfluss auf die Endometriose?
Die genaue Ursache der Endometriose ist noch unbekannt. Die am weitesten akzeptierte Theorie besagt, dass das Gewebe in der Gebärmutter während der Menstruationsblutung durch die Eileiter der Frau wandert und sich in der Bauchhöhle ansiedelt, wo es sich weiter entwickelt. Es wird angenommen, dass auch das Immunsystem von der Norm abweicht, um dies zu ermöglichen.
Findet sich Endometriose im Enddarm?
Endometriose ist ein sehr häufiges Gesundheitsproblem. Dieses Gewebe kann sowohl in den Organen innerhalb des Unterleibs (Eierstock, Gebärmutterkanal, Bauchfell, Darm, Enddarm, Harnblase) als auch außerhalb des Unterleibs (Scheide, Nabel, Auge, Brustfell) vorkommen. Je nach Schwere der Symptome und der Geschwindigkeit, mit der die endometriotischen Knoten den inneren Kanal des Rektums erreichen, kann es notwendig sein, das Rektum zu entfernen, das bei einigen Patientinnen der letzte Teil des Dickdarms ist, in dem sich der Knoten befindet, und die verbleibenden Teile wieder zu verbinden, und bei einigen Patientinnen kann es notwendig sein, den Knoten mit einer Schere aus dem Rektum zu schaben.
Was ist bei der Operation von Schokoladenzysten und Endometriose wichtig?
Bei diesen Operationen achten Gynäkologen und Geburtshelfer auf die folgenden Punkte:
- Die Ovarialreserve darf nicht beschädigt werden: Bei diesen Operationen sollte das Eierstockgewebe außerhalb der Zystenwand nicht beschädigt werden. Denn wenn das Eierstockgewebe beschädigt wird, können die dort befindlichen Eizellen geschädigt werden, und die Patientin kann in Zukunft mit frühen Wechseljahren und Unfruchtbarkeitsproblemen zu kämpfen haben. Das Wichtigste bei der Operation von Schokoladenzysten ist es, die Eierstöcke, die Eileiter und das Gebärmuttergewebe nicht zu beschädigen.
- Öffnung von Verwachsungen: Die Schokoladenzyste kann im Vergleich zu anderen Ovarialzysten dichte Verwachsungen verursachen. Das Öffnen und Korrigieren dieser Verwachsungen während der Operation kann die Schmerzbeschwerden verringern und die Erfolgsquote bei der Schwangerschaftsbehandlung erhöhen.
- Entfernung von tief sitzenden Endometrioseknötchen: Endometriose und Schokoladenzysten können auch mit starken Leisten- und Unterleibsschmerzen verbunden sein. Die präoperative Erkennung von Endometrioseknötchen, insbesondere von tief infiltrierender Endometriose, die starke Schmerzen verursachen, ist von großer Bedeutung. Bei Vorhandensein dieser Knötchen führt die Entfernung der Schokoladenzyste allein nicht zu einer vollständigen Schmerzlinderung. Tief infiltrierende Endometrioseknötchen müssen zusammen mit der Ovarialzyste entfernt werden. Diese Region ist für die Operation sehr wichtig. Denn sie befindet sich in unmittelbarer Nähe des Rektums, dem Teil des Dickdarms hinter der Gebärmutter und den Eierstöcken, und der röhrenförmigen Strukturen, die Harnleiter genannt werden und den Urin von den beiden Nieren zur Blase leiten. Der Schutz dieses Gewebes während der Operation ist von großer Bedeutung. Aus diesem Grund werden diese Operationen von erfahrenen Ärzten durchgeführt.
Ab wie vielen Zentimetern muss eine Schokoladenzyste operiert werden?
Für die Operation von Schokoladenzysten gibt es keine bestimmte Größengrenze. Das Alter der Patientin, die Unfruchtbarkeit, das Risiko einer Ruptur und einer Torsion sollten mit der Patientin besprochen werden, und es sollte gemeinsam eine Entscheidung getroffen werden. Unter Ruptur versteht man den Bruch der Endometriomteile des Eierstocks und das Austreten des Endometriominhalts in die Bauchhöhle. Eine Torsion hingegen ist die Drehung des Eierstocks und des Eileiters einschließlich des Endometrioms um sich selbst, die Unterbrechung des Blutflusses und die Gangrän. In diesem Fall werden der Eierstock und die Eileiter wieder gedreht und wiederhergestellt. Leider kann der Eierstock bei einigen Patientinnen nicht gerettet werden.
Verschwindet eine Schokoladenzyste von selbst?
Schokoladenzysten verschwinden nicht von selbst. Die Behandlung ist chirurgisch. Einige Medikamente verhindern zwar das Wachstum von Zysten, können sie aber nicht beseitigen. Wenn die Zyste platzt, kann ihr Inhalt in die Bauchhöhle austreten, aber das Risiko eines erneuten Auftretens ist ziemlich hoch, da die Wand der Zyste nicht entfernt wird.
Wie entsteht der Schmerz bei Schokoladenzysten?
Menschen mit Schokoladenzysten geben an, dass sie Menstruationsschmerzen haben. Sie geben auch an, dass die Schmerzen kurz vor der Menstruation beginnen und während der gesamten Menstruation anhalten. Die Patientinnen geben an, dass sie vor allem in der Leiste, den Beinen und der Taille Schmerzen haben. Die Schokoladenzyste kann auch Schmerzen beim Geschlechtsverkehr verursachen. Manchmal können auch Schmerzen im Darm und in der Blase beobachtet werden.
Woran erkennt man eine geplatzte Schokoladenzyste?
Patientinnen mit rupturierten Endometriomen berichten über einen stechenden Schmerz in der Leiste, der sich dann auf den gesamten Bauchraum ausbreitet. Eine rupturierte Schokoladenzyste kann durch Ultraschall nachgewiesen werden. Manchmal treten neben den Schmerzen auch Übelkeit, Erbrechen und Schwäche auf.
Wie hoch ist der CA 125-Wert bei Schokoladenzysten?
Der Ca125-Wert ist eigentlich ein Bluttest, mit dem wir bei Patientinnen mit einer Masse in den Eierstöcken unterscheiden können, ob die Masse bösartig oder krebsartig ist. Der Ca125-Wert kann in vielen anderen Fällen als Krebs erhöht sein. Einer dieser Fälle sind Schokoladenzysten. Vor allem bei rupturierten, d. h. geplatzten Schokoladenzysten können die Ca125-Werte sehr hohe Werte erreichen, und zusammen mit dem Inhalt der Schokoladenzyste, der sich in den Bauchraum ergießt, kann dies fortgeschrittenen Eierstockkrebs imitieren.
Verursacht eine Schokoladenzyste Ausfluss?
Da Schokoladenzysten in den Eierstöcken im Unterleib entstehen und nicht direkt mit der Scheide verbunden sind, verursachen sie keinen Ausfluss.
Bekommen alleinstehende Menschen Schokoladenzysten?
Schokoladenzysten können bei alleinstehenden Frauen auftreten.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST GEBÄRMUTTERKREBS?
Gebärmutterkrebs ist eine der häufigsten Krebsarten bei Frauen. Die Gebärmutter besteht aus Zellen, die Endometrium genannt werden, die sich regelmäßig verdicken und bei der Menstruation abgestoßen werden. Diese Zellen verändern sich manchmal und können sich abnormal teilen und vermehren. Dies wird als Gebärmutterkrebs oder Endometriumkrebs bezeichnet.
WIE ENTSTEHT GEBÄRMUTTERKREBS (ENDOMETRIUMKARZINOM)? WAS SIND DIE RISIKOFAKTOREN?
Was verursacht Gebärmutterkrebs? Die genaue Antwort auf diese Frage ist nicht bekannt. Allerdings können Veränderungen im Östrogen- und Progesteronspiegel im Körper Gebärmutterkrebs verursachen. Die Gebärmutterschleimhaut kann durch Veränderungen des Östrogen- und Progesteronspiegels beeinträchtigt werden. Diese Wechselwirkung kann eine Prädisposition für Gebärmutterkrebs darstellen. Obwohl die Ursachen von Gebärmutterkrebs nicht genau bekannt sind, sind die Risikofaktoren bekannt.
Die Risikofaktoren, die Gebärmutterkrebs verursachen, sind folgende:
- Alter: Das Risiko, an Gebärmutterkrebs zu erkranken, steigt mit dem Alter. Gebärmutterkrebs kann aber auch schon in jungen Jahren auftreten.
- Der Beginn der Menstruation in jungen Jahren kann Gebärmutterkrebs verursachen. Die jahrelange Exposition gegenüber dem Hormon Östrogen erhöht das Risiko von Gebärmutterkrebs.
- Späte Menopause Gebärmutterkrebs tritt in der Regel nach der Menopause auf. Die späte Menopause kann das Risiko für Gebärmutterkrebs erhöhen, da sie eine stärkere Exposition gegenüber dem Hormon Östrogen verursacht.
- Fettleibigkeit ist einer der Faktoren, die das Risiko für Gebärmutterkrebs erhöhen. Da übermäßiges Fettgewebe Östrogen produziert, ist das Risiko für Gebärmutterkrebs bei fettleibigen Frauen höher.
- Diabetes kann das Risiko für Gebärmutterkrebs erhöhen. Das Risiko für Gebärmutterkrebs ist bei Frauen mit Typ-2-Diabetes fast 2-mal höher als bei Frauen ohne Diabetes.
- Keine Schwangerschaft zu haben. Während der Schwangerschaft verschiebt sich der Hormonhaushalt in Richtung Progesteron. Nie schwanger zu werden, kann Gebärmutterkrebs verursachen.
- Polyzystisches Ovarsyndrom. Beim polyzystischen Ovarialsyndrom ist der Östrogenspiegel hoch und der Progesteronspiegel niedrig. Dies erhöht das Risiko für Gebärmutterkrebs.
- Einige hormonunterdrückende Medikamente, die bei der Behandlung von Brustkrebs eingesetzt werden, können auch Gebärmutterkrebs verursachen.
- Personen, bei denen Darmkrebs in der Familie vorkommt, gehören zu der Gruppe mit dem höchsten Risiko für Gebärmutterkrebs.
- Eine Strahlentherapie bei anderen Krebsarten kann Gebärmutterkrebs begünstigen.
- Eine Hormonersatztherapie nach der Menopause kann eine Ursache für Gebärmutterkrebs sein.
WER KANN GEBÄRMUTTERKREBS BEKOMMEN?
Gebärmutterkrebs ist in der Regel eine Krebserkrankung in den Wechseljahren. Er tritt häufiger im Alter von über 55 Jahren auf. Er kann aber auch schon in jungen Jahren auftreten.
WAS SIND DIE SYMPTOME VON GEBÄRMUTTERKREBS (ENDOMETRIUMKARZINOM)?
Die ersten Symptome von Gebärmutterkrebs sind vaginale Blutungen. Vaginale Blutungen, insbesondere in den Wechseljahren, sollten bis zum Beweis des Gegenteils als Gebärmutterkrebs angesehen werden. Bei menstruierenden Frauen können unregelmäßige Zwischenblutungen und übermäßige Blutungen die ersten Anzeichen für Gebärmutterkrebs sein.
Abgesehen von vaginalen Blutungen und Ausfluss können bei fortschreitendem Gebärmutterkrebs auch andere Symptome auftreten.
- Schmerzen im Beckenbereich
- Schmerzen im Unterleib
- Blähungen
- Häufiges Wasserlassen
- Schmerzen beim Wasserlassen
- Blutungen in der postmenopausalen Phase
Diese Beschwerden können auch aufgrund anderer Probleme auftreten. Es ist jedoch wichtig, dass diejenigen, die eines oder mehrere der Symptome von Gebärmutterkrebs verspüren, einen Arzt für Gynäkologie und Geburtshilfe aufsuchen, um eine frühzeitige Diagnose zu stellen.
WELCHE STADIEN GIBT ES BEI GEBÄRMUTTERKREBS?
Um die Behandlung von Gebärmutterkrebs richtig zu planen, ist es wichtig, das Stadium der Krebserkrankung zu kennen. Das Stadium des Gebärmutterkrebses wird durch die Ausdehnung des Tumorbereichs, die Ausbreitung des Gebärmutterkrebses auf die Lymphknoten und die Frage, ob der Gebärmutterkrebs Metastasen gebildet hat, bestimmt. Gebärmutterkrebs wird im Allgemeinen in 4 Stadien behandelt.
- Gebärmutterkrebs im Stadium 1: Der Krebs befindet sich nur in der Gebärmutter. Es gibt keine Ausbreitung auf umliegende Gewebe oder entfernte Teile des Körpers. Stadium 1 kann in zwei verschiedene Kategorien eingeteilt werden, je nachdem, wie weit sich die Krebszellen auf das Muskelgewebe der Gebärmutter (Myometrium) ausgebreitet haben.
- Gebärmutterkrebs im Stadium 2: Der Krebs befindet sich in der Gebärmutter und im Gebärmutterhals. Mit anderen Worten: Der Krebs hat sich vom Gebärmutterkörper aus ausgebreitet und ist auf das stützende Bindegewebe des Gebärmutterhalses übergegangen. Es gibt keine Metastasen in den Lymphknoten und entfernten Teilen des Körpers.
- Gebärmutterkrebs im Stadium 3: Der Krebs hat sich außerhalb der Gebärmutter ausgebreitet. Die Ausbreitung hat jedoch nicht das Rektum oder die Harnblase erreicht. Stadium 3 nach der Ausbreitung auf die Eileiter, Eierstöcke, Lymphe in der Nähe der Gebärmutter. Gebärmutterkrebs kann in Unterkategorien unterteilt werden.
- Gebärmutterkrebs im Stadium 4: Dies ist das letzte Stadium von Gebärmutterkrebs. Der Krebs hat sich auf das Rektum, die Blase oder weiter entfernte Organe im Körper ausgebreitet. Es wird in 2 Unterkategorien unterteilt. Gebärmutterkrebs Stadium 4A: Der Krebs hat sich auf die Schleimhaut des Enddarms oder der Blase ausgebreitet. Gebärmutterkrebs Stadium 4B: Der Krebs hat sich auf die Lymphe in der Leistengegend, die Knochen oder entfernte Organe wie die Lunge ausgebreitet.
Bei der Bestimmung der Stadien von Gebärmutterkrebs ist auch das Aussehen der Krebszellen unter dem Mikroskop wichtig. Wenn die Krebszellen wie gesundes Gewebe aussehen und verschiedene Zellgruppen aufweisen, spricht man von einem “differenzierten” oder “niedriggradigen Tumor”. Sieht das Krebsgewebe ganz anders aus als gesundes Gewebe, spricht man von einem “schlecht differenzierten” oder “hochgradigen Tumor”. Der Grad des Tumors kann Aufschluss darüber geben, wie schnell sich der Gebärmutterkrebs ausbreiten wird.
WIE WIRD GEBÄRMUTTERKREBS (ENDOMETRIUMKARZINOM) DIAGNOSTIZIERT?
Die Frage “Wie kann man Gebärmutterkrebs verstehen?” ist eine der kuriosesten Fragen. Frauen, bei denen eines oder mehrere der Symptome von Gebärmutterkrebs auftreten, sollten sich ohne Zeitverlust an den Arzt für Gynäkologie und Geburtshilfe wenden. Nach der Unterleibsuntersuchung können einige Tests erforderlich sein, um die Diagnose zu klären.
- Vaginal-Ultraschall Die Ultraschalluntersuchung dient der Darstellung von Tumoren und der Struktur der Gebärmutter. Mit der Ultraschallsonde, die am Eingang der Gebärmutter platziert wird, können die Dicke der Gebärmutterwand oder andere Anomalien festgestellt werden.
- Hysteroskopie Ein bildgebendes Verfahren namens Hysteroskopie kann zur Diagnose von Gebärmutterkrebs eingesetzt werden. Ein dünner flexibler Schlauch mit einer Glasfaserkamera wird in die Gebärmutter eingeführt. Auf diese Weise können das Innere der Gebärmutter und die Gebärmutterschleimhaut untersucht werden.
- Pathologische Beurteilung. Um eine endgültige Diagnose von Gebärmutterkrebs zu stellen, muss eine durch Kürettage entnommene Gewebeprobe aus der Gebärmutter pathologisch beurteilt werden. Die Biopsie kann unter Hysteroskopie und Anästhesie durchgeführt werden.
- Computertomographie (CT) und Magnetresonanztomographie (MR): Mit Hilfe von CT- oder MR-Bildgebungsverfahren kann die Größe der Anomalie oder des Tumors in der Gebärmutter bestimmt werden. Bei der CT- oder MRT-Bildgebung kann Kontrastmittel verwendet werden, um klarere Bilder zu erhalten. Wenn der Behandlungsplan eine Hormonbehandlung vorsieht, kann die MRT nützlich sein, um detaillierte Bilder zu erhalten. Mit MRT-Bildern lässt sich auch feststellen, wie weit der Krebs in die Gebärmutterwand eingewachsen ist und ob die Fruchtbarkeit erhalten werden kann.
WIE WIRD GEBÄRMUTTERKREBS (ENDOMETRIUMKREBS) BEHANDELT?
Bei der Behandlung von Gebärmutterkrebs werden viele Faktoren wie die Art des Krebses, das Stadium, mögliche Nebenwirkungen der Behandlung, der allgemeine Gesundheitszustand der Patientin, das Alter und die Auswirkungen der Behandlung auf die Fruchtbarkeit berücksichtigt.
Obwohl chirurgische Methoden bei der Behandlung von Gebärmutterkrebs im Vordergrund stehen, können auch Chemotherapie, Strahlentherapie, Hormontherapie, gezielte Therapie und Immuntherapie eingesetzt werden. Bei der Behandlung von Gebärmutterkrebs können manchmal nur eine oder mehrere dieser Methoden in Kombination angewendet werden.
- Operation von Gebärmutterkrebs
Die häufigste Methode zur Behandlung von Gebärmutterkrebs ist die Operation. Neben der Hysterektomie ist die pathologische Untersuchung der Gebärmutter während der Operation, das sogenannte Einfrieren, die wichtigste Behandlungsmethode. Je nach den Ergebnissen der Einfrierungsuntersuchung kann es auch erforderlich sein, die Lymphe um das Gefäß herum zu entfernen.
- Chemotherapeutische Behandlung von Gebärmutterkrebs
Bei der Behandlung von Gebärmutterkrebs kann eine Chemotherapie vor oder nach der Operation durchgeführt werden. Eine Chemotherapie kann nach der Operation gegen das Risiko eines Wiederauftretens von Gebärmutterkrebs verabreicht werden, und eine präoperative Chemotherapie kann vor der Operation verabreicht werden, um den Tumor zu schrumpfen und ihn vollständig zu entfernen. Sie kann auch allein oder in Kombination mit einer Strahlentherapie eingesetzt werden.
- Strahlentherapie zur Behandlung von Gebärmutterkrebs
Eine Strahlentherapie wird in der Regel nach der Operation durchgeführt, um verbleibende Krebszellen zu zerstören. In einigen Fällen kann die Strahlentherapie auch vor der Operation durchgeführt werden, um den gesamten Tumor zu entfernen. Die Strahlentherapie kann bei Patienten bevorzugt werden, deren allgemeiner Gesundheitszustand für eine Operation nicht geeignet ist.
- Hormontherapie bei Gebärmutterkrebs
Mit Hormonpräparaten und Hormonblockern kann der Hormonspiegel verändert werden. Eine Hormontherapie kann das Wachstum von Gebärmutterkrebszellen verlangsamen. Eine Hormontherapie kann bei einem Wiederauftreten von Gebärmutterkrebs und bei metastasierendem Gebärmutterkrebs eingesetzt werden. Die Hormontherapie wird häufig mit einer Chemotherapie kombiniert.
WAS IST BEI DER PRÄVENTION VON GEBÄRMUTTERKREBS ZU BEACHTEN?
Wie bei Brustkrebs und Gebärmutterhalskrebs gibt es keine Screening-Methode. Die wirksamste Präventionsmethode bei Gebärmutterkrebs (Endometriumkrebs) ist die Früherkennung. Deshalb
Jede Frau sollte sich regelmäßig einer gynäkologischen Untersuchung unterziehen.
Die Antibabypille kann eingenommen werden. Die Einnahme oraler Verhütungsmittel für ein Jahr kann das Risiko von Gebärmutterkrebs verringern. Es darf jedoch nicht vergessen werden, dass diese oralen Verhütungsmittel Nebenwirkungen haben. Eine Entscheidung sollte erst nach einem Gespräch mit dem Arzt über die Risiken und Vorteile getroffen werden.
Die Gewichtskontrolle sollte gewährleistet sein. Fettleibigkeit kann das Risiko für Gebärmutterkrebs erhöhen.
Verschiedene Faktoren tragen zu unterschiedlichen Krebsarten bei. Obwohl es keine nachgewiesene Möglichkeit gibt, Gebärmutterkrebs vollständig zu verhindern, können Sie Ihr Risiko verringern. Sprechen Sie mit Ihrem Ärzteteam, um mehr über Ihr persönliches Krebsrisiko zu erfahren.
Ein Gestagen freisetzendes Intrauterinpessar (IUP), eine Form der Empfängnisverhütung, kann verwendet werden.
HÄUFIG GESTELLTE FRAGEN ZU GEBÄRMUTTERKREBS
Unter den Kommentaren von Gebärmutterkrebs-Patienten finden sich häufig neugierige Fragen. Häufig gestellte Fragen über Gebärmutterkrebs können wie folgt aufgelistet werden:
Wie wird eine Gebärmutterkrebsoperation durchgeführt?
Die Operation von Gebärmutterkrebs kann je nach Patientin und Ausbreitung des Krebses variieren. Die Gebärmutterkrebs-Operation wird in der Regel durch die sogenannte Hysterektomie durchgeführt. Die Hysterektomie, im Volksmund auch als Gebärmutterentfernung bekannt, kann offen, laparoskopisch (geschlossen) oder robotergestützt durchgeführt werden.
Nach der Diagnose von Gebärmutterkrebs wird die chirurgische Planung je nach Stadium des Krebses und der körperlichen Leistungsfähigkeit der Patientin vorgenommen. Im Allgemeinen wird in den ersten drei Stadien von Gebärmutterkrebs eine Operation durchgeführt, während im letzten Stadium keine chirurgische Methode bevorzugt wird.
Bei der Operation von Gebärmutterkrebs können mehrere Operationen kombiniert werden. Je nach Stadium des Gebärmutterkrebses kann der Chirurg eine einfache Hysterektomie (Entfernung der Gebärmutter und des Gebärmutterhalses) oder eine radikale Hysterektomie (Entfernung der Gebärmutter, des Gebärmutterhalses, des oberen Teils der Vagina und des umliegenden Gewebes) durchführen. Je nach Alter und Menopausenstatus der Patientinnen werden bei einer Oophorektomie die Eierstöcke entfernt. Wenn der Gebärmutterkrebs auf das Lymphgewebe übergegriffen hat, kann auch dieses Gewebe während der Operation entfernt werden.
Wie hoch ist die Erfolgsquote bei der Behandlung von Gebärmutterkrebs?
Gebärmutterschleimhautkrebs ist eine Krankheit, die bei frühzeitiger Diagnose vollständig geheilt werden kann. Wenn sie im Frühstadium erkannt wird, haben die Patientinnen eine 5-Jahres-Überlebenschance von 95 Prozent.
Wie wird das Gebärmutterkrebs-Screening durchgeführt?
Es gibt keinen Screening-Test zur Erkennung von Endometriumkrebs.
Gibt es einen Bluttest für Gebärmutterkrebs?
Es gibt keinen bekannten Bluttest für die Diagnose von Gebärmutterkrebs
Ist Gebärmutterkrebs tödlich? Ist Gebärmutterkrebs tödlich? Überlebenszeiten bei Gebärmutterkrebs
Krebs ist eine tödliche Krankheit. Das wichtigste Konzept, das die Lebenserwartung bestimmt, ist das Stadium der Krankheit.
Gibt es einen Impfstoff gegen Gebärmutterkrebs?
Es gibt keinen Impfstoff gegen Gebärmutterkrebs.
Ist Gebärmutterkrebs ansteckend?
Gebärmutterkrebs ist nicht ansteckend.
Verursacht Gebärmutterkrebs Schmerzen?
Gebärmutterkrebs kann ohne Schmerzen fortschreiten, aber einige Patientinnen können Schmerzen haben.
Kann ein Mann Gebärmutterkrebs bekommen?
Gebärmutterkrebs wird nicht auf den Mann übertragen.
Verursacht Gebärmutterkrebs Beinschmerzen?
Wenn sich der Tumor auf das Nervengebiet ausgebreitet hat, kann er Beinschmerzen verursachen.
Wie viele Stunden dauert eine Gebärmutterkrebsoperation?
Die Dauer der Operation hängt vom Ausmaß der Erkrankung, d. h. vom Stadium und vom Können des Chirurgen ab.
Wie wird die Gebärmutterkrebsuntersuchung durchgeführt?
Nachdem die Diagnose durch eine Biopsie gestellt wurde, kann eine MRT durchgeführt werden, um das Ausmaß des Tumors zu untersuchen.
Kann Gebärmutterkrebs zurückkehren?
Gebärmutterkrebs kann wiederkehren.
Was ist nach einer Gebärmutterkrebsoperation zu beachten?
Einer der wichtigsten Punkte, die nach einer Gebärmutterkrebsoperation beachtet werden müssen, ist, die Routinekontrollen nicht zu unterbrechen. Darüber hinaus sollte auf eine gesunde Ernährung geachtet werden.
Wo metastasiert Gebärmutterkrebs?
Gebärmutterkrebs breitet sich vor allem auf das umliegende Gewebe aus. Er breitet sich auf die Lymphknoten und das umliegende Gewebe in der Beckenregion aus.
Kann eine Person mit Gebärmutterkrebs Geschlechtsverkehr haben?
Für Gebärmutterkrebspatientinnen ist es kein Hindernis, Geschlechtsverkehr zu haben.
Ist Gebärmutterkrebs genetisch bedingt?
Gebärmutterkrebs kann genetische Merkmale haben. Besonders diejenigen, bei denen in der Vergangenheit bei Verwandten ersten Grades Krebs aufgetreten ist, gehören zur Risikogruppe.
Können Jungfrauen Gebärmutterkrebs bekommen?
Er kann auftreten, wenn es Risikofaktoren oder eine familiäre Vorbelastung gibt. Unter 40 Jahren ist Gebärmutterkrebs jedoch selten.
Gibt es eine pflanzliche Behandlung für Gebärmutterkrebs?
Es gibt keine bekannte pflanzliche Behandlung für Gebärmutterkrebs.
Worauf sollten Menschen, die an Gebärmutterkrebs operiert wurden, achten?
Nach einer Gebärmutterkrebsoperation ist es wichtig, dass die Patientinnen auf ihre Lebensweise und Ernährung achten.
Kann Gebärmutterkrebs im Ultraschall erkannt werden?
Die Ultraschalluntersuchung kann Verdachtsmomente für Gebärmutterkrebs liefern. Zur endgültigen Diagnose sollte jedoch eine Biopsie durchgeführt werden.
Kann Gebärmutterkrebs in Bluttests nachgewiesen werden?
Es gibt keinen bekannten Bluttest für Gebärmutterkrebs.
In welchem Alter kann Gebärmutterkrebs auftreten?
Gebärmutterkrebs tritt häufiger in der Zeit nach den Wechseljahren auf.
Verursacht Gebärmutterkrebs Schmerzen im unteren Rückenbereich?
Obwohl selten, kann Gebärmutterkrebs Schmerzen im unteren Rückenbereich verursachen.
Verursacht die Spirale Gebärmutterkrebs?
Die Spirale verursacht keinen Gebärmutterkrebs. Vor allem Hormonspiralen können schützend wirken.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST GEBÄRMUTTERHALSKREBS?
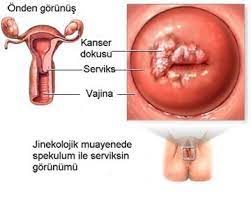
Gebärmutterhalskrebs ist die häufigste gynäkologische Krebsart in Entwicklungsländern und unterentwickelten Ländern. Jedes Jahr werden weltweit 500 Tausend neue Fälle von Gebärmutterhalskrebs diagnostiziert. Gebärmutterhalskrebs, der in der Regel um das 50. Lebensjahr auftritt, ist in den letzten Jahren auch bei jungen Frauen zu beobachten.
Das HPV-Virus (“Humane Papillomviren”), das für fast alle Gebärmutterhalskrebsarten verantwortlich ist, zeigt kaum Symptome und ist hoch ansteckend. Die meisten Frauen besiegen das HPV-Virus, dem sie irgendwann in ihrem Leben begegnet sind, mit Hilfe ihres körpereigenen Abwehrsystems. Einige HPV-Viren sind stärker als dieses Abwehrsystem und können Gebärmutterhalskrebs verursachen. Vorsichtsmaßnahmen zum Schutz vor dem krankheitsverursachenden HPV-Virus und regelmäßige Vorsorgeuntersuchungen tragen dazu bei, die Krankheit vor ihrem Auftreten oder im Frühstadium zu erkennen, und helfen bei der erfolgreichen Behandlung.
WAS IST DER GEBÄRMUTTERHALS?
Der Gebärmutterhals, der untere Teil der Gebärmutter, verbindet die Gebärmutter mit der Scheide. Der Gebärmutterhals, auch Zervix genannt, spielt eine wichtige Rolle für den Flüssigkeitsaustausch zwischen Gebärmutter und Vagina. Außerdem ermöglicht er es dem Baby, die Scheide zu passieren und die Gebärmutter während der Wehen zu verlassen.
WAS SIND DIE URSACHEN VON GEBÄRMUTTERHALSKREBS?
Wie bei vielen Krebsarten ist auch bei Gebärmutterhalskrebs die genaue Ursache unbekannt. Nur einige Faktoren können die Entstehung von Gebärmutterhalskrebs begünstigen und den Krankheitsprozess beschleunigen. Im Allgemeinen sind die Risikofaktoren für Gebärmutterhalskrebs wie folgt;
- Polygamie
- Geschlechtsverkehr vor dem Alter von 20 Jahren
- Rauchen
- Schwaches Immunsystem.
- Häufige virale und bakterielle Infektionen der Genitalorgane
- Geburten in großer Zahl
- Niedriger sozioökonomischer Status
- Vitamin-C- und Vitamin-A-Mangel
WELCHE ARTEN VON GEBÄRMUTTERHALSKREBS GIBT ES?
Adenokarzinom
Es gibt verschiedene Arten von Gebärmutterhalskrebs. Es gibt viele Arten von Gebärmutterhalskrebs, darunter invasive Krebsarten wie das Adenokarzinom und das Plattenepithelkarzinom. Unter den Gebärmutterhalskrebsen ist das Adenokarzinom, das schwieriger zu erkennen und seltener ist, eine relativ aggressive Krebsart. Adenokarzinome bilden sich in der Regel im inneren Kanal des Gebärmutterhalses und nicht an der äußeren Oberfläche des Gebärmutterhalses. Bei Abstrichtests werden Zellproben von der äußeren Oberfläche verwendet. Wenn ein Adenokarzinom diagnostiziert wird, befindet sich der Krebs daher meist schon in einem fortgeschrittenen Stadium. Bei den krebserregenden HPV-Typen 16, 18, 45 und 31 treten mehr Adenokarzinome auf.
WAS SIND DIE SYMPTOME VON GEBÄRMUTTERHALSKREBS?
Die Symptome von Gebärmutterhalskrebs können sich in einem frühen Stadium nicht manifestieren. Selbst bei einer gynäkologischen Untersuchung wird das Problem am Gebärmutterhals möglicherweise nicht erkannt. Nachdem die Hochrisiko-HPV-Screening-Tests, bei denen es sich um Früherkennungstests für Gebärmutterhalskrebs handelt, positiv ausgefallen sind oder Anomalien im Vaginalabstrich, dem sogenannten Abstrich, festgestellt wurden, können Veränderungen mit den Instrumenten, die den Gebärmutterhals vergrößern, dem sogenannten “Kolposkop”, festgestellt werden, und die endgültige Diagnose kann durch eine Biopsie aus dem verdächtigen Bereich gestellt werden.
Die Symptome von Gebärmutterhalskrebs treten meist im fortgeschrittenen Stadium der Krankheit auf. Zu den Symptomen von Gebärmutterhalskrebs gehören blutiger Ausfluss, Blutungen nach dem Geschlechtsverkehr und unregelmäßige Menstruation. In fortgeschrittenen Fällen kann der Tumor sogar bei einer Untersuchung entdeckt werden. Mit dem Fortschreiten des Gebärmutterhalskrebses kann es zu Problemen beim Wasserlassen, Schwierigkeiten beim Stuhlgang und Schmerzen in den Beinen kommen.
Eines der Symptome von Gebärmutterhalskrebs, Blutungen, die unerwartet unmittelbar nach dem Geschlechtsverkehr oder am nächsten Tag auftreten, werden “postkoitale Blutungen” genannt. Postkoitale Blutungen sind ein wichtiger Befund und können ein frühes Anzeichen für Gebärmutterhalskrebs sein.
Genitalwarzen, die durch HPV verursacht werden, gelten nicht als Anzeichen für Gebärmutterhalskrebs. Denn während einige HPV-Typen Genitalwarzen verursachen, verursachen andere Typen Veränderungen in den Zellen des Gebärmutterhalses bei Frauen. Dennoch sollten eine eingehende Untersuchung und eine HPV-Typisierung durchgeführt werden, da bei der Entdeckung von Genitalwarzen möglicherweise Hochrisiko-HPV-Typen nachgewiesen werden können. Um festzustellen, ob die Person eine HPV-Infektion hat, wird ein Abstrich vom Gebärmutterhals genommen. Anhand der Untersuchungsergebnisse kann festgestellt werden, ob eine HPV-Infektion vorliegt oder nicht, und wenn ja, um welchen Typ es sich handelt.
Die Symptome von Gebärmutterhalskrebs, insbesondere in fortgeschrittenen Stadien, lassen sich folgendermaßen zusammenfassen;
- Urin- und Fäkalienaustritt aus der Vagina
- Rückenschmerzen
- Schmerzen im Bein
- Appetitlosigkeit
- Schmerzen im Beckenbereich
- Geschwollene Füße
- Gewichtsverlust
- Müdigkeit, Schwäche
- Knochenschmerzen und Knochenbrüche
WAS SIND DIE RISIKOFAKTOREN FÜR GEBÄRMUTTERHALSKREBS?
Zu den Ursachen für Gebärmutterhalskrebs gehören eine hohe Anzahl von Geburten, Geschlechtsverkehr in jungen Jahren, eine hohe Anzahl von Partnern und Rauchen. Eine HPV-Infektion wurde bei 98 Prozent der Gebärmutterhalskrebs-Patientinnen festgestellt. Es gibt mehr als hundert HPV-Typen, die in der Regel durch Geschlechtsverkehr übertragen werden. Vor allem die Typen 16 und 18 verursachen Gebärmutterhalskrebs, während die Typen 6 und 11 Warzen in den Genitalien hervorrufen.
Zu den Risikofaktoren für Gebärmutterhalskrebs gehören Polygamie, Geschlechtsverkehr vor dem 20. Lebensjahr, Rauchen, ein schwaches Immunsystem, häufige virale und bakterielle Infektionen der Genitalorgane, Mehrlingsgeburten, ein niedriger sozioökonomischer Status, Vitamin-C- und Vitamin-A-Mangel.
WELCHE METHODEN GIBT ES ZUR PRÄVENTION VON GEBÄRMUTTERHALSKREBS?
Die Methoden zur Prävention von Gebärmutterhalskrebs lassen sich wie folgt auflisten:
- Lassen Sie sich regelmäßig ärztlich untersuchen
- Lassen Sie sich gegen HPV impfen
- Vermeiden Sie Rauchen und Tabakerzeugnisse
- Stärkung des Immunsystems
- Vorkehrungen gegen sexuell übertragbare Krankheiten treffen
- Ernähren Sie sich gesund
- Vorkehrungen gegen Fettleibigkeit treffen
STADIEN VON GEBÄRMUTTERHALSKREBS
Der Prozess, der zu Gebärmutterhalskrebs führt, verläuft als CIN 1, CIN 2, CIN 3 und schließlich als Gebärmutterhalskrebs. Eine spontane Rückbildung der Krankheit ist bei 70-90 % im ersten Stadium, bei 40-45 % im zweiten Stadium und bei 30-35 % im dritten Stadium zu beobachten. Bei Patientinnen, die keine Behandlung erhalten, entwickelt sich die Krankheit innerhalb von Jahren zu fortgeschrittenem Krebs. In den frühen Stadien muss die Gebärmutter nicht entfernt werden, und eine vollständige Heilung kann durch die teilweise Entfernung des Gebärmutterhalses mit einfachen chirurgischen Eingriffen (LEEP und Konisation) erreicht werden. Diese Patientinnen können nach der Behandlung schwanger werden und ein Kind bekommen.
Die Stadien des Gebärmutterhalskrebses lassen sich wie folgt einteilen;
Stadium 0: Die abnormen Zellen befinden sich in der innersten Schicht des Gebärmutterhalses. Es wird auch Karzinom insutu genannt.
Stadium I Krebszellen finden sich nur im Gebärmutterhals. Die Größe des Tumors kann zwischen 3 mm und 4 cm variieren.
Stadium II A: Der Krebs hat sich über den Gebärmutterhals hinaus auf die oberen zwei Drittel der Vagina ausgebreitet, aber nicht auf das Gewebe um die Gebärmutter.
Stadium II B: Der Krebs hat sich über den Gebärmutterhals hinaus auf die oberen zwei Drittel der Vagina und das Gewebe um die Gebärmutter herum ausgebreitet.
Stadium III A: Der Krebs hat sich auf den unteren Teil der Vagina, aber nicht auf die Beckenwand ausgebreitet.
Stadium IIIB: Der Krebs hat sich auf die Beckenwand ausgebreitet oder ist in die Harnleiter eingedrungen, d. h. in die Röhren, die die Nieren mit der Blase verbinden, wodurch der Urinabfluss behindert und die Nieren vergrößert werden.
Stadium IV: Der Krebs hat sich über den Gebärmutterhals hinaus auf die Blase, das Rektum oder andere Teile des Körpers ausgebreitet.
IMPFSTOFF GEGEN GEBÄRMUTTERHALSKREBS
HPV, das durch Geschlechtsverkehr übertragen wird, kann Gebärmutterhalskrebs verursachen. Zum Schutz gegen HPV wird empfohlen, dass sich Mädchen, Jungen und Erwachsene zwischen 9 und 26 Jahren gegen Gebärmutterhalskrebs impfen lassen. Obwohl drei Impfstoffe (9-valenter, 4-valenter und 2-valenter Impfstoff) die FDA-Zulassung erhalten haben und in den USA verwendet werden, ist der 9-valente Impfstoff in unserem Land noch nicht erhältlich. Der 2-valente Impfstoff enthält virusähnliche Partikel der HPV-Typen 16 und 18, die am häufigsten Gebärmutterhalstumore verursachen, und verleiht Immunität gegen diese Typen, während der 4-valente Impfstoff gegen Warzen schützt, indem er virusähnliche Partikel der HPV-Typen 6 und 11 enthält, die neben diesen Typen auch Warzen verursachen. Der neueste Impfstoff, der 9-valente Impfstoff, enthält zusätzlich zu den HPV-Typen 6, 11, 16 und 18 des 4-valenten Impfstoffs virusähnliche Partikel der anderen Hochrisiko-HPV-Typen 31, 33, 45, 52 und 58 und bietet eine höhere Schutzrate, da er gegen mehr HPV-Typen immunisiert, die Gebärmutterhalskrebs verursachen. Diese Impfstoffe bieten auch eine gewisse Immunität gegen andere HPV-Typen in Form einer Kreuzreaktion.
Bei Kindern im Alter zwischen neun und 15 Jahren sind 2 Impfdosen ausreichend. Zwischen der ersten und der zweiten Impfstoffdosis sollte ein Abstand von 6-12 Monaten liegen. In der Altersgruppe von 15 bis 26 Jahren werden 3 Impfdosen im Alter von 0, 1 und 6 Monaten empfohlen. Nach dem 26. Lebensjahr wird die Impfung aufgrund der hohen Wahrscheinlichkeit, bis zu diesem Alter mit HPV in Berührung zu kommen, nicht empfohlen, kann aber in geeigneten Fällen nach Rücksprache mit dem Arzt durchgeführt werden. Der HPV-Impfstoff wird intramuskulär verabreicht. Er kann über die Schulter oder die Hüfte verabreicht werden.
Eine Impfung gegen Gebärmutterhalskrebs, bevor man mit HPV in Berührung kommt, kann die meisten Fälle von Gebärmutterhalskrebs verhindern. Neben Gebärmutterhalskrebs schützt die Impfung auch vor Krebserkrankungen der Vagina und der Vulva. Die Impfstoffe der Typen 4 und 9 können Genitalwarzen und Analkrebs bei Männern und Frauen verhindern. Da einige HPV-Typen auch mit Krebserkrankungen im Mund- und Rachenraum in Verbindung gebracht werden, bietet die Impfung auch gegen diese Krebsarten Schutz. Die Centers for Disease Control and Prevention (CDC) empfehlen eine routinemäßige HPV-Impfung für Jungen und Mädchen ab dem 9. Lebensjahr. Der ideale Zeitpunkt für die Impfung gegen Gebärmutterhalskrebs ist vor Beginn der sexuellen Erfahrung, d. h. vor dem Kontakt mit dem HPV-Virus. Wenn das HPV-Virus bereits infiziert ist, ist der Impfstoff möglicherweise nicht mehr so wirksam wie zum empfohlenen Zeitpunkt.
WIE WIRD GEBÄRMUTTERHALSKREBS DIAGNOSTIZIERT?
Gebärmutterhalskrebs kann durch eine gynäkologische Untersuchung in fortgeschrittenen Stadien sowie durch eine kolposkopische Untersuchung und Biopsien diagnostiziert werden, die aufgrund eines positiven HPV-DNA-Hochrisikotests oder einer Anomalie im Abstrich durchgeführt werden, die zu den Früherkennungsuntersuchungen gehören. Bei Gebärmutterhalskrebs, der eine Erfolgsquote von 80-85 % hat, wenn er in einem frühen Stadium erkannt und behandelt wird, ist die Biopsie ebenfalls sehr wichtig für die Diagnose der Krankheit und für einen genauen Behandlungsplan.
Der erste Schritt bei Gebärmutterhalskrebs besteht darin, den Krebs zu diagnostizieren und das Stadium des Krebses zu bestimmen. Zu diesem Zweck wird eine Biopsie aus dem Gebärmutterhals entnommen und ein Krebs-Staging durchgeführt. Die Stadieneinteilung bei Gebärmutterhalskrebs richtet sich nach der Ausbreitung des Krebses im Körper. Das Staging basiert auf einer Becken- und Rektaluntersuchung sowie auf radiologischen Untersuchungen und möglichen anderen diagnostischen Tests. Abgesehen von Abstrichen und Biopsien werden diese Tests zur Diagnose von Gebärmutterhalskrebs eingesetzt;
WAS IST EIN ABSTRICHTEST?
Der Abstrich ist eine äußerst einfache und schmerzlose Methode der Krebsvorsorge. Ein Abstrich ist für Frauen sehr wichtig, um Gebärmutterhalskrebs vorzubeugen. Der Abstrich wird auf zwei Arten durchgeführt. Bei der klassischen Methode wird der entnommene Ausfluss auf ein Glas aufgetragen und nach dem Nachweis mit einem speziellen Spray an das Labor geschickt. Bei der zweiten Methode wird das entnommene Material in eine spezielle Flüssigkeit in einer Flasche gegossen. Auf diese Weise wird es an das Labor geschickt, wo es in bestimmten Phasen mikroskopisch untersucht wird.
Alle Frauen, die über 21 Jahre alt sind und ein aktives Sexualleben begonnen haben, sollten einen Abstrich machen lassen. Wenn das aktive Sexualleben vor diesem Alter begonnen hat, wird ein Abstrich innerhalb der ersten drei Jahre nach Beginn des Sexuallebens empfohlen. Bei Patientinnen mit einem normalen Abstrich ist ein Test alle 3 Jahre ausreichend, wenn keine anderen Risikofaktoren vorliegen. Auch während der Menopause sollten die Tests nicht unterbrochen werden. Nach dem 65. Lebensjahr können Abstrichtests mit Wissen des Arztes abgesetzt werden, wenn die Patientin bis dahin mindestens drei normale Abstrichergebnisse hat. Zeigt der Abstrich eine verdächtige Situation, kann der Test häufiger durchgeführt werden oder es können weitere Untersuchungen vorgenommen werden.
Kolposkopie: Es handelt sich um die Untersuchung des Epithels, das den Gebärmutterhals auskleidet, durch Betrachtung des Gebärmutterhalses mit einem speziellen binokularartigen Instrument. Gebärmutterhalskrebs beginnt nicht an einem Tag. Die Verschlechterung der Zellen nimmt mit der Zeit zu. Mit der Kolposkopie-Untersuchung kann man diese Veränderungen sehen und verfolgen. Wenn die Kolposkopie zusammen mit dem Abstrich ausgewertet wird, sinkt die Fehlerquote erheblich.
Diese Tests werden auch bei der Diagnose und Stadieneinteilung von Gebärmutterhalskrebs eingesetzt;
Rektovaginale Untersuchung: Bei diesem Test werden der Anus und der Vaginalbereich gleichzeitig untersucht. Es handelt sich um eine einfache Beckenuntersuchung, die unter Untersuchungsraumbedingungen durchgeführt werden kann. Es wird festgestellt, ob sich der Krebs außerhalb des Gebärmutterhalses ausgebreitet hat.
CT-Scan; Der CT-Scan, auch Computertomographie genannt, beginnt mit der intravenösen Injektion einer röntgendichten Substanz. Diese Substanz ermöglicht eine bessere Darstellung der inneren Organe auf Röntgenbildern.
MRT-Untersuchung (Magnetresonanztomographie): Diese Untersuchung nutzt magnetische Radiowellen und einen Computer, um innere Organe und Gewebe sichtbar zu machen.
PET-Scan (Positronen-Emissions-Tomographie): Radioaktive Glukose wird in die Vene gespritzt, und die Körperbereiche, in denen die Glukose stark verwertet wird, werden im PET bestimmt. Krebszellen sind aktiver als normale Zellen und verbrauchen mehr Glukose. Krebszellen erscheinen bei diesem Test heller.
Außerdem können eine Röntgenaufnahme der Brust und ein Blutbild angeordnet werden, um festzustellen, ob sich der Krebs auf die Brust oder die Lunge ausgebreitet hat.
WIE WIRD GEBÄRMUTTERHALSKREBS BEHANDELT?
Genitalwarzen, die durch eine Infektion mit dem HPV-Virus verursacht werden, können durch Verbrennung, Vereisung, Operation oder lokale Cremes behandelt werden. Das Verschwinden der Warze als Ergebnis dieser Behandlung bedeutet nicht, dass sie nicht wieder auftritt. Bei manchen Menschen tritt die Warze nach der Behandlung nicht wieder auf; bei anderen ist in regelmäßigen Abständen eine erneute Warzenbildung zu beobachten. Die Behandlung sollte bei jeder neuen Warzenbildung wiederholt werden. Das Risiko eines erneuten Auftretens von Genitalwarzen hängt davon ab, wie stark das Immunsystem ist. Bei Infektionen mit dem HPV-Virus ist bekannt, dass die Person das Virus ohne Behandlung spontan aus dem Körper entfernen kann.
Bei der Behandlung von Gebärmutterhalskrebs werden chirurgische Eingriffe, Strahlentherapie und Chemotherapie allein oder in Kombination miteinander eingesetzt. Wenn die präkanzeröse Läsion (CIN 2-3) nicht in die Tiefe des Gewebes vorgedrungen ist, kann der Bereich des Gebärmutterhalses durch Kolposkopie bestimmt werden. Durch die chirurgische Entfernung des Bereichs wird der Bereich, der zu Krebs werden kann, beseitigt und eine hohe Heilungsrate bei der Patientin erreicht. Bei einem einfachen chirurgischen Eingriff kann die Patientin noch am selben Tag entlassen werden. Wenn der Krebs invasiv geworden ist, das heißt, wenn er tief in das Gewebe eingedrungen ist, gibt es zwei Behandlungsmöglichkeiten. In diesem Fall wird eine “radikale Hysterektomie” durchgeführt, eine umfangreiche und schwierige Operation, die viel Zeit in Anspruch nehmen wird. Da die Krebszellen auch in die Lymphknoten im Beckenbereich eingedrungen sind, werden diese ebenfalls entfernt. Die Alternative ist die Chemo-Strahlentherapie: Die Krebszellen in diesem Bereich werden mit Chemotherapeutika für die Bestrahlung sensibilisiert, dann wird die Patientin bestrahlt und die Nachsorge wird fortgesetzt. Im Spätstadium wird eine Chemotherapie durchgeführt, aber die Heilungsrate bei diesen Patienten ist recht niedrig.
WAS IST HPV, WIE WIRD ES ÜBERTRAGEN?
HPV ist ein sexuell übertragbares Virus, das Gebärmutterhalskrebs verursachen kann. HPV (Humanes Papillomavirus), das bei mehr als 95 % der Frauen mit Gebärmutterhalskrebs diagnostiziert wird, ist ein Virus, das den Genitalbereich infiziert und sich durch Kontakt verbreitet. Es verursacht Warzen im Sexualbereich, besonders häufig bei Frauen, und Krebs im Gebärmutterhals, im äußeren Genitalbereich und in den Geschlechtsorganen. Das HPV-Virus ist recht heimtückisch und kann sich über Monate hinweg ausbreiten, ohne Symptome zu zeigen. Die Symptome des Virus werden als “stille Infektion” bezeichnet, wenn sie erst mehrere Monate oder Jahre nach der Infektion auftreten.
Das HPV-Virus kann Genitalwarzen bei Männern und Frauen, Gebärmutterhalskrebs bei Frauen und Peniskrebs bei Männern verursachen. HPV, eine ernst zu nehmende Infektion, kann bei einigen Menschen vom Immunsystem bekämpft werden. Es darf nicht vergessen werden, dass ein Virus, das vom Immunsystem nicht neutralisiert werden kann, jahrelang ohne jegliche Symptome weiterleben kann. Eine Person kann die Infektion jahrelang in sich tragen, ohne Beschwerden zu haben. Dies verhindert jedoch nicht die Ausbreitung der Krankheit, und das Virus kann weiterhin beim Geschlechtsverkehr übertragen werden.
Die HPV-Virustypen werden nach ihrer Wahrscheinlichkeit, Gebärmutterhalskrebs zu verursachen, in Risikogruppen eingeteilt. Die Typen, die mehr Warzen verursachen, sind in der niedrigen Risikogruppe für Gebärmutterhalskrebs. Es ist also nicht so, dass sich jede Genitalwarze in Gebärmutterhalskrebs verwandelt.
HERPES GENITALIS BEHANDLUNG
Warzen, die durch eine Infektion mit dem HPV-Virus verursacht werden, können durch Verbrennung, Vereisung, Operation oder lokale Cremes behandelt werden. Das Verschwinden der Genitalwarze als Ergebnis dieser Behandlung bedeutet nicht, dass sie nicht wieder auftreten wird. Während Genitalwarzen bei manchen Menschen nach der Behandlung nicht wieder auftreten, kann bei anderen Menschen in regelmäßigen Abständen eine erneute Genitalwarzenbildung beobachtet werden. Die Behandlung sollte bei jeder neuen Genitalwarzenbildung wiederholt werden. Bei Infektionen mit dem HPV-Virus ist bekannt, dass die Betroffenen das Virus ohne Behandlung spontan aus ihrem Körper entfernen können.
Gebärmutterhalskrebs nach der Behandlung
Je nach Stadium des Krebses und der Art der Behandlung kann Gebärmutterhalskrebs nicht verschwinden oder nach der Behandlung wieder auftauchen. Ein neuer Krebs kann sich auch an anderer Stelle im Körper entwickeln. Deshalb sind Routineuntersuchungen und Abstriche auch nach Abschluss der Behandlung wichtig. Ihr Arzt kann Sie bitten, in den ersten Jahren nach der Behandlung häufiger Abstriche machen zu lassen. Dies geschieht, um sicherzustellen, dass alle Krebszellen verschwunden sind. Auch andere Tests und Verfahren können erforderlich sein. Ihr Arzt wird mit Ihnen zusammen die Kontrolluntersuchungen planen, die Sie auch nach Abschluss der Behandlung benötigen.
HÄUFIG GESTELLTE FRAGEN ZU GEBÄRMUTTERHALSKREBS
Ist Gebärmutterhalskrebs ansteckend?
HPV ist der wichtigste Faktor für Gebärmutterhalskrebs. Dieses Virus wurde bei 99,7 Prozent der Patientinnen nachgewiesen. Obwohl Gebärmutterhalskrebs nicht ansteckend ist, ist HPV das am häufigsten sexuell übertragene Virus. Nach sexuellem Kontakt mit Menschen mit Warzen im Genitalbereich besteht eine hohe Ansteckungsrate von 60 %.
HPV wird meist sexuell und in sehr geringem Maße durch Handkontakt, Toiletten- und Körperpflegeprodukte übertragen. Bei mehreren Partnern besteht ein hohes Risiko einer HPV-Übertragung.
Was sind die ersten Anzeichen von Gebärmutterhalskrebs?
Zu den ersten Anzeichen von Gebärmutterhalskrebs gehören Symptome wie blutiger Ausfluss, Blutungen nach dem Geschlechtsverkehr und unregelmäßige Menstruationsblutungen.
Wo treten die Schmerzen bei Gebärmutterkrebs auf?
Gebärmutterhalskrebs kann mit Symptomen wie Rücken-, Bein-, Becken- und Knochenschmerzen einhergehen. Außerdem können Schmerzen und Druckgefühl im Unterbauch, Schmerzen beim Geschlechtsverkehr und Gewichtsverlust beobachtet werden.
Kann Gebärmutterhalskrebs abgetastet werden?
Bei der manuellen Untersuchung legt der Arzt zwei Finger in die Vagina und die andere Hand auf den Unterbauch. Auf diese Weise können die Organe und eventuelle tastbare Ansammlungen ertastet werden.
In welchem Stadium zeigt der Gebärmutterkrebs Symptome?
Die Symptome von Gebärmutterhalskrebs treten in fortgeschrittenen Stadien der Krankheit auf. In fortgeschrittenen Stadien kann der Tumor bei der Untersuchung gesehen werden. Wenn Gebärmutterhalskrebs fortschreitet, können Probleme beim Wasserlassen, Schwierigkeiten beim Stuhlgang und Schmerzen in den Beinen beobachtet werden.
In welchem Alter beginnt Gebärmutterhalskrebs?
Gebärmutterhalskrebs, der in der Regel um das 50. Lebensjahr während der Menopause auftritt, ist in letzter Zeit auch bei jungen Frauen zu beobachten. Obwohl Brustkrebs in der Liste der häufigsten Krebsarten bei Frauen an erster Stelle steht, kann Gebärmutterhalskrebs aufgrund seiner lebensbedrohlichen Eigenschaften den Brustkrebs übertreffen.
Was wird bei einem Abstrich festgestellt? Kann Gebärmutterhalskrebs erkannt werden?
Der Abstrich wird durchgeführt, um Veränderungen in der Vagina zu erkennen, bevor sie sich zu Krebs entwickeln. Auf diese Weise kann die Frau leicht behandelt werden, bevor sie das Krebsstadium erreicht. Frauen müssen möglicherweise einen Abstrich im Rahmen der von Gynäkologen festgelegten Routineuntersuchungen durchführen lassen.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS SIND EIERSTOCKZYSTEN?
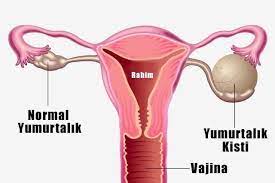
Die Häufigkeit von Ovarialzysten variiert je nach Altersgruppe. Verschiedene Zysten treten in der Adoleszenz, im reproduktiven Alter oder in der Menopause auf. Ovarialzysten lassen sich je nach Altersgruppe wie folgt einteilen:
Funktionelle Zysten: Zysten im Alter zwischen 13 und 18 Jahren, der so genannten Adoleszenzphase, sind meist funktionelle Zysten, die in der Regel nicht operiert werden müssen und mit der Zeit wieder verschwinden. Da sich der Hormonhaushalt des Körpers in dieser Zeit noch nicht eingependelt hat, kann der Körper vorübergehend Zysten bilden. Funktionelle Zysten sollten in der Regel weiterverfolgt werden. Denn auch wenn es unwahrscheinlich ist, kann es aufgrund des von der Zyste verursachten Gewichts zu Problemen wie der so genannten “Ovarialtorsion” oder dem Platzen der Zyste kommen. Abgesehen von dieser Nachsorge ist eine medikamentöse Behandlung nicht erforderlich. Funktionelle Zysten können auch während der Fruchtbarkeit festgestellt werden.
Keimzelltumore: Dies sind Eierstocktumore, die in der Pubertät und in den ersten Jahren des reproduktiven Alters auftreten können. Während bei einigen zum Zeitpunkt der Diagnose festgestellten Typen eine Operation ausreicht, kann bei einigen Typen zusätzlich zur Operation eine Chemotherapie erforderlich sein. Es handelt sich um solide zystische Massen, die sich meist als solide Organe manifestieren. Ob es sich um eine funktionelle Zyste oder eine solide zystische Masse handelt, lässt sich durch Ultraschallkontrolle leicht feststellen.
Corpus-luteum-Zysten: Dies sind Zysten, die während der Menstruation auftreten. Sie treten beim Eisprung (Ovulation) auf. Sie verschwindet fast vollständig, manchmal kann sie Blutungen verursachen.
Dermoidzysten: Sie treten häufig während der Schwangerschaft auf. Es handelt sich um Zysten, die ektodermale Gewebe wie Haut, Haare, Fett, Knochen, Zähne in der äußeren Struktur des Körpers enthalten. Dermoidzysten können die Patientin sehr schnell belasten und zu Zysten werden, die eine dringende Operation mit Torsion, d. h. Drehung der Eierstöcke, erfordern. Früher wurden bei einer Torsion alle Eierstöcke entfernt, doch heute kann eine Eierstocktorsion wiederhergestellt und die zystische Masse, die sie verursacht hat, entfernt werden. In den meisten Fällen wird die Funktion der Eierstöcke durch diese Methode wiederhergestellt. Wenn keine schwerwiegenden Verzögerungen vorliegen, kann das Problem auch ohne Entfernung der Eierstöcke gelöst werden.
Schokoladenzysten (endometriotische Zysten): Endometriosezysten, im Volksmund auch Schokoladenzysten genannt, heißen so, weil ihre Struktur geschmolzener Schokolade ähnelt. Sie sind die häufigsten speziellen Zysten während der Fortpflanzungszeit. Bei Schokoladenzysten handelt es sich eigentlich um die Bildung von Endometriose im Eierstock. Schokoladenzysten treten bei einer von 10 Frauen während der fruchtbaren Zeit auf. Bei diesen Zysten ist der chirurgische Eingriff sehr viel selektiver. Denn Schokoladenzysten treten meist bei Frauen in der fruchtbaren Phase auf. Mit anderen Worten: Die Patientinnen haben vor, Mutter zu werden. Aus diesem Grund wird eine Operation bei Schokoladenzysten nicht sofort empfohlen. Eine Operation ist jedoch erforderlich, wenn die Patientin über Schmerzen klagt. Ist die Zyste sehr groß, z. B. 9-10 cm, sollte eine Operation vorgezogen werden, wenn sie keinen Druck mehr auf das Becken ausübt. Wenn die Zyste jedoch beispielsweise 5 cm groß ist, keine verdächtigen Unregelmäßigkeiten im Ultraschall zu sehen sind und es sich um eine homogene Schokoladenzyste handelt, wird sie weiter beobachtet. Denn diese Zysten können wiederkehren, wenn nicht eine sehr erfolgreiche Operation durchgeführt wird. Außerdem kann sich die Eierstockreserve während der Operation verringern. Aus diesem Grund sollte je nach dem Erscheinungsbild im Ultraschall eine Operation vermieden und so weit wie möglich nachkontrolliert werden, insbesondere wenn die Patientin einen Kinderwunsch hat. Wenn jedoch der CA-125, ein aus dem Blut entnommener Tumormarker, einen Anstieg aufweist, ist bei diesen Patientinnen eine Operation erforderlich. Das Krebsrisiko ist bei Schokoladenzysten im gebärfähigen Alter gering. Mit zunehmendem Alter steigt das Risiko, dass Schokoladenzysten tumorös werden.
WAS SIND DIE SYMPTOME VON EIERSTOCKZYSTEN?
Das wichtigste Symptom, vor allem bei Zysten in der jüngeren Altersgruppe, sind Leistenschmerzen und Menstruationsunregelmäßigkeiten. Bei Schokoladenzysten können Beschwerden über Unfruchtbarkeit, insbesondere während der Fruchtbarkeitsperiode, sehr schmerzhafte, später auftretende Perioden und Schmerzen beim Geschlechtsverkehr bei sexuell aktiven Frauen auftreten. Manchmal kann es zu schmerzhaftem Stuhlgang kommen, wenn der Darm betroffen ist. Auch Schwierigkeiten beim Wasserlassen können beobachtet werden. Es können verschiedene Beschwerden an den Organen in der Beckenregion, dem sogenannten Beckenbereich, auftreten. Das häufigste Symptom ist jedoch die Unfähigkeit, schwanger zu werden. Darüber hinaus sind auch lang anhaltende Leistenschmerzen sehr häufig. Bei Tumorzysten in den Wechseljahren sind Schwellungen im Unterleib, häufiges Wasserlassen aufgrund des Drucks auf die Organe in der Region, Verstopfungsbeschwerden, das Auftreten von vaginalen Blutungen in den Wechseljahren, die manchmal als “postmenopausal” bezeichnet werden, und Beschwerden wie Unterleibsschmerzen Symptome, die in den Wechseljahren auftreten, insbesondere bei großen Tumoren. Darüber hinaus kann es Zysten geben, die keine Symptome verursachen und zufällig bei Routinekontrollen entdeckt werden.
WIE WERDEN EIERSTOCKZYSTEN DIAGNOSTIZIERT?
Das erste Diagnoseinstrument ist die körperliche Untersuchung. Bei der körperlichen Untersuchung wird der Unterleib manuell untersucht. Schmerzhafte Bereiche werden aufgespürt. Danach ist das wichtigste bildgebende Verfahren die Ultraschalluntersuchung. Bei der Ultraschalluntersuchung werden Größe, Aussehen und Struktur beurteilt. Bei bestimmten Patienten werden Bluttests, sogenannte Tumormarker, durchgeführt oder durch eine MRT unterstützt. Die MRT wird nicht bei jeder Zyste durchgeführt. Sie wird in verdächtigen Fällen angefordert. Bei Verdacht auf Krebs kann eine MRT durchgeführt werden, um festzustellen, ob sich der Krebs auf andere Bereiche ausgebreitet hat. Darüber hinaus spielen Tumortests im Blut eine wichtige Rolle bei der Diagnose. Bei Eierstöcken, insbesondere bei serösem Krebs und Schokoladenzysten, können CA-125, CA-19-9 bei muzinösen Eierstocktumoren, Alpha-Feto-Protein (AFP), Beta-HCG bei Keimzelltumoren in jungen Jahren, LDH-Bluttest bei einigen spezifischen Tumoren ebenfalls nützlich sein.
Obwohl das Krebsrisiko in der jungen Altersgruppe gering ist, muss bei jeder komplexen Zyste zunächst festgestellt werden, ob eine Krebserkrankung vorliegt. Daher wird im Allgemeinen bei allen nicht funktionellen Zysten in der jungen Altersgruppe eine Operation empfohlen. Funktionelle Zysten werden weiter beobachtet. Befindet sich die Patientin in den Wechseljahren oder kurz davor, d. h. Zysten, die nach den 40er Jahren auftreten, sind Zysten, bei denen die Möglichkeit einer Krebserkrankung etwas näher liegt. Vor allem bei Patientinnen in den Wechseljahren wird geprüft, ob die Struktur der Zyste auf dem Ultraschallbild regelmäßig ist. Wird eine Zyste in den Wechseljahren entdeckt und wird sie nicht als funktionelle Zyste eingestuft, wird im Allgemeinen eine Operation empfohlen.
WIE WERDEN EIERSTOCKZYSTEN BEHANDELT?
Bei Vorliegen einer Zyste werden der Ultraschallbefund, die Beschwerden des Patienten, Laboruntersuchungen und gegebenenfalls weitere bildgebende Verfahren in Kombination mit einem Nachsorgeprotokoll oder einem chirurgischen Eingriff ausgewertet. Es gibt Ultraschallbefunde, die Aufschluss darüber geben, ob die Zyste gutartig oder bösartig ist. Dazu gehören die Größe der Zyste, die Struktur des umgebenden Gewebes, die so genannte Zystenwand, das Vorhandensein von desorganisiertem Gewebe wie papillären Ausstülpungen und knotigen Strukturen. Besonders verdächtig sind z. B. feste Bereiche, d. h. komplizierte Zysten. In diesen Fällen ist in der Regel eine Operation vorzuziehen, und die pathologische Untersuchung sollte während der Operation durchgeführt werden. Stellt sich heraus, dass es sich um eine gutartige Zyste handelt, wird nur die Zyste entfernt, und es wird kein weiterer Eingriff vorgenommen. Stellt sich bei der pathologischen Untersuchung jedoch heraus, dass die Zyste bösartig ist, sollte eine präventive Operation oder eine Krebsoperation durchgeführt werden, je nach Alter der Patientin und je nachdem, ob die Patientin Kinder haben möchte oder nicht.
Wenn die Zyste nicht operiert werden muss und nur nachkontrolliert werden soll, wird sie in Abständen von 3 oder 6 Monaten kontrolliert. Wenn eine Operation erforderlich ist, werden geschlossene Methoden wie die Laparoskopie oder die robotergestützte oder offene Chirurgie angewandt, je nach Größe der Masse, ihrer Lage, ob sie sich in beiden Eierstöcken befindet, und dem Kinderwunsch der Patientin.
Wenn die Patientin sehr unentschlossen ist, ob es sich bei dem Befund um einen Tumor handelt oder nicht, kann zunächst die geschlossene laparoskopische Methode angewandt werden, um die Struktur der Masse zu erkennen. Wenn es sich jedoch um eine große Masse handelt, wenn zuerst das Vorhandensein eines Tumors in Betracht gezogen wird und wenn sie sich ausbreitet, d. h. wenn eine Masse in beiden Eierstöcken vorhanden ist, dann wird die offene Operation bevorzugt.
Bei der Behandlung von funktionellen Zysten wird ein Nachsorgeprotokoll angewandt. Zysten von Patientinnen ohne klinische Probleme, Schmerzen oder andere Beschwerden können über einen langen Zeitraum nachverfolgt werden. Bei diesen Patientinnen wird die Patientin nur über das Risiko einer Eierstockdrehung, d. h. das Risiko einer Torsion, aufgeklärt, und es wird nur im Notfall eingegriffen. Funktionelle Zysten oder Zysten, die nicht als krebsartig eingestuft werden, verschwinden oft spontan. Wenn sie nicht verschwinden, sondern an Größe zunehmen, werden sie aus der Nachsorge entfernt und eine chirurgische Behandlung eingeleitet.
HÄUFIG GESTELLTE FRAGEN
- Verhindert eine Eierstockzyste die Empfängnis?
Je nach Art können Eierstockzysten ein Hindernis für die Empfängnis darstellen. Im Allgemeinen verschwindet das Hindernis für die Empfängnis nach erfolgreicher operativer Entfernung von nicht zu weit fortgeschrittenen (unkomplizierten) Eierstockzysten.
- Was sollten Patienten mit Zysten, die überwacht werden, in einem Notfall tun?
Wenn der Patient weiß, dass er eine Zyste hat, wird er von seinem Arzt darüber informiert, ob sich die Zyste auf der rechten oder linken Seite befindet. Die Schmerzen in der Region können sich jedoch auf beiden Seiten bemerkbar machen. Aus diesem Grund sollte bei Schmerzen in der Bauchregion, insbesondere bei starken Schmerzen, die in Abständen kommen und gehen, zunächst der Arzt aufgesucht werden, der sich um die Zyste kümmert; ist er nicht erreichbar, muss unbedingt die Notaufnahme aufgesucht werden. Wird ein anderer Arzt aufgesucht, sollten die Untersuchungsergebnisse und Ultraschallbilder dem Arzt mitgeteilt werden. Außerdem sollte die orale Ernährung eingestellt werden, wenn die Schmerzen beginnen. Wenn die Schmerzen von Übelkeit, Erbrechen oder einer Bauchschwellung begleitet werden, deutet dies auf eine Reizung des Bauchfells hin. Mit anderen Worten bedeutet dies, dass die Zyste mit dem Bauchraum in Kontakt gekommen ist. Auch hier handelt es sich um Symptome, die dringend an eine medizinische Einrichtung weitergeleitet werden sollten.
- Verursacht eine Eierstockzyste Blutungen?
Bei einigen Eierstockzysten kann es je nach Lage und Größe zu Blutungen kommen.
- Wie kann man feststellen, ob eine Zyste in den Eierstöcken vorhanden ist?
Eine Ultraschalluntersuchung gibt in der Regel genauen Aufschluss über das Vorhandensein von Zysten.
- Verursacht eine Eierstockzyste Schmerzen?
Ja, eines der häufigsten Merkmale von Eierstockzysten sind Schmerzen.
- Wie entsteht eine Eierstockzyste?
Eierstockzysten können aus vielen Gründen entstehen. Die häufigste Ursache ist ein hormonelles Ungleichgewicht im Körper. Darüber hinaus können sich Eierstockzysten infolge verschiedener Infektionen der Eierstöcke, Strahlenbelastung, Tumore und einiger zellulärer Störungen entwickeln.
- Was sind die Symptome einer Schokoladenzyste?
Bei Schokoladenzysten können Beschwerden über mangelnden Kinderwunsch, insbesondere während der Fruchtbarkeitsperiode, sehr schmerzhafte Regelblutungen und Schmerzen beim Geschlechtsverkehr bei sexuell aktiven Frauen auftreten. Manchmal kann es zu schmerzhaftem Stuhlgang kommen, wenn der Darm betroffen ist. Auch Schwierigkeiten beim Wasserlassen können beobachtet werden. Es können verschiedene Beschwerden an den Organen in der Beckenregion, dem sogenannten Beckenbereich, auftreten. Das häufigste Symptom ist jedoch die Unfähigkeit, schwanger zu werden. Darüber hinaus sind auch lang anhaltende Leistenschmerzen häufig.
- Wie entsteht eine Schokoladenzyste?
Es gibt keine direkten Ursachen für Schokoladenzysten, aber es gibt Faktoren, die das Risiko erhöhen. Die wichtigsten davon sind genetische und umweltbedingte Faktoren. Sie können sich auch aus vielen verschiedenen Gründen entwickeln, z. B. durch ein schwaches Immunsystem, durch den Fluss von Menstruationsblut in die Bauchhöhle oder durch Gewebedifferenzierung.
- Verursacht eine Schokoladenzyste Blutungen?
Bei einer Schokoladenzyste kommt es in der Regel nicht zu Blutungen.
- Wo verursacht eine Schokoladenzyste Schmerzen?
Es kann bei sexuell aktiven Frauen zu Leistenschmerzen während der Menstruation oder zu Schmerzen im Vaginalbereich beim Geschlechtsverkehr führen.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
Was ist robotergestützte Chirurgie bei gynäkologischen Erkrankungen?
Parallel zum technologischen Fortschritt haben sich auch die chirurgischen Methoden und Techniken weltweit stark weiterentwickelt. Der Hauptzweck dieser Entwicklungen besteht darin, Operationen sicherer durchzuführen, die Komplikationsrate zu senken und unerwünschte Ergebnisse im Zusammenhang mit der Operation zu minimieren. Der wichtigste Fortschritt in diesem Bereich besteht darin, dass Operationen, die früher offen durchgeführt wurden, heute mit minimalinvasiven Methoden, d. h. geschlossen, durchgeführt werden können. Der neueste Stand der Technik bei geschlossenen Eingriffen sind robotergestützte Operationssysteme. Die robotergestützte Chirurgie ist, einfach ausgedrückt, eine geschlossene Operation, die mit Hilfe von Roboterarmen durchgeführt wird, die vom Chirurgen gesteuert werden. Im Vergleich zu den traditionellen laparoskopischen Eingriffen hat das Robotersystem viele Vorteile.
In welchen Fällen wird die robotergestützte Chirurgie bei gynäkologischen Erkrankungen eingesetzt?
Es gibt keine Situation, in der die robotergestützte Chirurgie bei gynäkologischen Erkrankungen nicht eingesetzt werden sollte. Die robotergestützte Chirurgie kann in allen Fällen durchgeführt werden, in denen die laparoskopische Chirurgie geeignet ist. Die Roboterchirurgie kann bei der Operation von Gebärmutter-, Gebärmutterhals- und Eierstockkrebs, der Entfernung von Myomen, der Hysterektomie, der Endometriose-Operation, Eierstockzysten, Harninkontinenz und Gebärmuttervorfall eingesetzt werden.
Technisch gesehen gibt es jedoch einige Situationen, in denen der Vorteil der geschlossenen Chirurgie gegenüber der offenen Chirurgie geringer ist. In diesen Fällen kann die offene Chirurgie der robotergestützten Chirurgie vorgezogen werden.
Wie wird die robotergestützte Chirurgie bei gynäkologischen Erkrankungen eingesetzt?
Die Vorbereitung der Patientin bei der robotergestützten Chirurgie ist der traditionellen laparoskopischen Methode sehr ähnlich. Nachdem die Patientin auf den Operationstisch gelegt und betäubt wurde, wird die Patientin in die gynäkologische Untersuchungsposition mit Fußstützen gebracht. Dann wird eine spezielle Nadel durch einen winzigen Einschnitt etwa 3 cm oberhalb des Nabels in den Bauch eingeführt und der Bauch mit Kohlendioxidgas aufgeblasen. Wenn ein Druck von etwa 15 mmHg erreicht ist, wird der Trokar (Metallrohr oder -hülse, durch die chirurgische Instrumente ein- und ausgeführt werden können) durch einen 7 mm langen Einschnitt 3 cm oberhalb des Nabels in den Bauch eingeführt. Die Kamera des Robotersystems wird durch den zuerst eingeführten Trokar in den Bauchraum vorgeschoben und das erste Bild der Organe im Bauchraum wird aufgenommen. Nach dieser Phase wird der Operationstisch in einem Winkel von etwa 35 Grad auf den Kopf gestellt. Um zu verhindern, dass der Patient auf dem Tisch nach unten rutscht, werden die Füße auf den Fußstützen fixiert und Schulterstützen auf die Schultern gelegt. Je nach Art der durchzuführenden Operation werden so viele Trokare wie die Gesamtzahl der Roboterarme, mit denen operiert werden soll, unter dem Blick der ersten Eintrittskamera in den Bauchraum eingeführt. Die Trokare werden in der Regel geradlinig oder leicht halbmondförmig in den Bauchraum eingebracht, wobei zwischen zwei Trokaren ein Abstand von mindestens 8 cm liegen sollte. Nachdem alle Trokare platziert sind, werden die zu verwendenden Roboterinstrumente durch die entsprechenden Trokare in den Bauchraum eingeführt, und schließlich werden die Instrumente mit den Roboterarmen verbunden und der Patient ist bereit für die Operation.
Myomektomie Das Robotersystem bietet einen großen Vorteil bei der chirurgischen Behandlung von Myomen, einem Problem, das bei einer beträchtlichen Anzahl von Frauen im gebärfähigen Alter auftritt. Der wichtigste Schritt bei der Myomchirurgie mit der geschlossenen Methode ist der solide und mehrschichtige Verschluss der Einschnitte in der Gebärmutter nach der Entfernung der Myome. Werden die Schnitte in der Gebärmutter nach der Entfernung der Myome nicht verschlossen, erhöht sich das Risiko einer Gebärmutterruptur bei nachfolgenden Schwangerschaften. Bei Myomektomien, die mit einem Robotersystem durchgeführt werden, ist das Nähen der Schnitte viel einfacher und zuverlässiger, da die Roboterarme die Bewegungen des Handgelenks in allen Achsen nachahmen können.
Hysterektomie (Gebärmutterentfernung): Alle für die geschlossene Chirurgie geeigneten Hysterektomieverfahren können mit dem Robotersystem durchgeführt werden. Dank des dreidimensionalen und qualitativ hochwertigen Bildes wird die Möglichkeit unerwünschter Situationen, die bei einer Hysterektomie auftreten können, reduziert. Nach der robotergestützten Durchtrennung der Gebärmutterbänder wird der obere Teil der Vagina rundherum aufgeschnitten und die von allen Verbindungen befreite Gebärmutter aus der Vagina herausgenommen. Die Einschnittstelle in der Vagina wird ebenfalls robotisch oder vaginal verschlossen.
Endometriose Endometriose ist eine Erkrankung, die die Gebärmutter, die Eileiter, die Eierstöcke und sogar den Dickdarm betrifft und schwere Verwachsungen, Funktionsverluste und Schmerzen in diesen Organen verursacht. Die Endometriose-Operation erfordert Erfahrung, und insbesondere die fortgeschrittene Endometriose-Operation ist ein langwieriger Eingriff. Die robotergestützte Chirurgie bietet in diesem Fall erhebliche Vorteile, denn sie erfordert hohe Konzentration über lange Zeiträume und die Öffnung von Verwachsungen in wichtigen Organen, ohne die Organe zu beschädigen.
Was sind die Vorteile der Roboterchirurgie bei gynäkologischen Erkrankungen?
Die Vorteile der robotergestützten Da Vinci-Chirurgie für den Patienten lassen sich wie folgt auflisten:
- Da die Operation mit winzigen Schnitten durchgeführt wird, ist die Blutung beim Patienten geringer.
- Da der Schnitt kleiner ist als bei der offenen Operation, hat der Patient weniger Schmerzen.
- Kürzere Wundheilungszeit
- Die Dauer des Krankenhausaufenthalts des Patienten wird verkürzt.
- Die Komplikationsrate ist niedriger als bei der offenen Chirurgie
- Der Patient kehrt in kürzerer Zeit ins tägliche und soziale Leben zurück
- Da die Erholungsphase kürzer ist, kann die onkologische Behandlung früher nach der Operation begonnen werden.
HÄUFIG GESTELLTE FRAGEN ZUR ROBOTERCHIRURGIE BEI GYNÄKOLOGISCHEN ERKRANKUNGEN
Wie unterscheidet sich die robotergestützte Chirurgie bei gynäkologischen Erkrankungen von offenen und geschlossenen Methoden? Warum wird die robotergestützte Chirurgie bei gynäkologischen Erkrankungen bevorzugt?
Die robotergestützte Chirurgie hat sowohl gegenüber der offenen Chirurgie als auch gegenüber den traditionellen geschlossenen Methoden (Laparoskopie) gewisse Vorteile.
Vorteile gegenüber der offenen Chirurgie:
- Der Blutverlust während der Operation ist viel geringer
- Die Komplikationsraten sind niedriger
- Kürzere Erholungszeit, kürzerer Krankenhausaufenthalt
- Postoperative Schmerzen sind geringer
- Nach der Operation kehrt er schneller ins normale Leben zurück.
- Die Operationsnarbe ist viel kleiner
Vorteile gegenüber der konventionellen laparoskopischen Chirurgie:
- Der Chirurg führt die Operation in einer viel bequemeren Position durch, indem er auf der Konsole sitzt. So kann der Chirurg die Operation fortsetzen, ohne zu ermüden und die Konzentration zu verlieren, selbst bei langen Krebsoperationen. Bei klassischen laparoskopischen Operationen hat der Chirurg viel mehr körperliche Schwierigkeiten und leidet bei längeren Operationen unter Müdigkeit, körperlichen Schmerzen und Konzentrationsverlust.
- Mit dem Robotersystem sieht der Chirurg das Operationsfeld in 3D und in hoher Qualität. Bei der klassischen laparoskopischen Methode, bei der der Eingriff durch den Blick auf einen zweidimensionalen Bildschirm erfolgt, verschwindet der Sinn für Tiefe, was in manchen Fällen zu Problemen führen kann.
- Im Robotersystem sind die Roboterarme im Patienten so konzipiert, dass sie die Finger- und Handgelenkbewegungen des Chirurgen mit hoher Präzision simulieren. So können chirurgische Instrumente mit 360-Grad-Bewegungsfähigkeit mit sehr hoher Präzision während der Operation eingesetzt werden. Dies ist bei der klassischen Laparoskopie nicht möglich.
- Beim Robotersystem kann der Chirurg selbst alle Instrumente und die Kamera im Patienten, d. h. in seinem Arbeitsbereich, nach Belieben steuern. Bei der klassischen Laparoskopie kann der Chirurg nur zwei Instrumente gleichzeitig steuern. Eine andere Person steuert die Kamera und das Assistenzinstrument. Daher hängt der Erfolg der Operation sowohl vom Chirurgen als auch vom Assistenten ab.
- Die Steuerung des Robotersystems verhindert das Zittern der Hand des Chirurgen vollständig und sorgt für eine vibrationsfreie und reibungslose Handhabung der Instrumente.
Wie verläuft die Genesung nach einer robotergestützten Operation?
Bei der robotergestützten Chirurgie werden Instrumente mit einem Durchmesser von 7 mm verwendet, und die robotergestützten Operationen werden durch durchschnittlich 4 Inzisionen von 7 mm durchgeführt. Daher ist die Erholungszeit nach robotergestützten Eingriffen extrem kurz.
Gibt es Risiken bei der robotergestützten Chirurgie bei gynäkologischen Erkrankungen?
Im Vergleich zur herkömmlichen laparoskopischen Methode bei gynäkologischen Erkrankungen bestehen bei der Roboterchirurgie keine spezifischen Risiken. Zwar kann es zu technischen Fehlfunktionen des Robotersystems kommen, doch sind diese äußerst selten, und in solchen Fällen kann die Operation mit der herkömmlichen laparoskopischen Methode fortgesetzt werden. Mit anderen Worten: Die Risiken, die bei einer Operation standardmäßig auftreten können, gelten auch für die Roboterchirurgie.
Kann die robotergestützte Chirurgie bei gynäkologischen Erkrankungen bei jeder Patientin angewendet werden?
Die robotergestützte Chirurgie kann in allen Fällen durchgeführt werden, die für die konventionelle laparoskopische Chirurgie geeignet sind. Da einige Bedingungen ein Hindernis für die geschlossene Chirurgie darstellen können, ist die robotergestützte Chirurgie auch in diesen Fällen nicht geeignet. Diese Situationen:
- Der Patient leidet an einer Krankheit, die einer geschlossenen Operation entgegensteht (intrakranielle Massen, bei denen eine Erhöhung des Hirndrucks gefährlich sein kann, schwere Lungen- und Herzerkrankungen usw.).
- Beispiele können angeführt werden, wenn die zur Operation vorgesehene Erkrankung nicht für eine geschlossene Operation geeignet ist (wie Eierstockkrebs mit diffuser Erkrankung im Bauchraum, eine Masse oder ein Tumor, der eine große Fläche im Bauchraum einnimmt)
Wie viele Tage Krankenhausaufenthalt nach einer robotergestützten Operation?
Der Krankenhausaufenthalt bei der robotergestützten Chirurgie ist im Vergleich zur offenen Chirurgie deutlich kürzer. Da heute auch komplizierte Krebsoperationen mit der Roboterchirurgie durchgeführt werden können, variiert die Dauer des Krankenhausaufenthalts der Patientin je nach Krankheit, Allgemeinzustand der Patientin und dem robotergestützten Verfahren. Der Krankenhausaufenthalt beträgt in der Regel 1 Nacht bei Myomen und Hysterektomien und 2 Nächte bei Gebärmutterkrebsoperationen.
Treten nach der Operation Schmerzen auf?
Die Schmerzen nach einer robotergestützten Operation sind viel geringer als bei einer offenen Operation. Die Schmerzen treten in der Regel nur kurzzeitig an den Trokar-Eingangsstellen auf. Er kann mit nicht starken Schmerzmitteln kontrolliert werden.
Ist ein Aufenthalt auf der Intensivstation nach der Operation erforderlich?
Der Bedarf an Intensivpflege nach robotergestützten Eingriffen hängt vom Allgemeinzustand des Patienten, der Schwere der Erkrankung und dem durchgeführten Eingriff ab. Im Allgemeinen ist nach robotergestützten Eingriffen keine Intensivpflege erforderlich, es sei denn, es ist etwas anderes erforderlich.
Wie häufig wird die Roboterchirurgie bei gynäkologischen Erkrankungen eingesetzt?
Vor allem in Nordamerika wird die robotergestützte Chirurgie zunehmend bei der chirurgischen Behandlung gynäkologischer Erkrankungen eingesetzt. Etwa 30-40 % aller geschlossenen Hysterektomien werden mit der robotergestützten Methode durchgeführt. Infolge der sich in Europa rasch verbreitenden robotergestützten Chirurgiesysteme ist die laparoskopische Hysterektomie im Laufe der Jahre zurückgegangen und die robotergestützte Hysterektomie hat zugenommen.
Was sollten Patienten nach einer robotergestützten Operation beachten?
Es gibt keine besonderen Probleme, auf die die Patienten nach der Roboteroperation achten sollten. Die Patienten können einige Tage nach dem Eingriff ein Bad nehmen. Für die Nähte ist keine besondere Pflege erforderlich, und die Patienten müssen die Fäden nicht entfernen lassen, da in der Regel resorbierbare Materialien verwendet werden.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
Was ist Leep-Konisation?
Die Leep-Konisation ist ein chirurgischer Eingriff, der sowohl zur Diagnose als auch zur Behandlung in Fällen durchgeführt wird, in denen CIN 2, CIN 3 (HSIL) bei Patientinnen festgestellt wird, die sich im Rahmen von gynäkologischen Routineuntersuchungen einer Kolposkopie/Biopsie unterziehen, um Vorläuferzellen des Gebärmutterhalskrebses zu entdecken. Das Leep-Konisationsverfahren kann zur Bestätigung der Diagnose und gleichzeitig zur Behandlung eingesetzt werden. Fragen wie “Was ist eine Leep-Konisation?”, “Was ist eine Leep-Operation?”, “Was ist ein Leep-Verfahren?”, “Was ist eine Leep-Behandlung?”, “Was ist eine Leep-Operation?”, “Was bedeutet Leep?”, “Was ist eine Leep-Konisation?”, “Was ist ein Leep-Verfahren?” werden von Patienten gestellt. Das Konisationsverfahren kann auf 2 Arten angewandt werden, als Heißkonisation (LEEP) und Kaltkonisation. Die Heißkonisation (LEEP) wird in der Welt und in unserem Land am meisten bevorzugt.
Bei der heißen Konisation (LEEP) wird der Gebärmutterhals unter Narkose mit einem speziellen Instrument an der vorgesehenen Stelle durchtrennt. Bei der kalten Konisation wird der Schnitt mit einem Skalpell durchgeführt. Die kalte Konisation wird vor allem bei der Diagnose Gebärmutterhalskrebs im Frühstadium bevorzugt.
Bei welchen Krankheiten wird die Lep-Konisation angewendet?
Wird das Leep-Konisationsverfahren nur bei der Behandlung von Gebärmutterhalskrebs oder Vorläuferzellen eingesetzt? Diese Frage wird von Patientinnen gestellt. Die Leep-Konisation ist ein Verfahren, das im Allgemeinen bei gynäkologischen Schmerzen am Gebärmutterhals angewendet wird. Es kann bei Gebärmutterhalskrebs eingesetzt werden, oder wenn ein anormaler Zustand des Gebärmutterhalses vorliegt, kann es eingesetzt werden, um den Gebärmutterhals entsprechend den Beschwerden der Patientin zu verkleinern oder den erkrankten Bereich zu entfernen, um den Gebärmutterhals zu reparieren. Bei Gebärmutterhalskrebs wird jedoch in der Regel eine Leep-Konisation durchgeführt.
Warum wird eine Lep-Konisation durchgeführt?
- Die Leep-Konisation wird in der Regel sowohl zur Diagnose als auch zur Behandlung von zellulären Veränderungen des Gebärmutterhalses durchgeführt, die durch eine HPV-Infektion verursacht werden. Sie zeichnet sich als chirurgisches Verfahren insbesondere bei den Diagnosen CIN 2 und CIN 3 aus.
- Bei Patientinnen, bei denen eine Biopsie mit Verdacht auf Gebärmutterhalskrebs durchgeführt wurde, kann bei Zweifeln an der Diagnose eine Leptokonisation durchgeführt werden, um die Diagnose zu klären.
- Bei Patientinnen, die sich einer Biopsie des Gebärmutterhalses unterziehen und bei denen Gebärmutterhalskrebs diagnostiziert wird, ist eine chirurgische Konisation des Lepus nicht erforderlich. Bei Patientinnen, bei denen Gebärmutterhalskrebs im Frühstadium diagnostiziert wird, kann jedoch eine Leepkonisation in Betracht gezogen werden. Bei Patientinnen, bei denen Gebärmutterkrebs im Frühstadium diagnostiziert wurde, wird im Allgemeinen die kalte Leepkonisation bevorzugt.
- Da Leep bei Gebärmutterhalskrebs im Frühstadium eingesetzt werden kann, kann die Leep-Konisation auch in Fällen durchgeführt werden, in denen abnorme Zellen wie CIN festgestellt werden.
- Bei Patientinnen mit fortgeschrittenem Gebärmutterhalskrebs reicht es aus, eine Biopsie vorzunehmen. Die LEEP-Technik wird nicht angewendet, wenn der Einschnitt durch eine Biopsie diagnostiziert wird.
- Ob das LEEP-Verfahren durchgeführt wird oder nicht, hängt vom Ergebnis der kolposkopischen Biopsie ab. Nachdem der durch die LEEP-Prozedur ermittelte Bereich entfernt wurde, wird er in die Pathologie geschickt.
Wie wird die Leep-Konisation durchgeführt?
- Wenn bei der Biopsie des Gebärmutterhalses abnorme Zellen festgestellt werden und beschlossen wird, eine Leep-Konisation durchzuführen, wird dieser Eingriff unter Vollnarkose durchgeführt.
- Die Leep-Konisation wird auf dem gynäkologischen Untersuchungstisch durchgeführt.
- Da der Patient eine Narkose erhält, ist es gesünder, den Eingriff im Operationssaal durchzuführen.
- Die Leekonisation ist ein chirurgischer Eingriff. Nachdem die Patientin auf den gynäkologischen Tisch gelegt wurde, macht der Gynäkologe den Gebärmutterhals mit einem Vaginalspekulum sichtbar, mit dem er die Scheidenwände und die Vagina untersucht.
- Die Operationsränder werden durch Anfärben des Gebärmutterhalses mit einer speziellen Lösung bestimmt.
- Der betroffene Teil des Gebärmutterhalses wird chirurgisch entfernt. Da er in Form eines Kegels entfernt wird, nennt man das Verfahren Leep-Konisation.
- Der chirurgisch entnommene Abschnitt wird an das Pathologielabor geschickt, um auf abnorme Zellveränderungen zu prüfen.
Häufig gestellte Fragen zur Leep-Konisation
Wie hoch ist der Preis der Leep-Konisationschirurgie?
Fragen wie “Wie hoch ist der Preis für die Leep-Konisation?”, “Wie hoch ist die Gebühr für die Leep-Konisation?” werden von Patienten gestellt. Das Honorar für die Leep-Konisation kann je nach Preispolitik des Arztes und des Krankenhauses, in dem der Eingriff durchgeführt wird, sowie nach dem bei der Leep-Konisation zu verwendenden Material variieren. Die Leep-Konisation ist ein Eingriff, der von erfahrenen Gynäkologen und Geburtshelfern sicher durchgeführt wird. Bevor man eine Antwort auf die Frage erhält, wie hoch der Preis für eine Leep-Konisationschirurgie ist, muss man den Arzt auswählen, eine Voruntersuchung vor dem Eingriff durchführen und den Fahrplan für die beste Lösung des Problems festlegen.
Gibt es nach Leep Menstruationsstörungen?
Fragen wie “Wie wird die Menstruation nach der Leep-Konisation eintreten?”, “Wann und wie wird die erste Menstruation nach der Leep-Konisation eintreten?”, “Wird es nach der Leep-Konisation Menstruationsunregelmäßigkeiten geben?” gehören zu den neugierigsten Themen. Der normale Menstruationsrhythmus wird nach der Leep-Konisation nicht verändert. Im ersten Menstruationszyklus nach der Leep-Konisation kann die Blutungsmenge und -dauer jedoch etwas höher sein. Bei übermäßiger Blutung ist es notwendig, einen Arzt aufzusuchen.
Gibt es einen geeigneten Zeitpunkt für eine Leptokonisationsoperation?
- Die Leep-Konisation kann jederzeit durchgeführt werden, aber es wird empfohlen, sie unmittelbar nach dem Menstruationszyklus vorzunehmen, um sowohl dem Arzt als auch der Patientin mehr Komfort zu bieten. Die Durchführung des Eingriffs so bald wie möglich nach Ende der Menstruation bietet der Patientin einige Vorteile.
- Ein blutungsfreier Zeitraum von 20-25 Tagen nach einer Lep-Konisationschirurgie sorgt für eine bessere Gewebeheilung. Die blutungsfreie Zeit nach der Operation kann den Heilungsprozess des Gewebes beschleunigen. Wenn eine Lep-Operation kurz vor der Menstruation durchgeführt wird, kommt es zu einer stärkeren Blutung und die Heilung erfolgt später. Dadurch wird die Lebensqualität der Patientin beeinträchtigt.
- Die Durchführung einer Leepkonisation während der Menstruationsblutung kann auch ein Infektionsrisiko darstellen.
Wie lange dauert die Erholungsphase nach einer Leep-Konisation?
Die Genesung nach einer Leep-Operation dauert etwa 4-6 Wochen.
Was zeigt das Ergebnis der Pathologie der Leep-Konisation?
- Die Pathologieauswertung nach dem Leep-Konisationsverfahren wird mit den Biopsieergebnissen verglichen. Es wird geprüft, ob die Pathologie des bei der Leep-Konisation entfernten Bereichs mit den Biopsieergebnissen übereinstimmt.
- Es wird geprüft, wie tief die Läsion ist und ob der Operationsrand normal ist. Die Tiefe des Gewebes wird auf das Vorhandensein von Krebszellen geprüft.
- Es wird geprüft, ob der Operationsrand frei ist, um die Kontinuität der Läsion zu gewährleisten. Wenn der chirurgische Rand frei ist, wird eine angemessene Operation durchgeführt.
- Das Ergebnis der Leep-Konisation-Pathologie zeigt, ob die Diagnose an der richtigen Stelle steht und ob die Behandlung angemessen ist.
- Die Pathologie ist auch entscheidend für den Verlauf der Behandlung in den späteren Stadien.
Was ist nach einer Leptokonisationsoperation zu beachten?
- Der Patient kann noch am selben Tag nach der Lepraoperation aufstehen. Da die Operation unter Vollnarkose durchgeführt wird, kann der Patient nach einer Ruhezeit von 1-2 Stunden wieder am gesellschaftlichen Leben teilnehmen.
- Der intraabdominale Druck sollte für 1-2 Tage nach der Leptokonisation nicht erhöht werden. Es ist besonders wichtig, das Anspannen auf der Toilette zu vermeiden.
- Die Erholungsphase nach der Leep-Operation beträgt etwa 4-6 Wochen. Während dieses Zeitraums sollte kein Geschlechtsverkehr stattfinden.
- Es ist wichtig, auf hygienische Bedingungen zu achten, um Infektionen zu vermeiden.
- Nach einer Leptokonisation kann es zu punktuellen Blutungen kommen, die nicht auf ein Problem hindeuten. Bei bruchstückhaften oder übermäßigen Blutungen ist es jedoch notwendig, einen Arzt aufzusuchen.
- Nach einer Leep-Operation gibt es keine Einschränkungen beim Baden.
Wie viele Tage dauert die Blutung nach einer Leep-Konisation?
Fragen wie “Wie lange hält die Blutung nach der Leep-Konisation an?”, “Treten Blutungen nach der Leep-Konisation auf?”, “Wie lange hält die Blutung nach der Leep-Konisation an?” gehören zu den Fragen, die sich die Patienten stellen.
Es kann sein, dass es nach einer Leptokonisation keine Blutung gibt. Wenn es nach der Operation zu Blutungen kommt, sind diese in der Regel fleckenförmig. Punktförmige Blutungen sollten als normal angesehen werden. Diese Art von Blutung kann bis zu 15 Tage andauern.
Nach der Lep-Konisation kann es zu einem Ausfluss kommen, der durch die Ablösung von Gewebe entsteht. Wichtig ist dabei, dass der Ausfluss nicht infiziert ist. Hygienische Bedingungen sollten eingehalten werden.
Wann ist Geschlechtsverkehr nach Leep?
In der Erholungsphase nach einer Lep-Konisation sollte 4-6 Wochen lang kein Geschlechtsverkehr stattfinden. Bevor Sie mit dem Geschlechtsverkehr beginnen, sollte der Arzt dies prüfen und dann entscheiden. .
Kann es nach einer Leptokonisationsoperation zu einer Schwangerschaft kommen?
Fragen wie “Gibt es eine Schwangerschaft nach der Leep-Operation?”, “Gibt es eine Schwangerschaft nach der Leep-Operation?”, “Schwangerschaft nach der Leep-Konisation”, gehören zu den neugierigsten Themen. Die Leep-Konisation wird nicht bei einer schwangeren Frau durchgeführt. Nach einer Leep-Konisation gibt es keine Probleme mit einer Schwangerschaft. Obwohl es keine Bedingung gibt, die eine Schwangerschaft verhindert, besteht ein Risiko für eine Frühgeburt bei Frauen, die sich einer Leep-Konisation unterziehen. Obwohl dieses Risiko nach der Leep-Operation gering ist, kann es aufgrund der Verkürzung des Gebärmutterhalses zu einer Frühgeburt kommen.
Gibt es ein Rezidiv nach einer Leprakonisation?
Die Frage, ob die Leep-Konisation ein zweites Mal durchgeführt werden kann, wird von Patienten gestellt. Die Leep-Konisation kann bei Bedarf mehr als einmal durchgeführt werden.
Eine HPV-Infektion kann den Gebärmutterhals angreifen und zur Bildung von abnormen Zellen führen. In solchen Fällen kann die Konisation des Gebärmutterhalses ein zweites oder sogar ein drittes Mal durchgeführt werden, falls erforderlich. Menschen mit einer HPV-Infektion und Raucherinnen sind in der Regel die Gruppe, die einen zweiten Eingriff benötigt. Rauchen ist der wichtigste Risikofaktor für das Wiederauftreten einer HPV-Infektion. In neueren wissenschaftlichen Studien wurde festgestellt, dass die Möglichkeit einer vollständigen Beseitigung der HPV-Infektion aus dem Körper sehr gering ist. In Fällen, in denen das Immunsystem geschwächt ist, tritt die HPV-Infektion erneut auf. Rauchen ist einer der wichtigsten Faktoren, die das Immunsystem schwächen. Wenn im sozialen Leben einer Person geraucht wird, ist es möglich, dass die abnormen Zellen, die durch die HPV-Infektion entstanden sind, wieder auftauchen.
Nach der Leptokonisation wird die erste Kontrolle nach 6 Monaten durchgeführt.
Ist die Lep-Konisation schmerzhaft?
Die Leep-Konisation ist kein schmerzhafter Eingriff. Da der Eingriff unter Narkose durchgeführt wird, spürt der Betroffene keine Schmerzen. Nach dem Eingriff kann der Patient leichte Schmerzen verspüren. Die Schmerzen können jedoch mit einfachen Schmerzmitteln unter Kontrolle gebracht werden. Das soziale Leben des Patienten wird durch die Schmerzen nicht beeinträchtigt. Bei der Lep-Konisation werden in der Regel keine Nähte gesetzt. Bei der kalten Leepkonisation können jedoch Nähte verwendet werden. Dies liegt ganz im Ermessen des Chirurgen.
Welche Komplikationen gibt es nach einer Leep-Konisation?
Die wichtigste Komplikation nach einer Leep-Operation sind Blutungen. Übermäßige Blutungen sollten eher in Betracht gezogen werden als punktförmige Blutungen. Langfristig kann es zu einer Zervixinsuffizienz in der Schwangerschaft kommen.
Gibt es einen stinkenden Ausfluss nach der Leckkonisation?
Geruchsbehafteter Ausfluss nach einer Leptokonisation deutet auf die Möglichkeit einer Infektion hin. Aber auch wenn es nach der Operation nicht riecht, kann es zu Ausfluss aufgrund von Gewebeablösungen kommen. Bei geruchsintensivem Ausfluss ist es notwendig, einen Arzt aufzusuchen.
Wie lange dauert das Verfahren der Lep-Konisation?
Die Leep-Konisation ist ein chirurgischer Eingriff, der 15-20 Minuten dauert.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
Pädiatrische Onkologie

Krebs ist die zweithäufigste Todesursache bei Kindern, und jedes Jahr wird in unserem Land bei etwa 3 000 Kindern Krebs diagnostiziert. Eines von zwei Kindern, bei denen Krebs diagnostiziert wird, stirbt aufgrund einer unzureichenden Behandlung oder einer verspäteten Diagnose. Dank frühzeitiger Diagnose und korrekter Behandlungsmethoden kann die Mehrheit der krebskranken Kinder vollständig genesen.
Der wichtigste Weg zum Erfolg bei Krebserkrankungen im Kindesalter ist die Behandlung dieser Patienten in vollwertigen Zentren mit entsprechender Infrastruktur und Servicequalität. Die pädiatrischen Onkologiezentren von Memorial dienen dazu, krebskranken Kindern Diagnose- und Behandlungsmöglichkeiten auf hohem Niveau zu bieten. Bei der Diagnose und Behandlung aller Krebserkrankungen im Kindesalter arbeiten Kinderonkologen, Kinderchirurgen, Orthopäden, Neurochirurgen, Augenärzte, Hals-Nasen-Ohren-Abteilungen und insbesondere auf Tumore und Tumorchirurgie spezialisierte Ärzte zusammen.
MULTIDISZIPLINÄRER ANSATZ BEI DER BEHANDLUNG ALLER KREBSERKRANKUNGEN IM KINDESALTER
Die häufigsten Krebsarten bei Kindern sind Leukämie, Hirntumore, Lymphome, Nieren- und Nebennierentumore, Weichteil- und Knochentumore, einige Organtumore und Retinoblastome (Augentumore). Während Leukämien stärker im Bewusstsein der Öffentlichkeit verankert sind, ist das Bewusstsein für solide Tumore und Lymphome, die 75 % aller Tumore im Kindesalter ausmachen, geringer. Krebserkrankungen im Kindesalter sind oft schwieriger zu behandeln, und eine frühzeitige Diagnose ist entscheidend. In den pädiatrischen Onkologiezentren in unserem Land wird dieser schwierige Prozess dank der Zusammenarbeit vieler Fachrichtungen sehr erfolgreich im Team durchgeführt.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
Was ist onkologische Chirurgie (Krebschirurgie)?
Die onkologische (Krebs-)Chirurgie ist die Entfernung von krebsartigen Tumoren oder Geweben aus dem Körper und die Reinigung des Gebiets vom Krebs. Die onkologische Chirurgie, die auf eine 100-jährige Geschichte zurückblicken kann, wurde seit ihren Anfängen klassisch offen durchgeführt. Heute werden verschiedene Techniken angewandt, die darauf abzielen, kleinere Einschnitte im Körper vorzunehmen, um sowohl das kosmetische Erscheinungsbild zu verbessern als auch die Heilungszeit zu verkürzen. Die minimal-invasive Chirurgie, die so genannte “kleine Inzision”, die laparoskopische Chirurgie, die durch ein oder mehrere Löcher geschlossen durchgeführt wird, und die Operationen der neuen Generation, die mit Robotersystemen durchgeführt werden, sind technologisch am weitesten fortgeschritten und stellen den Komfort und die Wiederherstellung der Gesundheit des Patienten in den Vordergrund.
Was sind die Ziele der onkologischen Chirurgie?
Das Ziel der onkologischen (Krebs-)Chirurgie, die den Patienten dank der großen Fortschritte in den letzten 20 Jahren Privilegien, Komfort und eine schnelle Rückkehr in den Alltag bietet, ist die vollständige Entfernung des Tumors aus dem Körper. Hier ist ein gutes Timing und eine sehr gute Organisation mit anderen Fachbereichen erforderlich. Die Operation ist eine der kritischsten Phasen des Behandlungsprozesses. Um ein erfolgreiches Behandlungsergebnis zu erzielen, darf die Krankheit am Ort des Tumors nicht wieder auftreten und es dürfen keine Fernmetastasen vorhanden sein, d. h. die Krankheit muss vollständig beseitigt werden. Das genaue Äquivalent dazu ist die kurative Behandlung. Dies ist das primäre und unverzichtbare Ziel der Krebschirurgie. Unter den personalisierten Behandlungsmöglichkeiten in der Krebschirurgie werden offene, laparoskopische (geschlossene) oder robotergestützte Methoden bevorzugt. Bei einer erfolgreichen Krebschirurgie geht es darum, die Krebszellen so genau wie möglich zu entfernen, dem Patienten weniger Schmerzen zu bereiten, alle Funktionen zu erhalten und ihn in kurzer Zeit zu erholen.
Bei welchen Krebsarten ist die chirurgische Onkologie wirksam? Was sind die behandelten Krankheiten?
Die chirurgische Onkologie oder Krebschirurgie wird in den Bereichen allgemeine Chirurgie, endokrine Chirurgie, Thoraxchirurgie, gynäkologische Onkologie, Urologie, Gehirn- und Nervenchirurgie, Kopf- und Halschirurgie, orthopädische Onkologie, Brust- und onkoplastische Chirurgie durchgeführt.
Allgemeine Chirurgie
Behandelt werden Brust- und Schilddrüsenkrebs, Lebertumore, Gallenblasen- und Gallenwegskrebs, Bauchspeicheldrüsen- und Haupttumore, Magen-, Dickdarm- und Mastdarmkrebs sowie Speiseröhrentumore.
Thoraxchirurgie
Es werden palliative Verfahren bei Lungen- und Pleurakrebs, Tumoren der Brustwand, Tumoren der Atemwege und des Mediastinums, Krebserkrankungen der Lunge und anderer Organe im fortgeschrittenen Stadium, interventionelle Verfahren und Stentanwendungen bei Lungen- und Atemwegstumoren durchgeführt.
Gynäkologische Onkologie
Operationen werden bei Krebserkrankungen der Gebärmutter, des Gebärmutterhalses, des Eierstocks, der Eierstöcke, der Eileiter, der Vulva und des Samenstrangs durchgeführt, die auch als weibliche Krebserkrankungen bezeichnet werden.
Urologie
Laparoskopische und robotergestützte Chirurgie des Prostatakrebses mit nervenschonenden Methoden, Blasentumorchirurgie und geschlossene chirurgische Anwendungen neuer Blasenrekonstruktionen, Nierentumorchirurgie und nierenschonende Methoden, Chirurgie von Nebennierentumoren und Hodentumoren werden durchgeführt.
Gehirnchirurgie
Chirurgische Eingriffe werden mit mikrochirurgischen und endoskopischen Techniken bei kindlichen Gehirn- und Nerventumoren, Hypophysentumoren und Tumoren der Schädelbasis durchgeführt. Bei der Operation von Tumoren, die sich im sensiblen Bereich des Gehirns befinden, wird die Neuromonitoring-Technologie eingesetzt, um dem Risiko von Lähmungen, die nach der Operation auftreten können, entgegenzuwirken.
Kopf- und Halschirurgie
Chirurgische Behandlung von Tumoren des Kehlkopfs, des Rachens, der Nasennebenhöhlen und der Nasenhöhle, von Mandel- und Speicheldrüsenkrebs sowie von Tumoren der Mundhöhle, des Mundbodens, der Zunge, des oberen Teils des Rachens, des Bereichs, der den Rest mit dem Rachen verbindet, des unteren Teils des Rachens und des Bereichs darunter, der Ohrmuschel und des äußeren Gehörgangs.
Abteilung für orthopädische Onkologie
Es werden Tumore, die vom Knochen selbst ausgehen, Knochenmetastasen anderer Organtumore, bösartige Tumore der Gewebe des Skelettsystems, Weichteiltumore einschließlich Muskeln, Fettgewebe, Bindegewebe, Gefäße und Nerven sowie alle Tumoroperationen des Skelettsystems im Kindes- und Erwachsenenalter durchgeführt.
Brust- und onkoplastische Chirurgie
Spezielle Operationen, die onkologische und ästhetische Chirurgie kombinieren, werden angewandt, um den Brustverlust von Brustkrebspatientinnen nicht nur aufgrund der Krebsdiagnose, sondern auch nach Brustoperationen zu beseitigen. Durch die Kombination der Prinzipien der onkologischen und plastischen Chirurgie werden komfortable Optionen für Patientinnen angeboten, die zuvor einen Brustverlust aufgrund von Krebs erlitten haben.
In welchen Fällen kann eine Krebsoperation nicht durchgeführt werden?
Die chirurgische Behandlung von Krebs ist nicht mehr nur eine einzige Behandlungsmethode, sondern hat sich zu einem der wichtigsten Bestandteile eines organisierten Behandlungsprozesses entwickelt. Durch den Einfluss der Technologie auf die Krebschirurgie ist Krebs zu einer Krankheit geworden, die von allen Chirurgen in diesem Bereich aktiver bekämpft werden kann. Dank der Operationen, die zum Wohle des Arztes und des Patienten auf die Tagesordnung gekommen sind, ist die Zahl der nicht durchführbaren Operationen allmählich zurückgegangen, und die Eingriffe an Organen mit Immunität sind relativ einfach geworden. In der Chirurgie des Bauchspeicheldrüsenkrebses, die das beste Beispiel dafür ist, können Patienten zusätzlich zu den künstlichen Gefäßoperationen, die durchgeführt werden, um zu verhindern, dass der Tumor die nahe gelegenen Gefäße befällt, mit sehr wirksamen Medikamenten in der Onkologie operiert werden, indem der Tumor in Fällen von Bauchspeicheldrüsenkrebs oder Metastasen in der Leber, die als inoperabel gelten, zunächst verkleinert wird. Die Krebschirurgie ist eine Form der Behandlung, die die Lebensqualität und -dauer so verlängert, wie sie sein sollte.
Trotz all dieser Entwicklungen sind jedoch nicht alle Krebsarten operabel. Bei soliden Organtumoren ist eine Operation eine Option, und bei Blutkrebs werden nichtoperative Behandlungsmethoden eingesetzt. Aber auch hier muss der Tumor bestimmte Merkmale aufweisen, um operativ entfernt werden zu können. In Fällen, in denen der Tumor zu groß ist, um chirurgisch entfernt zu werden, und Fernmetastasen den allgemeinen Gesundheitszustand des Patienten beeinträchtigen, kann eine Operation für Patientengruppen, die aufgrund ihres fortgeschrittenen Alters die Komplikationen einer Operation nicht verkraften können, nicht in Frage kommen. In solchen Fällen können nicht-chirurgische Behandlungen bevorzugt werden, um den Tumor zu verkleinern und operabel zu machen, sowie unterstützende Behandlungen für die Operation, um das Risiko von nach der Operation verbleibenden Krebszellen auszuschließen. Wird Magenkrebs in einem frühen Stadium erkannt, können fast alle Patienten durch eine Operation von der Krankheit geheilt werden. Für Menschen mit fortgeschrittenem Bauchspeicheldrüsenkrebs und einigen chronischen Krankheiten kommen jedoch verschiedene Behandlungsalternativen in Frage. Um die richtige Behandlungsmethode anzuwenden, ist es daher wichtig, den Patienten richtig auszuwählen und die Reihenfolge der Anwendung der Behandlung festzulegen. Das richtige Management der Behandlung von Patienten, bei denen Krebs unter dem Dach eines Krebszentrums diagnostiziert wurde, wird sich positiv auf die Behandlungsergebnisse auswirken.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST MUNDKREBS?
Unter Mundhöhlenkrebs versteht man das Wachstum abnormaler Zellen in der Mundhöhle oder an den Lippen. Da es für den Behandlungserfolg äußerst wichtig ist, Mundhöhlenkrebs so früh wie möglich zu erkennen, steht die Chirurgie bei der Behandlung von Tumoren in dieser Region an erster Stelle. Die Operation sollte so weit wie möglich und sicher durchgeführt werden, wobei ein chirurgischer Rand verbleiben sollte und der bei der Operation entfernte Bereich durch die Pathologie bestätigt werden muss (eingefroren). In einigen Fällen kann zusätzlich zur Operation auch eine Chemotherapie durchgeführt werden. Bei der Behandlung eines Krebses im Mund ist eine Halsdissektion (mit Ausnahme des harten Gaumens) unbedingt erforderlich.
WAS SIND DIE RISIKOFAKTOREN FÜR MUNDKREBS?
Das Risiko, an Mundkrebs zu erkranken, steigt bei Langzeit- und Intensivkonsumenten von Tabak und Tabakerzeugnissen. Tatsächlich hat man festgestellt, dass etwa 75 Prozent der Menschen mit Mundkrebs Tabak konsumieren. Mit zunehmender Menge und Dauer des Tabakkonsums steigt auch das Risiko für Mundkrebs. Übermäßiger Alkoholkonsum, zu viel Sonneneinstrahlung, ein Alter von über 40 Jahren und Fettleibigkeit erhöhen ebenfalls das Risiko für Mundkrebs. Menschen mit einer Vorgeschichte von Kopf- und Halskrebs haben ein erhöhtes Risiko, an Mundkrebs zu erkranken, insbesondere wenn sie weiterhin rauchen und Alkohol trinken. Darüber hinaus gehören HPV-Infektionen, ultraviolette Strahlen, Unterernährung, ein geschwächtes Immunsystem, bestimmte Gesundheitsprobleme wie die Graft-versus-Host-Krankheit oder die Fanconi-Anämie sowie schlechte Mundhygiene zu den Faktoren, die das Risiko für Mundkrebs erhöhen.
Hinweis: Menschen mit Mundhöhlenkrebs haben ein höheres Risiko, an Kehlkopfkrebs, Speiseröhrenkrebs oder Lungenkrebs zu erkranken.
WELCHE ARTEN VON MUNDKREBS GIBT ES?
Mundkrebs wird nach dem Zelltyp eingeteilt, in dem der Krebs (Karzinom) zu wachsen beginnt. Das Plattenepithelkarzinom ist mit 9 von 10 Fällen die häufigste Form von Mundkrebs.
Zu den weniger häufigen Arten von Mundkrebs gehören:
- Adenokarzinom, d.h. Krebs, der sich in den Speicheldrüsen entwickelt
- Sarkome, die aus Anomalien in Knochen, Knorpel, Muskeln oder anderen Geweben entstehen
- Orales malignes Melanom, bei dem der Krebs in den Zellen entsteht, die das Hautpigment oder die Farbe produzieren (Melanozyten). Diese erscheinen als sehr dunkle, gesprenkelte Beulen, die oft bluten.
- Lymphom, das sich aus Zellen entwickelt, die normalerweise in den Lymphknoten zu finden sind (sie können auch im Mund wachsen).
Andererseits ist Mundhöhlenkrebs eine Krebsart, die unter den Begriff “Kopf-Hals-Tumoren” fällt. Andere Arten von Krebserkrankungen im Kopf- und Halsbereich sind
- Krebs des Kehlkopfes
- Nasopharynxkrebs (der Bereich hinter der Nase (Rachen), der den oberen Teil des Rachens bildet)
- Oropharyngealer Krebs
- Hypopharynxkarzinom
- Schilddrüsenkrebs
- Nasen- und Nasennebenhöhlentumore
- Speiseröhrenkrebs
WAS SIND DIE SYMPTOME VON MUNDKREBS?
Wenn eines der Symptome von Mundkrebs länger als 2 Wochen anhält, ist es wichtig, sofort einen Arzt aufzusuchen. Die Symptome von Mundkrebs können wie folgt aufgelistet werden:
- Nicht heilendes Mund-/Lippengeschwür
- Klumpen oder Schwellung im Mund
- Weiße oder rote Flecken im Mund
- Ein Bereich im Mund, der sich verfärbt und so bleibt
- Klumpen oder Verdickungen an den Wangen
- Halsschmerzen, die seit langem nicht abgeklungen sind
- Heiserkeit der Stimme
- Schlechter Atem
- Probleme beim Kauen oder Schlucken
- Unfähigkeit, den Kiefer und die Zunge zu bewegen
- Taubheit der Zunge oder eines Teils der Mundhöhle
- Schmerzen um die Zähne und im Kiefer
- Ungeklärter Gewichtsverlust
- Ständiges Gefühl, dass etwas im Hals stecken bleibt
WIE WIRD MUNDKREBS DIAGNOSTIZIERT?
Der Diagnoseprozess bei Mundkrebs beginnt mit einer körperlichen Untersuchung. Ob mit oder ohne Symptome, der Zahnarzt wird bei einer Routineuntersuchung eine abnorme Gewebeveränderung im Mund feststellen und möglicherweise einen Knoten oder eine Masse ertasten.
Eine direkte Untersuchung der Läsion oder eine kleine Biopsie kann die Diagnose bestätigen. Sobald die Diagnose gestellt ist, wird der Arzt verschiedene Tests durchführen, um festzustellen, ob sich der Krebs über die Mundhöhle hinaus ausgebreitet hat und wie groß er ist. Zu den durchzuführenden Tests können gehören:
- MRT-Untersuchung von Kopf und Hals
- CT-Untersuchung der Brust, um nach Krebs in den Lymphknoten zu suchen
- Positronen-Emissions-Tomographie (PET), um nach Krebs in anderen Teilen des Körpers zu suchen
- Der Arzt kann auch den Kehlkopf, die Speiseröhre und die Lunge betrachten, indem er einen Schlauch mit einer kleinen Kamera am Ende in den Rachen schiebt.
WIE WIRD MUNDKREBS BEHANDELT?
Die Behandlungsmethoden bei Mundhöhlenkrebs können je nach dem allgemeinen Gesundheitszustand des Patienten, der Lokalisation und dem Stadium des Krebses variieren. Bei der Operation, der häufigsten Behandlung von Mundhöhlenkrebs, werden der Tumor und ein Teil des umliegenden gesunden Gewebes entfernt. In Fällen, in denen sich Krebszellen auf die Lymphknoten ausgebreitet haben, entfernt der Chirurg diese, um eine Ausbreitung des Krebses auf andere Körperteile zu verhindern. Eine der aufregendsten neuen Entwicklungen in der Behandlung von Mundhöhlenkrebs ist der weit verbreitete Einsatz der Roboterchirurgie.
Die Strahlentherapie ist die Hauptbehandlung für einige kleine Tumore. Bei der Strahlentherapie werden hochenergetische Röntgenstrahlen eingesetzt, um Krebszellen abzutöten. In einigen Fällen werden operierte Patienten bestrahlt, um Krebszellen zu entfernen, die nach der Operation im mikroskopischen Bereich im Körper verblieben sind. Auch wenn die Strahlentherapie den Krebs nicht heilen kann, kann sie Symptome wie Blutungen und Schluckbeschwerden lindern.
Falls erforderlich, können die Ärzte vor einem chirurgischen Eingriff eine Chemotherapie zur Tumorverkleinerung durchführen. Wenn der Tumor zu groß für eine Operation ist, können Chemo- und Strahlentherapie die durch den Krebs verursachten Symptome lindern.
Wenn der Krebs in einem früheren Stadium (Stadium I und II) diagnostiziert wird, sind die Heilungschancen wesentlich besser. Das liegt daran, dass die Tumore in diesen Stadien an der breitesten Stelle kleiner als 4 Zentimeter sind und noch nicht auf die Lymphknoten übergegriffen haben. Krebspatienten in diesen Stadien können mit einer Operation und Strahlentherapie behandelt werden. Tumore im Stadium III und IV sind weiter fortgeschritten. In diesen Stadien werden die Tumore mit Strahlen- oder Chemotherapie oder beidem sowie mit größeren chirurgischen Eingriffen behandelt. Auch eine gezielte medikamentöse Therapie kann allein oder in Kombination mit Chemo- und Strahlentherapie eingesetzt werden.
Bei der Immuntherapie werden Medikamente eingesetzt, die das Immunsystem bei der Krebsbekämpfung unterstützen. Die Immuntherapie kann bei Menschen mit fortgeschrittenem Mundhöhlenkrebs eingesetzt werden, der auf Standardbehandlungen nicht anspricht.
HÄUFIG GESTELLTE FRAGEN ZU MUNDKREBS
Wie lässt sich das Risiko von Mundkrebs verringern?
Obwohl es keine nachgewiesene Methode zur Vorbeugung von Mundkrebs gibt, kann das Risiko, an Mundkrebs zu erkranken, durch Beachtung der folgenden Empfehlungen verringert werden.
Der Tabakkonsum sollte eingestellt oder nicht aufgenommen werden: Tabakkonsum erhöht das Risiko von Mundkrebs. Durch Rauchen und Kautabak werden die Zellen im Mund gefährlichen Chemikalien ausgesetzt, die Krebs verursachen können.
Alkohol sollte nur in Maßen konsumiert werden: Übermäßiger Alkoholkonsum kann die Zellen im Mund reizen und sie anfällig für Mundkrebs machen. Tatsächlich sollte übermäßiger Alkoholkonsum vermieden werden.
Übermäßige Sonneneinstrahlung sollte vermieden werden: Halten Sie sich so oft wie möglich im Schatten auf und verwenden Sie Sonnenschutzcreme als Basisschicht, um die Lippen vor den schädlichen Sonnenstrahlen zu schützen. Tragen Sie einen breitkrempigen Hut, der das gesamte Gesicht, einschließlich des Mundes, abschirmt.
Darüber hinaus kann eine ausgewogene, gesunde Ernährung mit einer Vielzahl von Obst und Gemüse das Risiko von Mundkrebs verringern.
Was ist eine unterstützende Behandlung bei Mundkrebs?
Die unterstützende Pflege hilft dabei, die körperlichen, praktischen, emotionalen und spirituellen Herausforderungen von Mundhöhlenkrebs zu bewältigen. Es gibt zahlreiche Programme und Dienste, die die Bedürfnisse von Menschen mit Krebs und ihren Angehörigen erfüllen und ihre Lebensqualität verbessern, insbesondere nach der Behandlung.
Die Genesung von Mundhöhlenkrebs und die Anpassung an das Leben nach der Behandlung ist bei jedem Menschen anders, je nach Lage des Tumors, dem Stadium des Krebses, den bei der Operation entfernten Organen und Geweben, der Art der Behandlung und vielen anderen Faktoren. Selbst wenn die Behandlung abgeschlossen ist, können noch Probleme auftreten, z. B. bei der Bewältigung von Langzeitnebenwirkungen. Eine Person, die sich einer Behandlung gegen Mundhöhlenkrebs unterzieht, kann die folgenden Sorgen haben.
Selbstwertgefühl und Körperbild
Wie eine Person sich selbst sieht, wird als Selbstvertrauen definiert. Das Körperbild gibt an, wie eine Person ihren eigenen Körper sieht. Mundkrebs und seine Behandlungen können das Selbstwertgefühl und das Körperbild einer Person beeinträchtigen. Dies ist häufig auf die folgenden Faktoren zurückzuführen:
- Narben
- Hautveränderungen
- Veränderungen der Gesichtsform
- Eine Prothese benutzen zu müssen
- Schwierigkeiten beim Sprechen oder Essen
- Gewichtsverlust
Einige dieser Veränderungen können vorübergehend sein, während andere lange andauern oder dauerhaft werden können.
Manche Menschen meiden soziale Kontakte, auch wenn die Auswirkungen der Behandlung außerhalb des Körpers nicht sichtbar sind. Dies liegt daran, dass sie befürchten, von anderen beurteilt zu werden, und dass sie Angst haben, einen emotionalen Ausbruch zu erleben.
Diejenigen, deren Aussehen nach einer Mundkrebsoperation beeinträchtigt ist, müssen sich Zeit lassen. Gespräche mit jemandem, der ähnliche Erfahrungen gemacht hat, familiäre Unterstützung und geselliges Beisammensein mit Freunden können helfen. Es gibt auch Hilfsmittel, die bei Gesichtsveränderungen helfen können, z. B. Camouflage-Make-up für Narben oder das Tragen von Schals und Hüten.
Trockener Mund
Viele Menschen leiden während und nach der Behandlung von Mundkrebs unter Mundtrockenheit. Eine Strahlentherapie oder ein chirurgischer Eingriff, der die Speicheldrüsen schädigt, kann Mundtrockenheit verursachen. Eine Chemotherapie, die in Kombination mit einer Strahlentherapie verabreicht wird, kann die Beschwerden der Mundtrockenheit oft noch verstärken. Die intensitätsmodulierte Strahlentherapie (IMRT) kann diese Komplikation bei vielen Patienten verringern.
Schwierigkeiten beim Kauen und Schlucken
Oralchirurgische Eingriffe, insbesondere wenn bestimmte Strukturen wie Zunge und Kieferknochen entfernt wurden, können zu Kau- und Schluckbeschwerden führen. In einigen Fällen kann eine Rekonstruktion oder ein Zahnersatz notwendig sein, um eine Struktur im Mund zu ersetzen. Zu den Möglichkeiten, das Schlucken zu verbessern, gehören eine Änderung der Kopfhaltung und Bewegungsübungen für Kiefer und Zunge. Mit einem sogenannten Glossektomielöffel kann eine Person, die nur einen Teil ihrer Zunge hat, weiche Nahrung in den hinteren Teil ihres Mundes geben. Auch dies hilft beim Schlucken.
Sprachliche Probleme
Operationen, bei denen große Teile der Zunge, der Kieferknochen oder des Gaumens entfernt werden, können Sprachprobleme verursachen. Eine Rekonstruktion hilft, diese Komplikationen zu verringern, aber es ist oft schwierig, die normale Funktion wiederherzustellen. Orale Prothesen können den Gewebeverlust während der Operation ausgleichen und die Sprache verbessern.
Ein Logopäde kann Sprachprobleme beurteilen und bei deren Bewältigung helfen.
Geschmacksveränderungen
Eine Strahlentherapie des Kopfes, des Halses oder des Mundes kann die Speicheldrüsen und die Geschmacksknospen auf der Zunge schädigen, was den Geschmack einiger Lebensmittel beeinträchtigen kann. Auch Chemotherapeutika können die Geschmackszellen im Mund beeinträchtigen. Operative Eingriffe, bei denen ein Teil oder die gesamte Zunge entfernt wird, können zu einem verminderten oder verlorenen Geschmacksempfinden führen.
Probleme mit den Zähnen
Eine Strahlentherapie kann Zahnprobleme verursachen. Speichel trägt zur Reinigung der Zähne und des Zahnfleisches bei. Wenn also weniger Speichel abgesondert wird, besteht ein höheres Risiko für die Entstehung von Karies und Zahnfleischerkrankungen. Eine Strahlentherapie kann auch den Zahnschmelz angreifen. Dadurch erhöht sich das Risiko von Karies.
Vor Beginn der Behandlung können Sie eine Kontrolluntersuchung beim Zahnarzt durchführen lassen. Eine gute Mundpflege ist sehr wichtig, um Probleme zu vermeiden. Zur Vorbeugung von Karies können Fluoridbehandlungen durchgeführt werden. Nach der Behandlung sollte der Zahnarzt regelmäßig kontrolliert werden.
Ernährungsprobleme
Schwierigkeiten beim Kauen und Schlucken sowie Appetitlosigkeit können zu Unterernährung und Gewichtsverlust führen. Es können Maßnahmen ergriffen werden, um den Appetit zu steigern und den Betroffenen zu helfen, mehr zu essen und weiterhin gut zu essen. Möglicherweise werden Nahrungsergänzungsmittel empfohlen. Ein eingetragener Diätassistent kann den Betroffenen oft helfen, ihre Ernährung und Magersucht in den Griff zu bekommen.
Verminderte Schilddrüsenfunktion (Hypothyreose)
Zwischen 30 und 40 Prozent der Menschen, die wegen Kopf- und Halskrebs, einschließlich Mundhöhlenkrebs, bestrahlt werden, entwickeln eine Schilddrüsenunterfunktion (Hypothyreose). Zu den Symptomen einer Hypothyreose gehören extreme Müdigkeit, trockene Haut und Haare, Haarausfall, Gewichtszunahme und Kälteunverträglichkeit.
Menschen mit Hypothyreose müssen nach einer oralen Krebsbehandlung möglicherweise täglich Medikamente einnehmen.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST NIERENKREBS?
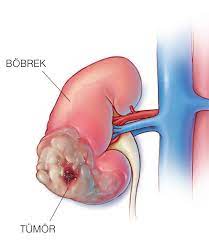
Nierenkrebs ist eine Krankheit, bei der Nierenzellen bösartig (krebsartig) werden und unkontrolliert wachsen und einen Tumor bilden. Mit anderen Worten: Nierenkrebs wird durch abnormales Wachstum von Zellen in den Nieren verursacht. Fast alle Nierenkrebse entstehen zunächst in der Auskleidung der kleinen Röhren (Tubuli) in der Niere. Diese Art von Nierenkrebs wird als Nierenzellkarzinom bezeichnet.
Nierenzellkarzinome (RCCs) machen etwa 90 Prozent der Nierenkrebsfälle aus. Andere Arten von Nierenkrebs sind:
- Übergangszellkarzinom oder Nierenbeckenkrebs, der an der inneren Oberfläche des Nierenbeckens beginnt
- Wilms-Tumor (Nephroblastom), die häufigste Krebserkrankung bei Kindern unter 14 Jahren
- Das seltene Nierensarkom entwickelt sich in den Weichteilen der Niere.
WAS SIND GUTARTIGE NIERENTUMORE (NICHT KREBSARTIGE LÄSIONEN IN DER NIERE)?
Gutartige Nierentumore können mit vielen der gleichen Verfahren wie Nierenkrebs behandelt werden, z. B. durch Operation oder Radiofrequenzablation. Die Wahl der Behandlung hängt von vielen Faktoren ab, unter anderem von der Größe des Tumors und davon, ob er Symptome verursacht, von der Anzahl der Tumore, davon, ob sich die Tumore in beiden Nieren befinden, und vom allgemeinen Gesundheitszustand der Person.
Angiomyolipom
Angiomyolipome sind der häufigste gutartige Nierentumor. Sie sind häufiger bei Frauen anzutreffen. Sie können bei Menschen mit tuberöser Sklerose, einer genetischen Erkrankung, auftreten.
Diese Tumore bestehen aus verschiedenen Arten von Bindegewebe (Blutgefäße, glatte Muskeln und Fett). Wenn sie keine Symptome verursachen, können sie normalerweise engmaschig überwacht werden. Wenn sie Probleme verursachen (z. B. Schmerzen oder Blutungen…), müssen sie möglicherweise behandelt werden.
Onkozytom
Onkozytome sind gutartige Nierentumore, die nicht häufig vorkommen und manchmal recht groß werden können. Sie treten häufiger bei Männern auf und streuen nicht in andere Organe.
WAS SIND DIE URSACHEN VON NIERENKREBS?
Nierenkrebs macht etwa 2,5 Prozent aller Krebserkrankungen aus. Nierenkrebs ist bei Männern doppelt so häufig wie bei Frauen. Das Risiko, an Nierenkrebs zu erkranken, nimmt mit dem Alter zu. Tatsächlich treten die meisten Fälle von Nierenkrebs bei Menschen über 50 Jahren auf. Obwohl die Ursache von Nierenkrebs nicht genau bekannt ist, können die unten aufgeführten Faktoren das Risiko für die Entstehung von Nierenkrebs erhöhen.
Rauchen: Das Risiko, an Nierenkrebs zu erkranken, ist bei Rauchern fast doppelt so hoch wie bei Nichtrauchern. Man geht davon aus, dass etwa 1 von 3 aller Nierenkrebsarten mit dem Rauchen zusammenhängt
Fettleibigkeit Fettleibigkeit kann Veränderungen bestimmter Hormone verursachen, die zu Nierenkrebs führen können.
Hoher Blutdruck Hoher Blutdruck kann das Risiko für Nierenkrebs erhöhen.
Nierenversagen: Menschen mit Nierenversagen haben ein höheres Risiko, an Nierenkrebs zu erkranken.
Krebs in der Familie: Menschen, in deren Familie ein Elternteil, ein Bruder oder eine Schwester (Verwandte ersten Grades) an Nierenkrebs erkrankt ist, haben ein hohes Risiko.
Vererbte Erkrankungen: Etwa 2 bis 3 Prozent der Nierenkrebserkrankungen treten bei Menschen mit bestimmten erblichen Syndromen auf, darunter die von-Hippel-Lindau-Krankheit, das hereditäre papilläre Nierenzellkarzinom, das Birt-Hogg-Dubé-Syndrom und das Lynch-Syndrom.
Strahlenbelastung: Das Risiko, an Nierenkrebs zu erkranken, kann bei Personen erhöht sein, die sich zuvor einer Strahlentherapie zu therapeutischen Zwecken unterzogen haben oder aus anderen Gründen über einen längeren Zeitraum einer Strahlung ausgesetzt waren.
Exposition gegenüber toxischen Stoffen bei der Arbeit: Das Risiko, an Nierenkrebs zu erkranken, kann bei regelmäßiger Exposition gegenüber Chemikalien wie bestimmten Metallentfettungsmitteln, Arsen oder Kadmium, die im Bergbau, in der Landwirtschaft, beim Schweißen und Lackieren verwendet werden, höher sein.
WAS SIND DIE SYMPTOME VON NIERENKREBS?
In seinen frühen Stadien verursacht Nierenkrebs in der Regel keine offensichtlichen oder störenden Symptome. Kleine Tumore im Frühstadium werden in der Regel zufällig entdeckt, vor allem bei einer Ultraschalluntersuchung des Abdomens oder einer Tomographie, die wegen einer anderen Krankheit durchgeführt wird.
Wenn der Nierentumor wächst, können die unten aufgeführten Symptome auftreten:
- In einigen Fällen kann sich Blut im Urin befinden. In anderen Fällen werden Blutspuren bei der Urinanalyse nachgewiesen, einer Laboruntersuchung, die in der Regel im Rahmen einer regelmäßigen ärztlichen Untersuchung durchgeführt wird
- Ein Klumpen oder eine Masse in der Nierengegend
- Nicht sehr starke, anhaltende Schmerzen, insbesondere in der Lendengegend
Weniger häufige Symptome von Nierenkrebs können sein
- Ermüdung
- Appetitlosigkeit
- Gewichtsverlust
- Hohes Fieber
Hoher Blutdruck oder eine abnorm niedrige Anzahl roter Blutkörperchen (Anämie) können ebenfalls auf einen Nierentumor hinweisen. Diese Symptome sind weniger häufig.
Hat sich der Tumor hingegen auf Organe wie Knochen und Lunge ausgebreitet, können auch Symptome wie Husten, blutiger Auswurf und Knochenschmerzen aufgrund dieser Ausbreitung beobachtet werden.
WIE WIRD NIERENKREBS DIAGNOSTIZIERT?
Da Nierenkrebs in der Regel asymptomatisch ist, d. h. keine Symptome verursacht, wird der Tumor häufig entdeckt, wenn sich der Patient aus einem anderen Grund einer medizinischen Untersuchung unterzieht. Bei Ultraschall- und Computertomographie-Untersuchungen, die bei allen Beschwerden des Patienten durchgeführt werden, kann ein Nierentumor, der dem Patienten nicht bewusst ist, entdeckt werden, während sich die Krankheit noch im Frühstadium befindet. Wenn sich ein Patient beispielsweise mit Gallenblasenbeschwerden beim Arzt vorstellt und von einem Facharzt für Innere Medizin zur Ultraschalluntersuchung überwiesen wird, ist die Wahrscheinlichkeit, dass ein sich entwickelnder Nierentumor bei der Ultraschalluntersuchung entdeckt wird, recht hoch.
Computertomografien (CT) und MRT-Scans sind oft die einzigen Untersuchungen, die Ärzte zur Diagnose von Nierenkrebs benötigen. Manchmal führen Ärzte auch eine so genannte perkutane Biopsie durch, wenn sie mehr Informationen über einen Tumor benötigen, bevor sie eine Behandlung empfehlen. Bei diesem Verfahren betäubt der Arzt die Haut mit einem Lokalanästhetikum. Dann zieht er mit einer kleinen Nadel einen Teil des Gewebes heraus.
Die Ärzte können CT-Scans oder Ultraschall (die Verwendung von Schallwellen zur Erzeugung von Bildern auf einem Computermonitor) verwenden, um den Tumor zu lokalisieren und die Platzierung und das Herausziehen der Nadel zu steuern. Ein Pathologe, ein Arzt, der Krankheiten in einem Labor untersucht, untersucht Gewebeproben unter einem Mikroskop auf Anzeichen von Krebs.
Urinuntersuchungen dienen nicht der Diagnose von Nierenkrebs; der Arzt kann jedoch nachsehen, ob sich Blut im Urin befindet, was ein häufiges Anzeichen für fortgeschrittenen Nierenkrebs ist. Blutuntersuchungen hingegen helfen Ärzten festzustellen, ob die Nieren ordnungsgemäß funktionieren, werden aber nicht zur Diagnose von Nierenkrebs eingesetzt.
WELCHE STADIEN GIBT ES BEI NIERENKREBS?
Bei der Stadieneinteilung wird das Ausmaß der Krebserkrankung bestimmt; sie ist ein wichtiger Bestandteil der Diagnose. Je nach Stadium des Krebses werden die am besten geeigneten Behandlungsmöglichkeiten festgelegt. Die Stadien von Nierenkrebs reichen von Stadium I (dem am wenigsten schweren Stadium) bis Stadium IV. Wenn bei einem Patienten Nierenkrebs festgestellt wird, bespricht der Arzt die Stadieneinteilung.
Stadium I (am wenigsten schweres Stadium)
Der Tumor ist 7 cm oder kleiner und befindet sich nur in der Niere. Er hat sich nicht auf Lymphknoten oder entfernte Organe ausgebreitet.
Phase II
Der Tumor ist größer als 7 cm und befindet sich ausschließlich in der Niere. Er hat sich nicht auf Lymphknoten oder entfernte Organe ausgebreitet.
Phase III
Im Stadium III dehnt sich der Tumor auf das umgebende Gewebe außerhalb der Niere aus und kann sich auf regionale Lymphknoten ausgebreitet haben.
Stufe IV
Der Tumor hat sich auf Bereiche außerhalb der Gerota-Faszie, der Bindegewebsschicht, die die Nieren und Nebennieren zusammenpresst, ausgebreitet und reicht bis zur Nebenniere. Der Krebs hat sich auch auf zahlreiche Lymphknoten oder auf weit entfernte Bereiche des Körpers, wie Knochen, Leber oder Lunge, ausgebreitet.
WIE WIRD NIERENKREBS BEHANDELT?
Die Behandlungsmöglichkeiten bei Nierenkrebs hängen von einer Reihe von Faktoren ab, darunter der allgemeine Gesundheitszustand des Patienten, die Art des Nierenkrebses, ob der Krebs gestreut hat und die bevorzugte Behandlung. Die Standardmethode zur Behandlung von Nierenkrebs ist die Operation. Ziel des chirurgischen Eingriffs ist es, den Krebs zu entfernen und dabei die normale Nierenfunktion so weit wie möglich zu erhalten. Je nach Stadium des Krebses, der Größe der Masse, dem Bereich der Niere, in dem sich die Masse befindet, und ihrer Anzahl wird die gesamte Niere oder nur die Masse im geschlossenen Verfahren entfernt. Wenn sich der Krebs über die Niere hinaus ausgebreitet hat, können zusätzliche Behandlungen empfohlen werden.
Entfernung der betroffenen Niere (Nephrektomie)
Bei einer vollständigen (radikalen) Nephrektomie werden die gesamte Niere, der gesunde Geweberand und manchmal auch weitere nahe gelegene Gewebe wie Lymphknoten, Nebenniere oder andere Strukturen entfernt.
Der Chirurg kann die Nephrektomie durch einen einzigen Schnitt im Bauch oder in der Seite (offene Nephrektomie) oder durch eine Reihe kleiner Schnitte im Bauchraum (laparoskopische oder robotergestützte laparoskopische Nephrektomie) durchführen.
Entfernung des Tumors aus der Niere (partielle Nephrektomie)
Dieses Verfahren, das auch als nierenschonende oder nephronschonende Operation bezeichnet wird, ist eine gängige Behandlung für Tumore im Frühstadium. Ziel der nierenschonenden Chirurgie ist es, die Nierenfunktion so weit wie möglich zu erhalten und das Risiko von Folgekomplikationen wie Nierenerkrankungen und Dialysebedarf zu verringern.
Die Wirksamkeit von nicht-chirurgischen Behandlungen wie Chemo- und Strahlentherapie bei der Behandlung von Nierenkrebs ist gering.
Die Immuntherapie dient der Stärkung des körpereigenen Immunsystems. Die Immuntherapie ist eine Behandlungsmöglichkeit für Menschen mit fortgeschrittenem Nierenkrebs. Zytokine (Proteine, die das Immunsystem aktivieren) können intravenös oder oral verabreicht werden und den Krebs zum Schrumpfen bringen. Auch zielgerichtete Therapien können bei fortgeschrittenem Nierenkrebs eingesetzt werden. Zielgerichtete Therapien richten sich gegen bestimmte Moleküle. Zielgerichtete Therapien werden in der Regel als Tabletten oder intravenös verabreicht. Tyrosinkinase-Inhibitoren (TKI) wurden bei Menschen mit fortgeschrittenem Nierenkrebs getestet und haben sich als nebenwirkungsärmer erwiesen als Chemotherapeutika.
Hinweis: Die robotergestützte Da Vinci-Chirurgie bietet dem Patienten bei Nierentumoroperationen große Vorteile. In Fällen wie der Teilentfernung der Niere oder der Entfernung des tumorösen Teils der Niere wird das Problem gelöst, indem 4-5 Löcher vom Bauchraum aus eingeführt werden und das tumoröse Gewebe abgetrennt wird, ohne dass große chirurgische Schnitte erforderlich sind, ohne dass onkologische und chirurgische Prinzipien beeinträchtigt werden.
HÄUFIG GESTELLTE FRAGEN ZU NIERENKREBS
Was ist eine Embolisation bei der Behandlung von Nierenkrebs?
Der Chirurg führt einen Katheter ein und bringt ein synthetisches Material in das Blutgefäß ein. Dieses Material blockiert die Blutzufuhr zur Niere, wodurch dem Tumor Sauerstoff und Nährstoffe entzogen werden und er schrumpft.
Kann Nierenkrebs verhindert werden?
Eine hundertprozentige Vorbeugung der Krankheit ist nicht möglich, da die Ursachen von Nierenkrebs nicht vollständig bekannt sind. Eine gesunde Lebensweise, eine Kombination aus gesunder Ernährung und regelmäßiger körperlicher Betätigung, kann jedoch dazu beitragen, Übergewicht, einem der Hauptrisikofaktoren für Nierenkrebs, vorzubeugen.
Ist Nierenkrebs tödlich?
Die Genesung bei Nierenkrebs hängt vom Stadium des Krebses ab. Obwohl die durchschnittliche Lebenserwartung von Nierenkrebsfällen nach den Krebsstadien bestimmt wird, kann diese Situation von Person zu Person unterschiedlich sein.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST ZUNGENKREBS?
Zungenkrebs ist eine ernste, lebensbedrohliche Form von Mundhöhlenkrebs. Die Zunge ist nach den Lippen die häufigste Krebsart in der Mundhöhle.
WAS SIND DIE SYMPTOME VON ZUNGENKREBS?
Die Symptome von Zungenkrebs ähneln denen anderer Arten von Mundkrebs. Je nach Entwicklungsstadium ist das häufigste Symptom von Zungenkrebs eine nicht heilende Wunde in der Mundhöhle. Einige Symptome von Mundhöhlenkrebs oder Zungenkrebs können auch auf andere Erkrankungen zurückgeführt werden. Wenn die entsprechenden Symptome länger als zwei Wochen anhalten, ist eine gründliche klinische Untersuchung, eine Laboruntersuchung und die Konsultation eines Arztes erforderlich, um eine endgültige Entscheidung zu treffen.
Die Symptome von Zungenkrebs sind in der Regel schmerzlos und nicht krankheitsspezifisch. Aufgrund der unspezifischen und oft schmerzlosen Symptome werden Zungenkrebs und andere Arten von Mundhöhlenkrebs oft nicht in einem frühen Stadium erkannt. Zu den Symptomen von Zungenkrebs, der eher gesehen und gefühlt werden kann als hypopharyngealer Zungenkrebs (oraler Zungenkrebs), gehören
- Eine gräulich-rosafarbene Masse oder Wunde an den Seitenflächen der Zunge
- Schmerzen in der Zunge
- Halsweh
- Schwierigkeiten beim Schlucken oder Kauen
- Schwierigkeiten bei der Bewegung der Zunge
Krebs, der sich im Zungengrund entwickelt, wird in der Regel in einem fortgeschrittenen Stadium diagnostiziert, wenn der Tumor größer ist und der Krebs auf die Lymphknoten im Hals übergegriffen hat.
Einige Symptome, die durch Krebs an der Zungenwurzel verursacht werden, sind folgende:
- Halsweh
- Schwierigkeiten beim Schlucken
- Gefühl, einen Kloß im Hals zu haben
- Veränderungen in der Stimme
- Ohrenschmerzen
Es ist wichtig, dass Menschen, die über eines dieser Symptome klagen, von einem Hals-Nasen-Ohren-Arzt untersucht werden. Denn wie bei den meisten Krebsarten ist eine frühzeitige Diagnose sehr wichtig für den Erfolg der Zungenkrebsbehandlung.
WAS SIND DIE RISIKOFAKTOREN FÜR ZUNGENKREBS?
Die beiden wichtigsten Risikofaktoren für die Entstehung von Zungenkrebs sind Tabakkonsum und Alkoholkonsum. Bei Männern ist die Wahrscheinlichkeit, an Zungenkrebs zu erkranken, doppelt so hoch wie bei Frauen. Während Zungenkrebs bei jungen Menschen selten vorkommt, tritt er bei Menschen über 40 Jahren häufiger auf.
Die Risikofaktoren für Zungenkrebs lassen sich wie folgt zusammenfassen:
- Rauchen oder andere Formen von Tabak (Kautabak usw.)
- Alkoholkonsum
- HPV-16 und 18: Humanes Papillomavirus
- Asbestexposition
- Faktoren, die mit Unterernährung zusammenhängen
- Genetische Veranlagung
- Schlechte Mundhygiene und langfristige Reizung
WIE WIRD ZUNGENKREBS DIAGNOSTIZIERT?
Eine Biopsie ist der erste Schritt bei der Diagnose von Zungenkrebs. Bei einer Biopsie wird eine kleine Menge Gewebe aus dem Teil der Zunge entnommen, in dem Krebs vermutet wird. Das Gewebe wird an einen Pathologen geschickt, der es unter dem Mikroskop untersucht und hilft, eine Diagnose zu stellen. Die Untersuchung einer Gewebeprobe aus der vermuteten Krebsstelle durch einen Pathologen ist der Schlüssel zur Diagnose. Nach der Diagnose von Zungenkrebs werden radiologische Untersuchungen wie Ultraschall, Computertomografie und MRT eingesetzt, um Größe, Stadium, Ausbreitung und Beziehung zu anderen Organen zu beurteilen. Auf diese Weise wird über die anzuwendende Behandlungsmethode entschieden.
Das Stadium des Krebses zum Zeitpunkt der Diagnose bestimmt die Behandlungsmöglichkeiten und hat einen starken Einfluss auf das Überleben. Je früher der Zungenkrebs diagnostiziert wird, desto besser sind die Überlebenschancen fünf Jahre nach der Diagnose.
WELCHE ARTEN VON ZUNGENKREBS GIBT ES?
Die häufigste Form von Zungenkrebs ist das Plattenepithelkarzinom (SCC). Plattenepithelzellen sind flache, hautähnliche Zellen, die die Innenseite von Mund, Nase, Kehlkopf, Schilddrüse und Rachen auskleiden. Das Plattenepithelkarzinom ist die Bezeichnung für Krebs, der in diesen Zellen entsteht.
WELCHE STADIEN GIBT ES BEI ZUNGENKREBS?
Das Krebsstadium gibt an, wie groß der Tumor ist und ob er sich ausgebreitet hat. Die Klassifizierung des Krebsstadiums im Körper ist die TNM-Klassifikation. Nach dieser
T ist die Größe des Tumors an der Ursprungsstelle,
N; bei Tumoren in der Kopf-Hals-Region: Größe und Zustand des Tumors, der in die Halslymphknoten metastasiert (gestreut) hat,
M weist auf das Vorhandensein von Metastasen jenseits des Halses in entfernten Organen hin, häufig über das Blut.
Zusammenfassend lässt sich sagen, dass das Krebsstadium von den folgenden Faktoren abhängt:
- Wie stark der Krebs in den lokalen Geweben wächst
- ob sich der Krebs auf nahe gelegene Lymphknoten ausgebreitet hat
- ob die Krankheit auf einen anderen Teil des Körpers übergegriffen hat
WAS SIND DIE BEHANDLUNGSMETHODEN BEI ZUNGENKREBS?
Die Behandlungsmöglichkeiten für Zungenkrebs hängen vom allgemeinen Gesundheitszustand des Patienten sowie von der Art und dem Stadium des Tumors ab. Eine frühzeitige Diagnose ist sehr wichtig für das Überleben und den Lebenskomfort bei Zungenkrebs.
Chirurgisches Verfahren
Bei kleinen Zungenkarzinomen ist die chirurgische Entfernung des Tumors in der Regel die einzige erforderliche Behandlung. Je nach Tumorstadium und den Ergebnissen der radiologischen Untersuchung können jedoch eine Halsdissektion und die chirurgische Entfernung der betroffenen oder potenziell betroffenen Halslymphknoten erforderlich sein.
Strahlentherapie
Die Strahlentherapie wird in der Regel in Kombination mit einer Chemotherapie oder vor/nach einer Operation eingesetzt, um die Vermehrung der Krebszellen zu stoppen.
Bei der intensitätsmodulierten Strahlentherapie (IMRT) wird ein fortschrittliches Computersystem eingesetzt, um die für die Behandlung des Tumors erforderliche Strahlendosis zu berechnen. Dadurch wird die übermäßige Strahlenbelastung des den Tumor umgebenden Normalgewebes minimiert, was die Nebenwirkungen der Strahlentherapie begrenzt und eine möglichst wirksame Strahlentherapie gewährleistet.
Chemotherapie
Die Chemotherapie wird in Kombination mit anderen Behandlungsmöglichkeiten wie Operation und/oder Bestrahlung eingesetzt. Ziel der Chemotherapie ist es, das Wachstum des Krebstumors zu kontrollieren. Wird sie mit einer Bestrahlung kombiniert, spricht man von Chemoradiation. Sie wird auch als palliative Behandlung bezeichnet, wenn sie allein verabreicht wird, um die Symptome der Krankheit zu bekämpfen. Eine Chemotherapie kann auch nach einer Operation durchgeführt werden, um das Risiko eines erneuten Auftretens des Krebses zu verringern.
Nach chirurgischen Eingriffen, Bestrahlung und Chemotherapie können Diät-, Sprach-, Schluck-, physikalische und berufliche Rehabilitationstherapien eingesetzt werden, um die Lebensqualität von Zungenkrebspatienten zu verbessern.
WAS KANN MAN TUN, UM ZUNGENKREBS VORZUBEUGEN?
Obwohl es keine nachgewiesene Methode zur Vorbeugung von Zungenkrebs gibt, kann das Risiko, an Zungenkrebs zu erkranken, durch Beachtung der folgenden Empfehlungen verringert werden.
- Rauchen Sie nicht und konsumieren Sie keine Tabakerzeugnisse. Raucher und/oder Konsumenten von Tabakerzeugnissen sollten gegebenenfalls professionelle Hilfe in Anspruch nehmen, um diese Gewohnheiten aufzugeben.
- Alkoholkonsum sollte vermieden werden.
- Es ist notwendig, regelmäßig einen Arzt für Kontrolluntersuchungen und Krebsvorsorgeuntersuchungen aufzusuchen.
- Auf die Mundhygiene sollte geachtet werden.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST LEBERKREBS?
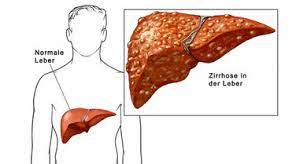
Bösartige Tumore, die von den eigenen Zellen der Leber ausgehen, werden als primärer Leberkrebs bezeichnet. Da er von den lebereigenen Zellen ausgeht, wird er als hepatozelluläres (Leberzell-)Karzinom bezeichnet. Es ist eine der häufigsten und lebensbedrohlichsten Tumorarten. Darüber hinaus gibt es Lebertumore, die nicht von Hepatozyten ausgehen. Dabei handelt es sich um cholangiozelluläre Karzinome (Tumore, die von den Gallenwegen ausgehen). Es gibt aber auch Angiosarkome, d. h. Lebertumore, die von Gefäßstrukturen ausgehen. Wenn die Leber gesund ist, ist das Risiko, an dieser Krebsart zu erkranken, sehr gering. Besonders leberkranke Menschen und Personen mit strukturellen Störungen in der Leber (mit Zirrhose oder Zirrhosegrund) haben ein erhöhtes Risiko für Leberkrebs. Leberkrebs ist eine der häufigsten Krebsarten der Welt. Es handelt sich um eine Krankheit, die frühzeitig diagnostiziert werden sollte, da sie ein Lebensrisiko darstellt. Die frühzeitige Diagnose dieser Krankheit ist sehr wichtig. Die wichtigste Behandlung ist die Entfernung des Krebsgewebes. Es ist sehr schwierig, nur den tumorbefallenen Teil der Leber zu entfernen, da die Leber krank ist und ihre Funktion für den Betroffenen nur noch unzureichend ist. Die Lebertransplantation stellt eine wichtige Behandlungsmethode für Leberkrebspatienten dar.
WAS SIND DIE SYMPTOME VON LEBERKREBS?
Leberkrebs weist in der Frühphase keine sehr spezifischen Befunde auf. Daher wird die Diagnose in der Regel erst gestellt, wenn der Krebs bereits ein großes Ausmaß erreicht hat. Befunde wie Gewichtsverlust, Appetitlosigkeit, Schwäche, Müdigkeit, Gelbsucht, Flüssigkeitsansammlung im Bauchraum werden häufig beobachtet. Manchmal kann es zu einem Schmerz- und Völlegefühl in der rechten Oberbauchseite kommen. Da eine chronische Lebererkrankung (z. B. eine Leberzirrhose) häufig im Hintergrund des Krebses auftritt und diese Erkrankungen oft ähnliche Symptome hervorrufen, kann es zu Verwechslungen kommen. Obwohl Leberkrebs weltweit die sechsthäufigste Krebsart ist, kommt er in unserem Land aufgrund der hohen Zahl von Zirrhose-Erkrankungen häufiger vor. Aus diesem Grund sollten Patienten mit chronischer Hepatitis und Zirrhose im Frühstadium alle 6 Monate bis 1 Jahr radiologisch mit Methoden wie Ultraschall und gegebenenfalls MRT und CT gegen das Risiko einer Tumorentwicklung überwacht werden.
WAS VERURSACHT LEBERKREBS?
Die Ursachen für Lebererkrankungen können wie folgt aufgelistet werden:
- Hepatitis-B-Virus-Infektionen,
- Hepatitis C und
- Hepatitis-D-Virus-Infektionen,
- Aflatoxin (Gift des Aspergillus flavus),
- Zirrhose,
- Genetisch bedingte angeborene Stoffwechselkrankheiten,
- Hämochromatose
- Wilson-Krankheit
- Glykogenspeicherkrankheit,
- Chemikalien (Nitrite, Kohlenwasserstoffe, Lösungsmittel) zählen zu den Ursachen von Leberkrebs.
Die Leber, die Fabrik des Körpers, ist ein Zentrum, das alle Systeme beeinflusst, ein Blutreservoir und ein Teil des Abwehrsystems. Die Gruppe mit dem höchsten Risiko für Leberkrebs sind Menschen mit Hepatitis. Da Leberkrebs in der Anfangsphase keine Symptome verursacht, ist die Möglichkeit der Früherkennung gering. 80 Prozent dieser Krebsarten entwickeln sich vor allem bei Menschen mit Leberzirrhose, weshalb die Patienten genau überwacht werden sollten. Im Vergleich zu nicht gefährdeten Personen haben Menschen mit Hepatitis B und C ein 200-mal höheres Risiko, an Leberkrebs zu erkranken. Hepatitis B kann durch eine Impfung verhindert werden. Die für Hepatitis C entwickelten Therapien zeigen ebenfalls sehr gute Ergebnisse. Zirrhose ist eine Krankheit, die durch eine Schädigung der Leberzellen aufgrund von Alkohol, Hepatitis, immunsystembedingten Ursachen usw. verursacht wird. Bei 5 % der Zirrhose-Patienten besteht das Risiko, an Leberkrebs zu erkranken. Fettleibigkeit gehört ebenfalls zu den wichtigen Risiken, da sie eine Fettleber und eine Zirrhose auslösen kann.
WIE WIRD LEBERKREBS DIAGNOSTIZIERT?
In manchen Fällen verursacht Leberkrebs keine Symptome, bis er ein fortgeschrittenes Stadium erreicht hat. Wenn der Krebs fortschreitet, können Symptome wie grundloser Gewichtsverlust, ständiges Anschwellen des Bauches, Flüssigkeitsansammlungen, Appetitlosigkeit und ständige Schwäche, Gelbsucht auftreten. Menschen mit solchen Beschwerden sollten so schnell wie möglich einen Arzt aufsuchen. Mit Hilfe bildgebender Verfahren ist es heute möglich, jede Art von Entwicklung in der Leber zu erkennen. Vor allem Risikopatienten sollten mit einer Ultraschalluntersuchung überwacht werden, die die kostengünstigste und am leichtesten anwendbare Methode ist. Computertomografie (CT), Magnetresonanztomografie (MRT) und Angiografie sind weitere Methoden, die eingesetzt werden können. Manchmal können mehrere dieser bildgebenden Verfahren zusammen eingesetzt werden, um die Diagnose zu sichern. Alpha-Feto-Protein (AFP), ein Tumormarker, kann im Blut nachgewiesen werden. Ein hoher Wert dieses Tests deutet auf Krebs hin. Es sollte jedoch nicht vergessen werden, dass der Wert auch bei Patienten mit bekanntem Krebs normal sein kann. Ein normales Ergebnis bedeutet nicht, dass kein Tumor vorhanden ist. In einigen Fällen kann zur Diagnose eine Nadelbiopsie der Leber durchgeführt werden. Dies ist jedoch keine Methode, die häufig angewendet werden sollte. Ob eine Biopsie durchgeführt werden sollte oder nicht, sollte von Ärzten entschieden werden, die in diesen Fragen erfahren sind, d. h. von Gastroenterologen und/oder Chirurgen, die sich für Lebererkrankungen interessieren.
WIE WIRD LEBERKREBS BEHANDELT?
Die Folgen von unbehandeltem Leberkrebs sind ungünstig. Die Lebenserwartung liegt in diesen Fällen bei 6-9 Monaten. Die wirksamste Methode ist die chirurgische Entfernung des Tumors. Die Möglichkeit einer chirurgischen Behandlung hängt vom Stadium des Tumors ab und davon, ob er sich auf die Umgebung ausgebreitet hat oder nicht, und wenn der Patient eine Lebererkrankung hat, vom Grad dieser Erkrankung. Bei Leberkrebs, der sich außerhalb der Leber ausgebreitet hat, kommt eine Operation nicht in Frage. Der Erfolg der Operation hängt auch mit dem Durchmesser des Tumors zusammen. Die Überlebenschancen nach einer Operation sind bei Patienten mit einem Durchmesser <5 cm wesentlich besser als bei Patienten mit einem Tumor >5 cm. Die erwartete 5-Jahres-Überlebensrate nach chirurgischer Entfernung liegt unter idealen Bedingungen (<5 cm, einzeln, keine Invasion) bei etwa 60 %. In Fällen, in denen eine Operation nicht möglich ist, kann der Facharzt für Interventionelle Radiologie Methoden wie Radioembolisation, Chemoembolisation, Chemotherapie, Alkoholinjektion oder Radiofrequenzablation anwenden. In geeigneten Fällen können diese auch zusammen mit einer Operation eingesetzt werden. Bei der Operation sollte darauf geachtet werden, dass die verbleibende Leber von ausreichender Qualität und Größe ist, um das Leben des Patienten auf gesunde Weise zu erhalten. Wenn eine chirurgische Entfernung des Tumors in der Leber nicht in Frage kommt, kann eine Lebertransplantation durchgeführt werden. Es gibt viele Gründe, die zu einer Lebertransplantation führen. Lebertumore sind einer von ihnen. Wenn der Tumor die entsprechenden Kriterien erfüllt, ist eine Lebertransplantation die idealste Behandlung, was die Ergebnisse angeht. Bei einer Lebertransplantation wird die kranke Leber, die ein potenzielles Risiko für die Entwicklung eines Tumors birgt, vollständig entfernt. An ihrer Stelle wird eine gesunde Leber transplantiert. Das Risiko eines erneuten Auftretens des Tumors ist bei transplantierten Patienten geringer.
HÄUFIG GESTELLTE FRAGEN ZU LEBERKREBS
Was sind die ersten Symptome von Leberkrebs?
Leberkrebs weist in der Frühphase keine sehr spezifischen Befunde auf. Daher wird die Diagnose in der Regel erst gestellt, wenn der Krebs bereits ein großes Ausmaß erreicht hat. Befunde wie Gewichtsverlust, Appetitlosigkeit, Schwäche, Müdigkeit, Gelbsucht, Flüssigkeitsansammlung im Bauchraum werden häufig beobachtet.
Geht Leberkrebs wieder weg?
Die Folgen von unbehandeltem Leberkrebs sind ungünstig. Die Lebenserwartung liegt in diesen Fällen bei 6-9 Monaten. Die wirksamste Methode ist die chirurgische Entfernung des Tumors. Die Möglichkeit einer chirurgischen Behandlung hängt vom Stadium des Tumors ab, davon, ob er auf die Umgebung übergegriffen hat oder nicht, und vom Grad der Lebererkrankung des Patienten. Bei Leberkrebs, der sich außerhalb der Leber ausgebreitet hat, kommt eine Operation nicht in Frage. Der Erfolg der Operation hängt auch mit dem Durchmesser des Tumors zusammen. Das Überleben nach einer Operation ist bei Patienten mit einem Durchmesser <5 cm wesentlich besser als bei Patienten mit einem Tumor >5 cm. Die erwartete 5-Jahres-Überlebensrate nach chirurgischer Entfernung liegt unter idealen Bedingungen (<5 cm, einzeln, keine Invasion) bei etwa 60 %. In Fällen, in denen eine Operation nicht möglich ist, kann der Facharzt für Interventionelle Radiologie Methoden wie Radioembolisation, Chemoembolisation, Chemotherapie, Alkoholinjektion oder Radiofrequenzablation anwenden. In geeigneten Fällen können diese auch zusammen mit einer Operation eingesetzt werden. Bei der Operation sollte darauf geachtet werden, dass die verbleibende Leber von ausreichender Qualität und Größe ist, um das Leben des Patienten auf gesunde Weise zu erhalten. Wenn eine chirurgische Entfernung des Tumors in der Leber nicht in Frage kommt, kann eine Lebertransplantation durchgeführt werden. Es gibt viele Gründe, die zu einer Lebertransplantation führen. Lebertumore sind einer von ihnen. Wenn der Tumor die entsprechenden Kriterien erfüllt, ist die Lebertransplantation die idealste Behandlung, was die Ergebnisse angeht. Bei einer Lebertransplantation wird die kranke Leber, die ein potenzielles Risiko für die Entwicklung eines Tumors birgt, vollständig entfernt. An ihrer Stelle wird eine gesunde Leber transplantiert. Das Risiko eines erneuten Auftretens des Tumors ist bei transplantierten Patienten geringer.
Wie wird Leberkrebs erkannt?
Leberkrebs weist in der Frühphase keine sehr spezifischen Befunde auf. Daher wird die Diagnose in der Regel erst gestellt, wenn der Krebs bereits ein großes Ausmaß erreicht hat. Befunde wie Gewichtsverlust, Appetitlosigkeit, Schwäche, Müdigkeit, Gelbsucht, Flüssigkeitsansammlung im Bauchraum werden häufig beobachtet. Manchmal kann es zu einem Schmerz- und Völlegefühl in der rechten Oberbauchseite kommen. Da eine chronische Lebererkrankung (z. B. eine Leberzirrhose) häufig im Hintergrund des Krebses auftritt und diese Erkrankungen oft ähnliche Symptome hervorrufen, kann es zu Verwechslungen kommen. Obwohl Leberkrebs weltweit die sechsthäufigste Krebsart ist, kommt er in unserem Land aufgrund der hohen Zahl von Zirrhose-Erkrankungen häufiger vor. Aus diesem Grund sollten Patienten mit chronischer Hepatitis und Zirrhose im Frühstadium alle 6 Monate bis 1 Jahr radiologisch mit Methoden wie Ultraschall und gegebenenfalls MRT und CT gegen das Risiko einer Tumorentwicklung überwacht werden.
Wo verursacht Leberkrebs Schmerzen?
Befunde wie Gewichtsverlust, Appetitlosigkeit, Schwäche, Müdigkeit, Gelbsucht, Flüssigkeitsansammlungen im Bauchraum werden häufig beobachtet. Manchmal kann es zu einem Schmerz- und Völlegefühl in der rechten Oberbauchseite kommen.
Wer kann an Leberkrebs erkranken?
Lebertumore, die sich bei Patienten mit Hepatitis B und Hepatitis C oder Leberzirrhose entwickeln, können in der Anfangsphase oft asymptomatisch sein. Hepatitis B und Hepatitis C gehören zu den häufigsten Krankheiten in unserem Land. Das Vorhandensein des Hepatitis-Virus ist auch ein wichtiger Risikofaktor für die Entwicklung von Leberkrebs.
In welchem Alter tritt Leberkrebs auf?
Das Durchschnittsalter bei der Diagnose von Leberkrebs liegt bei 62 Jahren. Mehr als 90 % der Patienten, bei denen Leberkrebs diagnostiziert wird, sind über 45 Jahre alt, 3 % sind zwischen 35 und 44 Jahre alt und weniger als 3 % sind jünger als 35 Jahre.
Wie viele Stadien von Leberkrebs gibt es?
Für die Behandlungsplanung bei Leberkrebs sollte zunächst eine Stadieneinteilung vorgenommen werden. Leberkrebs wird im Allgemeinen in 4 Stadien eingeteilt:
Stadium 1: Bei Leberkrebs befindet sich das Tumorgewebe in der Leber und hat keine anderen Organe oder Strukturen befallen.
Stadium 2: Bei Leberkrebs finden sich kleine Tumorbildungen im Lebergewebe oder ein bösartiges Tumorgewebe, das die Blutgefäße erreicht hat.
Stadium 3: Bei Leberkrebs sind mehrere große Tumore in das Lebergewebe eingedrungen oder ein großer Tumor hat ein großes Blutgefäß befallen.
Stadium 4: Bei Leberkrebs hat der Leberkrebs inzwischen Metastasen gebildet und sich auf andere Teile des Körpers ausgebreitet.
Was ist gut für Leberkrebs?
Was ist gut gegen Leberkrebs? Diese Frage wird häufig von Anwendern gestellt. Es gibt keinen Platz für unterstützende Produkte oder irgendwelche Nahrungsmittel/Getränke bei der Behandlung von Leberkrebs. Jedes Produkt, das angeblich nützlich sein soll, sollte nie verwendet werden, ohne einen Arzt zu fragen.
Worauf deutet eine Masse in der Leber hin?
Eine Masse in der Leber wird auch als Tumor bezeichnet. Bei diesen Massen handelt es sich in der Regel um gutartige oder bösartige Tumore, die aus dem Gewebe des Organs selbst entstehen. Andererseits kann es sich auch um gutartige Geschwülste handeln, die sich infolge einer anderen Krankheit in der Leber ausgebreitet haben.
Ist eine Masse in der Leber gefährlich?
Die meisten Lebergeschwülste sind gutartige Tumore. Obwohl die meisten bösartigen Tumore Metastasen sind, die von anderen Organen in die Leber gestreut haben, werden auch häufig Tumore aus dem eigenen Gewebe der Leber beobachtet.
Verursacht eine Masse in der Leber Schmerzen?
Leberkrebs kann in der Anfangsphase keine Symptome zeigen. Wenn die Masse im Durchmesser wächst, treten diffuse Schmerzen auf der rechten Seite des Bauches auf. In fortgeschrittenen Stadien gehen starke Bauchschmerzen mit Gewichtsverlust und Schwellungen im Bauchraum einher.
Was ist eine gutartige Masse in der Leber?
Die häufigsten gutartigen Lebertumore sind Hämangiome, Adenome und fokale noduläre Hyperplasien. Hämangiome sind die häufigsten gutartigen Tumore der Leber. Sie bergen kein Risiko der Karzinogenese und haben ein geringes Risiko, aufzubrechen und zu bluten. Daher werden die Patienten in der Regel durch regelmäßige bildgebende Untersuchungen überwacht.
Wie behandelt man eine Masse in der Leber?
Die wirksamste Methode ist die chirurgische Entfernung des Tumors. Die Möglichkeit einer chirurgischen Behandlung hängt vom Stadium des Tumors und davon ab, ob er sich auf die Umgebung ausgebreitet hat, und, falls der Patient eine Lebererkrankung hat, vom Grad der Lebererkrankung. Bei Leberkrebs, der sich außerhalb der Leber ausgebreitet hat, kommt eine Operation nicht in Frage. Der Erfolg der Operation hängt auch mit dem Durchmesser des Tumors zusammen. Wenn eine chirurgische Entfernung des Tumors in der Leber nicht sinnvoll ist, kann eine Lebertransplantation durchgeführt werden. Es gibt viele Gründe für eine Lebertransplantation. Lebertumore sind einer von ihnen.
Wie erkennt man eine gutartige Leberzyste?
Leberzysten verursachen in der Regel keine Symptome und sind in den meisten Fällen gutartig. Bei Zysten, die keine Symptome verursachen, handelt es sich meist um kleine Zysten. Wenn die Zyste jedoch wächst, können Beschwerden im Bauchraum auftreten.
Wie viele Zentimeter einer Leberzyste sind gefährlich?
Das Überleben nach der Operation ist bei Patienten mit einem Tumor von <5 cm Durchmesser wesentlich besser als bei Patienten mit einem Tumor von >5 cm. Die erwartete 5-Jahres-Überlebensrate nach chirurgischer Entfernung liegt unter idealen Bedingungen (<5 cm, einzeln, keine Invasion) bei etwa 60 %.
Wie lange dauert die Operation der Lebermasse?
Obwohl dies je nach Größe der Masse und je nachdem, ob Metastasen vorhanden sind oder nicht, unterschiedlich ist, dauert es etwa 1-2 Stunden.
Wie kann man Leberkrebs vorbeugen?
Um Leberkrebs vorzubeugen, müssen Hepatitisviren verhindert werden. Eine Impfung gegen das Hepatitis-B-Virus sollte durchgeführt werden, bevor es zu spät ist. Auch übermäßiger Alkoholkonsum sollte vermieden werden, da er langfristig zu Zirrhose und Leberkrebs führen kann. Durch die Verringerung des Risikos von Fettleibigkeit und Diabetes mit einer gesunden Ernährung wird auch das Risiko einer Fettlebererkrankung, einer Zirrhose und von Leberkrebs verringert.
Welche Bedeutung hat die interventionelle Radiologie bei der Behandlung von Leberkrebs?
Die Arten der interventionellen radiologischen Anwendungen in der Krebsbehandlung und ihre Wirksamkeit haben in den letzten Jahren mit der sich entwickelnden Technologie allmählich zugenommen. Die wichtigsten dieser Behandlungen sind die Radiofrequenz- (RF) und Mikrowellen- (MW) Ablationsbehandlungen, bei denen der Tumor mit einer unter bildgebender Führung durch die Haut in den Tumor eingeführten Nadel verbrannt wird, sowie die Chemoembolisation und die Radioembolisation (Yitrium 90-Y-90), bei denen hohe Dosen chemotherapeutischer oder mit radioaktiven Isotopen beladener Medikamente verabreicht werden, um den Tumor mit angiographischen Techniken durch die Blutgefäße zu erreichen und die Gefäße zu blockieren, um die Ernährung des Tumors zu unterbrechen und ihn gleichzeitig zu zerstören. Diese Methoden, die bei kleinen Tumoren im Frühstadium eine vollständige Behandlung ermöglichen, können eingesetzt werden, um die Ausbreitung des Tumors zu verlangsamen oder zu stoppen oder um den Tumor bei Patienten in fortgeschrittenen Stadien zu verkleinern, bei denen andere Behandlungen nicht anwendbar sind.
Was zeichnet die Yitrium 90-Behandlung von Leberkrebs aus?
Diese Behandlungsmethode, die auch als Radioembolisation oder selektive interne Strahlentherapie (SIRT) bezeichnet wird, beruht auf dem Prinzip, einen Tumor in der Leber über die Arterien zu erreichen und das in Mikrokügelchen geladene Radioisotop Yttrium 90 zu injizieren, um eine Strahlendosis abzugeben, die zu hoch ist, um von außen verabreicht zu werden, und so die Lebensfähigkeit des Tumors zu eliminieren. Die Yttrium-90-Behandlung wird in zwei Schritten durchgeführt. Im ersten Schritt werden die Leberarterien des Patienten genau bestimmt, und wenn es Gefäße gibt, die mit dem Magen-Darm-System verbunden sind, werden diese blockiert. Dann wird ein Testpräparat, das das eigentliche radioaktive Y90-Medikament imitiert, in die Leber verabreicht und eine vorbereitende Angiographie durchgeführt, um die eigentliche Behandlung zu testen. Der Patient muss für die vorbereitende Angiographie nicht ins Krankenhaus. Wird festgestellt, dass das Lebergefäßsystem für die Behandlung geeignet ist, berechnet der Nuklearmediziner die entsprechende Behandlungsdosis und legt den eigentlichen Behandlungstag fest. In der Regel wird die Behandlung etwa 7-10 Tage nach der vorbereitenden Angiographie im zweiten Schritt mittels Angiographie in die Leber verabreicht.
Wer kommt für eine Behandlung mit Yittrium-90 bei Leberkrebs in Frage?
Die für die Behandlung geeignete Patientengruppe besteht aus Patienten, deren bestehende Tumorerkrankung auf die Leber beschränkt ist und die keinen bedeutenden Tumorherd außerhalb der Leber haben. Darüber hinaus wird in der vorbereitenden Angiographie auch die Eignung des Patienten für die Behandlung beurteilt.
Ist es möglich, Lebermetastasen zu behandeln?
Die Behandlung von Lebermetastasen richtet sich nach dem Ursprung der Ausbreitung (Krebs in welchem Organ), dem Ausmaß der Ausbreitung (wie viele Metastasen sich in der Leber befinden), der Lage der Metastasen in der Leber und danach, ob eine Ausbreitung außerhalb der Leber vorliegt. Vor allem Lymphome können mit bestimmten Kombinationen von Chemotherapien behandelt werden. Brust- und Lungenkrebs profitieren teilweise von einer Chemotherapie. Die Behandlung von Lebermetastasen muss von der Behandlung von Metastasen bei Dickdarmkrebs (Kolorektalkrebs) unterschieden werden. Dickdarmkrebs metastasiert häufig in die Leber, und die chirurgische Entfernung von Metastasen in der Leber ist für die Behandlung sehr wichtig.
Was ist eine Lebermetastase?
Die Ausbreitung von Krebs in irgendeinem Teil des Körpers von seinem Ursprung (Organ) zu einem anderen Ort wird als Metastasierung dieses Krebses bezeichnet. Das Auftreten dieser Metastasen in der Leber wird als Lebermetastase bezeichnet.
Ist die Metastasierung in der Leber eine häufige Erkrankung?
Ja, das ist sie. Die Leber ist ein großes Organ, das das Blut filtert. Daher bleiben Krebszellen, die in den Blutkreislauf gelangen, in diesem Organ stecken und wachsen weiter. Lebermetastasen von Krebserkrankungen des Verdauungssystems (Darm) sind besonders häufig, da das Blut aus diesen Organen zunächst durch die Leber fließt. Krebserkrankungen von Organen wie Dickdarm, Magen, Bauchspeicheldrüse, Gallenwege und Dünndarm metastasieren häufig in die Leber. Auch Metastasen von Brustkrebs, Lungenkrebs und Lymphomen sind häufig.
Wie hoch ist die Überlebenszeit bei metastasiertem Leberkrebs?
Dieser Zeitraum ist von Patient zu Patient unterschiedlich und hängt von der Art der Behandlung und vielen Parametern ab.
Ist Leberkrebs ein Problem, das mit pflanzlicher Behandlung gelöst werden kann?
Pflanzliche Lösungen haben bei der Behandlung von Leberkrebs nichts zu suchen. Es ist niemals notwendig, ohne Rücksprache mit einem Arzt zu pflanzlichen Mitteln zu greifen.
Was sind die Risikofaktoren für die Entstehung von Leberkrebs?
- Hepatitis-B-Virus-Infektionen
- Hepatitis-C-Virus-Infektionen
- Hepatitis-D-Virus-Infektionen
- Aflatoxin (Gift des Aspergillus flavus)
- Zirrhose
- Genetische, angeborene und metabolische Krankheiten
- Hämachromatose, Wilson, Glykogenspeicherkrankheit
- Chemikalien; Nitrite, Kohlenwasserstoffe, Lösungsmittel
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST DICKDARMKREBS?
Dickdarmkrebs, eine Krankheit, die sich im letzten Teil des Verdauungssystems, dem so genannten “Dickdarm”, entwickelt, tritt bei einem von 20 Menschen im Laufe ihres Lebens auf.
Der Dickdarm und der Mastdarm gehören zum Verdauungssystem. Der Dickdarm folgt auf den Dünndarm und ist etwa 1,5 m lang. Er beginnt mit dem Blinddarm in der unteren rechten Seite des Bauches in Form eines umgekehrten U, geht nach oben und durchquert den Bauch horizontal, indem er eine Kurve unter der Leber macht. Er kommt unter der Milz, die sich in der oberen linken Ecke befindet, macht erneut eine Kurve und wendet sich von der linken Seite nach unten und mündet in den Enddarm. Der Enddarm ist der letzte Teil des Verdauungssystems, der etwa 15 cm lang ist und durch die Erweiterung des Dickdarms gebildet wird.
Dickdarmkrebs beginnt in den Zellen des Dickdarms. Wenn die Zahl der Zellen zunimmt, breitet er sich kreisförmig wie ein Serviettenring um den Dickdarm aus. Bei einer frühzeitigen Diagnose lassen sich Krebszellen nur im Dickdarm nachweisen. Wird der Krebs nicht frühzeitig diagnostiziert, kann er sich auf nahe gelegene Organe, Lymphknoten und über den Blutkreislauf auf Leber, Lunge und andere Organe ausbreiten.
Das wichtigste Kriterium für den Erfolg einer Darmkrebsbehandlung ist die Früherkennung. Wenn Dickdarmkrebs in einem frühen Stadium erkannt wird, ist es möglich, die Krankheit vollständig zu beseitigen.
RISIKOFAKTOREN FÜR DICKDARMKREBS
In den Industrieländern ist die Häufigkeit von Dickdarm- und Enddarmkrebs 4 bis 10 Mal höher als in den Entwicklungsländern. Als Ursachen für Darmkrebs lassen sich Lebensstil, veränderte Umweltfaktoren und vererbte genetische Faktoren nennen.
Genetische Faktoren
Menschen, in deren Familie Darmkrebs vorkommt, haben ein erhöhtes Risiko, an Krebs zu erkranken. Vererbte genetische Faktoren erhöhen das Risiko. Sowohl familiäre adenomatöse Polypen im Dickdarm als auch erblicher Darmkrebs ohne Polypen, auch bekannt als Lynch-Syndrom, erhöhen das Darmkrebsrisiko. Obwohl genetisch bedingte Darmkrebserkrankungen nur 5-10 % der Fälle ausmachen, haben Menschen mit diesen genetischen Faktoren ein jüngeres Erkrankungsalter und ein höheres Überlebensrisiko als andere Darmkrebspatienten.
Hereditärer nicht-polypöser Darmkrebs (Lynch-Syndrom) ist der häufigste genetisch bedingte Darmkrebs. Es wird durch eine vererbte Genmutation infolge von inkompatiblen DNA-Übereinstimmungen verursacht. Das Durchschnittsalter bei der Diagnose liegt bei 45 Jahren. Diese Art von Genmutation prädisponiert für Krebs des Endometriums (Gebärmutterschleimhaut), der Eierstöcke, des Dünndarms, des Harnleiters (Harnwege) und des Nierenbeckens.
Das Vorhandensein einer Krebsgeschichte in der eigenen Familie und bei Verwandten ersten Grades hat einen erheblichen Einfluss auf das Auftreten der Krankheit. Menschen mit einer familiären Vorgeschichte von Darmkrebs sollten sich 10 Jahre vor dem Alter, in dem bei ihren Verwandten Darmkrebs festgestellt wurde, einer Darmspiegelung unterziehen. Völlig gesunde Menschen, bei denen Darmkrebs nicht in der Familie vorkommt oder die keine Beschwerden haben, sollten mindestens einmal ab dem 50. Sie können ganz einfach online einen Termin in einem Krankenhaus vereinbaren, um spezialisierte Ärzte aufzusuchen.
WAS VERURSACHT DARMKREBS?
Bei der Entstehung von Dickdarmkrebs spielen eine übermäßig fettreiche, auf rotem Fleisch basierende Ernährung, Fettleibigkeit, Rauchen und Alkoholkonsum sowie Polypen eine Rolle. Wenn bei der Vorsorgekoloskopie Polypen im Dickdarm entdeckt werden, ist es möglich, die Krankheit zu verhindern, indem sie entfernt werden, bevor sie zu Krebs werden. Eine Vorgeschichte von Brust- und Eierstockkrebs bei Frauen erhöht ebenfalls das Darmkrebsrisiko. Es wird empfohlen, dass Personen mit Brust- und Eierstockkrebs vor dem Alter von 50 Jahren auf Darmkrebs untersucht werden.
Polypen machen sich in der Regel erst in der Spätphase bemerkbar, d. h. wenn sie sich in Krebs verwandeln. Nur ein kleiner Teil der Polypen entwickelt sich zu Krebs. Da sich jedoch die meisten Krebsarten aus Polypen entwickeln, ist dies ein Thema, dem man Aufmerksamkeit schenken muss. In der Allgemeinbevölkerung liegt die Rate bei etwa 10-15 %. Im Alter von 50 Jahren haben etwa 25 % der Bevölkerung verschiedene Arten von Polypen. Im Alter von 70 Jahren liegt die Inzidenz bei fast 50 %, d. h. die Häufigkeit von Polypen nimmt mit dem Alter zu.
Merkmale von Polypen;
- Es geht nicht von selbst vorbei.
- Er hat genetische Merkmale. Patienten, bei denen Verwandte ersten Grades an Darmkrebs erkrankt sind und bei denen bei früheren Untersuchungen Polypen festgestellt wurden, bilden die Risikogruppe und müssen engmaschig überwacht werden.
- Polypen sind in der Regel etwa 1 cm groß. Polypen, die größer als 2 cm sind, können gefährlich sein und sollten entfernt werden.
- Symptome wie starke Schmerzen, Darmverschluss und Gewichtsverlust sind in der Regel Spätsymptome. Probleme wie Hämorrhoiden und Fissuren im Anus können bei einigen Patienten zu Verzögerungen bei der Diagnose und Behandlung von Enddarmkrebs führen, da sie ähnliche Symptome aufweisen. Diese Symptome können sowohl die Patienten als auch selten die Ärzte in die Irre führen. Generell sollte bei Blutungen aus dem Enddarmbereich im Alter von 40 Jahren und darüber die Möglichkeit eines Rektum- oder Dickdarmkrebses gut untersucht werden.
- Es ist noch nicht möglich, die Bildung von Polypen zu verhindern. Menschen mit einer sitzenden Lebensweise, Menschen mit übermäßigem Stress, Raucher und Alkoholkonsumenten, Übergewichtige und Menschen, die überwiegend rotes Fleisch essen, sind gefährdet. Der Verzehr von Lebensmitteln mit Zellstoff, der Verzicht auf das Rauchen, also alles, was den Stuhlgang reguliert, ist jedoch ein wichtiger Faktor, um die Bildung von Polypen zu verhindern.
Andere Risikofaktoren für Darmkrebs (Dickdarmkrebs)
Alter: Obwohl er in jedem Alter auftreten kann, wird er meist bei Menschen über 50 Jahren beobachtet. Das Risiko, an Darmkrebs zu erkranken, steigt mit dem Alter. Bei Patienten über 60 Jahren ist die Wahrscheinlichkeit, an Dickdarm- und Enddarmkrebs zu erkranken, zehnmal höher als bei Menschen unter 40 Jahren.
Entzündungen des Darms: Es gibt hauptsächlich zwei Arten von Darmentzündungen. Die erste ist die Colitis ulcerosa, bei der es sich um eine infektionsbedingte Geschwürbildung der Dickdarmschleimhaut handelt. Die zweite ist der Morbus Crohn, der mit schubweise auftretenden Entzündungen in jedem Teil des Verdauungssystems vom Mund bis zum Anus oder in mehreren verschiedenen Teilen gleichzeitig auftritt. Obwohl es sich um eine lang anhaltende, chronische Krankheit handelt, ist sie behandelbar. Aufgrund des hohen Krebsrisikos sollten Darmkrebsvorsorgeuntersuchungen häufiger durchgeführt werden.
Ernährung: Die Häufigkeit von Dickdarm- und Mastdarmkrebs ist vor allem in den USA und den europäischen Ländern, in denen der Verzehr von Fast Food üblich ist, recht hoch. Der Verzehr von Lebensmitteln ohne Brei verstärkt die Verstopfung und führt dazu, dass die Fäkalien lange Zeit im Darm verbleiben und dort Krebs verursachen. Feinkostprodukte, gepökeltes und geräuchertes Fleisch, Grillgerichte und frittierte Speisen sind Lebensmittel, die Verstopfung verursachen. Darüber hinaus wurde festgestellt, dass der Verzehr von Lebensmitteln, die reich an Obst, Gemüse, Hülsenfrüchten, Huhn und Getreide sind, das Risiko verringert.
Fettleibigkeit: Übergewicht erhöht das Darmkrebsrisiko, unabhängig davon, ob es sich um einen Mann oder eine Frau handelt.
Rauchen: Viele Studien haben gezeigt, dass es einen Zusammenhang zwischen Rauchen und Darmkrebs gibt.
WAS SIND DIE SYMPTOME VON DICKDARMKREBS?
Die Frage “Was sind die Symptome von Darmkrebs?” kann wie folgt beantwortet werden. Die häufigsten Symptome von Darmkrebs:
- Ständiger Durchfall und Verstopfung,
- Verschmälerung der großen Blase, die immer eine normale Dicke aufweist,
- Blut, das aus dem Anus kommt, und große Ablution,
- Es handelt sich um ein eierschalenartiges Sekret bei der großen Ablatio.
Wenn Dickdarmkrebs fortschreitet und den Darm verstopft, kommt es zu Schwellungen und Schmerzen im Bauchraum. Bei solchen Beschwerden ist es wichtig, einen Arzt aufzusuchen, um eine frühzeitige Diagnose zu stellen.
- Gefühl, dass sich der Darm nicht ausreichend entleeren kann,
- Schwierigkeiten bei der Stuhlentleerung
- Schmerzhafte Darmentleerung
- Ungeklärter Gewichtsverlust
- Erbrechen
Zu den wichtigsten Symptomen von Dickdarmkrebs, auch Kolonkarzinom genannt, gehören die Symptome. Dickdarmkrebs, der die rechte Seite des Darms betrifft, und Dickdarmkrebs, der die linke Seite betrifft, können unterschiedliche Symptome hervorrufen. Da die linke Seite des Darms eine engere Region ist, treten bei Krebs in dieser Region eher Beschwerden wie Verdünnung des Stuhls, Blutungen, Veränderung des Stuhlmusters auf, während auf der rechten Seite, da der Darm breiter ist, der Krebs hier schleichend fortschreitet und länger braucht, um Symptome zu verursachen.
Der Patient hat Symptome wie Schwäche, Anämie, Appetitlosigkeit und Bauchschmerzen. Schmerzhafter Stuhlgang, Eisenmangelanämie und das Gefühl einer abdominalen Masse sind wichtige Symptome von Dickdarmkrebs. Die Diagnose von Dickdarmkrebs vor dem Fortschreiten der Krankheit erhöht die Lebenschance erheblich. Daher ist es sehr wichtig, die Symptome von Dickdarmkrebs für eine frühzeitige Diagnose zu beachten.
WIE WIRD DICKDARMKREBS DIAGNOSTIZIERT?
Dickdarmkrebs ist eine Krebsart, die in die Vorsorgeprogramme aufgenommen wird. Die wirksamste Art, Krebs vorzubeugen oder die Krankheit in einem frühen Stadium zu erkennen, sind regelmäßige endoskopische Untersuchungen. Die wichtigste dieser Untersuchungen ist die Darmspiegelung (Koloskopie). Die Darmspiegelung ist ein Verfahren, mit dem sowohl ein bereits bestehender Tumor in einem frühen Stadium entdeckt werden kann als auch Polypen und ähnliche Probleme, die zu Krebs führen können, bevor sie krebsartig werden, aufgespürt werden können und die Person vor der Entstehung von Krebs schützen. Jedem Menschen über 50 Jahren wird empfohlen, sich je nach Risikostatus, persönlicher Gesundheits- und Familienanamnese in Abständen von 2-5 Jahren einer Darmspiegelung zu unterziehen. Die Vorbereitung und Durchführung der Koloskopie ist heute viel einfacher und angenehmer für den Patienten geworden. Die neuen Kolonoskope sind äußerst einfach anzuwenden, und die gewünschten Ergebnisse werden erzielt, ohne dem Patienten Unannehmlichkeiten zu bereiten.
Dickdarmkrebs wird mit einigen Tests unter der Leitung von Fachärzten diagnostiziert. Nach der Anmeldung des Patienten beim Arzt und der körperlichen Untersuchung werden die folgenden Tests durchgeführt;
- Untersuchung auf okkultes Blut im Stuhl: Hierbei handelt es sich um einen sehr einfachen Test, bei dem eine kleine Stuhlprobe im Labor untersucht wird.
- Radiologische Untersuchungen: Es werden eine Doppelkontrast-Darmröntgenaufnahme und eine Computertomografie durchgeführt.
- Laboruntersuchungen: Es werden ein vollständiges Blutbild und biochemische Tests durchgeführt. Unter diesen Tests ist CEA (carcinoembryonales Antigen) einer der Tests, der bei Dickdarmkrebs im Blut erhöht sein kann und die Diagnose erleichtert.
- Endoskopische Untersuchungen zur endgültigen Diagnose: Rektoskopie, Sigmoidoskopie, Kolonoskopie und Biopsie werden durchgeführt. Ein Stück der Läsion wird entnommen und von einem Pathologen untersucht.
Wenn in der Familie vor dem 50. Lebensjahr Darmkrebs aufgetreten ist, ist eine Darmspiegelung ab dem 40. Lebensjahr obligatorisch. Es ist sehr wichtig, die Koloskopie alle 5 Jahre zu wiederholen. Darüber hinaus ist es auch sehr wichtig, einmal im Jahr auf okkultes Blut im Stuhl zu achten, um Krebs zu erkennen und frühzeitig zu diagnostizieren. Wenn es in der Familie keine Anzeichen für Darmkrebs gibt, sollte ab dem 50. Lebensjahr regelmäßig alle 5 Jahre eine Darmspiegelung durchgeführt werden.
Die klassische Koloskopie ermöglicht es, das Vorhandensein von Polypen oder Krebs zu diagnostizieren, und wenn der Patient Polypen hat, ist sie in der Lage, diese zu behandeln und die Entstehung von Krebs zu verhindern. Einmal in 5 Jahren sollte dies für den Patienten nicht schwierig sein. Denn die Koloskopie ist heute ein Verfahren, bei dem der Patient mit einer intravenösen Nadel entspannt und mit Sedierung und Schmerzmitteln erträglicher gemacht wird.
WELCHE BEHANDLUNGSMETHODEN GIBT ES BEI DICKDARMKREBS?
Bei Dickdarmkrebs ist eine Operation möglicherweise nicht erforderlich, wenn der Krebs in einem frühen Stadium an den bei der Koloskopie entnommenen Polypen entdeckt wird. Er wird lediglich engmaschig überwacht. Die Koloskopie ist von großer Bedeutung für die Diagnose von Polypen in einem frühen Stadium, bevor sie sich zu Krebs entwickeln. Jüngste Studien haben gezeigt, dass Darmkrebs durch eine Darmspiegelung und die Entfernung von Polypen in einem frühen Stadium weitgehend verhindert werden kann. Aus diesem Grund sollte sich jeder Mann ab 45 und jede Frau ab 50 Jahren einem Screening auf okkultes Blut im Stuhl und einer Koloskopie unterziehen. Der Patientenkomfort ist bei der Koloskopie von großer Bedeutung. Aus diesem Grund wird der Patient mit einem leichten intravenösen Schmerzmittel, der so genannten “bewussten Sedierung”, halb bewusstlos gemacht. Zuvor muss der Darm mit verschiedenen Methoden vollständig entleert werden. Dann wird eine Glasfaserkamera in den Darm eingeführt und alle Polypen werden entfernt. Allerdings sind hier die Erfahrung des Arztes, der die Darmspiegelung durchführt, die Desinfektion des verwendeten Gerätes und die hohe Bildqualität von großer Bedeutung.
Die Standardbehandlung bei fortgeschrittenem Dickdarmkrebs ist die Operation, d. h. die Entfernung des tumorösen Bereichs zusammen mit einem Teil des umgebenden gesunden Gewebes und der Lymphknoten. Studien zeigen, dass eine nach den Grundsätzen der Onkologie und von erfahrenen Chirurgen durchgeführte Operation der wichtigste Faktor für die Zukunft des Patienten ist. Bei Dickdarmkrebs wird nach der Operation je nach Stadium der Erkrankung eine zusätzliche, vorbeugende Chemotherapie durchgeführt. In Fällen im Stadium III”, in denen der Tumor auf die an den Darm angrenzenden Lymphknoten übergegriffen hat, ist die adjuvante” Chemotherapie (Verhinderung der Ausbreitung der Krankheit) heute weltweit Standard.
Bei Dickdarmkrebs kann es bei Tumoren in unmittelbarer Nähe des Anus manchmal unvermeidlich sein, den Anus zu entfernen und auf die Entleerung durch den Bauch (mit Kolostomiebeuteln) umzustellen. In den letzten Jahren hat sich jedoch gezeigt, dass eine präoperative Chemotherapie in Kombination mit einer Strahlentherapie den Anus weitgehend erhalten kann. Bei Patienten, die in andere Organe gestreut haben (Metastasen), werden alle drei Behandlungsmethoden (Operation, Chemotherapie, Strahlentherapie) je nach Allgemeinzustand des Patienten, Alter und Ausmaß der Erkrankung angewandt. Ziel ist es, die Lebenszeit und die Lebensqualität der Patienten zu verlängern. Dank der neuen zielgerichteten biologischen Arzneimitteltherapien, die in den letzten Jahren entwickelt wurden, steigen die Erfolgsquoten bei der Behandlung von Tag zu Tag.
Ernährung und Vorsorgeuntersuchungen sind von großer Bedeutung für die Prävention von Darmkrebs. Es ist wichtig, reichlich faserhaltige Lebensmittel wie Gemüse, Obst und Getreideprodukte zu verzehren und genügend Kalzium und Vitamin D zu sich zu nehmen. Als sekundäre Vorbeugungsmaßnahme sind Früherkennungsuntersuchungen und Frühdiagnose von besonderer Bedeutung. Dazu werden für beide Geschlechter ab dem 50. Lebensjahr Vorsorgeuntersuchungen empfohlen. Bei Personen, in deren Familie Darmkrebs vorkommt, sollten die Früherkennungsuntersuchungen bereits in einem früheren Alter beginnen.
DINGE, DIE MAN ZUR VORBEUGUNG VON DICKDARMKREBS BEACHTEN SOLLTE
Obwohl es noch nicht möglich ist, Dickdarmkrebs zu verhindern, kann das Risiko von Dickdarmkrebs verringert werden, indem man auf schädliche Gewohnheiten wie falsche Ernährung, Bewegungsmangel, Übergewicht, Rauchen und Alkohol achtet. Dazu sollten einige Lebensumstellungen vorgenommen werden. Diese sind;
- Ernährung: Eine Ernährung, die reich an Obst, Gemüse und Hülsenfrüchten ist, trägt zur Verringerung des Darmkrebsrisikos bei. Der Konsum von rotem Fleisch und Alkohol sollte mäßig sein, da er das Risiko für Darmkrebs erhöht. Eine gesunde Ernährung und der Verzehr von fettarmen Lebensmitteln helfen, das Gewicht in einem bestimmten Rahmen zu halten.
- Sport treiben: Studien haben gezeigt, dass regelmäßiger Sport das Risiko von Dickdarm- und Enddarmkrebs sowie vieler anderer Krebsarten verringert. Bevor Sie mit einem Bewegungsprogramm beginnen, sollten Sie einen Arzt aufsuchen. Der Arzt wird Ihnen bei der Erstellung eines geeigneten Übungsprogramms helfen. Es wird empfohlen, sich 5 Tage oder mehr als 5 Tage pro Woche 30 Minuten lang zu bewegen. Ein 45-minütiges bis 1-stündiges Training kann einen größeren Nutzen bringen. Zu den mäßigen Aktivitäten gehören zügiges Gehen, Radfahren in flachem Gelände… Zu den anstrengenden Aktivitäten gehören Klettern und Laufen.
- Nicht-steroidale entzündungshemmende Medikamente (wie Aspirin): Forschungsergebnisse deuten darauf hin, dass diese Art von Medikamenten das Krebsrisiko verringert. Bei regelmäßiger Einnahme haben sie einen potenziellen Nutzen. Wenn jedoch ein potenzielles Darmkrebsrisiko besteht, ist es in Ihrem besten Interesse, sie unter ärztlicher Aufsicht einzunehmen. Andernfalls kann es zu Magenblutungen kommen.
- Kalzium: Es kann bei Darmkrebs von einigem Nutzen sein. Es ist bekannt, dass die tägliche Einnahme von 1200 mg Kalzium die Bildung von kolorektalen Adenomen um 20 % und von fortgeschrittenen Adenomen um 45 % reduziert. Darüber hinaus wurde festgestellt, dass die gemeinsame Einnahme von Vitamin D und Kalzium die Form von Adenomen reduziert.
- Vitamin D: Es ist ein fettlösliches Vitamin und kommt in Nahrungsmitteln wie angereicherter Milch, Getreide, Makrele, Lachs, Thunfisch und bestimmten Fischarten sowie im Sonnenlicht vor. Es wird vermutet, dass Vitamin D eine wichtige Rolle bei der Vorbeugung einiger Krebsarten, einschließlich Dickdarmkrebs, spielt.
- Krebsvorstufen (Polypen, die zu Krebs führen können) Polypen-Screening und -Behandlung: Screening-Tests, die bei verschiedenen Krebsarten, insbesondere bei Brustkrebs, durchgeführt werden, können die Entstehung von Krebs nicht verhindern, erhöhen aber die Erfolgsquote bei der Behandlung, da sie helfen, die Diagnose in einem frühen Stadium zu stellen. Die Entwicklung von Krebs kann durch Screening-Tests zur Erkennung von Krebsvorstufen (Polypen) verhindert werden. Die Entfernung der entdeckten Polypen kann die Entstehung von Krebs in einem späteren Stadium verhindern.
- Vorbeugende chirurgische Eingriffe: Für Menschen mit einem hohen Darmkrebsrisiko kann eine präventive Operation empfohlen werden. Bei dieser Operation werden der Dickdarm und manchmal auch der Mastdarm und andere betroffene Organe entfernt, bevor sich Krebs entwickelt. Diese Art der Operation kommt jedoch nur für Patienten in Frage, die ein hohes Risiko für Dickdarm- und Enddarmkrebs haben. Bevor Sie sich für eine Operation entscheiden, sollten Sie unbedingt die Vorteile und Folgen mit Ihrem Arzt besprechen.
HÄUFIG GESTELLTE FRAGEN ZU DARMKREBS
Welche Stadien gibt es bei Dickdarmkrebs?
Darmkrebs hat vier Stadien. Im Stadium 1 hat sich der Krebs auf die Darmwand ausgebreitet. Im Stadium 2 hat sich der Krebs auf alle Schichten des Darms ausgebreitet. Im Stadium 3 hat sich der Krebs auf die Lymphknoten ausgebreitet. Im 4. Stadium hat er sich auf Orte wie die Leber, das Bauchfell und die Lunge ausgebreitet.
In welchem Alter tritt Dickdarmkrebs auf?
Dickdarmkrebs, der in jedem Lebensalter auftreten kann, wird häufig im fortgeschrittenen Alter beobachtet. Genetische Veranlagung, Bewegungsmangel, Übergewicht, Übergewicht, Alkohol, Tabakkonsum und übermäßiger Verzehr von verarbeitetem Fleisch sind die Hauptrisiken für Dickdarmkrebs, wobei der Faktor fortgeschrittenes Alter eine wichtige Rolle spielt.
Was ist das wichtigste Symptom von Darmkrebs?
Bei Dickdarmkrebs gehören Blutungen aus dem 15 cm langen Dickdarmabschnitt in der Nähe des Anus zu den wichtigsten Symptomen. Dickdarmkrebs, der vom ersten Teil des Dickdarms in der Nähe des Dünndarms ausgeht, verursacht jedoch eher einen Blutverlust mit okkulten Blutungen als rektale Blutungen und äußert sich durch Anämie.
Wie kommt es zu Blutungen bei Dickdarmkrebs?
Blutungen im Anus, die zu den Symptomen von Dickdarmkrebs gehören, können frisch und hellrot sein.
Ist Dickdarmkrebs vollständig geheilt?
Bei vielen Krebsarten kann sich die Krankheit ausbreiten und auf verschiedene Organe übergreifen. Im Allgemeinen kann Dickdarmkrebs in die Leber metastasieren. Um dies zu verhindern, kann nach der Operation eine Chemotherapie durchgeführt werden.
Kann Dickdarmkrebs durch eine Operation geheilt werden?
Studien, Operationen, die nach den Prinzipien der Onkologie und von erfahrenen Chirurgen durchgeführt werden, sind die wichtigsten Faktoren für die Zukunft des Patienten.
Tritt Darmkrebs nach einer Operation wieder auf?
Bei Dickdarmkrebs wird nach der Operation eine Chemotherapie verabreicht, um je nach Krankheitsstadium ein Wiederauftreten zu verhindern.
Wie hoch ist das Sterberisiko bei Dickdarmkrebs?
Dickdarmkrebs, die häufigste Krebsart, steht an dritter Stelle der krebsbedingten Todesursachen bei Männern und Frauen. Das Risiko, an Dickdarmkrebs zu sterben, kann jedoch durch eine frühzeitige Diagnose und Behandlung verringert werden.
Wo treten Schmerzen bei Dickdarmkrebs auf?
Bei Dickdarmkrebs, bei dem Durchfall und Verstopfung als Symptome auftreten, beeinträchtigen der häufige Wunsch, auf die Toilette zu gehen, und starke Bauchschmerzen die Lebensqualität. Diese Symptome, die zu einem Verlust des Selbstbewusstseins führen, können eine psychologisch schwierige Zeit mit sich bringen. In dieser Phase, in der es zu Depressionen und Angststörungen kommen kann, kann psychologische Unterstützung angeboten werden.
Ich habe keine familiäre Vorbelastung durch Darmkrebs oder Polypen. Sollte ich mich auf Darmkrebs testen lassen?
Es ist möglich, dass Krankheiten durch genetische Vererbung an die nächste Generation weitergegeben werden können. Das Fehlen einer Familienanamnese bedeutet jedoch nicht, dass kein Darmkrebs auftritt. Daher sollten auch zu Kontrollzwecken in der Frühphase Tests durchgeführt werden.
Bedeuten Polypen, dass ich Dickdarmkrebs bekommen werde?
Polypen sind in der Regel gutartig. Ob Polypen jedoch Krebs verursachen können oder nicht, sollte unter der Aufsicht eines Facharztes beurteilt werden.
Ist Dickdarmkrebs genetisch bedingt?
Bei Dickdarmkrebs, bei dem Umweltfaktoren eine wichtige Rolle spielen, ist es möglich, dass einige genetische Störungen von den Eltern auf die nächste Generation übertragen werden. Genetische Störungen können sich mit Umweltfaktoren entwickeln.
Können Frauen Dickdarmkrebs bekommen?
Dickdarmkrebs, auch Kolonkarzinom genannt, ist eine der lebensbedrohlichsten Krebsarten und kann bei Männern und Frauen unabhängig vom Geschlecht auftreten.
Welche Ernährung sollte ich einhalten, um Darmkrebs vorzubeugen?
Experten gehen davon aus, dass die mediterrane Ernährung eine wichtige Rolle bei der Vorbeugung von Dickdarmkrebs spielt. Forschungen zufolge kann ein übermäßiger Verzehr von rotem Fleisch Darmkrebs auslösen. Bei der mediterranen Ernährung wird der Verzehr von rotem Fleisch auf ein Minimum reduziert, und es wird viel Gemüse verzehrt. Der Verzehr von frischem Obst und Gemüse durch Kochen im täglichen Leben ist Teil dieser Diät.
Wer kann an Dickdarmkrebs erkranken?
Es heißt, dass sie häufiger bei älteren Menschen, bei Menschen mit sitzender Lebensweise, bei Übergewichtigen, bei Alkohol- und Tabakkonsumenten und bei Menschen, die verarbeitete Fleischprodukte konsumieren, auftritt.
Wo ist der häufigste Ort für Dickdarmkrebs?
Untersuchungen haben ergeben, dass Dickdarmkrebs bei Afrikanern und Amerikanern häufiger vorkommt. Es ist auch eine häufige Krebsart in unserem Land.
Kann Darmkrebs durch einen Bluttest nachgewiesen werden?
Dickdarmkrebs kann nicht allein durch einen Bluttest diagnostiziert werden. Es sind zusätzliche Untersuchungen erforderlich.
Warum tritt Dickdarmkrebs auf?
Als Ursachen für Darmkrebs lassen sich Lebensstil, Fehlernährung, Übergewicht, veränderte Umweltfaktoren und genetische Erbfaktoren nennen.
Ist Dickdarmkrebs im Stadium 4 heilbar?
Im Stadium 4 wird eine Operation nicht bevorzugt. Chemotherapie und Bestrahlung zielen darauf ab, die Krebszellen zu verkleinern. Die Behandlung und die Prognose für jeden Patienten im Stadium 4 sind nicht gleich. Sie hängt von der Ausbreitung der Krankheit und dem Ansprechen auf die Behandlung ab.
Ist Dickdarmkrebs gutartig?
Dickdarmkrebs ist ein bösartiger Tumor des Dickdarms. Manchmal können sich gutartige Polypen in Krebs verwandeln.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST BLASENKREBS?
Die Blase, deren Hauptfunktion im Körper die Speicherung von Urin ist, ist ein Organ, das sich dehnen kann, wenn es sich mit leerem Urin füllt. Blasenkrebs geht in der Regel von den Urothelzellen der Schleimhaut aus, die die innere Oberfläche der Blase auskleidet. Blasentumore können bösartig oder gutartig sein. Es gibt jedoch auch nicht bösartige, gutartige Blasentumore.
WAS SIND DIE SYMPTOME VON BLASENKREBS?
Die Symptome von Blasenkrebs sind wie folgt;
- Blut im Urin (Hämaturie): Bei Blasenkrebs ist die Blutung im Urin in der Regel schmerzlos. Es kann zu sichtbaren Blutungen im Urin kommen, aber auch zu Blutungen, die unter dem Mikroskop zu sehen sind. Die Blutungen müssen nicht unbedingt im gesamten Urin sein, sondern können auch in Form von Blutgerinnseln auftreten. Blut im Urin kann viele Ursachen haben, die nicht auf einen Tumor zurückzuführen sind. Es darf nicht vergessen werden, dass verschiedene Krankheiten wie Nierensteine oder Infektionen Blut im Urin verursachen können.
- Schmerzhaftes Wasserlassen
- Häufiges Wasserlassen
- Harndrang
- Beschwerden wie Schwierigkeiten beim Wasserlassen oder sogar Unfähigkeit zu urinieren aufgrund von Blutgerinnseln können ein Symptom für Blasenkrebs sein.
Wenn die ersten Symptome von Blasenkrebs auftreten, kann der Krebs in einigen Fällen bereits in einen anderen Teil des Körpers metastasiert haben. Die Symptome, die bei Patienten mit Metastasen auftreten, können je nach dem Bereich, in dem sich der Krebs ausgebreitet hat, unterschiedlich sein. Bei fortschreitenden Blasentumoren;
- Rückenschmerzen
- Schmerzen im Unterleib
- Es kann zu Symptomen wie Appetitlosigkeit und Gewichtsverlust kommen.
WAS SIND DIE URSACHEN FÜR BLASENKREBS?
Obwohl die genaue Ursache von Blasenkrebs nicht bekannt ist, gibt es Risikofaktoren, die ihn verursachen können.
- Rauchen Der häufigste Risikofaktor für Blasenkrebs ist Rauchen und Tabakkonsum. Die Wahrscheinlichkeit, an Blasenkrebs zu erkranken, ist bei Rauchern von Zigaretten und Tabakprodukten 4-7 Mal höher als bei Nichtrauchern. Auch Passivrauchen erhöht das Risiko.
- Alter: Blasenkrebs tritt ab einem bestimmten Alter häufiger auf. Die Mehrheit der Menschen, bei denen Blasenkrebs diagnostiziert wird, sind über 50 Jahre alt.
- Geschlecht: Bei Männern ist die Wahrscheinlichkeit, an Blasenkrebs zu erkranken, 3 bis 4 Mal höher als bei Frauen. Allerdings hat der weit verbreitete Zigarettenkonsum bei Frauen in den letzten Jahren zu einem Anstieg der Häufigkeit von Blasenkrebs bei Frauen geführt. Die Wahrscheinlichkeit, an Blasenkrebs zu sterben, ist bei Frauen höher als bei Männern.
- Chemikalien Chemikalien, die in der Textil-, Gummi-, Leder-, Farben-, Chemie-, Batterie- oder Druckindustrie verwendet werden, erhöhen das Risiko von Blasenkrebs
- Die Zugehörigkeit zur weißen Rasse
- Chronische Blasenentzündungen
- Unzureichende Flüssigkeitszufuhr und zu starke Urinrückhaltung
- Verzehr von vielen fettreichen oder mit Zusatzstoffen versetzten Lebensmitteln
- Familienanamnese von Blasenkrebs
- Das Risiko, an Blasenkrebs zu erkranken, ist höher bei Patienten, die eine Chemotherapie mit Cyclophosphamid erhalten haben, und bei Patienten, die sich aus anderen Gründen einer Strahlentherapie in den angrenzenden Bereichen der Blase unterzogen haben.
WIE WIRD BLASENKREBS DIAGNOSTIZIERT?
Blasenkrebs wird durch Symptome oder durch einen Verdacht bei Routineuntersuchungen festgestellt. Zunächst ist eine Untersuchung durch einen erfahrenen urologischen Arzt erforderlich.
Urologische Untersuchung
Der Urologe wird zunächst die Risikofaktoren für Blasenkrebs wie Genetik, Rauchen oder Strahlenbelastung beurteilen. Der Urologe wird eine körperliche Untersuchung durchführen;
- Führen Sie eine systemische Untersuchung durch und stellen Sie fest, ob es Anzeichen für Krebs gibt.
- Kontrolle der abdominalen und hepatischen Distension.
- Untersuchung auf vergrößerte Lymphknoten in der Leiste, im Bauch und am Hals.
Bei Auffälligkeiten und Verdacht auf Blasenkrebs können zur Klärung der Diagnose zusätzliche Untersuchungen angefordert werden.
Urintests bei Blasenkrebs
- Die Urinanalyse ist ein einfacher Labortest. Sie wird durchgeführt, um Blut und andere Substanzen in der Urinprobe zu überprüfen.
- Zytologie des Urins: Eine Urinprobe wird unter dem Mikroskop untersucht, um festzustellen, ob Krebszellen vorhanden sind.
- Urinkultur: Welche Art von Mikroben wird in der im Labor aufbewahrten Urinprobe untersucht. Sie ist wichtig, um festzustellen, ob eine Blaseninfektion vorliegt.
- Tests auf Tumormarker im Urin: Ein empfindlicher und spezifischer Marker ist noch nicht gefunden worden. Diese Tests suchen nach Substanzen, die von Blasenkrebszellen ins Blut abgegeben werden.
Diagnose von Blasenkrebs durch bildgebende Verfahren
- Ultraschalluntersuchung (USG): Mit Ultraschall, bei dem keine Kontrastmittel verabreicht werden müssen, können Blasentumore, die größer als 5 mm sind, leicht erkannt werden. Mit Ultraschall lässt sich auch die Größe des Blasenkrebses bestimmen und feststellen, ob er sich auf benachbarte Organe oder Gewebe ausgebreitet hat.
- Computertomographie (CT-Urogramm): Kann Aufschluss über die Größe, Form und Lage aller Tumore im Harntrakt, einschließlich der Blase, geben. Sie kann auch helfen, vergrößerte Lymphknoten, die Krebs enthalten können, sowie andere Organe im Bauchraum und im Becken darzustellen. Manchmal wird dem Patienten ein Kontrastmittel über den Mund oder intravenös verabreicht, damit das Bild detaillierter dargestellt werden kann. Patienten, die allergisch auf Jod und andere Substanzen reagieren, sollten ihren Arzt vorher darüber informieren.
- Intravenöses Pyelogramm (IVP): Diese Methode, die früher zur Feststellung von Anomalien der Blase und der Harnwege verwendet wurde, ist durch neuere Methoden ersetzt worden, die bessere Informationen liefern.
- Retrogrades Pyelogramm: Es ist ein ähnliches Verfahren wie das intravenöse Pyelogramm. Das verwendete Kontrastmittel wird jedoch nicht intravenös injiziert, sondern mittels Zystoskopie direkt in die Harnwege eingeführt. Das Verfahren des retrograden Pyelogramms dient dazu, die Ursache für die Behinderung des normalen Urinflusses zu ermitteln. Es kann auch helfen, Krebs in der Auskleidung des Harnleiters oder der Niere zu diagnostizieren.
- MRT (Magnetresonanz): Damit lassen sich die Tiefe und Größe eines Blasentumors messen und die Lymphknoten, in denen sich der Krebs ausgebreitet hat, sichtbar machen. Dem Patienten muss ein Kontrastmittel verabreicht werden, um ein detailliertes Bild des Tumors und seiner Auswirkungen zu erhalten.
- PET-CT-Scan: Eine kleine Menge radioaktiven Materials wird in den Körper des Patienten injiziert. Da diese radioaktive Substanz von Krebszellen, die dazu neigen, Energie zu verbrauchen, absorbiert wird, wird sichtbar gemacht, wo sich der Krebs im Körper ausgebreitet hat. Die PET-CT ist nicht als Standardbildgebung für Blasenkrebs anerkannt. Es kann jedoch eine potenzielle Rolle bei der Bewertung von metastasierendem Blasenkrebs spielen.
- Röntgenaufnahme des Brustkorbs: Kann verwendet werden, um festzustellen, ob sich der Blasenkrebs auf die Lunge ausgebreitet hat. Wenn eine CT-Untersuchung des Brustkorbs durchgeführt wurde, ist eine Röntgenaufnahme des Brustkorbs nicht erforderlich.
Zystoskopie
Die Zystoskopie ist eines der Standardverfahren zur Diagnose von Blasenkrebs. Ein dünnes, flexibles Endoskop mit einem Licht und einer Kamera am Ende wird verwendet, um die Harnröhre und das Innere der Blase zu untersuchen. Bei der Zystoskopie lassen sich Größe, Lage und Wachstumsmuster von Anomalien in der Blase feststellen. Während der Zystoskopie können auch Biopsien und Urinproben entnommen werden.
Biopsie – Transurethrale Resektion eines Harnblasentumors (TUR-BT)
Bei der Zystoskopie entnimmt der Urologe ein Stück abnormales Gewebe und sendet es zur Untersuchung an das Labor. Bei diesem Verfahren, das auch als transurethrale Resektion des Blasentumors (TUR-BT) bezeichnet wird, kann auch eine Probe des Blasentumors und des tumornahen Blasenmuskels entnommen werden. Während der Biopsie kann der Arzt die Blase untersuchen, um festzustellen, ob ein Tumor tastbar ist. Die TUR-BT kann auch zur Behandlung von nicht-muskelinvasiven Blasentumoren eingesetzt werden.
BEHANDLUNG VON HARNBLASENKREBS
Die Behandlungsmöglichkeiten bei Blasenkrebs hängen von verschiedenen Faktoren wie dem allgemeinen Gesundheitszustand des Patienten, der Krebsart, dem Grad des Krebses und dem Krebsstadium ab.
Chirurgische Behandlung von Harnblasenkrebs
Die Art der chirurgischen Behandlung bei Blasenkrebs hängt von der Art des Blasentumors und dem Stadium des Krebses ab.
TUR-Operation (Transurethrale Resektion): Die transurethrale Resektion von Blasentumoren (TUR) wird in der Regel zur Entfernung von Tumoren eingesetzt, die nicht muskelinvasiv sind, d. h. von Tumoren, die sich in der Blasenschleimhaut befinden und nicht bis in die Muskelschicht der Blasenwand reichen. Die TUR kann auch bei der Diagnose und Stadieneinteilung von Blasenkrebs eingesetzt werden.
Die TUR-Operation kann unter Vollnarkose oder Regionalanästhesie durchgeführt werden. Die TUR-Operation wird ohne einen Schnitt im Körper durchgeführt, indem man durch das natürliche Loch am Ende der Harnwege eindringt.
Bei der TUR-Operation gelangt der Urologe mit einem Endoskop, an dessen Ende sich ein kleiner U-förmiger Draht befindet, in die Harnblase. Das Krebsgewebe wird mit elektrischem Strom durchtrennt und aus dem Körper entfernt. Bei sehr kleinen Tumoren wird die Behandlung durch Verbrennung des Krebszellenbereichs nach der Entfernung des Stücks beendet.
Nach der TUR-Operation kann der Urologe eine Chemotherapie empfehlen, die 6-8 Wochen lang einmal wöchentlich über einen Katheter in die Blase verabreicht wird, um die verbleibenden Krebszellen zu zerstören und ein Wiederauftreten zu verhindern.
Partielle oder segmentale Zystektomie: Hierbei handelt es sich um die chirurgische Entfernung des Tumors und eines Teils der Harnblase. Die Rolle der partiellen Zystektomie bei der Behandlung von Blasenkrebs ist äußerst begrenzt und wird nur bei der Behandlung von Krebsarten mit spezieller Histologie eingesetzt.
Radikale Zystektomie: Dabei handelt es sich um eine chirurgische Methode, bei der die gesamte Blase und die umliegenden Gewebe und Organe zusammen mit dem Tumor entfernt werden. Bei der radikalen Zystektomie werden neben der Blase auch die Prostata und die Samenblasen des Mannes und bei Bedarf der gesamte Harntrakt entfernt. Bei Frauen werden nach der klassischen Definition die Gebärmutter, die Eileiter, die Eierstöcke und die Gebärmutter ganz oder teilweise entfernt, aber in den letzten Jahren wird auch die Blase mit sicheren Grenzen entfernt, während die gynäkologischen Organe erhalten bleiben.
Sowohl bei Männern als auch bei Frauen ist die Entfernung der Lymphknoten im Becken ebenfalls Teil der Operation. Die Beckenlymphknotendissektion ist die genaueste Methode, um Krebs zu erkennen, der sich auf die Lymphe ausgebreitet hat.
Bei der radikalen Zystektomie, die laparoskopisch oder robotergestützt durchgeführt werden kann, kann der chirurgische Eingriff mit kleineren Schnitten anstelle der großen Schnitte bei offenen Operationen durchgeführt werden.
Neue Blase aus dem Darm (Neoblasenrekonstruktion): Bei Patienten, die sich einer radikalen Zystektomie unterzogen haben, wurde die Blase entfernt, so dass sie einen neuen Weg benötigen, um den Urin aus dem Körper zu leiten. Es gibt verschiedene Arten von Harnableitungsoperationen, darunter auch Methoden, bei denen eine neue Blase aus einem Teil des Darms geschaffen wird. Welche Methode der Harnableitung für den Patienten geeignet ist, entscheidet der Arzt für Urologie anhand des biologischen Alters des Patienten, des Stadiums der Erkrankung und möglicher Behandlungen wie Chemo- und Strahlentherapie, die später erforderlich sein könnten. Die endgültige Entscheidung wird nach einem ausführlichen Gespräch mit dem Patienten getroffen.
Chemotherapeutische Behandlung von Blasenkrebs
Sie wird eingesetzt, um Blasenkrebszellen zu zerstören, die sich im Körper ausgebreitet haben. Das Leben ohne Blase kann sich manchmal negativ auf das soziale Leben des Patienten auswirken. Chemo- und Strahlentherapie können bei geeigneten Patienten als Alternative zur Blasenentfernung eingesetzt werden, um die Blase ganz oder teilweise zu erhalten.
Die Chemotherapie bei Blasenkrebs kann auf zwei verschiedene Arten durchgeführt werden.
- Systemische Chemotherapie: Die systemische Chemotherapie wird auch als Ganzkörper- oder intravenöse Chemotherapie bezeichnet. Bei der von einem medizinischen Onkologen angewandten Methode zielen die intravenös verabreichten Chemotherapeutika darauf ab, im ganzen Körper zu zirkulieren und die Krebszellen zu zerstören. Sie wird bei metastasiertem Blasenkrebs oder nach einer radikalen Zystektomie in ausgewählten Fällen eingesetzt. Eine systemische Chemotherapie kann auch eingesetzt werden, um den Tumor vor der Operation zu verkleinern.
- Intravesikale Chemotherapie: Die intravesikale oder lokale Chemotherapie wird in der Regel von einem Urologen verabreicht. Da die Krebszellen bei oberflächlichen Blasenkrebsen nicht das tiefe Muskelgewebe erreichen, kann die intravesikale Chemotherapie bei diesen Patienten als Ergänzung zur TUR-Behandlung eingesetzt werden. Bei der intravesikalen Chemotherapie werden die Medikamente über einen in die Harnröhre eingeführten Katheter in die Blase verabreicht.
Strahlentherapie bei Harnblasenkrebs
Sie kann zusätzlich zur TUR oder nach der TUR in Kombination mit einer Chemotherapie zur Behandlung von Blasenkrebs bei Patienten eingesetzt werden, die für eine Operation nicht geeignet sind oder die keine chirurgische Behandlung wünschen. Sie kann bevorzugt werden, um durch einen Tumor verursachte Beschwerden wie Schmerzen, Blutungen oder Verstopfung zu lindern, oder bei der Behandlung von metastasierten Krebserkrankungen.
Immuntherapie bei Harnblasenkrebs
Die Immuntherapie, auch biologische Behandlung genannt, ist der Einsatz von Medikamenten, die dem Immunsystem helfen, Krebszellen zu erkennen und zu zerstören. Bei der Behandlung von Blasenkrebs wird die Immuntherapie in der Regel direkt in die Harnblase verabreicht. Der BCG-Impfstoff wird als Standard-Immuntherapie bei Blasenkrebs eingesetzt. Der BCG-Impfstoff wird als Flüssigkeit über einen Katheter in die Blase verabreicht und aktiviert die Zellen des Immunsystems in der Blase.
In den letzten Jahren haben Studien über T-Zellen, die das Immunsystem unterstützen und bekanntermaßen eine schützende Wirkung gegen Infektionen und Krebs haben, zu positiven Ergebnissen geführt.
HÄUFIG GESTELLTE FRAGEN ZU BLASENKREBS
Wie häufig ist Blasenkrebs?
Blasenkrebs ist die siebthäufigste Krebsart bei Männern, bei Frauen ist er seltener. Allerdings ist Blasenkrebs bei Frauen eine tödlichere Krebsart. Die American Cancer Society schätzt, dass im Jahr 2019 in den USA bei 80.000 Menschen (62.000 Männer, 18.000 Frauen) Blasenkrebs diagnostiziert werden wird.
Zu welchem Arzt sollte ich gehen, wenn ich Blasenkrebs oder gutartige Blasentumore habe?
Die Diagnose und Behandlung von Blasenkrebs oder gutartigen Tumoren der Blase, die in jedem Alter auftreten können, obwohl sie meist erst nach dem 50. Da es bei der Behandlung von Blasenkrebs und gutartigen Blasentumoren auch chirurgische Methoden gibt, ist es wichtig, einen auf diesen Bereich spezialisierten Urologen zu wählen.
Welche Arten von Blasenkrebs gibt es?
Verschiedene Zelltypen in der Blase können krebsartig sein. Blasenkrebs kann in verschiedene Typen eingeteilt werden, je nachdem, von welcher Blasenzelle der Krebs ausgeht. Die Art und das Stadium des Blasenkrebses werden auch durch die Tests bestimmt, die bei der Diagnose von Blasenkrebs verwendet werden.
- Das Urothelkarzinom, auch bekannt als Übergangszellkarzinom, ist die häufigste Form von Blasentumoren. Er entsteht in den Urothelzellen, die das Innere der Blase auskleiden. Urothelzellen finden sich auch in anderen Teilen des Harntrakts. Aus diesem Grund sollten Patienten mit Blasenkrebs ihren gesamten Harntrakt untersuchen lassen.
- Plattenepithelkarzinom: Es entsteht, wenn sich nach einer langwierigen Infektion, einer Reizung der Blase oder nach längerem Gebrauch eines Katheters dünne, flache Zellen in der Blase bilden. Unter dem Mikroskop sehen die Zellen den flachen Zellen auf der Hautoberfläche sehr ähnlich.
- Adenokarzinom Etwa 1 % der Blasenkrebsfälle sind Adenokarzinome. Es entsteht in den schleimabsondernden Drüsen der Blase. Es tritt nach längerer Reizung oder Infektion der Blase auf.
- Kleinzelliges Karzinom: Weniger als 1 % der Blasenkrebsfälle sind kleinzellige Karzinome. Es beginnt in nervenähnlichen Zellen, den sogenannten neuroendokrinen Zellen. Diese Krebsarten wachsen oft schnell und müssen mit einer Chemotherapie behandelt werden, die normalerweise bei kleinzelligen Karzinomen der Lunge eingesetzt wird.
- Sarkom: Sarkome entstehen in den Muskelzellen der Blase, sind aber sehr selten.
Die Klassifizierung von Blasenkrebstumoren kann auch auf mikroskopischen Bildern von Krebszellen beruhen.
- Geringgradiger Blasentumor: Auch gut differenzierter Blasentumor genannt. Das Aussehen und die Organisation der Krebszellen ähneln normalen gesunden Zellen. Ein niedriggradiger Blasentumor wächst langsamer.
- Hochgradiger Harnblasentumor: Er wird auch als schlecht differenzierter Blasentumor bezeichnet. Das Aussehen der Krebszellen und des Tumors ähnelt nicht den normalen gesunden Zellen. Hochgradige Blasentumore zeigen ein aggressiveres Verhalten.
Blasenkrebs kann auch durch seine Nähe zur Blasenwand unterschieden werden.
Die Blasenwand besteht aus vielen Schichten verschiedener Zellen. Die meisten Blasenkrebsarten beginnen in der innersten Schicht der Blase, die mit Urin in Berührung kommt, und breiten sich im Laufe der Zeit auf die Muskeln der Blase aus. Diejenigen, die die Muskelschicht der Blase erreichen, breiten sich anschließend außerhalb der Blase und auf benachbarte Strukturen aus. Blasenkrebs kann in nahe gelegene Lymphknoten oder andere Teile des Körpers metastasieren. Blasenkrebs streut in der Regel in entfernte Lymphknoten, Knochen, die Lunge oder die Leber.
- Nicht-invasiver Blasenkrebs: Es handelt sich um einen Blasenkrebs, der sich nicht auf den Muskel ausbreitet und in der inneren Schicht verbleibt. Er wird auch als oberflächlicher Blasenkrebs oder Blasenkrebs im Frühstadium bezeichnet.
- Invasiver Blasenkrebs: Das bedeutet, dass sich die Krebszellen tiefer als die innere Schicht der Blase, in die Muskelschicht, ausgebreitet haben. Bleibt er unbehandelt, besteht die Gefahr, dass der Krebs auf andere Körperteile übergreift. Diese Krebsarten haben ein höheres Streuungsrisiko und müssen behandelt werden.
Blasenkrebs wird auch nach der Art seines Wachstums unterschieden.
- Papilläres Urothelkarzinom: Papilläre Tumore sind Wucherungen, die von den Urothelzellen in der Blasenschleimhaut ausgehen und sich in das Innere der Blase ausbreiten. Manchmal wachsen diese Tumore zwar, bleiben aber in der Blase, ohne sich auszubreiten. Aggressivere Formen dieses Krebses können jedoch auf die tieferen Schichten der Blase und dann auf andere Organe übergreifen.
- Flaches Karzinom (Karzinom insitu): Es wächst nicht in den tiefen Teil oder die innere Höhle der Blase ein. Es handelt sich um eine invasive Tumorform, die sich an der Blasenwand in einer flachen Tumorschichtstruktur ausbreitet.
Was sind die Stadien von Blasenkrebs?
Um das Stadium des Blasenkrebses zu bestimmen, werden 3 Kriterien berücksichtigt.
- Die Tiefe des Krebstumors in der Blasenwand und die Ausdehnung des Tumors
- ob der Blasentumor auf regionale Lymphknoten übergegriffen hat
- Es wird untersucht, ob der Blasenkrebs Metastasen in anderen Organen wie der Lunge oder der Leber gebildet hat.
Die aus der Pathologie und den Untersuchungen gewonnenen Informationen dienen dazu, herauszufinden, welche Teile der Blase von Krebs befallen sind, ob sich der Krebs von seinem Ursprungsort aus ausgebreitet hat und wo der Krebs gestreut hat. Die Stadieneinteilung bei Blasenkrebs wird nach dem internationalen TNM-System vorgenommen.
Risiken und Nebenwirkungen der chirurgischen Behandlung von Blasenkrebs
TUR-Operation
- Die Nebenwirkungen der TUR-Operation bei Blasenkrebs sind in der Regel gering und dauern nicht lange an. Nach der TUR-Operation können Schmerzen beim Wasserlassen und leichte Blutungen auftreten. Diese Auswirkungen normalisieren sich innerhalb von 1-2 Wochen.
- Obwohl der Blasentumor nach der TUR-Operation vollständig entfernt wird, kann der Tumor wieder auftreten.
- Mehrfache TUR-Operationen können zu Problemen wie einer Verengung der Harnwege führen.
Radikale Zystektomie und neue Blase aus dem Darm oder Umleitung der Darmschlinge
- Die radikale Zystektomie ist ein schwererer Eingriff als die TUR. Die Nebenwirkungen der Anästhesie können sichtbar sein.
- Hämorrhagie
- Infektion
- Blutgerinnsel in den Beinen oder der Lunge
- Schädigung von Nachbarorganen
- Inkontinenz oder Behinderung des Urinflusses
- Bei Männern können das Verschwinden der Spermienproduktion und Erektionsprobleme beobachtet werden. Neue nervenschonende Operationstechniken können Erektionsprobleme und sexuelle Unlust verhindern. Bei Frauen können Menopause und sexuelle Unlust auftreten, aber organerhaltende Techniken werden bei altersgemäßen Patienten bevorzugt.
Wie sollte die Nachsorge nach einer Blasenkrebsbehandlung aussehen?
Da bei Blasenkrebspatienten das Risiko besteht, dass der Blasenkrebs nach der Behandlung wieder auftritt, ist die Nachsorge sehr wichtig. Die Nachsorge ist ein wichtiger Bestandteil der Krebsbehandlung. Die Nachsorge nach einer Blasenkrebsbehandlung kann je nach Stadium und Grad des Krebses und der Art der Behandlung variieren. Die Wahrscheinlichkeit eines Wiederauftretens von Blasenkrebs ist in den ersten zwei Jahren nach der Behandlung hoch, danach wird die Nachsorge auf bis zu zehn Jahre ausgedehnt, obwohl die Wahrscheinlichkeit eines Wiederauftretens abnimmt.
Obwohl die Nachsorge je nach Patient unterschiedlich ist, ist es wichtig, im ersten Jahr alle 3 Monate zu kontrollieren. Bei den Nachuntersuchungen werden die Leber und die Lymphknoten kontrolliert und die Blase mittels Blasenspiegelung beobachtet, um festzustellen, ob es zu einem Rezidiv in der Blase kommt. Bildgebende Verfahren wie CT, MR, Ultraschall und PET-CT werden ebenfalls eingesetzt, wenn der behandelnde Arzt dies für erforderlich hält.
Wie hoch ist die Überlebenszeit bei Blasenkrebs?
Die Genesung von Blasenkrebs oder die Überlebenszeit ist von Mensch zu Mensch unterschiedlich. Der Erfolg hängt von der Art des Blasenkrebses, seinem Stadium, der Anzahl und Größe der Tumore, den Merkmalen des Krebses, dem Wiederauftreten, den gewählten Behandlungen und der Reaktion des Patienten auf die Behandlung ab. Daher sind die Überlebensraten bei Blasenkrebs tatsächlich personalisiert. In der Studie der American Cancer Society, die alle Stadien von Blasenkrebs berücksichtigt, liegt die 5-Jahres-Überlebensrate für Menschen mit Blasenkrebs bei 77 %, die 10-Jahres-Überlebensrate bei 70 % und die 15-Jahres-Überlebensrate bei 65 %.
In welches Organ metastasiert der Blasenkrebs am häufigsten?
Blasenkrebs bildet am häufigsten Metastasen in der Lunge, der Leber oder in den Knochen.
Wie sollte man sich bei Blasenkrebs ernähren?
Es ist nicht genau bekannt, was die Rückfallquote nach einer Blasenkrebsbehandlung verringert. Der Nutzen der Ernährung bei der Entstehung von Blasenkrebs oder nach der Behandlung ist in wissenschaftlichen Studien nicht eindeutig belegt. Es kann jedoch von Vorteil sein, mit dem Rauchen aufzuhören, sich natürlich und ausgewogen zu ernähren und sich regelmäßig körperlich zu betätigen.
Gibt es eine pflanzliche oder natürliche Behandlungsmethode für Blasenkrebs?
Es gibt keine wissenschaftlichen Beweise dafür, dass Ernährung, pflanzliche Produkte, Vitamine und Mineralien die Entstehung von Blasenkrebs verhindern oder das Risiko eines Rückfalls verringern. Es wurden viele Studien zu diesem Thema durchgeführt, und im Allgemeinen werden eine natürliche und gesunde Ernährung und aktive Mobilität empfohlen.
Kommt Blasenkrebs bei jungen Menschen vor?
Blasentumore sind eine häufige Erkrankung, die in der Regel erst ab einem Alter von 50 Jahren auftritt. In der Praxis wird er jedoch auch schon in den 20er Jahren beobachtet. Außerdem ist die Häufigkeit von Blasentumoren bei Männern etwa viermal so hoch wie bei Frauen. Bei Frauen ist die Prognose jedoch tendenziell schlechter.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST METASTASIERENDER KREBS?
Unter Metastasierung versteht man die Ausbreitung des Krebses über das Ursprungsorgan hinaus. Eine Metastasierung ist nachweisbar, wenn sich Krebszellen von ihrem Ursprungsort über den Blutkreislauf oder die Lymphgefäße in einen anderen Teil des Körpers ausbreiten und neue Tumorherde bilden.
Krebs kann sich auf drei Arten ausbreiten:
- Durch Gewebe: Der Krebs kann wachsen und sich von seinem Ursprungsort über die Nachbarschaft auf nahe gelegene Gebiete ausbreiten.
- Über das Lymphsystem: Krebszellen können sich über die Lymphgefäße in andere Teile des Körpers ausbreiten.
- Über das Blut: Krebszellen können durch die Blutgefäße in andere Teile des Körpers gelangen.
Die Lymphknoten sind der häufigste Ort, an dem Krebs metastasiert. Krebszellen neigen auch dazu, in verschiedene Organe wie Leber, Gehirn, Lunge und Knochen zu streuen. Bei einigen Krebsarten ist die Wahrscheinlichkeit größer, dass sie in bestimmte Organe streuen. Prostatakrebs zum Beispiel breitet sich am häufigsten in den Knochen aus. Krebszellen, die aus dem Knochengewebe stammen, siedeln sich am häufigsten im Lungengewebe an.
WAS SIND DIE SYMPTOME VON METASTASIERENDEM KREBS?
Die Beschwerden (d. h. Symptome) bei metastasierendem Krebs variieren je nach Art des Krebses und dem Ort, an dem er sich ausgebreitet hat. Häufige Symptome von Krebs, der sich im Gehirn ausgebreitet hat, d. h. Hirnmetastasen, können beispielsweise Kopfschmerzen, Krampfanfälle, Sehstörungen (verschwommenes Sehen, Doppelbilder, Gesichtsfelddefekte) und Schwindel sein, während Lebermetastasen Beschwerden wie Appetitlosigkeit, Blähungen, frühzeitige Sättigung, Verdauungsstörungen und Gelbsucht (Gelbfärbung der Haut oder der Augen) verursachen können.
In einigen Fällen können sich Krebszellen auch dann noch ausbreiten, wenn die primäre Krebserkrankung bereits behandelt wurde. Metastasierende Tumore können Monate oder sogar Jahre nach der ersten Krebsbehandlung auftreten.
WAS SIND DIE CHARAKTERISTISCHEN MERKMALE DER METASTASIERUNG?
Damit eine Krebszelle “metastatisch” ist, muss sie die folgenden Merkmale aufweisen:
Mobilität und Invasion
Invasion, das definierende Merkmal der Bösartigkeit, ist die Fähigkeit von Tumorzellen, die Basalmembran (eine dünne, faserige, extrazelluläre Gewebematrix, die die Auskleidung einer inneren oder äußeren Körperoberfläche vom darunter liegenden Bindegewebe trennt) zu durchbrechen und durch das darunter liegende Bindegewebe (das Bindegewebe des Tumors) zu wandern. Motilität, d. h. die Fähigkeit von Krebszellen, sich zu bewegen, reicht für die Metastasierung allein nicht aus; wenn sich eine Krebszelle erfolgreich von einem Tumorherd ablösen kann, danach aber nicht überlebt, kann sie nicht metastasieren.
Möglichkeit, Sekundärzonen zu ändern
Krebszellen rekrutieren neue Zellen in der lokalen Mikroumgebung, mobilisieren Immun-/Entzündungszellen, restrukturieren andere Gewebe, verändern den Stoffwechsel des umgebenden Stromas, hemmen alle Antitumormaßnahmen des Immunsystems, manipulieren und verändern das Verhalten anderer Krebszellen. Rekonstruiert die extrazelluläre Matrix und das normale Verhalten anderer Zellen.
Plastizität
Primäre oder sekundäre Tumore sind nicht statisch; auf zellulärer Ebene sind sie sehr dynamisch. Krebszellen müssen ihren Stoffwechsel anpassen, um den Anforderungen gerecht zu werden, die mit dem schnellen Wachstum des Primärtumors und der Besiedlung verschiedener Metastasen einhergehen. Darüber hinaus können neoplastische Zellen die Wachstumsraten anderer Zellen, die Arzneimittelresistenz und die Metastasierungsfähigkeit verändern.
Fähigkeit zur Besiedlung von Sekundärgeweben
Die Besiedlung von Sekundärgeweben ist das Kennzeichen von metastasierendem Krebs. In der Hurst-Welch-Studie wird davon ausgegangen, dass eine oder mehrere Tumorzellen, die sich vom Primärtumor ablösen und überleben, aber nicht an anderer Stelle im Körper Fuß fassen, keine Metastasen bilden können.
WELCHE BEHANDLUNGSMÖGLICHKEITEN GIBT ES BEI METASTASIERENDEM KREBS?
Metastasierender Krebs ist schwieriger zu behandeln als Krebs im Frühstadium. Die Behandlungsmöglichkeiten sind bei jeder Krebsart sehr unterschiedlich. In der Tat gibt es keine einzige anerkannte Behandlung für Krebs oder Metastasen. Mit den Fortschritten, die die Forschung bei der Behandlung macht, sind bestimmte Arten von metastasierendem Krebs zunehmend behandelbar.
In einigen klinischen Situationen können Metastasen auf bestimmte Weise behandelt werden.
Bei Hirnmetastasen;
Je nach Anzahl der Tumore und dem Ausmaß der Erkrankung im übrigen Körper kommen als Behandlungsmöglichkeiten eine Operation (in sehr speziellen Fällen), eine Strahlentherapie, eine Gamma-Knife-Operation, Smart-Therapien, eine Chemotherapie und/oder Steroide in Frage.
Bei Knochenmetastasen
Wenn Knochenmetastasen keine Schmerzen verursachen oder Brüche drohen, können sie während der systemischen Behandlung überwacht oder mit Medikamenten behandelt werden. Wenn starke Schmerzen auftreten oder der Knochen brüchig ist, kann eine Operation und/oder eine Strahlentherapie am Ort der Schädigung durchgeführt werden. Es gibt nicht-chemotherapeutische Medikamente, von denen bekannt ist, dass sie das Risiko von Schmerzen und Knochenbrüchen aufgrund von Knochenmetastasen verringern.
Bei Lungenmetastasen
Die Behandlung von Lungenmetastasen hängt von der Anzahl und Größe der Metastasen ab und davon, wie der Primärkrebs behandelt wird. In den meisten Fällen werden sie auf die gleiche Weise (mit den gleichen Medikamenten) behandelt wie der Primärkrebs. Wenn sich durch die Metastasen Flüssigkeit um die Lunge herum bildet, kann ein Verfahren zur Entfernung der Flüssigkeit durchgeführt werden, um das Atmen zu erleichtern (Thorazentese), und ein Verfahren zur Abdichtung der Lungenmembranen, um zu verhindern, dass sich erneut Flüssigkeit bildet (Pleurodese).
Bei Lebermetastasen
Es gibt verschiedene Möglichkeiten, Lebermetastasen zu behandeln, je nach Art und Ausmaß des Primärkrebses sowie der Anzahl und Größe der Lebermetastasen. In den meisten Fällen werden Lebermetastasen auf die gleiche Weise (mit den gleichen Medikamenten) behandelt wie der Primärkrebs.
Bei begrenzter Erkrankung, sowohl primär als auch metastatisch, gibt es verschiedene neue Ansätze, z. B. Operation und Radiofrequenzablation (RFA), Radio- oder Chemoembolisation (wie TARE, TAKE), Mikrosphärentherapie. Eine Lebertransplantation ist bei einer metastasierten Erkrankung in der Regel keine Option.
Hinweis In Fällen, in denen der Krebs nicht geheilt werden kann, besteht die Behandlung hauptsächlich darin, das Wachstum des Krebses zu verlangsamen oder die von ihm verursachten Symptome zu reduzieren oder zu lindern.
WAS SIND DIE STADIEN DER METASTASIERUNG?
Die Ausbreitung von Krebszellen auf neue Körperteile erfolgt in den folgenden Stadien:
- Abtrennung vom Primärtumor
- Invasion von Geweben in der Umgebung der ursprünglichen Läsion und Durchdringung ihrer Basalmembran
- Eintritt in Blutgefäße und Überleben im Blut (die Ausbreitung durch Blutgefäße wird als hämatogene Ausbreitung bezeichnet)
- Eindringen in die Lymphgefäße oder in die Bauchhöhle (so genannte lymphatische Ausbreitung, die sich über die Lymphbahnen ausbreitet)
- Lunge, Leber, Gehirn, Knochen usw. erreichen entfernte Organe
- Die Bildung einer neuen Läsion mit neuen Blutgefäßen, die den Tumor versorgen (die Bildung neuer Blutgefäße wird als Angiogenese bezeichnet).
WIE KANN MAN DIE METASTASIERUNG KONTROLLIEREN?
Einige Krebsarten sind bereits zum Zeitpunkt der Diagnose metastasiert, während andere erst metastasiert werden, nachdem der Krebs fortgeschritten ist oder einen Rückfall erlitten hat. Ärzte verwenden verschiedene medizinische Tests, um die Metastasierung festzustellen:
Bei den Labortests werden Körpergewebe, Blut, Urin oder andere Substanzen im Körper untersucht. Diese Tests helfen dem Pflegeteam zu wissen, wie die Organe der Person funktionieren.
Bei bildgebenden Untersuchungen werden Röntgenstrahlen, Magneten, Radiowellen und Computertechnik eingesetzt. Bei diesen Tests werden detaillierte Bilder von Knochen und inneren Organen und Strukturen erstellt, um nach Krebs zu suchen.
WARUM IST DIE METASTASIERUNG GEFÄHRLICH?
Die Metastasierung ist von großer Bedeutung, da die meisten Krebstodesfälle auf die Ausbreitung des Primärtumors auf entfernte Stellen zurückzuführen sind. In den meisten Fällen haben Krebspatienten mit lokalisierten Tumoren eine bessere Überlebenschance als solche mit metastasierten Tumoren.
Neue Erkenntnisse deuten darauf hin, dass bei 60 bis 70 Prozent der Patienten der Metastasierungsprozess bereits zum Zeitpunkt der Diagnose begonnen hat. Darüber hinaus besteht auch bei Patienten, die zum Zeitpunkt der Diagnose keine Anzeichen für eine Tumorausbreitung aufweisen, das Risiko einer Metastasierung.
WAS IST DIE METASTASEN-SAMEN-BODEN-THEORIE?
Einige Organe sind anfälliger für die Metastasierung von Primärtumoren als andere. Dies wurde erstmals von Stephen Paget vor einem Jahrhundert im Jahr 1889 als “Saat und Boden”-Theorie diskutiert. So sind beispielsweise die Knochen der bevorzugte Ort für Prostatakrebs, Dickdarmkrebs breitet sich in der Leber aus, Magenkrebs kann in die Eierstöcke metastasieren. Die Theorie besagt, dass es für Krebszellen schwierig ist, außerhalb ihres Primärherdes zu überleben. Mit anderen Worten: Krebszellen müssen einen Ort mit ähnlichen Eigenschaften finden, um sich ausbreiten zu können. So benötigen Brustkrebszellen beispielsweise Kalziumionen aus der Muttermilch, um sich zu vermehren. Da Knochen reich an Kalzium sind, können sie daher ein Ausbreitungsort sein.
Das maligne Melanom unterstützt Melanozyten und Nerven und kann sich daher auf das Gehirn ausbreiten, da Nervengewebe und Melanozyten aus der gleichen Zelllinie im Embryo stammen.
Die Theorie von “Samen und Boden” wurde 1928 von James Ewing in Frage gestellt. Ewing schlug vor, dass die Metastasierung auf rein anatomische und mechanische Weise erfolgt. Ewing postulierte eine Ausbreitung über Lymphbahnen und Blutgefäße und stellte fest, dass Krebszellen regionale Lymphknoten in der Nähe des Primärtumors befallen.
KANN DIE METASTASIERUNG VERHINDERT WERDEN?
Das Risiko, an einem Sekundärkarzinom zu erkranken, hängt von vielen Faktoren ab, z. B. von der Art der Krebserkrankung und dem Alter des Patienten. Während es möglich ist, die Metastasierung bei einer bedeutenden Gruppe von Patienten zu verhindern, ist es leider noch nicht möglich, sie vollständig zu vermeiden.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST MAGENKREBS?
Magenkrebs, die vierthäufigste Krebsart unter allen Krebsarten, ist in jedem Teil des Magens lokalisiert und kann in der Regel auf Organe wie Lymphknoten, Leber und Lunge übergreifen. Magenkrebs entsteht durch die Entwicklung von bösartigen Tumoren in der Magenschleimhaut, die verschiedene Ursachen haben. Magenkrebs, der zu den häufigsten Krebsarten in unserem Land gehört, kostet jedes Jahr 800 Tausend Menschen in der Welt das Leben. Magenkrebs, der bei Männern häufiger vorkommt als bei Frauen, kann dank der technologischen Entwicklungen der letzten Jahre frühzeitig diagnostiziert und mit den richtigen Behandlungsmethoden kontrolliert werden. Mit fachkundiger Kontrolle und richtiger Ernährung kann man Magenkrebs vorbeugen und ihn loswerden.
WAS SIND DIE SYMPTOME VON MAGENKREBS?
Magenkrebs kann in der Anfangsphase keine Symptome verursachen. Die ersten Symptome von Magenkrebs sind Verdauungsstörungen und Blähungen. Eine Abneigung gegen fleischhaltige Speisen gehört ebenfalls zu den Symptomen von Magenkrebs. In den späteren Stadien von Magenkrebs werden Bauchschmerzen, Übelkeit, Erbrechen, Blähungen nach dem Essen und Gewichtsverlust beobachtet. Vor allem Patienten über 40 Jahre, die bisher noch keine ähnlichen Beschwerden hatten, sollten unbedingt auf Verdauungsstörungen und Gewichtsverlust achten.
Die Symptome von Magenkrebs sind sehr wichtig, um die Krankheit in einem frühen Stadium zu erkennen. Sobald Sie verschiedene Störungen des Verdauungssystems, Schmerzen in der Magengegend und Verdauungsbeschwerden bemerken, ist es sehr wichtig, einen Facharzt aufzusuchen, um Magenkrebs in einem frühen Stadium zu erkennen.
Wir können die Symptome von Magenkrebs kurz wie folgt auflisten.
- Übersäuerung und Aufstoßen: Erhöhte Magensäure und Aufstoßen sind sehr häufige Symptome bei Magenkrebs. Das bedeutet jedoch nicht, dass jeder, der diese Beschwerden hat, auch Magenkrebs hat.
- Völlegefühl Eines der wichtigsten Symptome von Magenkrebs ist das Sättigungsgefühl, das früher als gewöhnlich auftritt, wenn man isst. Anhaltendes Sättigungsgefühl kann zu Gewichtsverlust führen.
- Blutungen und Müdigkeit: Magenkrebs kann im Frühstadium Blutungen im Magen verursachen. Anhaltende Blutungen können auch eine Blutarmut (Anämie) verursachen. Wenn die Zahl der roten Blutkörperchen abnimmt, können Sie blasser aussehen und atemlos werden. In einigen Fällen kann es auch zum Erbrechen von Blut kommen.
- Blutgerinnsel: Menschen mit Magenkrebs haben ein höheres Risiko, Blutgerinnsel zu entwickeln. Daher ist es bei plötzlichen Brustschmerzen, Kurzatmigkeit und Schwellungen der Beine dringend notwendig, die Bildung von Blutgerinnseln zu verhindern. In diesem Fall ist es notwendig, sofort einen Facharzt aufzusuchen.
- Übelkeit und Schluckbeschwerden: Übelkeit und Schluckbeschwerden sind sehr wichtige Symptome von Magenkrebs. Sie sind zwei der wichtigsten Symptome, die bei mehr als der Hälfte der Menschen mit Magenkrebs auftreten. Diese Symptome werden von Schmerzen im Magen oder unter dem Brustbein begleitet.
- Symptome von fortgeschrittenem Magenkrebs: Wenn Magenkrebs fortschreitet, kann es zu Blut im Stuhl, Flüssigkeit im Bauch, Appetitlosigkeit und Gewichtsverlust kommen.
Magenkrebs kann manchmal schleichend fortschreiten, ohne dass es zu Symptomen kommt. Wenn die Symptome erst spät auftreten, hat der Patient möglicherweise die Chance auf einen chirurgischen Eingriff verloren. Daher ist eine frühzeitige Diagnose bei Magenkrebs sehr wichtig.
WAS VERURSACHT MAGENKREBS?
Magenkrebs kann viele Ursachen haben. Magenkrebs kann sich in jedem Teil der Verdauungsorgane entwickeln und ausbreiten. Auch Verhaltensweisen und Risikofaktoren, die alle am Verdauungsprozess beteiligten Organe betreffen, können Magenkrebs auslösen. Diese lassen sich wie folgt aufzählen;
- Ernährung: Die wichtigste Ursache für Magenkrebs sind falsche Ernährungsgewohnheiten. Vor allem gegrilltes Fleisch und ähnliche Lebensmittel, versalzenes und eingelegtes Gemüse sowie verarbeitete Lebensmittel bereiten den Boden für Magenkrebs. Der beste Weg, Magenkrebs vorzubeugen, ist eine mediterrane Ernährung. Biologisches und frisches Obst und Gemüse schützen vor Magenkrebs.
- Infektionen: Ein wichtiger Faktor, der Magenkrebs verursacht, ist eine H.plori-Infektion.
Eine H.plori-Infektion wurde bei 65-85 % der Fälle von Magenkrebs beobachtet. Magenkrebs wird auch in 2 % der Fälle mit H.plori-Infektion gefunden.
- Rauchen und Alkohol: Eine vermeidbare Ursache von Magenkrebs ist das Rauchen. Besonders wenn es zusammen mit Alkohol konsumiert wird, erhöht es die Wahrscheinlichkeit von Magenkrebs. Das Risiko von Magenkrebs kann durch den Verzicht auf Rauchen und Alkohol verringert werden.
- Genetik: Genetische Faktoren spielen bei Magenkrebs wie bei allen anderen Krebsarten eine wichtige Rolle. Genetische Faktoren treten bei 10 % der Magenkrebsfälle in den Vordergrund.
WIE ERKENNT MAN MAGENKREBS? WIE WIRD ER DIAGNOSTIZIERT?
Eine frühzeitige Diagnose von Magenkrebs ist für den Erfolg der Behandlung sehr wichtig. Aus diesem Grund ist es sehr wichtig, dass Menschen mit Magenproblemen in der Frühphase mit einer Endoskopie unter der Kontrolle von Fachärzten überwacht werden. Bei der Endoskopie kann Ihr Arzt die Speiseröhre, den Magen und die ersten Teile des Dünndarms mit einem langen Schlauch mit einer beleuchteten Kamera betrachten. Wenn Teile davon abnormal erscheinen, wird eine Biopsie entnommen, um eine endgültige Diagnose zu stellen. Mit dem richtigen Einsatz der Endoskopie ist es möglich, die Krankheit in einem frühen Stadium zu erkennen. Neben der Endoskopie sind Röntgenkontrastaufnahmen und Computertomographie weitere wichtige diagnostische Verfahren, die die Diagnose von Magenkrebs ermöglichen.
Weitere Untersuchungen sind erforderlich, um das Stadium des Magenkrebses zu bestimmen und um festzustellen, ob er sich auf andere Organe ausgebreitet hat. Diese Tests sind auch notwendig, um die für den Patienten am besten geeignete Behandlung zu bestimmen. Tests wie Computertomographie (CT) zur Bestimmung der Größe und Lage des Magenkrebses, Laparoskopie und MRT zur Überprüfung, ob der Krebs gestreut hat, PET-CT, Nieren-Ultraschall, Röntgenaufnahmen der Brust können durchgeführt werden.
ARTEN VON MAGENKREBS
Nach der Diagnose von Magenkrebs und der Bestimmung der Krebsart wird über die anzuwendende Behandlung entschieden. Die häufigste Form von Magenkrebs ist das Adenokarzinom. Wir können die Arten von Magenkrebs wie folgt erklären;
- Adenokarzinom: 95 von 100 Magenkrebsarten sind Adenokarzinome. Das Adenokarzinom, die häufigste Form von Magenkrebs, beginnt in den Drüsenzellen der Magenschleimhaut.
- Plattenepithelkarzinom: Beim Plattenepithelkarzinom, das wie ein Adenokarzinom behandelt wird, handelt es sich um hautzellähnliche Zellen zwischen den Drüsenzellen, aus denen die Magenschleimhaut besteht.
- Lymphom des Magens Das Lymphom des Magens ist sehr selten, aber es unterscheidet sich von anderen Krebsarten des Magens.
- Gastrointestinale Stromatumoren (GIST):Seltene gastrointestinale Stromatumoren (GIST) können gutartig oder bösartig sein. Diese Art von Krebs tritt in den Bindegewebszellen auf, die die Organe des Verdauungssystems (Magen-Darm-Trakt) stützen, am häufigsten im Magen.
- Neuroendokrine Tumore (NETs):Neuroendokrine Tumore (NETs) können gutartig oder bösartig (Krebs) sein. Diese seltene Krebsart wächst in der Regel in hormonproduzierenden Geweben im Verdauungssystem.
WIE WIRD MAGENKREBS BEHANDELT?
Nachdem die Diagnose Magenkrebs gestellt und die Art des Krebses bestimmt wurde, wird über die anzuwendende Behandlung entschieden. Die Behandlung von Magenkrebs erfordert einen multidisziplinären Ansatz. Ein Erfolg kann nur durch die Zusammenarbeit von Experten und ein gut ausgestattetes Krankenhaus erzielt werden. Bei der Behandlung von Magenkrebs ist der wichtigste Teil der Behandlung die angemessene Entfernung des krebserregenden Tumors. Erfolgreiche chirurgische Eingriffe in einem frühen Stadium sind sehr wichtig für die Lebenserwartung des Patienten. Bei der Operation kann ein Teil oder der gesamte Magen des Patienten entfernt werden. Bei Patienten, deren gesamter Magen entfernt wurde, wird aus dem Darm ein neuer Magen hergestellt, und der Patient kann sein Leben normal weiterführen. Patienten, die auf diese Weise leben, erhalten Ernährungsempfehlungen, die vorsehen, dass sie wenig und oft essen. Bei einigen Patienten kann nach der Entfernung des Magens eine Strahlentherapie oder eine medikamentöse Behandlung durchgeführt werden, je nach der vom Arzt festgestellten Form des Krebses.
HYPERTHERMIE-BEHANDLUNG BEI MAGENKREBS
Bei den Behandlungen, die je nach Stadium des Magenkrebses variieren, wird eine Chemotherapie durchgeführt, wenn der Tumor auf die Lymphknoten übergegriffen hat. Eine vor der Operation durchgeführte Chemotherapie ist insbesondere bei Magenkrebs ab dem zweiten Stadium sehr wichtig, um die Wirksamkeit nach der Operation zu erhöhen. Darüber hinaus bietet die “Hyperthermie” genannte heiße Chemotherapie bei der Behandlung von Magenkrebs erfolgreiche Ergebnisse bei geeigneten Patienten. Die Hyperthermie genannte heiße Chemotherapie ist eigentlich eine Behandlungsmethode, die seit 20-30 Jahren angewendet wird. Die Methode, die erstmals bei Krebserkrankungen von Frauen angewandt wurde, wird in letzter Zeit auch häufig bei Dickdarm- und Magenkrebs eingesetzt.
Magenkrebs-Chirurgie
Bei der Magenoperation, die etwa 2-5 Stunden dauert, wird ein großer Teil des Magens oder der gesamte Magen entfernt. Nach der Magenoperation wird empfohlen, in kurzen Abständen und in kleinen Portionen zu essen und die Nahrung sehr gut zu kauen und zu schlucken. Nach der Magenkrebsoperation und -behandlung sollten die regelmäßigen Kontrollen fortgesetzt werden.
HÄUFIG GESTELLTE FRAGEN ZU MAGENKREBS
Verursachen gegrilltes Fleisch und geräucherte Lebensmittel Magenkrebs?
Gegrilltes Fleisch ist zwar sehr beliebt, aber wenn man das Fleisch bis zur Verbrennung kocht und beim Marinieren zu viel Salz verwendet, wird das Fleisch zu einem krebserregenden Lebensmittel. Vor allem in den östlichen Regionen trifft man immer häufiger auf geräucherte Lebensmittel. Geräuchertes Fleisch, Fisch, Käse, eingelegte Lebensmittel, rohes Fleisch, nitrathaltige Lebensmittel, Konserven und zubereitete Lebensmittel können zu Magenkrebs führen.
Wie wirkt sich heißer Tee auf den Magen aus?
Obwohl Tee in der Regel heiß getrunken wird, verursacht er, wenn er zu heiß getrunken wird, Reizungen der Speiseröhre und der Magenschleimhaut. Diese Reizung bereitet auch den Boden für Krebs vor. Heißer Tee ist eine der häufigsten Ursachen für Magenkrebs in der Schwarzmeer- und der östlichen Schwarzmeerregion.
Welcher Zusammenhang besteht zwischen Rauchen und Magenkrebs?
Magenkrebs tritt häufiger bei Rauchern auf. Magenkrebs ist jedoch eine Krebsart, die bei Menschen mit Polypen im Magen, bei Menschen mit Helicobacter pylori-Infektion oder in asiatischen Gesellschaften, die viel geräucherte Lebensmittel und Essiggurken konsumieren, häufiger auftritt. Die Häufigkeit von Magenkrebs nimmt jedoch ab, wenn die Menschen mehr Zugang zu frischem Obst und Gemüse haben.
Können sich Gastritis und Magengeschwüre zu Krebs entwickeln?
Die Helicobacter pylori-Infektion verursacht Gastritis und Geschwüre und ist eine der Ursachen für Magenkrebs. Bei Gastritis und Geschwüren muss dieses Bakterium beseitigt werden. Um Magenkrebs vorzubeugen, sollten außerdem Rauchen und Alkoholkonsum vermieden werden. Zink und Blei im Wasser, das Sie trinken, ist ein wichtiger Faktor, der Magenkrebs verursacht. Darüber hinaus sind Umweltfaktoren wie Talk und Asbest in der Atemluft ebenfalls Risikofaktoren.
Haben Magenkrebspatienten einen schlechten Atem?
In den Magenausgängen von Menschen mit Magenkrebs entsteht ein totes Gewebe. An der Stelle, an der sich dieses tote Gewebe befindet, entstehen Bakterien, die sich von hier aus ernähren. Diese Situation verursacht einen extrem schlechten Geruch. Wenn der Magenkrebs jedoch schon so weit fortgeschritten ist, dass er Mundgeruch verursacht, bedeutet dies, dass er zuvor bereits andere Befunde geliefert hat. Die Person, die unter Mundgeruch leidet, muss also nicht befürchten, dass die Ursache für diesen Geruch Magenkrebs ist.
Wie bereitet man sich auf eine Chemotherapie bei Magenkrebs vor?
Es ist wichtig, während der Behandlung eine Begleitperson zu haben. Besonders an den Tagen der Chemotherapie ist es wichtig, eine Begleitperson zu haben, auf die Hygiene zu achten und sich auf die Chemotherapie vorzubereiten, indem man die Haare kurz schneidet, da sie ausfallen werden.
Wie lange dauert die Erholungsphase nach einer Magenkrebsoperation?
Es kann einige Zeit dauern, bis man sich nach einer Magenoperation an eine neue Ernährung gewöhnt hat. Während dieser Zeit können Bauchkrämpfe in einem unangenehmen Ausmaß auftreten. Im Allgemeinen können onkologische Behandlungen nach einem Monat in der Erholungsphase nach einer Magenkrebsoperation eingenommen werden.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST BAUCHSPEICHELDRÜSENKREBS?
Die Bauchspeicheldrüse, eine 15 Zentimeter lange bifunktionelle Drüse in der Bauchhöhle, ist von Magen, Dünndarm, Milz und Leber umgeben. Die Bauchspeicheldrüse, die zwei grundlegende Aufgaben hat, die als exokrin und endokrin bezeichnet werden, verfügt über zwei getrennte Zellgruppen, die es ihr ermöglichen, diese Aufgaben zu erfüllen. Das Exokrinum sondert den Saft ab, der die Verdauung unterstützt, und leitet ihn an den Dünndarm weiter. Auf diese Weise werden die in der Nahrung enthaltenen Kohlenhydrate, Proteine und Fette aufgespalten und als Energie gespeichert. Die endokrine Funktion versucht, den Glukosespiegel im Blut auf einem bestimmten Niveau zu halten, indem sie Glykogen- und Insulinhormone ausschüttet.
WAS VERURSACHT BAUCHSPEICHELDRÜSENKREBS?
Bauchspeicheldrüsenkrebs entsteht, wenn Zellen in der Bauchspeicheldrüse beginnen, sich unkontrolliert zu vermehren. Meistens entsteht Bauchspeicheldrüsenkrebs in dem Bereich, in dem sich die exokrinen Zellen befinden, die die Pankreasgänge umgeben. Bauchspeicheldrüsenkrebs, der in diesem Bereich beginnt, ist ein exokriner Tumor, der auch als Adenokarzinom bezeichnet wird. Eine viel seltenere Form von Bauchspeicheldrüsenkrebs, der endokrine Tumor, beginnt in den Inselzellen.
ARTEN VON BAUCHSPEICHELDRÜSENKREBS
Bei Bauchspeicheldrüsenkrebs gibt es den seltenen “neuroendokrinen” oder “Inselzell”-Typ, der in hormonproduzierenden Zellen auftritt, und den häufigeren “exokrinen” Typ, der in den Gängen auftritt, die den Pankreassaft transportieren. Beim exokrinen Bauchspeicheldrüsenkrebs sind zystische Tumore und azinäre Zelltypen weniger häufig. “Ampulla-Vateri-Tumore, die an der Einmündung der Bauchspeicheldrüse und des Gallengangs in den Zwölffingerdarm auftreten können, werden erst nach einer Operation als Bauchspeicheldrüsenkrebs angesehen.
RISIKOFAKTOREN BEI BAUCHSPEICHELDRÜSENKREBS
Obwohl die Ursachen von Bauchspeicheldrüsenkrebs nicht genau bekannt sind, gelten Rauchen und genetische Faktoren als die wichtigsten Risikofaktoren für die Krebsentstehung.
Die wichtigsten bekannten Ursachen für Bauchspeicheldrüsenkrebs lassen sich wie folgt auflisten;
- Dreißig Prozent der Bauchspeicheldrüsenkrebsfälle werden durch Rauchen verursacht.
- Fortgeschrittenes Alter ist ein wichtiger Risikofaktor für Bauchspeicheldrüsenkrebs.
- Eine Ernährung, die hauptsächlich aus Eiweiß besteht und wenig Obst und Gemüse enthält, erhöht das Krebsrisiko.
- Menschen mit einem hohen Body-Mass-Index (BMI) haben ein höheres Risiko, an Bauchspeicheldrüsenkrebs zu erkranken.
- Bauchspeicheldrüsenkrebs tritt häufiger bei Menschen auf, die Benzin und Chemikalien ausgesetzt sind.
- Eine chronische Pankreatitis, die über einen längeren Zeitraum unbehandelt bleibt, erhöht das Risiko, an Bauchspeicheldrüsenkrebs zu erkranken.
- Diabetes erhöht die Rate an Bauchspeicheldrüsenkrebs im Vergleich zu gesunden Personen um das Doppelte.
WAS SIND DIE SYMPTOME VON BAUCHSPEICHELDRÜSENKREBS?
Bauchspeicheldrüsenkrebs kann in den ersten Stadien ohne Symptome verlaufen. Wenn sich erste Symptome zeigen, ist die Krankheit oft schon fortgeschritten.
Zu den Symptomen von Bauchspeicheldrüsenkrebs gehören Übelkeit, Appetitlosigkeit, Gewichtsverlust, sich langsam entwickelnde Gelbsucht, Verstopfung und Schmerzen im Magenausgang. Bei Krebs, der im Kopf der Bauchspeicheldrüse lokalisiert ist, werden eine schmerzlose Gelbsucht und eine helle, glaskittartige Farbe der großen Blase beobachtet. Schmerzen im Rücken, die bei Bauchspeicheldrüsenkrebs auftreten können, sind in der Regel ein Vorbote einer lokalen Ausbreitung der Krankheit und treten meist im Körper und im Schwanz der Bauchspeicheldrüse auf und gelten als Zeichen für ein Fortschreiten der Krankheit. Weniger häufige Krankheitssymptome sind Diabetes, Durchfall und Depressionen, die wir als die “3 Ds” kennen. Diese Symptome können auch bei Bauchspeicheldrüsenkrebs beobachtet werden;
- Verstärkte Unterleibsschmerzen nach dem Essen oder beim Einnehmen einer waagerechten Position
- Gasschmerzen, Blähungen
- Erbrechen und Appetitlosigkeit
- Dunkler oder blutiger Urin
- Allgemeines Unwohlsein
- Vergrößerung der Leber und der Gallenblase
- Juckreiz
- Krampfadern (Varizen)
Bei solchen Symptomen ist es wichtig, sofort einen Arzt aufzusuchen.
DIAGNOSE VON BAUCHSPEICHELDRÜSENKREBS
Die Früherkennung von Bauchspeicheldrüsenkrebs ist nicht immer einfach. Denn in den frühen Stadien des Bauchspeicheldrüsenkrebses gibt es keine Symptome und Befunde. Die Tatsache, dass die Symptome von Bauchspeicheldrüsenkrebs den Symptomen vieler Krankheiten ähneln und dass die Bauchspeicheldrüse hinter Organen wie Magen, Dünndarm und Leber verborgen ist, trägt ebenfalls dazu bei, dass die Früherkennung nicht möglich ist.
Bauchspeicheldrüsenkrebs wird in der Regel durch eine detaillierte Bildgebung der Bauchspeicheldrüse und ihrer Umgebung mit Hilfe verschiedener Tests diagnostiziert. Das Staging dient dazu, das Ausmaß der Ausbreitung von Krebszellen in und aus der Bauchspeicheldrüse zu bestimmen (Ausmaß der Krebsausbreitung). Für das Staging werden radiologische Bildgebungsverfahren eingesetzt. Für einen korrekten Behandlungsplan bei Bauchspeicheldrüsenkrebs sind eine frühe Diagnose und das Krebsstadium sehr wichtig.
Die zur Diagnose von Bauchspeicheldrüsenkrebs angewandten Tests lassen sich wie folgt auflisten;
- Anamnese und körperliche Untersuchung des Patienten: Der Patient wird einer allgemeinen körperlichen Untersuchung unterzogen und nach früheren Krankheiten befragt. Krankheiten wie Diabetes und Pankreatitis, die Risikofaktoren für Bauchspeicheldrüsenkrebs sind, werden untersucht.
- Blutuntersuchung Bei einer Blutuntersuchung wird die Menge bestimmter Substanzen wie Bilirubin gemessen. Messungen, die über oder unter dem Normalwert liegen, gelten als Anzeichen für eine Erkrankung der Organe oder Gewebe, die den Stoff absondern.
- Tumormarker: Um das Vorhandensein von Krebs im Blut oder Gewebe festzustellen, wird eine Gewebe-, Urin- oder Blutprobe entnommen und es werden einige Messungen durchgeführt. Bei diesen Messungen können zwei Tumormarker namens CA 19. 9 und CEA hilfreiche Informationen über Bauchspeicheldrüsenkrebs liefern. Diese Tests dienen eher der Nachsorge von Patienten, bei denen Bauchspeicheldrüsenkrebs diagnostiziert wurde, als dass sie eine Diagnose stellen. Gesunde Personen werden solchen Tests nicht unterzogen.
- Magnetresonanztomographie (MRT): Wie bei allen Krebsarten ist die MRT auch bei Bauchspeicheldrüsenkrebs eines der wichtigsten bildgebenden Verfahren. Sie ist besonders effektiv, um die Beziehungen zwischen der Bauchspeicheldrüse und den umliegenden Geweben sowie der Leber zu verstehen.
- Computertomographie (CT): Sie ist eine der wichtigsten bildgebenden Methoden in der Krebsdiagnose. Bei der CT, auch Computertomographie oder axiale Computertomographie genannt, kann dem Patienten intravenös oder oral Kontrastmittel verabreicht werden, um die Bilder zu verbessern.
- Positronen-Emissions-Tomographie (PET-Scan): Die PET-Untersuchung wird ebenfalls eingesetzt, um die Lage und Ausdehnung des Tumors zu bestimmen. Dem Patienten wird eine kleine Menge radionuklidmarkierter Glukose injiziert, und die Stellen, an denen sich Glukose ansammelt, werden ermittelt. Da Krebszellen mehr Glukose anreichern, erscheinen sie dunkler in der Farbe und werden erkannt.
- Abdomen-Ultraschall Bei der abdominalen Ultraschalluntersuchung werden hochenergetische Schallwellen in den Bauchraum gesendet. Diese Schallwellen treffen auf das Gewebe und erzeugen ein Echo. So werden die Bauchhöhle und die Organe sichtbar gemacht.
- Endoskopischer Ultraschall (EUS): Dabei handelt es sich um eine Diagnosemethode, bei der im Allgemeinen ein Endoskopiegerät mit einer Licht- und Abbildungslinse am Ende durch den Anus oder den Mund eingeführt wird. Das Gerät nimmt die von Hochfrequenz-Schallwellen erzeugten Echos auf und liefert ein detailliertes Bild der Organe, das so genannte Sonogramm, so dass bei Bedarf Biopsien aus verdächtigen Bereichen entnommen werden können.
- Endoskopische retrograde Cholangiopankreatikographie (ERCP): Mit dieser Methode können der Bauchspeicheldrüsengang sowie der Hauptgallengang und die Gallengänge vom Zwölffingerdarm aus dargestellt werden. Ein kleiner röhrenförmiger Katheter wird durch das Endoskop in die Bauchspeicheldrüsengänge eingeführt, und es wird Kontrastmittel injiziert, um ein detailliertes Bild der Gallengänge zu erhalten.
- Perkutane transhepatische Cholangiographie (PTC): Mit Hilfe der Ultraschalluntersuchung wird ein Katheter durch die Haut eingeführt, um Zugang zu den Gallengängen zu erhalten. Die Gallengänge werden mit Hilfe von Röntgenstrahlen und einem durch den Katheter verabreichten Kontrastmittel sichtbar gemacht. Falls erforderlich, wird der Katheter zur Ableitung der Galle belassen. Dieses Verfahren wird nur angewandt, wenn eine ERCP nicht durchgeführt werden kann.
- Laparoskopie: Dabei handelt es sich um eine chirurgische Methode, bei der die Krankheitssymptome kontrolliert werden, indem der Bauchraum und die inneren Organe von innen betrachtet werden. Durch millimetergroße Schnitte in der Bauchdecke werden röhrenförmige Instrumente, sogenannte Ports, eingeführt. Mit der Kamera und den Instrumenten, die durch diese Ports eingeführt werden, wird das Innere des Abdomens betrachtet. Die Lage des Tumors und ob er sich auf das Bauchfell oder andere Organe ausgebreitet hat, kann so sichtbar gemacht werden. Zur Diagnose kann eine Biopsie entnommen werden.
- Biopsie Bei der Biopsie wird eine Zell- oder Gewebeprobe entnommen, um den Krebsbefund im Gewebe genauer zu untersuchen. Bei Bauchspeicheldrüsenkrebs gibt es mehrere verschiedene Biopsieverfahren. Es ist möglich, mit einer dünnen Nadel während einer Röntgen- oder Ultraschalluntersuchung eine Zellprobe aus der Bauchspeicheldrüse zu entnehmen, oder das gleiche Verfahren kann während einer Laparoskopie durchgeführt werden.
BAUCHSPEICHELDRÜSENKREBS-STADIEN
Krebszellen verbreiten sich über das Gewebe, das Lymphsystem und das Blut im ganzen Körper. Krebszellen können sich vom Haupttumor lösen und durch Blutgefäße oder Lymphbahnen in andere Teile des Körpers wandern und dort andere Tumore bilden. Dies wird als Metastasierung bezeichnet. Sekundäre oder metastatische Tumore haben die gleichen Merkmale wie der Haupttumor. Die Stadien des Bauchspeicheldrüsenkrebses sind mit bildgebenden Verfahren nur schwer zu erkennen. Daher ist es sehr wichtig, vor einem chirurgischen Eingriff zu entscheiden, ob der gesamte Krebstumor entfernt werden soll. So können wir die Stadien des Bauchspeicheldrüsenkrebses erklären;
0: In diesem Stadium gibt es keine Ausbreitung. Und der Bauchspeicheldrüsenkrebs ist auf eine einzige Zellschicht begrenzt. Bauchspeicheldrüsenkrebs ist weder auf bildgebenden Verfahren noch mit bloßem Auge sichtbar.
Stadium I: In diesem Stadium wächst der Krebs lokal. Bauchspeicheldrüsenkrebs ist auf die Bauchspeicheldrüse beschränkt.
Stadium II: Bauchspeicheldrüsenkrebs wächst außerhalb der Bauchspeicheldrüse oder in der Nähe der Lymphknoten.
Stadium III: In diesem Stadium hat sich der Bauchspeicheldrüsenkrebs bereits weiter ausgebreitet. Der Tumor breitet sich auf nahe gelegene Hauptgefäße, Lymphknoten oder Nerven aus, metastasiert aber nicht.
Stadium IV: In diesem Stadium breitet sich der Bauchspeicheldrüsenkrebs auf entfernte Organe wie die Leber aus.
BAUCHSPEICHELDRÜSENKREBS-BEHANDLUNG
Die Behandlung von Bauchspeicheldrüsenkrebs besteht aus 3 verschiedenen Methoden: Operation, Chemotherapie und Strahlentherapie. Daher sind bei der Behandlung von Bauchspeicheldrüsenkrebs verschiedene Spezialisten beteiligt. Die Behandlung von Bauchspeicheldrüsenkrebs wird von Ärzten durchgeführt, die auf Gastroenterologie, Chirurgie, medizinische Onkologie, Radioonkologie, interventionelle Radiologie und viele andere Bereiche spezialisiert sind.
Die meisten Patienten mit Bauchspeicheldrüsenkrebs kommen für eine kurative Operation nicht in Frage, da sich der Krebs bereits auf entfernte Organe ausgebreitet hat oder lokal weit verbreitet ist. Diese Patienten unterziehen sich chirurgischen Eingriffen, um behindernde Symptome wie Gelbsucht und Schmerzen zu lindern, die das Leben nicht verlängern, aber eine angenehmere Zeit ermöglichen sollen. Je nach Allgemeinzustand und Begleiterkrankungen der Patienten liegt die durchschnittliche Lebenserwartung von Patienten, bei denen sich der Bauchspeicheldrüsenkrebs auf andere Organe des Körpers ausgebreitet hat, zwischen 3 und 6 Monaten. Bei Patienten mit lokaler Ausbreitung der Krankheit liegt die durchschnittliche Lebenserwartung bei 6 bis 10 Monaten.
Das Stadium der Erkrankung spielt eine sehr wichtige Rolle bei der Festlegung der Behandlung von Bauchspeicheldrüsenkrebs.
Resektabel (für einen chirurgischen Eingriff geeignet, operabel): Wenn der Tumor bei Bauchspeicheldrüsenkrebs resektabel ist, sollte eine Operation durchgeführt werden, die die einzige Methode zur Heilung von Bauchspeicheldrüsenkrebs ist. Auch wenn der Tumor durch einen chirurgischen Eingriff entfernt wird, kann der Bauchspeicheldrüsenkrebs in den meisten Fällen wiederkehren. Eine Chemotherapie mit Gemcitabin (Gemzar) oder 5-FU nach einer Bauchspeicheldrüsenoperation kann das Wiederauftreten des Krebses um bis zu 6 Monate verzögern.
Er ist lokal fortgeschritten: Der Bauchspeicheldrüsenkrebs ist lokal fortgeschritten, hat sich aber nicht auf entfernte Organe ausgebreitet. Wenn der Patient für einen chirurgischen Eingriff nicht geeignet ist, werden die Eingriffe je nach Klinik des Patienten durchgeführt. Bei einem Verschluss der Gallenwege kann ein Stent eingesetzt werden. Ist ein Darmabschnitt durch Krebs blockiert, wird ein neuer Weg zwischen Magen und Dünndarm durch einen Bypass eröffnet.
Metastasiert (weit gestreut): Wenn sich der Bauchspeicheldrüsenkrebs in den Bauchraum, die Leber, die Lunge, die Knochen und das Gehirn ausgebreitet hat, reicht eine Strahlentherapie oder Operation allein nicht aus. Eine der Standardbehandlungsmethoden für Bauchspeicheldrüsenkrebs, der gestreut hat, ist die Chemotherapie. Mit dieser Behandlung wird der Krebs behandelt
verlängert die Lebensdauer des Patienten durch Verkleinerung.
Rezidivierender Bauchspeicheldrüsenkrebs: Wenn der Krebs nach einer Bauchspeicheldrüsenkrebs-Operation in oder in der Nähe desselben Bereichs wieder auftritt, spricht man von einem Rezidiv. Tritt der Krebs an einer entfernten Stelle wieder auf, so geschieht dies zuerst in der Leber. Wenn exokriner Bauchspeicheldrüsenkrebs wieder auftritt, ist die gleiche Behandlung wie bei metastasiertem Krebs vorgesehen, und der Patient wird mit Chemotherapie behandelt.
Neuroendokriner Bauchspeicheldrüsenkrebs (Pnet)
Resektabel (für einen chirurgischen Eingriff geeignet): Wenn ein chirurgischer Eingriff durchgeführt werden kann, wird die geeignete Operationstechnik je nach Art, Größe und Lage des Tumors in der Bauchspeicheldrüse festgelegt. Eine präoperative Laparoskopie kann durchgeführt werden, um das Stadium und die genaue Lage des Tumors zu bestimmen.
Anresektabel (nicht für einen chirurgischen Eingriff geeignet): Neuroendokrine Pankreastumoren wachsen in der Regel langsam. Bei diesen Tumoren wird die Gallium-68-DOTATOC-Methode, eine der molekularen Bildgebungsmethoden, die als endokrine Krebsbildgebung bezeichnet wird, eingesetzt und der Tumor kann untersucht werden. Bei der Behandlung werden zwei Methoden gemeinsam eingesetzt. Um die Probleme zu beseitigen, die durch das vom Tumor ausgeschüttete Hormon verursacht werden, erhält der Patient Protonenpumpenhemmer, sogenannte säuresekretionshemmende Magenmittel. Anschließend werden Chemotherapie, die Anwendung von Smart Drugs und/oder gezielte Radioisotope eingesetzt, um den Tumor zurückzudrängen.
WHIPPLE-OPERATION BEI BAUCHSPEICHELDRÜSENKREBS
Bauchspeicheldrüsenkrebsoperationen gehören zu den schwierigsten und komplexesten Operationen der Chirurgie. Insbesondere wegen des Risikos von Komplikationen, die in der postoperativen Phase auftreten können, ist es für den Patienten von entscheidender Bedeutung, dass sowohl der Chirurg als auch die Krankenhauseinrichtungen angemessen sind.
Die Whipple-Operation bei Bauchspeicheldrüsenkrebs ist eine lebensrettende Operation bei Tumoren des Bauchspeicheldrüsenkopfes, der Gallenwege und des Zwölffingerdarms. Die Whipple-Operation ist ideal für Tumore, die in drei nahe beieinander liegenden und miteinander verbundenen Organen auftreten, um diesen Bereich vollständig zu reinigen. Bei der Whipple-Operation wird eine “Pylorus-Protective-Whipple”-Operation durchgeführt, um das Muskelsystem, auch Magenklappe genannt, zu schützen. Dadurch treten nach der Operation keine Beschwerden des Verdauungssystems auf. Bei der Whipple-Operation werden der Kopf der Bauchspeicheldrüse, fast die Hälfte des Magens, der gesamte Zwölf-Finger-Darm und der an diesen Bereich angrenzende Teil der Gallengänge vollständig entfernt. Der wichtigste Aspekt der Operation ist es, die richtige Koordination dieser Organe untereinander zu gewährleisten. Aus diesem Grund muss die Whipple-Operation von spezialisierten Ärzten durchgeführt werden.
VOR DER OPERATION VON BAUCHSPEICHELDRÜSENKREBS
Etwa 85 Prozent der Patienten, bei denen Bauchspeicheldrüsenkrebs diagnostiziert wird, haben keine Chance auf eine Operation. In diesem Fall werden einige Behandlungsmöglichkeiten eingesetzt. Dazu gehören die Schrumpfung des Tumors vor der Operation und seine Anpassung an den Operationsrand sowie eine unterstützende Behandlung nach der Operation.
STRAHLENTHERAPIE BEI BAUCHSPEICHELDRÜSENKREBS
Die bei der Behandlung von Bauchspeicheldrüsenkrebs am häufigsten eingesetzte Strahlentherapie ist die externe Strahlentherapie. In der Regel werden Chemo- und Strahlentherapie gleichzeitig angewendet, weil sie wirksamer sind. Eine gleichzeitige Chemo- und Strahlentherapie kann dazu beitragen, dass Bauchspeicheldrüsentumore schrumpfen und zerstört werden.
CHEMOTHERAPIE BEI BAUCHSPEICHELDRÜSENKREBS
Die Chemotherapie, d. h. die medikamentöse Behandlung, wird eingesetzt, um das Wachstum und die Teilung der Bauchspeicheldrüsenkrebszellen zu stoppen.
GEZIELTE THERAPIE FÜR BAUCHSPEICHELDRÜSENKREBS
Bei der zielgerichteten Therapie von Bauchspeicheldrüsenkrebs handelt es sich um eine Behandlungsmethode, die auf bestimmte Gene, Proteine oder die Gewebeumgebung abzielt, die zum Wachstum und Überleben des Krebses beitragen.
NANOKNIFE-BEHANDLUNG BEI BAUCHSPEICHELDRÜSENKREBS
Eine wichtige Option für Patienten, die bei Bauchspeicheldrüsenkrebs keine Chance auf eine Operation haben, ist die Nanoknife-Ablationsbehandlung. Dabei handelt es sich um ein Verfahren zur Zerstörung des Tumors, ohne Gewebe wie Gefäße, Nerven und Eingeweide zu schädigen. Die am besten geeignete Patientengruppe bei Bauchspeicheldrüsenkrebs, die einen der wichtigsten Einsatzbereiche der Methode darstellt, sind Patienten, die keine Fernmetastasen haben, aber nicht operiert werden können, weil die umliegenden Gefäße betroffen sind. Bei dieser Patientengruppe, die als lokal fortgeschrittenes Stadium bezeichnet wird, kann Nanoknife das umliegende Tumorgewebe abtöten, ohne die betroffenen Gefäße zu schädigen, und die Patienten wieder für eine Operation geeignet machen oder die Überlebenszeit durch Schrumpfung des Tumors verlängern.
Patienten, die für eine Bauchspeicheldrüsenkrebs-Operation in Frage kommen, sollten vor der Operation einiges beachten. Die Kommunikation zwischen Patient und Arzt vor der Operation, eine vollständige Operation und eine gute Vorbereitung auf die Operation, die Durchführung aller Untersuchungen entsprechend dem Alter und dem Allgemeinzustand des Patienten und die Entscheidungsfindung auf der Grundlage dieser Untersuchungen, die sorgfältige Durchführung der Operationsmethode und der Voruntersuchungen entsprechend dem Zustand des Tumors sind von großer Bedeutung.
WIE GEHT ES NACH DER BEHANDLUNG VON BAUCHSPEICHELDRÜSENKREBS WEITER?
Die Bauchspeicheldrüsenkrebs-Operation ist eine der wichtigsten Operationen der allgemeinen Chirurgie. Ein erfahrenes Operationsteam ist wichtig, damit die Operation erfolgreich durchgeführt werden kann. Manche Menschen müssen nach diesen Operationen den Zuckerkonsum einschränken. Nach der Operation sollte der Patient die Empfehlungen des Arztes befolgen. Die Behandlung richtet sich nach dem Zustand des Patienten und dem Stadium der Krankheit. Auch eine Chemo- und Strahlentherapie kann erforderlich sein. Nach Abschluss der Behandlung wollen die Ärzte den Patienten in bestimmten Abständen wiedersehen. Diese Termine sollten wahrgenommen werden. Den Ärzten sollte genau mitgeteilt werden, welche Beschwerden der Patient hat. Bei den Kontrollen können verschiedene Untersuchungen verlangt werden. Manchmal können nach Beendigung der Behandlung Nebenwirkungen auftreten. Diese müssen den Ärzten mitgeteilt werden. Manchmal kann es aufgrund der Krebserkrankung zu einem Gewichtsverlust kommen. Aus diesem Grund können die Ärzte nach verschiedenen Nahrungsergänzungsmitteln oder neuen Essgewohnheiten fragen. Bei einigen Patienten können Schmerzen auftreten. Jeder Schmerz sollte dem Arzt mitgeteilt werden. In diesem Fall kann eine wirksame und schnelle Schmerzbehandlung erfolgen. Nach der Behandlung ist es wichtig, sich gesund zu ernähren, regelmäßig Sport zu treiben und ein gesundes Gewicht zu halten. Bei Bedarf benötigen die Patienten emotionale Unterstützung.
WAS SIND DIE SYMPTOME VON BAUCHSPEICHELDRÜSENKREBS?
Nach der Whipple-Operation, die eine sehr wichtige Option bei der Behandlung von Bauchspeicheldrüsenkrebs ist, kann sich Ihr Patient innerhalb von etwa 6 Monaten erholen und zu einem normalen Leben zurückkehren. Die Operation, die in den letzten 10 Jahren nicht als Option für Patienten mit Bauchspeicheldrüsenkrebs in Betracht gezogen wurde, ist unter den heutigen Bedingungen eine wichtige Alternative für Patienten mit vielen verschiedenen Methoden. Dank fortschrittlicher bildgebender Verfahren wird die Wahrscheinlichkeit einer Operation für den Patienten im Voraus bestimmt und eine geeignete Behandlung durchgeführt. Auch hier sind die langen Erholungszeiten aufgrund offener Operationen, die große Einschnitte im Körper verursachen, durch laparoskopische (geschlossene) und robotergestützte Operationen ersetzt worden, die eine schnellere Rückkehr zum normalen Leben ermöglichen, bei der ästhetische Bedenken ausgeschlossen sind. Die rasche Genesung nach der Operation ermöglicht es den Patienten, zusätzliche Behandlungen, die möglicherweise notwendig sind, schneller zu erhalten. Auf diese Weise verschwinden die zehn häufigsten Symptome, die auf das Vorhandensein von Bauchspeicheldrüsenkrebs hinweisen, wie starke Übelkeit, Appetitlosigkeit, unfreiwilliger Gewichtsverlust, Dunkelfärbung des Urins, Verstopfung des Magenausgangs, sich langsam entwickelnde Gelbsucht, Rückenschmerzen, Durchfall, Diabetes und Depression nach der Behandlung.
HÄUFIG GESTELLTE FRAGEN ZU BAUCHSPEICHELDRÜSENKREBS
Kann Bauchspeicheldrüsenkrebs im Ultraschall erkannt werden?
Bauchspeicheldrüsenkrebs kann mit Methoden wie Bauchultraschall, MRT, CT, PET-Scan nachgewiesen werden.
Wo metastasiert der Bauchspeicheldrüsenkrebs zuerst?
Bauchspeicheldrüsenkrebs kann im Stadium 4 zu entfernten Organen metastasieren. Der Krebs kann sich zunächst im Bauchraum und in der Leber ausbreiten. Dann kann er auf die Lunge und die Knochen übergreifen.
Wie erkennt man eine Bauchspeicheldrüsenerkrankung?
Es können Symptome wie Appetitlosigkeit, Übelkeit, Gewichtsverlust, Veränderung der Stuhlfarbe, Rückenschmerzen, Blähungen, Schwäche und Juckreiz auftreten.
Wer kann an Bauchspeicheldrüsenkrebs erkranken?
Das Risiko, an Bauchspeicheldrüsenkrebs zu erkranken, ist bei Rauchern, Diabetikern, chronischen Entzündungen der Bauchspeicheldrüse, familiärer Vorbelastung, Fettleibigkeit, fortgeschrittenem Alter und Menschen mit Unterernährung erhöht.
Ist Bauchspeicheldrüsenkrebs tödlich?
Bauchspeicheldrüsenkrebs ist eine der gefährlichsten Krebsarten, da er in der Regel erst spät erkannt wird. Eine frühzeitige Diagnose verlängert das Leben der Patienten.
Ist Bauchspeicheldrüsenkrebs überlebensfähig?
Bauchspeicheldrüsenkrebs ist eine behandelbare Krankheit, wenn er frühzeitig diagnostiziert wird.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
Prostatakrebs
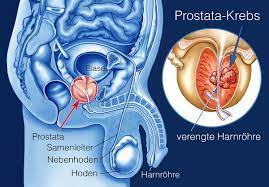
Prostatakrebs ist eine der häufigsten Krebsarten bei Männern, und während die Häufigkeit weltweit bei 28 pro 100.000 liegt, ist diese Rate in unserem Land etwas höher und beträgt 37 pro 100.000. Nach Angaben der American Cancer Society liegt das Lebenszeitrisiko von Männern, an Prostatakrebs zu erkranken, bei 16,7 % und das Risiko, daran zu sterben, bei 2,5 %. Einer von 5-6 Männern hat ein Lebenszeitrisiko für Prostatakrebs. Weltweit wird alle 3 Minuten eine Person mit Prostatakrebs diagnostiziert, und alle 14 Minuten stirbt ein Mann an Prostatakrebs.
Prostatakrebs ist eine der Krebsarten mit hohen Behandlungserfolgen, wenn er in einem frühen Stadium erkannt wird. Da es sich um eine Krebsart handelt, die im Anfangsstadium in der Regel keine Symptome verursacht, sollte sich jeder Mann ab dem 40. Unter den chirurgischen Anwendungen, die bei der Behandlung von Prostatakrebs einen sehr wichtigen Platz einnehmen, bietet das “da Vinci Robotic Surgery System”, das die Welt der Medizin revolutioniert hat, dem Patienten wichtige Privilegien in Bezug auf die Lebensqualität und das Erreichen eines krebsfreien Lebens. Mit der robotergestützten Chirurgie ist es möglich, die Nerven, die für den Harnverhalt und die Aufrechterhaltung des Sexuallebens sorgen, besser zu schützen.
WO BEFINDET SICH DIE PROSTATA UND WELCHE FUNKTIONEN HAT SIE?
Die Prostata, die Teil des männlichen Fortpflanzungssystems ist, ist eine Drüse direkt unterhalb der Blase, vor den Eingeweiden, die den Ausgang der Blase umgibt. Die Prostata, deren Hauptaufgabe darin besteht, die Flüssigkeit zu produzieren, die die Spermien schützt, und die Spermien in dieser Flüssigkeit auf gesunde Weise zu speichern, beugt auch der Harninkontinenz vor, indem sie den Blasenausgang mit Schließmuskeln zusammenpresst. Die Prostatakapsel, die in drei Bereiche unterteilt ist, die von einer Kapsel umgeben sind, trennt die Prostata von anderen Teilen des Körpers.
WAS IST EINE GUTARTIGE PROSTATAVERGRÖSSERUNG?
Wenn Männer älter werden, vergrößert sich die Prostata. Diese Vergrößerung wird als gutartige Prostatahyperplasie (gutartige Vergrößerung der Prostata) bezeichnet und tritt in der Regel in der Übergangszone der Prostata auf, die die Harnröhre (Urethra) umgibt. Eine vergrößerte Prostata kann die Blase oder die Harnröhre blockieren und so den Urinfluss verhindern. Bei Männern kann es zu häufigem, schmerzhaftem, blutigem Urin oder zu Spermaproblemen sowie zu Steifheit und Schmerzen im unteren Rücken kommen. Diese Symptome können die Folge einer gutartigen Vergrößerung der Prostata sein oder als Anzeichen von Krebs auftreten.
WAS IST PROSTATAKREBS?
Prostatakrebs entwickelt sich in der Prostata, einer kleinen walnussförmigen Drüse, die Teil des Fortpflanzungssystems des Mannes ist. Prostatakrebs entsteht, wenn die Zellen in der Prostata außer Kontrolle geraten. Die Krebszellen wachsen zunächst unkontrolliert und breiten sich in der Prostata aus. Dann dehnt er sich auf die Kapsel aus, die die Prostata umgibt, durchdringt die Kapsel und breitet sich außerhalb der Prostata aus. Anders als bei einer gutartigen Prostatavergrößerung geht der Prostatakrebs nicht vom Zentrum der Prostata aus, sondern von der kapselnahen Region, die vom Zentrum entfernt ist. Daher stören die Beschwerden beim Wasserlassen bei Prostatakrebs den Patienten erst in einem späteren Stadium. Während der Wachstums- und Ausbreitungsphase kann er sich über den Blutkreislauf auf nahe gelegene Organe, das Lymphsystem und andere Teile des Körpers ausbreiten. Da Prostatakrebs einen langsamen Verlauf hat, kann der Tumor einen sehr aggressiven Charakter aufweisen und auf Knochen und andere Organe übergreifen.
SYMPTOME VON PROSTATAKREBS
Die Symptome von Prostatakrebs können je nach Fortschreiten der Krankheit auftreten. In dieser Hinsicht handelt es sich um eine schleichende Krankheit. Vor allem in den frühen Stadien kann es vorkommen, dass keine Symptome und Beschwerden auftreten. Wenn die Symptome von Prostatakrebs auftreten, kann der Patient einige Behandlungschancen verlieren, so dass regelmäßige ärztliche Kontrollen für den Behandlungserfolg von großer Bedeutung sind.
Die Symptome von Prostatakrebs lassen sich wie folgt auflisten;
- Schwierigkeiten beim Urinieren
- Verminderte Stärke des Urinstrahls
- Blut in Sperma oder Urin
- Schmerzen bei der Ejakulation
- Unbehagen in der Leistengegend
- Schmerzen in den Knochen
- Erektile Dysfunktion
Diese Symptome, die auf Prostatakrebs hinweisen, können manchmal auch ein Hinweis auf eine gutartige Prostatavergrößerung sein. Ähnliche Symptome und Beschwerden können auch bei einer gutartigen Prostatahyperplasie (gutartige Vergrößerung der Prostata) auftreten, die durch eine Vergrößerung der Vorsteherdrüse entsteht. Wenn sich der Prostatakrebs auf andere Teile und Organe des Körpers ausgebreitet hat, kann er auch in diesem Bereich Symptome verursachen. Zum Beispiel, wenn er sich auf die Knochen ausgebreitet hat, wie Knochenschmerzen…
RISIKOFAKTOREN FÜR PROSTATAKREBS
Die Ursache von Prostatakrebs ist nicht genau bekannt. Prostatakrebs entsteht, wenn einige Prostatazellen aufgrund genetischer Defekte auf zellulärer Ebene außer Kontrolle geraten und normale Zellen ersetzen. Er kann sich dann auf das umliegende Gewebe und in fortgeschrittenen Stadien auch auf entfernte Organe ausbreiten.
Die Ursachen und Risikofaktoren für Prostatakrebs können wie folgt aufgelistet werden;
- Vererbte oder genetische Faktoren
9 % der Prostatakarzinome sind erblich bedingt, und bei 15 % der an Prostatakrebs Erkrankten wird die Krankheit von männlichen Verwandten ersten Grades vererbt. Es wurde beobachtet, dass Mutationen im BRCA2-Gen, die bei Frauen mit Brust- und Eierstockkrebs in Verbindung gebracht werden, das Risiko für Prostatakrebs bei Männern erhöhen.
- Nicht-genetische (Umwelt-) Faktoren
Umweltfaktoren sind bei Prostatakrebs wirksamer als genetische Faktoren. So hat beispielsweise ein Chinese, der in China lebt, im Vergleich zu einem Amerikaner ein sehr geringes Risiko, an Prostatakrebs zu erkranken, während derselbe Chinese ein ähnliches Prostatakrebsrisiko wie ein Amerikaner zu haben beginnt, wenn er/sie lange in den USA lebt.
- Auswirkungen des Alters
Das Risiko, an Prostatakrebs zu erkranken, steigt mit dem Alter. Während Prostatakrebs bei Männern unter 50 Jahren selten ist, tritt er bei Männern über 55 Jahren häufig auf. Es ist bekannt, dass bei 1 von 6 Männern im Laufe ihres Lebens Prostatakrebs diagnostiziert wird. - Rasse-Faktor
Der Faktor Rasse spielt auch bei Prostatakrebs eine wichtige Rolle. Prostatakrebs tritt am häufigsten bei schwarzen Männern auf, gefolgt von weißen Männern. Seltener tritt er auch bei Männern auf, die auf asiatischen / pazifischen Inseln leben.
- Ernährung
Die direkte Wirkung der Ernährung auf Prostatakrebs ist nicht erwiesen. Frühere Forschungen haben gezeigt, dass Selen und Vitamin E das Prostatakrebsrisiko senken können, aber klarere Ergebnisse späterer Studien haben gezeigt, dass keines von beiden von Vorteil ist. Da jedoch eine gesunde Ernährung das Krebsrisiko senkt, kann der Verzehr ungesunder Lebensmittel das Risiko für Prostatakrebs direkt erhöhen.
DIAGNOSE VON PROSTATAKREBS
Wenn die Ergebnisse des PSA-Bluttests und/oder der rektalen Fingeruntersuchung des Patienten die Möglichkeit eines Prostatakrebses nahelegen, sollte der Verdacht durch eine Biopsie bestätigt werden. Prostatakrebs wird nach einer oder mehreren Biopsien der Prostatadrüse diagnostiziert. Durch die Biopsie wird festgestellt, ob der Patient eine gutartige Prostatahyperplasie, Krebs oder andere medizinische Probleme hat. Bei der Biopsie wird eine Nadel durch den Enddarm eingeführt und es werden mehrere kleine Stücke Prostatagewebe entnommen. Diese Gewebeproben werden unter dem Mikroskop untersucht, um eventuelle Krebszellen zu erkennen.
Die folgenden Untersuchungen werden zur Diagnose von Prostatakrebs durchgeführt;
PSA-Bluttest: Der PSA-Wert im Blut eines Patienten, bei dem Prostatakrebs diagnostiziert wurde, ist gleichbedeutend mit der Menge des Krebses im Körper. PSA (Prostata-spezifisches Antigen) ist ein Protein, das von den Zellen in der Prostata produziert wird, und je höher der Wert im Blut ist, desto weiter ist der Prostatakrebs fortgeschritten. Gleichzeitig ist der PSA-Wert äußerst hilfreich bei der Überwachung des Behandlungserfolgs oder bei der Feststellung einer Regeneration nach einer Operation.
Steißbeinuntersuchung: Sie ist eine der am häufigsten angewandten Prostatakrebs-Vorsorgeuntersuchungen. Die Prostata des Patienten wird mit dem Finger berührt, und Anomalien werden anhand ihrer Größe und Merkmale untersucht.
Transrektale Ultraschalluntersuchung: Bei der transrektalen Ultraschalluntersuchung wird eine kleine Sonde in den Enddarm eingeführt. Die Sonde sendet hochfrequente Schallwellen aus, die Echos erzeugen und beim Auftreffen auf die Prostata zurückgeworfen werden. Der Computer verwendet diese Echos, um das Bild des Sonogramms zu erstellen, das abnormale Bereiche zeigen kann. Derzeit wird erforscht, dass die transrektale Sonographie das Überlebensrisiko bei Prostatakrebs verringert.
Fortschrittlicher PSA-Test: Derzeit wird an der Verbesserung des PSA-Tests gearbeitet, um spezifischere Ergebnisse für Bauchspeicheldrüsenkrebs zu erhalten. Je eindeutiger die PSA-Ergebnisse sind, desto weniger besorgt ist der Patient und desto weniger sind weitere Tests erforderlich.
Insulin-ähnlicher Wachstumsfaktor: Der insulinähnliche Wachstumsfaktor (IGF) ist ein wichtiger Wachstums- und antiapoptotischer (den Zelltod hemmender) Faktor für Krebszellen bei vielen Krebsarten. Das Insulin-ähnliche Wachstumsfaktor-Bindungsprotein-3 (IGFBP-3) stimuliert die Apoptose (Zelltod) unabhängig von IGF-1 und hemmt das Wachstum. Jüngste Forschungsergebnisse deuten darauf hin, dass hohe IGF-I-Werte und niedrige GFBP-3-Werte bzw. ein erhöhtes Verhältnis beider Werte mit einem erhöhten Prostatakrebsrisiko verbunden sind.
FRÜHDIAGNOSE BEI PROSTATAKREBS
Wie bei anderen Krebsarten kann eine frühzeitige Diagnose von Prostatakrebs die Zahl der Todesfälle verringern. Ein weiterer Vorteil der Frühdiagnose ist, dass die Nebenwirkungen der Prostatakrebsbehandlung minimiert werden. Zur Früherkennung von Prostatakrebs werden Bluttests zur Messung des als prostataspezifisches Antigen (PSA) bezeichneten Eiweißwertes, digital-rektale Untersuchungen und/oder transrektale Ultraschallverfahren eingesetzt. Die Früherkennung von Prostatakrebs ist jedoch ein komplexes und umstrittenes Thema, und es gibt keine ausreichenden Beweise dafür, dass sie das Überlebensrisiko verringert. Außerdem sind alle Früherkennungsuntersuchungen mit gewissen Risiken verbunden. Es ist wichtig, dass vor einer Prostatakrebs-Früherkennungsuntersuchung mit einem spezialisierten Arzt über die Unsicherheiten in Bezug auf den Nutzen und die möglichen Schäden gesprochen wird. Nach der Erörterung des potenziellen Nutzens, der Unsicherheiten und der Risiken von Früherkennungsuntersuchungen ist es die persönliche Entscheidung des Patienten, ob er sich einer Früherkennungsuntersuchung unterziehen möchte oder nicht.
PROSTATAKREBS-STADIEN
Prostatakrebs wird nach dem Ausmaß seiner Ausbreitung in Stadien eingeteilt. Die wichtigsten Kriterien für die Stadieneinteilung sind, ob der Prostatatumor auf umliegendes Gewebe wie Blase oder Rektum übergegriffen hat und ob Lymphknoten und Knochen befallen sind. Gleason-Score und PSA-Wert, die den Grad des Tumors angeben, sind ebenfalls wichtig für die Bestimmung der Stadien von Prostatakrebs.
- Phase
Im Stadium 1 befindet sich der Tumor nur in der Prostata. Manchmal kann er zu klein sein, um bei der rektalen Untersuchung ertastet zu werden. Der Gleason-Score ist 6 oder niedriger. Der PSA-Wert liegt unter 10.
- Phase
- In diesem Stadium befindet sich der Tumor noch in der Prostata. Die Struktur des Tumors ist jedoch aggressiv. Er kann bei der Untersuchung mit dem Finger deutlich ertastet werden oder der Tumorgrad kann hoch sein.
- Phase
- In diesem Stadium hat sich der Prostatakrebs außerhalb der Prostata ausgebreitet. In der Regel hat er sich auf die Samenblasen ausgebreitet. Er hat sich jedoch nicht auf Knochen und Lymphknoten ausgebreitet.
- Phase
In diesem Stadium hat sich der Prostatakrebs auf die Blase, den Mastdarm oder das umliegende Gewebe (außer den Samenblasen) ausgebreitet. Er kann sich auch auf nahe gelegene Lymphknoten und Knochen ausgebreitet haben.
PROSTATAKREBS-BEHANDLUNG
Bei der Behandlung von Prostatakrebs können je nach Wachstumsrate des Krebses, seiner Ausbreitung, dem allgemeinen Gesundheitszustand des Patienten und der Wirksamkeit der anzuwendenden Behandlung sowie den möglichen Nebenwirkungen unterschiedliche Behandlungen bevorzugt werden. Befindet sich der Prostatakrebs in einem frühen Stadium, kann anstelle einer sofortigen Behandlung eine Nachsorge empfohlen werden. Die Operation ist eine der häufigsten und wirksamsten Behandlungsmethoden bei Prostatakrebs. Es stehen robotergestützte, laparoskopische und offene Operationsmethoden zur Verfügung, und jede Operationsmethode sollte je nach Patient bevorzugt werden. Das Ziel des chirurgischen Ansatzes ist die Entfernung der gesamten Prostata. In geeigneten Fällen können die Nerven um die Prostata, die die Erektion des Penis unterstützen, erhalten werden.
Die bevorzugte Operation bei Prostatakrebs im Frühstadium ist die Laparoskopie. Die Strahlentherapie der Prostata (Radiotherapie) ist bei geeigneten Patienten ebenfalls eine wichtige Behandlungsoption. Die laparoskopische Chirurgie bietet dem Patienten einen komfortablen Eingriff und hat hohe Erfolgsraten bei der Krebsbekämpfung. Nach diesen Eingriffen, die durch 4-5 kleine Löcher durchgeführt werden, hat der Patient weniger Schmerzen und kann schon nach kurzer Zeit wieder seinen täglichen Aktivitäten nachgehen. Da es keinen chirurgischen Einschnitt gibt, sind diese Eingriffe auch kosmetisch sehr zufriedenstellend für die Patienten. Dank der großen Fortschritte bei der Diagnose und Behandlung von Prostatakrebs ist diese Krankheit nicht mehr gefürchtet.
BEHANDLUNG JE NACH STADIUM DES PROSTATAKREBSES
Befindet sich der Prostatakrebs im Stadium 1 oder 2, kann er mit einer Operation oder Strahlentherapie behandelt werden. Danach kann eine Hormonbehandlung eingeleitet oder je nach Zustand des Patienten durchgeführt werden. Bei der Behandlung von Prostatakrebs im Stadium 3 sollte entweder eine Operation oder eine Strahlentherapie durchgeführt werden. Untersuchungen haben ergeben, dass eine 5-monatige Chemotherapie nach Operation und Bestrahlung die Lebenserwartung bei Prostatakrebs verlängert. Bei Patienten mit einem PSA-Wert über 40, Lymphknotenbefall oder einem Gleason-Score über 7 sollte zusätzlich zur Hormonbehandlung nach der Operation oder Strahlentherapie eine Chemotherapie in Betracht gezogen werden. Im Stadium 4 sollte die Hauptbehandlung des Prostatakrebses eine Hormonbehandlung sein. Bei der Hormonbehandlung können die Eierstöcke des Patienten operativ entfernt oder das männliche Hormon durch Injektionen alle 1-3 Monate blockiert werden. Nach 2010 gab es viele Innovationen bei der Behandlung von Prostatakrebs im Stadium 4. Es hat sich gezeigt, dass einige Medikamente und Chemotherapien die Lebenserwartung im Stadium 4 deutlich erhöhen. Darüber hinaus wurden einige Wirkstoffe entwickelt, die eingesetzt werden, wenn die herkömmlichen Hormonblocker nicht wirken. Obwohl eine Impfung gegen Prostatakrebs erprobt wurde, hat sie nicht die erwartete Wirkung gezeigt. Strahlentherapeutika haben sich nur bei Patienten mit Knochenmetastasen als wirksam erwiesen. Darüber hinaus sind in unserem Land auch Behandlungen mit PSMA in Kombination mit radioaktivem Lutetium bei Prostatakrebs möglich.
DA-VINCI-ROBOTERCHIRURGIE
Prostatakrebsoperationen, die mit dem da Vinci Robotic System durchgeführt werden, sind besonders wichtig, damit der Patient nach der Operation seine sexuelle Funktion nicht einbüßt. Der erfahrene laparoskopische Chirurg kann mit den Armen des da Vinci-Roboters, der ein 3D-Bild in “High Definition”-Qualität mit 10- bis 20-facher Vergrößerung liefert, den Prostatakrebs entfernen und eine radikale Behandlung durchführen, indem er die Nerven und Gefäße im Körper auch an den schwierigsten Stellen schont.
HÄUFIG GESTELLTE FRAGEN ZU PROSTATAKREBS
Was ist die Prostatadrüse?
Die Prostata ist ein Teil des männlichen Fortpflanzungssystems. Die Drüse produziert Flüssigkeit, die sich bei der Ejakulation mit dem Sperma vermischt. Diese Flüssigkeit hilft, die Spermien zu konservieren.
Wer hat ein höheres Risiko für Prostatakrebs?
Männer über 55 sind anfälliger für diese Krankheit. Das Risiko, an Prostatakrebs zu erkranken, steigt mit dem Alter. Tatsächlich treten etwa 60 Prozent der Prostatakrebsfälle bei Männern über 65 Jahren auf. Weitere Risikofaktoren für Prostatakrebs sind:
- Ethnizität (schwarze Männer haben das höchste Risiko)
- Familienanamnese von Prostatakrebs
- Rauchen
- Fettleibigkeit
Was sind die Komplikationen von Prostatakrebs?
Einige aggressive Krebsarten breiten sich schnell außerhalb der Prostata aus (Metastasenbildung). Prostatakrebs breitet sich am häufigsten in den Knochen und Lymphknoten aus. Er kann sich auch in der Leber, im Gehirn, in der Lunge und in anderen Organen entwickeln.
Was ist eine Prostata-Sonographie-Untersuchung?
Die Ultraschalluntersuchung ist eine diagnostische Methode zur Untersuchung der inneren Organe mit Hilfe von Schallwellen, deren Frequenz für das menschliche Ohr zu hoch ist, um wahrgenommen zu werden. Das Gerät besteht aus einer Konsole mit Computer- und elektronischen Elementen, einem Videobildschirm und Teilen, die Sonden genannt werden und zur Abtastung des Körpers dienen. Die Ultraschalluntersuchung zur Erkennung gutartiger und bösartiger Wucherungen der Prostata wird als transabdominaler Ultraschall (TAUS) bezeichnet, wenn sie durch die vordere Bauchdecke durchgeführt wird, und als transrektaler Ultraschall (TRUS), wenn sie durch den Anus erfolgt.
Wie wird die Prostata-Ultraschalluntersuchung durchgeführt?
Beim TAUS-Verfahren wird die Ultraschallsonde auf den Bauch gelegt und die Prostata durch die verstärkende Wirkung der Ultraschallwellen sichtbar gemacht. Die Blase muss für dieses Verfahren voll sein. Es reicht aus, 1,5 Liter (ca. 6 Gläser) Wasser 1,5 – 2 Stunden vor dem Eingriff zu trinken. Bei der TRUS-Untersuchung wird die Prostata durch den Anus mit einer steril beschichteten Spezialsonde dargestellt. Da für dieses Verfahren eine Darmreinigung erforderlich ist, ist es notwendig, am Vortag nach dem Abendessen ein Abführmittel zu trinken und kurz vor dem Verfahren die Blase zu entleeren.
Was sind die Vorteile der Prostata-Sonographie?
Ein wichtiger Vorteil der Ultraschalluntersuchung bei der Prostatakontrolle ist, dass sie den Patienten nicht schädigt. Die einfache Anwendung, die geringen Kosten und das Fehlen ionisierender Strahlung sind weitere wichtige Vorteile. Bei der transabdominalen Ultraschalluntersuchung werden die Größe, das Gewicht und die anatomische Form der Prostata bestimmt. Bei der transrektalen Ultraschalluntersuchung werden darüber hinaus auch die Gewebedetails der Prostata beurteilt. Bei diesem Verfahren können Farbdoppler- und Power-Doppler-Methoden eingesetzt werden, um die Blutversorgung in den krebsverdächtigen Bereichen zu beurteilen, und es kann in derselben Sitzung nach entsprechender Vorbereitung eine Biopsie durchgeführt werden. Die Ultraschalluntersuchung kann dem Arzt detaillierte Informationen über die Prostata des Patienten liefern, die richtige Diagnose stellen und die geeignete Behandlung planen.
Welche Maßnahmen können gegen Prostatakrebs ergriffen werden?
Von gesunder und richtiger Ernährung bis hin zur Lebensweise gibt es wirksame Maßnahmen, die das Risiko von Prostatakrebs verringern können. Lycopin, das roten Früchten wie Tomaten, Wassermelonen, Hagebutten, rosa Grapefruits und Papaya ihre Farbe verleiht, ist ein starkes Antioxidans. Zahlreiche Studien deuten darauf hin, dass Isoflavone, die entzündungshemmende Eigenschaften haben, vor Prostatakrebs schützen. Der Verzehr von Granatapfel, insbesondere von Granatapfelsaft, hat schützende Eigenschaften gegen Prostatakrebs und hält den PSA-Wert unter Kontrolle. Kurkuma ist aufgrund seiner entzündungshemmenden Eigenschaften und der darin enthaltenen Substanz Curcumin ein guter Schutz gegen Prostatavergrößerung und Prostatakrebs. Andererseits gibt es verschiedene Studien, die zeigen, dass regelmäßige körperliche Aktivitäten die Wahrscheinlichkeit, an Prostatakrebs zu erkranken, verringern.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST REKTUMKARZINOM?
Rektumkarzinom ist eine Krankheit, bei der sich krebsartige, d. h. bösartige Zellen im Gewebe des Enddarms bilden. Rektumkarzinom wird in der Regel durch Polypen in der Schleimhaut des Enddarms verursacht. Krebs des Enddarms und des Dickdarms wird oft als “kolorektaler Krebs” bezeichnet.
WAS SIND DIE SYMPTOME VON ENDDARMKREBS?
Die Symptome von Rektumkarzinomen können auf unterschiedliche Weise auftreten. Viele Rektumkarzinome werden jedoch bei Routineuntersuchungen ohne Symptome entdeckt. Zu den Symptomen des Rektumkarzinoms gehören im Allgemeinen die folgenden.
- Blutungen im Anus oder Blut im Stuhl sind eines der häufigsten Symptome von Enddarmkrebs. Bei fast 8 von 10 Patienten treten Blutungserscheinungen auf.
- Schleim in den Fäkalien
- Veränderungen im Stuhlgang wie Verstopfung, Durchfall, übermäßige Blähungen können erste Anzeichen für Enddarmkrebs sein.
- Neben Veränderungen des Stuhlgangs gehören auch das Gefühl, dass der Darm leer ist, oder die Unfähigkeit, trotz häufiger Toilettenbesuche ausreichend Stuhlgang zu haben, zu den Symptomen von Enddarmkrebs.
- Schmerzhafter Stuhlgang
- Unbemerkte Blutungen im Stuhl können zu Blutarmut führen. Kurzatmigkeit, Schwindel, schneller Herzschlag aufgrund von Blutarmut sollten als Symptome von Enddarmkrebs ernst genommen werden.
- Ein Darmverschluss kann auftreten, wenn der Tumor wächst und den Abflussweg blockiert. Ein Darmverschluss kann starke Schmerzen und Krämpfe im Unterleib verursachen.
- Das Wachstum des Tumors kann zu Veränderungen der Stuhlgröße führen. Bleistiftdünner Stuhl kann ein Anzeichen für Enddarmkrebs sein.
- Eine unerklärliche Gewichtsabnahme, die nicht auf eine Diät oder sportliche Betätigung zurückzuführen ist, gehört zu den ersten Anzeichen von Enddarmkrebs.
WAS VERURSACHT ENDDARMKREBS?
Die Ursache von Enddarmkrebs ist nicht sicher bekannt. Es gibt jedoch viele Risikofaktoren, die Enddarmkrebs verursachen.
- Die meisten Rektumkarzinome treten im fortgeschrittenen Alter auf.
- Alkohol und Rauchen erhöhen das Risiko für Enddarmkrebs.
- Eine fettreiche Ernährung tierischen Ursprungs kann die Ursache für Enddarmkrebs sein.
- Eine Vorgeschichte von Darmkrebs oder Polypen kann Rektumkarzinom verursachen.
- Chronisch entzündliche Erkrankungen des Dick- und Enddarms wie Colitis ulcerosa und Morbus Crohn erhöhen das Risiko für Enddarmkrebs.
- Genetische Syndrome wie das nicht erbliche kolorektale Karzinom ohne Polypen (Lynch) und die familiäre adenomatöse Polyposis (FAP) zählen zu den Ursachen von Enddarmkrebs.
- Bewegungsmangel und Fettleibigkeit
- Eine Strahlentherapie zur Krebsbehandlung, insbesondere im Unterleib, kann Mastdarm- und Dickdarmkrebs verursachen.
- Diabetes (Zuckerkrankheit)
- Das Vorhandensein von Dickdarm- und Mastdarmkrebs in der Familie, insbesondere bei Verwandten ersten Grades, ist eine wichtige Ursache für Mastdarmkrebs.
WIE WIRD ENDDARMKREBS DIAGNOSTIZIERT?
- Zur Früherkennung von Enddarmkrebs sollten Routine-Screening-Programme durchgeführt werden. Für die Früherkennung von Rektumkarzinomen ist es von entscheidender Bedeutung, dass die routinemäßige Vorsorgeuntersuchung bei Personen, die keine Risikofaktoren aufweisen, im Alter von 50 Jahren beginnt. Bei Personen mit Risikofaktoren kann das Screening früher beginnen. Rektumkarzinom wird in der Regel bei Kontrollen diagnostiziert, die nach rektalen Blutungen oder Eisenmangel durchgeführt werden, die Symptome von Rektumkarzinom sind.
- Die Koloskopie ist das am häufigsten verwendete Verfahren im Rahmen von Vorsorgeprogrammen und zur Diagnose. Bei der Koloskopie ist es in der Regel möglich, kleine Gewebeproben aus verdächtigen Bereichen zu entnehmen. Die Laboranalyse der zur Biopsie entnommenen Gewebeproben hilft bei der Diagnose von Enddarmkrebs.
BEHANDLUNG VON ENDDARMKREBS
Die Behandlung wird geplant, nachdem das Stadium und der Grad des Rektumkarzinoms bestimmt worden sind. Bei der Behandlung von Enddarmkrebs richtet sich die Planung nach dem Stadium und dem Grad des Krebses, der Lage und Größe des Tumors im Enddarm, dem Alter und dem allgemeinen Gesundheitszustand des Patienten.
Chemotherapie und Strahlentherapie bei Enddarmkrebs
Die Chemotherapie bei Rektumkarzinom besteht in der Regel aus zwei oder mehr Medikamenten, die die Krebszellen angreifen. Bei Rektumkarzinom können Chemo- und Strahlentherapie vor oder nach einer Operation eingesetzt werden. Eine Operation kann der einzige notwendige Schritt bei der Behandlung von Rektumkarzinom im Stadium 1 sein. Bei Rektumkarzinom im Stadium 1 ist das Risiko eines Wiederauftretens nach der Operation gering, so dass eine Chemotherapie im Allgemeinen nicht empfohlen wird. In den Stadien 2 und 3 des Rektumkarzinoms wird nach der Operation eine Chemo- und Strahlentherapie durchgeführt, um ein Wiederauftreten des Krebses zu verhindern. Bei Patienten mit Rektumkarzinom im Stadium 2 und 3 kann eine Chemo- und Strahlentherapie eingesetzt werden, um den Tumor vor der Operation zu verkleinern.
Chirurgie des Rektumkarzinoms
Die Operation ist eine der am häufigsten angewandten Methoden bei der Behandlung von Enddarmkrebs. Die Operation des Rektumkarzinoms wird je nach Lage und Größe des Tumors geplant.
Die Rektumkarzinomchirurgie kann in 2 Gruppen eingeteilt werden: rektumsparende Rektumchirurgie und Rektumchirurgie mit Rektumverlust.
Chirurgie des Rektumkarzinoms;
- Kolostomie beenden
- Koloanale Anastomose
- Niedrige anteriore Resektion
- Lokale Exzision – Lokale oder transanale Exzision – Transanale endoskopische Mikrochirurgie
- Intraoperative Strahlentherapie (IORT).
- Abdominoperineale Exzision (APR) – Extra-Levator Abdominoperineale Exzision
- Polypektomie
- Radiofrequenz-Ablation
- Kryochirurgie
Chirurgische Techniken wie die minimal-invasive Chirurgie können eingesetzt werden
HÄUFIG GESTELLTE FRAGEN ZUM ENDDARMKREBS
Wer kann an Rektalkrebs erkranken? Ist es ein häufiger Krebs?
Rektumkarzinome treten bei Männern häufiger auf als bei Frauen. Mit den Fortschritten bei den endoskopischen und radiologischen Untersuchungen kann das Rektumkarzinom leichter diagnostiziert werden. Mit der Zunahme des Bewusstseins steigt auch die Inzidenzrate. Weltweit wird jedes Jahr bei etwa 1 Million Menschen Dickdarm- und Enddarmkrebs diagnostiziert. Obwohl es keine genauen Zahlen für unser Land gibt, wird geschätzt, dass jedes Jahr bei 30 Tausend Menschen Dickdarm- und Enddarmkrebs diagnostiziert wird. Die häufigste Form des Rektumkarzinoms ist das Adenokarzinom, ein Krebs, der von der Schleimhaut ausgeht.
In welchem Alter tritt Enddarmkrebs auf?
Für Mastdarm- und Dickdarmkrebs gibt es kein bestimmtes Erkrankungsalter. Rektumkarzinome treten jedoch in der Regel nach dem Alter von 35 Jahren auf. Die Mehrheit der Patienten ist älter als 50 Jahre.
Zu welchem Arzt sollte ich bei Rektumkrebs gehen?
In Fällen, in denen eines oder mehrere der Symptome von Mastdarm- und Dickdarmkrebs auftreten, sollte sofort ein Arzt der Abteilung für Gastroenterologie oder allgemeine Chirurgie konsultiert werden. Da bei der Behandlung von Mastdarm- und Dickdarmkrebs die chirurgischen Methoden im Vordergrund stehen, ist es wichtig, einen Facharzt auf diesem Gebiet zu wählen. Da die Behandlung von Darmkrebs einen multidisziplinären Ansatz erfordert, bei dem viele medizinische Abteilungen wie Allgemeinchirurgie, Gastroenterologie und Onkologie zusammenarbeiten, ist es wichtig, Krankenhäuser mit ausreichender medizinischer Infrastruktur zu wählen.
Ist Rektalkrebs ansteckend?
Es gibt keine Übertragung von einer Person mit Rektumkarzinom auf eine andere Person. Es gibt keine Hinweise darauf, dass der Krebs durch Atmung, Luft, Kontakt oder sexuell übertragen wird. Mastdarm- und Dickdarmkrebs hat jedoch genetische Merkmale. Menschen mit einer familiären Vorgeschichte von Mastdarm- und Dickdarmkrebs haben ein höheres Risiko, an Darmkrebs zu erkranken.
Was ist der Unterschied zwischen Rektalkrebs und Darmkrebs?
Die Symptome und Ursachen von Mastdarm- und Dickdarmkrebs sind sehr ähnlich. Obwohl sich Mastdarm- und Dickdarmkrebs in vielerlei Hinsicht ähneln, ist ihre Behandlung unterschiedlich. Der Hauptgrund dafür ist, dass der Enddarm in einem engen Raum liegt, der kaum von anderen Organen und Strukturen in der Beckenhöhle getrennt ist
Verursachen Hämorrhoiden Mastdarmkrebs?
Es besteht kein Zusammenhang zwischen Enddarmkrebs und Hämorrhoiden. Blutungen, insbesondere im Enddarmbereich, und Schmerzen treten jedoch sowohl bei Hämorrhoiden als auch bei Enddarmkrebs auf. Viele Menschen mit Dickdarm- und Enddarmkrebs haben auch Hämorrhoiden. Die Patienten zögern oft, einen Arzt aufzusuchen, weil sie ihre Beschwerden auf Hämorrhoiden zurückführen. Beim Auftreten von Symptomen ist es wichtig, einen Facharzt aufzusuchen, um keine Zeit für eine frühzeitige Diagnose zu verlieren.
Welche Tests werden für das Staging von Rektumkarzinomen durchgeführt?
Nach einer körperlichen Untersuchung durch einen auf kolorektale Karzinome spezialisierten Allgemeinchirurgen und einer Koloskopie-Untersuchung sollte das Stadium des Enddarmkrebses bestimmt werden.
Die Stadieneinteilung des Rektumkarzinoms ist wichtig, um über die am besten geeignete Behandlungsmethode zu entscheiden. Die folgenden Untersuchungen können bei der Stadieneinteilung des Rektumkarzinoms eingesetzt werden.
- Rektale Untersuchung: Dabei handelt es sich um eine Fingeruntersuchung, bei der ein glatter Handschuh in den Anus eingeführt wird, um den Krebs in der Rektumwand zu ertasten. In Fällen, in denen der Tumor weit vom Anus entfernt ist, kann der Enddarmkrebs bei dieser Untersuchung möglicherweise nicht entdeckt werden. Wird bei der digitalen rektalen Untersuchung eine Abnormalität festgestellt, wird eine Endoskopie durchgeführt, um den Krebs weiter zu untersuchen.
- Flexible Sigmoidoskopie: Wie bei der Koloskopie wird ein flexibler Schlauch mit einer Kamera durch den Anus in den Enddarm eingeführt. Diese Untersuchung kann Aufschluss über die Diagnose von Enddarmkrebs und das Stadium des Enddarmkrebses geben.
- Starre Sigmoidoskopie: Dabei wird ein starres optisches Endoskop durch den Anus in den Enddarm eingeführt. Die starre Sigmoidoskopie wird in der Regel von einem Gastroenterologen oder Allgemeinchirurgen durchgeführt. Der Vorteil der starren Sigmoidoskopie besteht darin, dass der Abstand des Tumors zum Anus genauer gemessen werden kann.
- Vollständiges Blutbild: Die Feststellung, ob die Anzahl der roten Blutkörperchen im Blut niedrig ist, ist wichtig, um festzustellen, ob der Tumor einen Blutverlust verursacht. Eine hohe Anzahl weißer Blutkörperchen kann ein Zeichen für eine Infektion sein, die das Risiko birgt, dass der Tumor durch die Enddarmwand wächst.
- Tumormarker-Tests: Krebs kann manchmal Substanzen, so genannte Tumormarker, im Blut produzieren. Wenn mehr Tumormarker im Blut vorhanden sind als normal, kann dies ein Zeichen für Enddarmkrebs sein. Das karzinoembryonale Antigen und das Kohlenhydrat-Antigen können auf Enddarmkrebs untersucht werden. Das karzinoembryonale Antigen (CEA) wird normalerweise in sehr niedrigen Konzentrationen im Blut von Erwachsenen gefunden. CEA kann bei bestimmten Krebsarten und bei nicht krebsartigen (gutartigen) Erkrankungen erhöht sein.
- Computertomographie (CT): Mit Hilfe der Computertomographie kann überprüft werden, ob sich der Darmkrebs auf die Lymphknoten in Brust, Bauch und Becken oder auf Organe wie Lunge und Leber ausgebreitet hat. Mit der Computertomographie kann auch der Abstand des Tumors zum Anus bestimmt und ein Staging des Enddarmkrebses durchgeführt werden.
- Magnetresonanztomographie (MRI): Es kann ein detailliertes Bild der Muskeln, Organe und anderer Gewebe, die den Tumor im Enddarm umgeben, erstellt werden. Außerdem können die Lymphknoten neben dem Enddarm und die verschiedenen Gewebeschichten in der Enddarmwand mit der Magnetresonanz sichtbar gemacht werden.
- Röntgen des Brustkorbs Mit Hilfe von Röntgenaufnahmen lässt sich feststellen, ob der Enddarmkrebs in die Lunge metastasiert hat.
- Endoskopischer Ultraschall (EUS): Sie basiert auf der Kombination von Endoskopie und Ultraschall. EUS zeigt die Wandschichten des Verdauungstrakts im Detail. Sie erleichtert die Diagnose von Krankheiten im Verdauungstrakt oder in den an den Verdauungstrakt angrenzenden Organen.
- PET-Scan (Positronen-Emissions-Tomographie): Ein Verfahren zum Auffinden bösartiger Tumorzellen im Körper. Eine kleine Menge radioaktiver Glukose wird in eine Vene injiziert. Der PET-Scanner dreht sich um den Körper und zeigt an, wo im Körper Glukose verbraucht wird. Bösartige Tumorzellen erscheinen auf dem Bild heller, weil sie aktiver sind und mehr Glukose aufnehmen als normale Zellen.
- Zell- und Gewebestudien: Zell- und Gewebestudien sind Studien zur Bestimmung der Art des Dickdarm- oder Enddarmkrebses. KRAS ist ein Gen, das in einigen Darmkrebszellen mutiert ist. KRAS-Tests werden in der Regel bei Kolorektaltumoren durchgeführt, die Metastasen gebildet haben. Er ist wichtig für die Angemessenheit des Einsatzes gezielter Medikamente. Ein MSI-Test kann auch durchgeführt werden, um festzustellen, ob der Tumor durch das Lynch-Syndrom verursacht wird.
Rektalkrebs Stadien
Der Grad des Enddarmkrebses und das Stadium des Enddarmkrebses sind wichtig für die Behandlung. Bei der Einstufung des Rektumkarzinoms geht es darum, wie die Krebszellen im Vergleich zu normalen und gesunden Zellen aussehen. Die Kenntnis des Grades des Rektumkarzinoms kann Aufschluss darüber geben, wie schnell der Krebs wachsen kann und wie wahrscheinlich es ist, dass er Metastasen bildet, d. h. sich ausbreitet.
Bei niedriggradigem Rektumkarzinom sind die Zellen abnormal, sehen aber wie normale Zellen aus. Ein niedriggradiger Rektumkarzinom wächst in der Regel langsam und hat eine geringere Wahrscheinlichkeit, Metastasen zu bilden. Hochgradiges Rektumkarzinom weist mehr undifferenzierte Krebszellen auf. Hochgradiges Rektumkarzinom, dessen Zellen nicht wie normale Zellen aussehen, neigt zu schnellem Wachstum und hat ein höheres Metastasierungsrisiko als niedriggradiges Karzinom.
Die Stadieneinteilung des Rektumkarzinoms hängt von den Informationen ab, die bei den Untersuchungen gewonnen werden, welche Teile des Rektums von Krebs befallen sind, wie groß der Tumor ist und ob sich der Krebs vom Ursprungsort aus ausgebreitet hat. Die Stadieneinteilung ist wichtig für die Planung der Behandlung von Rektumkrebs. Beim Staging von Rektumkarzinom;
- Wie tief der Tumor in der Enddarmwand sitzt
- Ob Krebs in der Lymphe vorhanden ist
- Es wird geprüft, ob der Krebs des Enddarms Metastasen in anderen Organen wie der Lunge oder der Leber gebildet hat.
Die Rektumkarzinomstadien werden in 5 Gruppen bewertet.
- Rektumkarzinom im Stadium 0: Die Krebszellen befinden sich nur in der inneren Auskleidung des Dickdarms oder Rektums, der so genannten Schleimhaut. Die Krebszellen haben die Muskelschicht der Schleimhaut nicht überwunden.
- Rektumkarzinom Stadium 1: Der Tumor hat sich auf die Bindegewebsschicht, die die Schleimhaut umgibt, oder auf die dicke äußere Muskelschicht des Enddarms ausgebreitet.
- Rektalkrebs Stadium 2: Das Stadium 2 des Rektumkarzinoms wird in drei Stufen behandelt.
- Rektumkarzinom 2 Stadium A: Der Krebs hat die äußerste Schicht der Rektumwand erreicht und hat sich nicht auf die umliegenden Organe ausgebreitet. Es gibt keine Metastasen in der Lymphe oder in entfernten Organen.
- Rektumkarzinom 2 Stadium B: Der Krebs hat alle Schichten der Rektumwand befallen, aber nicht auf umliegende Organe oder Gewebe gestreut. Keine Metastasen in Lymphknoten oder entfernten Organen.
- Rektalkrebs 2 Stadium C: Der Krebs hat sich über die Rektumwand hinaus ausgebreitet. Er ist in benachbarte Organe oder Gewebe eingewachsen. Es gibt keine Metastasen in der Lymphe oder in entfernten Organen.
- Rektumkarzinom im Stadium 3: Der Krebs hat sich auf nahe gelegene Lymphknoten ausgebreitet. Das Stadium 3 des Rektumkarzinoms wird in drei Stufen eingeteilt, je nachdem, wo der Tumor gewachsen ist und auf wie viele Lymphknoten er sich ausgebreitet hat.
- Rektumkarzinom Stadium 4: Rektumkarzinom im Stadium 4 hat Metastasen in Organen wie der Leber oder der Lunge gebildet. Der Krebs kann sich in nur einem Organ oder in entfernten Lymphknoten befinden. Er wird in 3 Stadien behandelt.
- Rektumkarzinom Stadium A: Der Krebs hat sich auf ein Gebiet oder Organ ausgebreitet, das nicht in der Nähe des Rektums liegt, z. B. die Leber, die Lunge, die Eierstöcke oder eine entfernte Lymphe.
- Rektumkarzinom Stadium B: Der Krebs hat sich auf mehr als ein Gebiet oder Organ ausgebreitet, das nicht in der Nähe des Rektums liegt, z. B. auf die Leber, die Lunge, die Eierstöcke oder einen entfernten Lymphknoten.
- Rektumkarzinom Stadium C: Der Krebs hat sich auf das Gewebe der Bauchdecke ausgebreitet und kann auch andere Bereiche oder Organe befallen haben.
Was sind Metastasen bei Rektumkarzinom?
Wenn sich Krebs in einen anderen Teil des Körpers ausbreitet, spricht man von einer Metastasierung. Die Zellen des Rektumkarzinoms verlassen den Ort, an dem sie entstanden sind (den Primärtumor) und können über das Lymphsystem oder das Blut in andere Teile des Körpers metastasieren.
Die Antwort auf die Frage, auf welche Organe sich der Enddarmkrebs ausbreitet, lautet wie folgt;
- Metastasen von Enddarmkrebs treten am häufigsten in den nahe gelegenen Lymphknoten auf.
- Krebs des Enddarms kann sich auf das Bauchfell ausbreiten.
- Metastasen können in Geweben in der Nähe des Bauches oder des Beckens auftreten.
- Sie kann in weit entfernten Lymphen gesehen werden.
- Krebs des Enddarms kann in die Niere und die Nebenniere metastasieren.
- Lebermetastasen bei Rektumkarzinomen treten meist im Stadium 4 auf.
- Lungenmetastasen bei Rektumkarzinomen treten meist im Stadium 4 auf.
- Metastasen des Rektumkarzinoms können in den Knochen und im Gehirn vorkommen.
Wie hoch ist die Lebenserwartung bei Rektumkarzinom?
Eine der neugierigsten Fragen von Patienten mit Rektumkarzinom lautet: “Wie lange lebt ein Rektumkarzinom?”. Die Lebenserwartung bei Rektumkarzinom hängt von vielen Faktoren ab, z. B. vom Grad der Krebserkrankung, dem Stadium, der Höhe des karzinoembryonalen Antigens (CEA), dem allgemeinen Gesundheitszustand des Patienten, der gewählten Behandlungsmethode und dem Ansprechen des Patienten auf die Behandlung. Die Antwort auf eine Frage wie “Wie lange lebt ein Rektumkarzinom?” ist nicht eindeutig und variiert von Patient zu Patient.
Die Überlebensstatistiken für Rektumkarzinome sind sehr allgemeine Schätzungen und sollten sehr vorsichtig interpretiert werden.
Nach den allgemeinen Statistiken in der Welt sind die 5-Jahres-Überlebensraten wie folgt
Rektumkarzinom Stadium 1 5-Jahres-Überleben 80- 88
Rektalkrebs Stadium 2 5-Jahres-Überlebensrate 60% – 81
Rektalkrebs Stadium 3 5-Jahres-Überleben 40-75
Rektumkarzinom Stadium 4 (letztes Stadium des Rektumkarzinoms) 5-Jahres-Überlebensrate 8-13
Wie sollte die Nachsorge nach einer Enddarmkrebsbehandlung aussehen?
Einige der Tests, die zur Diagnose des Rektumkarzinoms oder zur Bestimmung des Stadiums des Rektumkarzinoms durchgeführt werden, können nach der Behandlung wiederholt werden. Die Entscheidung, ob die Behandlung fortgesetzt oder geändert werden soll, kann von den Ergebnissen dieser Tests abhängen.
Nach der Behandlung des Rektumkarzinoms können Tests wie die Messung der Menge des karzinoembryonalen Antigens, die Koloskopie und die virtuelle Koloskopie wiederholt werden, um zu prüfen, ob der Krebs wieder aufgetreten ist.
Kann man Darmkrebs vorbeugen?
Rektumkarzinom ist wie Darmkrebs eine vermeidbare Krebserkrankung. Mastdarmkrebs kann sich aus gutartigen Mastdarmpolypen in der Mastdarmwand entwickeln. Die Erkennung und Entfernung dieser Polypen durch eine Darmspiegelung senkt das Risiko von Mastdarmkrebs. In Anbetracht der familiären Vorbelastung ist die Vorsorgeuntersuchung auf Rektumkarzinom ab dem Alter von 45-50 Jahren von entscheidender Bedeutung. Die genaueste und wirksamste Vorsorgeuntersuchung ist die Koloskopie.
Neben den Vorsorgeuntersuchungen gibt es zahlreiche wissenschaftliche Studien, die zeigen, dass auch die Ernährung mit dem Enddarmkrebs in Verbindung steht. Der Verzehr von fettarmen Lebensmitteln wie ballaststoffreichen Vollkornprodukten, Obst, Gemüse und Nüssen kann das Risiko, an Enddarmkrebs zu erkranken, verringern.
Zur Vorbeugung von Enddarmkrebs im Allgemeinen;
- Die routinemäßige Darmkrebsvorsorge darf nicht vernachlässigt werden
- Gewichtskontrolle sollte gewährleistet sein
- Ein aktives Leben sollte bevorzugt werden. Bewegung und Sport sollten regelmäßig betrieben werden
- Gemüse wie Blattsalate, Tomaten, Zwiebeln, Brokkoli, Auberginen, Karotten, Knoblauch und Obst wie Melonen, Äpfel, Birnen, Orangen und Bananen sollten häufig verzehrt werden. Darüber hinaus sollten Lebensmittel wie Hafer, schwarzer Reis, Gerste, Wildreis, Linsen und Bohnen in den Speiseplan aufgenommen werden.
- Rotes Fleisch, verarbeitetes Fleisch und Fast-Food-Ernährung sollten vermieden werden.
- Alkohol und Rauchen sollten eingestellt werden.
Rektalkrebs Ernährung
Eine ausgewogene Ernährung vor, während oder nach der Behandlung von Enddarmkrebs kann dazu beitragen, dass sich der Betroffene wohlfühlt, seine Kräfte erhält und die Genesung beschleunigt.
- Achten Sie auf Ihre Gewichtskontrolle. Behandlungen wie Chemotherapie, Strahlentherapie und Rektumkarzinom-Operationen können oft zu unerwünschtem Gewichtsverlust führen. Es ist wichtig, einen übermäßigen Gewichtsverlust während der Behandlung zu vermeiden, da eine schlechte und unausgewogene Ernährung zu einer verminderten Fähigkeit des Körpers führen kann, Infektionen zu bekämpfen.
- Nehmen Sie über den Tag verteilt kleine, häufige Mahlzeiten zu sich. Durch häufige kleine Mahlzeiten wird sichergestellt, dass Ihr Körper genügend Kalorien, Eiweiß und Nährstoffe erhält, um die Behandlung zu vertragen. Kleine Mahlzeiten können auch dazu beitragen, behandlungsbedingte Nebenwirkungen wie Übelkeit zu verringern.
- Wählen Sie Lebensmittel, die reich an Proteinen sind. Eiweiß hilft dem Körper bei der Reparatur von Zellen und Geweben. Außerdem hilft es dem Immunsystem, sich von einer Krankheit zu erholen. Nehmen Sie zu allen Mahlzeiten und Zwischenmahlzeiten eine magere Proteinquelle zu sich. Gute Quellen für mageres Eiweiß sind:
- Mageres Fleisch wie Huhn, Fisch oder Truthahn
- Eier
- Fettarme Milch oder Molkereiprodukte wie Milch, Joghurt und Käse
- Nüsse
- Bohnen
- Soja-Lebensmittel
- Nehmen Sie Vollkornprodukte in Ihre Ernährung auf. Vollkornprodukte sind eine gute Quelle für Kohlenhydrate und Ballaststoffe, die dazu beitragen, Ihr Energieniveau hoch zu halten.
- Gute Quellen für Vollkornprodukte sind:
- Haferflocken
- Vollkornbrot
- Brauner Reis
- Vollkornnudeln
- Essen Sie jeden Tag eine Vielzahl von Obst und Gemüse. Obst und Gemüse versorgen den Körper mit Antioxidantien, die zur Krebsbekämpfung beitragen können. Wählen Sie eine Vielfalt an buntem Obst und Gemüse, um den größten Nutzen zu erzielen.
- Wählen Sie gesunde Fettquellen. Vermeiden Sie gebratene, fettige und fette Lebensmittel
- Beschränken Sie Süßigkeiten.
- Denken Sie daran, Wasser zu trinken. Eine ausreichende Flüssigkeitszufuhr während der Krebsbehandlung ist wichtig, um eine Dehydrierung zu verhindern.
- Achten Sie auf Veränderungen der Darmgewohnheiten. Darmkrebs und seine Behandlungen können häufig zu Veränderungen der Darmgewohnheiten wie Durchfall, Verstopfung, Blähungen und Blähungen führen. Sprechen Sie mit Ihrem Arzt über jede Veränderung Ihrer Darmgewohnheiten.
- Sprechen Sie mit Ihrem Arzt, bevor Sie Vitamine oder Nahrungsergänzungsmittel einnehmen.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST GALLENBLASENKREBS?
Gallenblasenkrebs ist ein bösartiger Tumor, der von der Wand der Gallenblase ausgeht. Polypen in der Gallenblase, Gallenblasenentzündungen, Fettleibigkeit und bestimmte Chemikalien wie Nitrosamine können die Hauptursachen für Gallenblasenkrebs sein. Gallenblasenkrebs, der bei Menschen mit Gallensteinen sehr viel leichter zu diagnostizieren ist, wird im fortgeschrittenen Krebsstadium erkannt, wenn er aus verschiedenen Gründen erste Symptome zeigt.
SYMPTOME VON GALLENBLASENKREBS
Obwohl Gallenblasenkrebs meist bei Menschen über 60 Jahren auftritt, handelt es sich um eine sehr heimtückische Krebsart. Da der Patient sein Leben fortsetzen kann, auch wenn die Gallenblase ihre Funktion nicht erfüllt, kann es sein, dass sie nicht viele Symptome verursacht oder dass ihre Symptome auf andere Krankheiten hinweisen.
Zu den Symptomen von Gallenblasenkrebs gehören häufig;
- Gelbsucht
- Schmerzen im Unterleib
- Probleme mit der Verdauung,
- Übelkeit, Erbrechen,
- Nahrungsmittelunverträglichkeiten,
- Abnehmen
- Es werden dunkler Urin und weißer Stuhl beobachtet.
Die wichtigsten Symptome des fortgeschrittenen Gallenblasenkrebses sind Gelbsucht, das Gefühl einer großen Masse im Bauchraum und im Bereich der Gallenblase sowie Schmerzen. Die Symptome von Gallenblasenkrebs machen sich in der Regel 3-6 Monate vor dem Ausbruch der Krankheit bemerkbar. Bei einigen Patienten kann Gallenblasenkrebs nach einem Jahr mit Gallenblasenbeschwerden auftreten. Auch eine Gelbsucht ohne jegliche Symptome gilt als Anzeichen für Gallenblasenkrebs allein. 75 % der Gallenblasenkrebsfälle treten bei Frauen auf, und 80 % dieser Patienten haben Steine in der Gallenblase. Wenn die Steine größer als 3 cm sind, erhöht sich das Risiko für Gallenblasenkrebs. Wenn eines der Symptome von Gallenblasenkrebs festgestellt wird, muss so schnell wie möglich die Abteilung für Allgemeinchirurgie eines gut ausgestatteten Krankenhauses aufgesucht werden.
RISIKOFAKTOREN FÜR GALLENBLASENKREBS
Zu den Risikofaktoren für Gallenblasenkrebs gehören Gallenblasenpolypen und eine Gallenblasenerkrankung, die so genannte “Porzellangallenblase”. Übergewicht, ungesunde Ernährung und die Exposition gegenüber Chemikalien wie Nitrosaminen gelten ebenfalls als wichtige Risikofaktoren. Darüber hinaus gelten wiederkehrende Infektionen der Gallenwege als einer der Faktoren, die zu Gallenblasenkrebs führen. Die Infektionen gehen mit Gelbsucht, hohem Fieber und Schmerzbeschwerden einher, und bei schweren Anfällen wird der Patient in ein Krankenhaus eingewiesen. Obwohl der Zusammenhang mit Krebs nicht schlüssig bewiesen ist, wird empfohlen, dass Patienten mit Steinen in der Gallenblase ihre Kontrollen nicht unterbrechen und sich regelmäßig untersuchen lassen sollten.
VERURSACHEN GALLENBLASENSTEINE KREBS?
Das Vorhandensein von Gallensteinen bei über 90 % der Patienten mit Gallenblasenkrebs ist durch Studien nachgewiesen worden. Obwohl diese Situation zu der Ansicht geführt hat, dass Gallensteine Krebs verursachen können, hat sich die Ansicht, dass “Gallensteine Krebs verursachen”, nicht durchgesetzt. Lediglich der enge Zusammenhang von Gallensteinen und Krebs gibt seit Jahren Anlass zur Skepsis. Krebs steht unter den von Gallensteinen verursachten Krankheiten an letzter Stelle. Noch vor Krebs verursachen Gallensteine Infektionen, Gallenstau, Gelbsucht und Bauchspeicheldrüsenentzündung.
DIAGNOSE UND STADIEN VON GALLENBLASENKREBS
Es ist sehr wichtig, dass Gallenblasenkrebs in einem frühen Stadium diagnostiziert wird. Bildgebende Verfahren wie Ultraschall, Tomographie und MRT werden je nach den beim Patienten festgestellten Symptomen eingesetzt. Wie bei vielen Krebsarten wird die endgültige Diagnose von Gallenblasenkrebs durch eine Biopsie nach fortgeschrittenen bildgebenden Verfahren gestellt. Die Diagnosemethoden richten sich nach dem Gesundheitszustand des Patienten, seinem Alter, seinen Krankheitssymptomen und früheren Untersuchungsergebnissen.
Diese Methoden werden zur Diagnose von Gallenblasenkrebs eingesetzt;
Blutuntersuchungen: Zur Diagnose von Gallenblasenkrebs müssen abnorme Bilirubinwerte und andere Substanzen im Blut gemessen werden.
Ultraschall: Die Verwendung von Schallwellen zur Untersuchung auf Tumore im Körper. Krebsartiges Gewebe weist andere Schallwellen auf als normales Gewebe.
Computertomographie (CT): Der CT-Scan liefert ein dreidimensionales Bild des Körpers. Es wird auf Tumore oder andere Anomalien untersucht. Außerdem lässt sich so die Größe des Tumors erkennen.
Magnetresonanztomographie (MRT): Mithilfe der MRT kann festgestellt werden, ob sich der Krebs außerhalb der Gallenblase ausgebreitet hat und wie groß der Tumor ist.
Biopsie Eine endgültige Diagnose kann durch eine Biopsie gestellt werden, bei der eine kleine Gewebeprobe unter dem Mikroskop untersucht wird. Die Biopsie kann mittels minimalinvasiver chirurgischer Technik oder durch Feinnadel- oder Dicknadelaspiration durchgeführt werden. Auch Computertomographie und Endoskopie können eingesetzt werden.
Endoskopische retrograde Cholangiopankreatographie (ERCP): Mit einem Endoskop, das durch die Speiseröhre in den Magen und den Dünndarm eingeführt wird, wird das Innere des Körpers sichtbar gemacht. Ein kleiner Schlauch oder Katheter wird durch das Endoskop in die Gallengänge eingeführt. Diese Methode wird am häufigsten zur Diagnose von Gallengangskrebs eingesetzt. Sie wird auch eingesetzt, wenn sich der Gallenblasenkrebs ausgebreitet und die Gallengänge blockiert hat.
Perkutane Cholangiographie: Bei dieser bildgebenden Methode wird eine dünne Nadel mit einem Farbstoff durch die Haut in den Bereich der Gallenblase eingeführt, um ein klares Bild auf Röntgenstrahlen zu erzeugen. Mit Hilfe der Röntgenstrahlen wird festgestellt, ob sich in der Gallenblase ein Tumor befindet.
Laparoskopie: Um die Gallenblase und andere innere Organe zu untersuchen, wird ein Endoskop durch einen kleinen Einschnitt in den Bauch eingeführt und eine Bildgebung durchgeführt.
Endoskopische Ultraschalluntersuchung (Endosonographie): Ein umfangreicheres und spezialisiertes Endoskop kann unter Sedierung vom Mund aus in den Magen und den Darm eindringen.
Positronen-Emissions-Tomographie (PET): Bei der PET-Untersuchung werden Bilder von Organen und Geweben im Körper erstellt. Auf diese Weise können wir feststellen, auf welche Organe im Körper sich ein bestehender Tumor ausgebreitet hat, und das Stadium des Krebses bestimmen.
Die Stadien der Gallenblase können wie folgt definiert werden;
Stadium 1: Carcinoma in situ, der Gallenblasentumor ist nur intramuskulär lokalisiert.
Stadium 2: Der Tumor betrifft nur die Muskelschicht der Gallenblase.
Stadium 3: Alle Schichten der Gallenblasenwand sind mit einem Krebstumor konfrontiert. Die Lymphknoten des Ductus cysticus können befallen sein, müssen es aber nicht.
Stadium 4: In diesem Stadium hat sich der Gallenblasenkrebs auf die Leber und andere Nachbarorgane ausgebreitet. Gallengänge und andere Lymphknoten sind betroffen.
BEHANDLUNG VON GALLENBLASENKREBS
Die Behandlung von Gallenblasenkrebs beruht auf der chirurgischen Entfernung des Tumors. Während der Behandlung, die aus einer groß angelegten Operation besteht, kann es auch erforderlich sein, einen Teil der Leber zu entfernen. Da Gallenblasenkrebs in der Regel erst in einem fortgeschrittenen Stadium diagnostiziert wird, haben die Patienten oft keine Chance auf eine Operation. Eine frühzeitige Diagnose des Krebses gewährleistet jedoch eine erfolgreiche Behandlung des Gallenblasenkrebses. Einige endoskopische Verfahren zur Linderung von Gelbsucht und Schmerzen, Schmerzbehandlung, perkutane Drainage (radiologischer Eingriff) können bei Patienten mit fortgeschrittener Erkrankung, die nicht operiert werden können, durchgeführt werden. Auch eine heiße Chemotherapie und einige kürzlich entwickelte intelligente Medikamente können das Fortschreiten des Tumors beeinflussen.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST GALLENGANGSKREBS?
Gallengangskrebs (Cholangiokarzinom) ist ein seltener Tumor, der aus Gallengangswandzellen besteht. Obwohl er sich in allen Teilen der Gallenwege entwickelt, gehen 60 % von der Bifurkation aus, der Kreuzung zwischen dem rechten und dem linken Hauptgallengang.
WAS VERURSACHT GALLENGANGSKREBS?
Die häufigsten Ursachen für Gallengangskrebs sind primär sklerosierende Cholangitis, Choledochuszysten, Hepatitis B-C, Colitis ulcerosa, Hepatolithiasis (Leberstein), fortgeschrittenes Alter, Fettleibigkeit, bilienterische Anastomosen und chronische Typhuserkrankungen bei älteren Menschen.
WELCHE SYMPTOME TRETEN BEI GALLENGANGSKREBS AUF?
Bei Gallenwegskrebs ist eine schmerzlose Gelbsucht eines der ersten Symptome. Es folgt ein Juckreiz, der auf eine Ansammlung von Bilirubin unter der Haut zurückzuführen ist. Bei Patienten im Spätstadium kommt es zu einem Gewichtsverlust, der zu Kachexie führt. Die Symptome können von Fieber begleitet sein.
WIE WIRD GALLENGANGSKREBS DIAGNOSTIZIERT?
Es ist sehr wichtig, Gallenblasenkrebs in einem frühen Stadium zu diagnostizieren. Der erste Schritt bei der Untersuchung von Gallengangskrebs ist eine Ultraschalluntersuchung der Gallenwege. Wird eine Vergrößerung der Gallengänge festgestellt, hilft eine Schnittbilduntersuchung mittels Computertomographie oder Magnetresonanztomographie bei der Diagnose. Ein plötzlicher Verschluss der Gallengänge kann auch ohne eine Masse in den Gallengängen festgestellt werden. Eine Biopsie oder ein Abstrich kann mittels ERCP (endoskopische retrograndiale Kolonjio-Pankreatographie) durchgeführt werden. Auch eine EUS-Untersuchung ist nützlich, insbesondere bei distal gelegenen Tumoren. Ein Patient mit klinischer Gelbsucht, Juckreiz und Gewichtsverlust und einem Tumormarker CA19-9 von 100 U/ml unterstützt ebenfalls die Diagnose. Die Diagnosemethoden richten sich nach dem Gesundheitszustand des Patienten, seinem Alter, seinen Krankheitssymptomen und früheren Untersuchungsergebnissen.
WIE WIRD GALLENGANGSKREBS BEHANDELT?
Wenn Gallengangskrebs diagnostiziert wird, hat mehr als die Hälfte der Patienten keine Chance auf eine Operation. Da es sich um eine heimtückische Krankheit handelt, treten die Symptome erst spät auf. Das Ausmaß des Krebses bei Patienten, die operiert werden können, bestimmt die Art des Eingriffs. Während bei proximalem Krebs eine Hepatektomie erforderlich ist, wird bei distalem Krebs meist eine Whipple-Operation durchgeführt.
Die Behandlung von Gallengangskrebs beruht auf der chirurgischen Entfernung des Tumors. Während der Behandlung, die aus einer groß angelegten Operation besteht, kann es auch erforderlich sein, einen Teil der Leber zu entfernen. Da Gallenblasenkrebs in der Regel erst in einem fortgeschrittenen Stadium diagnostiziert wird, haben die Patienten oft keine Chance auf eine Operation. Eine frühzeitige Diagnose des Krebses gewährleistet jedoch eine erfolgreiche Behandlung des Gallenblasenkrebses. Einige endoskopische Verfahren zur Linderung von Gelbsucht und Schmerzen, Schmerzbehandlung, perkutane Drainage (radiologischer Eingriff) können bei Patienten mit fortgeschrittener Erkrankung, die nicht operiert werden können, durchgeführt werden.
HÄUFIG GESTELLTE FRAGEN ZU GALLENGANGSKREBS
Was passiert, wenn der Gallengang blockiert ist?
Gelbsucht entsteht in erster Linie durch eine Obstruktion der Gallengänge. Die Gallengänge in der Leber werden vergrößert. Eine Entzündung der Gallenwege (Cholangitis) entwickelt sich aufgrund des erhöhten Drucks und der Bakteriendichte in den Gallengängen. Dieser Zustand, der als Gallensepsis bezeichnet wird, kann tödlich sein.
Welche Stadien gibt es bei Gallenwegskrebs?
Gallenwegskrebs wird in 3 Stadien eingeteilt.
- Im ersten Stadium des Gallengangskrebses befindet sich der Krebs in den Gallenwegen. Dies ist die Gruppe, die am besten auf eine Operation anspricht.
- Im zweiten Stadium hat der Krebs die Gallenblase, die Leber, die Bauchspeicheldrüse oder einen Teil der Pfortader und der Leberarterie befallen.
- Im dritten Stadium gibt es Krebsmetastasen in nahe gelegenen Organen und im vierten Stadium in entfernten Organen.
Welche Arten von Gallenwegskrebs gibt es?
Krebserkrankungen der Gallenwege werden je nach ihrer Lokalisation unterschieden. Es gibt intrahepatische, hiläre und distale Typen. Mit 60 % ist der hiläre Typ am häufigsten. Hiläre Gallenwegskarzinome werden von Bizmuth speziell klassifiziert.
Typ I: Krebs im Ductus hepaticus communis und entfernt von der Verzweigung.
Typ II: Der Krebs befindet sich im Ductus hepaticus communis und ist in die Bifurkation eingedrungen.
Typ III: Der Krebs befindet sich im Ductus hepaticus communis und betrifft den rechten oder linken Ductus hepaticus mit Verzweigung.
Typ IV: Krebs, der die Bifurkation betrifft, betrifft sowohl den rechten als auch den linken Ductus sowie die Segmente, die in diese Gänge münden.
Kann ein Stent in den Gallengang eingesetzt werden?
Ein Stent wird in den Gallengang eingesetzt, um die Ikteruswerte zu senken. Der Grund für das Stenting kann eine gutartige Stenose oder Krebs sein. Bei Patienten, die wegen Gallengangskrebs operiert werden, wird ein Stent auf der Seite des Lebersegments platziert, die im Patienten verbleibt.
Worauf sollte der Patient nach einer Gallenwegskrebsoperation achten?
Sie sollten ihre postoperative Chemotherapie (chemische Behandlung) regelmäßig einnehmen und sich eng mit ihren Ärzten abstimmen. Sie sollten Kontrolluntersuchungen und Bildgebung nicht vernachlässigen.
Verursachen Gallenblasensteine Krebs?
Das Vorhandensein von Gallensteinen bei über 90 % der Patienten mit Gallenblasenkrebs ist durch Studien nachgewiesen worden. Obwohl diese Situation zu der Ansicht geführt hat, dass Gallensteine Krebs verursachen können, hat sich die Ansicht, dass “Gallensteine Krebs verursachen”, nicht durchgesetzt. Lediglich der enge Zusammenhang von Gallensteinen und Krebs gibt seit Jahren Anlass zur Skepsis. Krebs steht unter den von Gallensteinen verursachten Krankheiten an letzter Stelle. Noch vor Krebs verursachen Gallensteine Infektionen, Gallenstau, Gelbsucht und Bauchspeicheldrüsenentzündung.
Was verursacht eine Verengung der Gallengänge?
Eine Verengung der Gallengänge wird in der Regel durch Steine in den Gallengängen verursacht. Sie kann auch durch frühere Eingriffe (Operationen – Stenting) verursacht werden.
Sind Polypen in der Gallenblase gefährlich?
Bei Polypen, die größer als 10 mm sind, und bei mehr als einem Polypen in der Gallenblase besteht das Risiko, an Krebs zu erkranken. Die Entfernung der Gallenblase durch Cholezystektomie (laparoskopisch oder offen) ist angebracht. Einzelne Polypen, die kleiner als 10 mm sind, werden mit einer 6-monatigen Ultraschallkontrolle weiterverfolgt.
Welche Mangelerscheinungen verursacht die Entfernung der Gallenblase im Körper?
Die Entfernung der Gallenblase hat keine negativen Auswirkungen auf den Körper. Die Galle wird von der Leber produziert. Nach einer Gallenblasenoperation besteht kein Mangel an Galle.
Verursachen Gallensteine Krebs?
Aufgrund der chronischen Entzündung kann sie Krebs verursachen. Bei 90 % der Patienten, die wegen Gallenblasenkrebs operiert wurden, wurden Steine in der Gallenblase festgestellt.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS SIND HODEN?
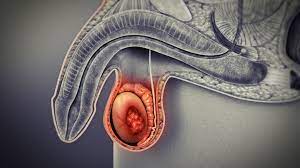
Die Hoden, Teil des männlichen Fortpflanzungssystems, sind zwei ovale Drüsen, die hinter dem Penis in einem Hautsack namens Hodensack sitzen. Die Hoden produzieren und speichern Spermien. Zusätzlich zu dieser Funktion produzieren sie auch Testosteron, das für die Entwicklung der Gesichtsbehaarung, die Zunahme der Muskelmasse und den Sexualtrieb (Libido) verantwortlich ist. Die Spermienbildung und die Testosteronausschüttung werden durch die Hormone FSH und LH gesteuert, die von der Hirnanhangsdrüse ausgeschüttet werden.
WAS IST HODENKREBS?
Hodenkrebs ist eine Tumorerkrankung, die in den Hoden beginnt und manchmal auf andere Körperteile übergreifen kann. Hodenkrebs entsteht, wenn sich im Gewebe eines Hodens Krebszellen (bösartige Zellen) entwickeln. Hodenkrebs ist die häufigste Krebsart bei Männern im Alter von 20 bis 35 Jahren. Die Krankheit kann in der Regel erfolgreich behandelt werden. Die Häufigkeit von Hodenkrebs im rechten Hoden beträgt 52,3 Prozent und im linken Hoden 47,7 Prozent. Die Entwicklung von Krebszellen kann in beiden Hoden auftreten, dies ist jedoch sehr selten (2-3 Prozent).
WAS SIND DIE RISIKOFAKTOREN FÜR HODENKREBS?
Zu den Risikofaktoren für Hodenkrebs gehören im Allgemeinen die folgenden:
Alter
Die meisten Fälle treten im Alter zwischen 15 und 40 Jahren auf. Hodenkrebs ist die häufigste Krebsart bei Männern im Alter zwischen 20 und 35 Jahren.
Rasse-Ethnizität
Das Risiko, an Hodenkrebs zu erkranken, ist bei weißen Männern fünfmal höher als bei schwarzen Männern. Weltweit ist das Risiko, an Hodenkrebs zu erkranken, in Amerika und Europa höher und in Afrika und Asien niedriger.
Familienanamnese von Hodenkrebs
Eine familiäre Vorbelastung erhöht das Risiko, an Hodenkrebs zu erkranken. Wenn ein Mann in der Familie an Hodenkrebs erkrankt ist, erhöht sich die Wahrscheinlichkeit, dass auch sein Bruder und/oder sein Sohn an Hodenkrebs erkranken.
Nicht herabgesunkener Hoden (Kryptorchismus)
Männer mit Hoden, die vor der Geburt nicht in den Hodensack absteigen, haben ein hohes Risiko. Männer, bei denen dieser Zustand durch eine Operation korrigiert wurde, sind weiterhin gefährdet, an Hodenkrebs zu erkranken.
Abnorme Entwicklung der Hoden
Erkrankungen, die eine abnorme Entwicklung der Hoden verursachen, können das Risiko von Hodenkrebs erhöhen
HIV-Infektion
Das Risiko, an Hodenkrebs zu erkranken, ist bei Männern mit HIV-Infektion erhöht, insbesondere bei AIDS-Patienten.
Krebs in der Vorgeschichte des anderen Hodens
Ungefähr 3 bis 4 Prozent der Männer, die von Krebs in einem Hoden geheilt werden, haben auch Krebs im anderen Hoden.
Klinefelter-Syndrom
Das Klinefelter-Syndrom ist einer der Faktoren, die das Risiko für Hodenkrebs erhöhen.
WELCHE ARTEN VON HODENKREBS GIBT ES?
Etwa 90 bis 95 Prozent der Hodenkrebserkrankungen gehen von den so genannten “Keimzellen” aus, die der Spermienproduktion dienen. Es gibt zwei Haupttypen von Hodenkrebs: Seminom und Nichtseminom.
Seminom-Tumore
Seminome haben zwei Hauptmerkmale:
- Entwickelt sich tendenziell langsamer als Nicht-Seminom-Tumore
- Sie tritt in der Regel zwischen dem 25. und 45. Lebensjahr auf, kann aber auch in höherem Alter auftreten.
Nicht-Seminom-Tumoren (Nicht-Seminom)
Nicht-Seminom-Tumore sind durch folgende Merkmale gekennzeichnet:
- Entwickelt sich in der Regel schneller als Seminom-Krebs
- Es gibt vier Hauptsubtypen: Teratom, Choriokarzinom, Dottersacktumor und Embryonalkarzinom
- Sie tritt in der Regel in der späten Adoleszenz und Anfang der 30er Jahre auf.
Andere Tumore
Gemischte Tumore
Manchmal kann ein Hodenkrebs eine Mischung aus Seminomzellen und Nicht-Seminomzellen oder eine Kombination verschiedener Subtypen von Nicht-Seminomzellen enthalten (gemischte Tumore).
Stroma-Tumoren
Stromatumoren entstehen in den Zellen, die das Stütz- (Struktur-) und Hormongewebe der Hoden bilden. Sie sind in der Regel gutartig und werden chirurgisch entfernt.
Hinweis: Einige Hodenkrebsarten beginnen als sogenannte intratubuläre Keimzellneoplasie (ITGCN oder IGCN). In diesem Fall sind die Zellen abnormal, breiten sich aber nicht außerhalb des Bereichs aus, in dem sich die Samenzellen entwickeln. ITGCN ist kein Krebs, aber es besteht ein 50-prozentiges Risiko, dass sie sich innerhalb von fünf Jahren zu Hodenkrebs entwickelt. Etwa 5 bis 10 Prozent der Menschen, bei denen Hodenkrebs diagnostiziert wird, haben ITGCN. ITGCN hat ähnliche Risikofaktoren wie Hodenkrebs. ITGCN ist schwer zu diagnostizieren, da es keine Symptome gibt und die Diagnose nur durch die Untersuchung einer Gewebeprobe gestellt werden kann.
WAS SIND DIE ANZEICHEN UND SYMPTOME VON HODENKREBS?
Das erste Anzeichen für Hodenkrebs ist in der Regel ein geschwollener Hoden oder ein harter Klumpen am Hoden. In den Hoden treten in der Regel keine Schmerzen auf, aber im Hodensack, dem sackartigen Organ, in dem sich bei Männern die Hoden befinden, sind oft Schmerzen oder Unwohlsein zu spüren.
Andere Symptome von Hodenkrebs sind folgende:
- Ein Ziehen oder ein Gefühl von Unbehagen im Hodensack
- Ein Hoden, der größer als normal erscheint
- Leichte Schmerzen im Unterbauch und in der Leistengegend
- Flüssigkeitsansammlung im Hodensack (Hydrozele)
Je nach Stadium des Hodenkrebses können auch andere Symptome auftreten, darunter
- Rückenschmerzen
- Husten
- Schwellungen an einem oder beiden Beinen oder Kurzatmigkeit aufgrund eines Blutgerinnsels können Symptome von Hodenkrebs sein. Ein Blutgerinnsel in einer großen Vene wird als tiefe Venenthrombose oder DVT bezeichnet. Ein Blutgerinnsel in einer Arterie in der Lunge wird als Lungenembolie bezeichnet. Diese verursacht Kurzatmigkeit.
- Gewichtsverlust
- Infektion: Eine Infektion der Hoden wird als Orchitis bezeichnet. Eine Infektion der Nebenhoden wird als Epididymitis bezeichnet. Besteht der Verdacht auf eine Infektion, können dem Patienten Antibiotika verschrieben werden. Wenn Antibiotika das Problem nicht lösen, sind weitere Untersuchungen erforderlich, in der Regel bei Verdacht auf Hodenkrebs.
- Brustspannen oder -vergrößerung: Obwohl selten, produzieren einige Hodentumore Hormone, die Brustspannen oder eine Vergrößerung des Brustgewebes verursachen, ein Zustand, der als Gynäkomastie bezeichnet wird.
Da eine frühzeitige Diagnose von Hodenkrebs die Erfolgsquote bei der Behandlung erhöht, ist es notwendig, bei den oben genannten Symptomen sofort einen Arzt aufzusuchen.
WIE WIRD HODENKREBS DIAGNOSTIZIERT?
Für die Diagnose von Hodentumoren sind eine körperliche Untersuchung, ein Hodenultraschall und Bluttests erforderlich. Zusätzlich zu diesen Untersuchungen werden auch Röntgenaufnahmen des Brustkorbs und eine Computertomographie durchgeführt, falls der Tumor gestreut hat. Wie bei vielen Krebstumoren können Verzögerungen bei der Diagnose gefährlich sein. Eine Verzögerung von 6 Wochen bei der Diagnose von Hodenkrebs erhöht das Risiko, an dem Krebs zu sterben, um das Zweifache.
Wird eine tastbare Masse im Hoden festgestellt, wird davon ausgegangen, dass es sich um einen Tumor handelt, und die Behandlung wird entsprechend eingeleitet, sofern nicht durch Untersuchungen etwas anderes nachgewiesen wird. Der erkrankte Hoden sollte sofort entfernt und die notwendige pathologische Untersuchung zur Bestätigung der Diagnose durchgeführt werden.
Außerdem werden die folgenden Bluttests durchgeführt, um die Konzentration von Tumormarkerproteinen zu messen
- Alpha-Fetoprotein (AFP)
- Beta-Human-Chorion-Gonadotropin (Beta-hCG)
- Milchsäure-Dehydrogenase (LDH)
- Alkalische Phosphatase der Plazenta
Anhand der Ergebnisse aller Untersuchungen (CT, MRT, Röntgenaufnahme des Brustkorbs) und der pathologischen Untersuchung werden das Krankheitsstadium und die Subtypen, die sich je nach Zellstruktur unterscheiden, bestimmt. Anhand der Ergebnisse wird entschieden, ob eine zusätzliche Behandlung wie eine “Chemotherapie” oder “Strahlentherapie” erforderlich ist. Nach der Operation sollte je nach Stadium und Art des Tumors eine gute Nachsorge durchgeführt werden. Wie bei anderen Krebsarten sind die Erfolgsaussichten bei frühzeitiger Diagnose und angemessener Behandlung in kurzer Zeit sehr hoch.
WELCHE BEHANDLUNGSMETHODEN GIBT ES BEI HODENKREBS?
Die Behandlung von Hodenkrebs richtet sich nach dem Ausbreitungsgebiet der Krebszellen, der Art des Krebses und dem allgemeinen Gesundheitszustand der Patienten. Stadium 1 bedeutet, dass der Krebs nur im Hoden vorkommt; Stadium 2 bedeutet, dass der Krebs auf die Lymphknoten im Bauchraum oder im Becken übergegriffen hat. Stadium 3 bei Hodenkrebs bedeutet, dass sich der Krebs über die Lymphknoten hinaus auf andere Körperteile, wie die Lunge, ausgebreitet hat. Man kann sagen, dass die wichtigste Behandlungsmethode die Operation ist, insbesondere bei Krebs, der in einem frühen Stadium diagnostiziert wird. Mit anderen Worten: Befindet sich der Krebs nur im Hoden (Stadium 1), kann die Entfernung des Hodens (Orchidektomie) die einzige erforderliche Behandlung sein. Wenn sich der Krebs über den Hoden hinaus ausgebreitet hat, kann der Patient auch eine Chemo- und/oder Strahlentherapie erhalten. Hodenkrebs kann erneut auftreten oder auf andere Körperteile übergreifen. Nach einer erfolgreichen Behandlung ist daher eine Nachsorge wichtig.
Operation
Die wichtigste Behandlungsmethode für Hodenkrebs ist eine Operation zur Entfernung des vom Krebs befallenen Hodens, die so genannte Orchidektomie. Man kann sagen, dass die wichtigste Behandlungsmethode bei früh diagnostiziertem Hodenkrebs die Operation ist.
Nach der Operation wird ein Team von Spezialisten, darunter ein onkologischer Berater, alle Ergebnisse untersuchen. Wenn der Krebs beispielsweise weiter fortgeschritten ist, kann ein weiterer chirurgischer Eingriff erforderlich sein, um die Lymphknoten im Bauchraum zu entfernen.
Chemotherapie
Eine Chemotherapie kann häufig zur Behandlung von Hodenkrebs eingesetzt werden, wenn sich der Krebs außerhalb des Hodens ausgebreitet hat oder nach einer Operation wieder aufgetreten ist. Auch wenn der Krebs nicht gestreut hat, kann der Arzt dem Patienten bei Bedarf eine Chemotherapie verschreiben. Damit soll die Wahrscheinlichkeit verringert werden, dass der Hodenkrebs in Zukunft wieder auftritt.
Strahlentherapie
Bei der Strahlentherapie werden Krebszellen durch Strahlung abgetötet. Die Strahlentherapie wird zur Behandlung von Hodenkrebs des Typs Seminom eingesetzt, da Seminome sehr strahlenempfindlich sind. Eine Strahlentherapie kann eingesetzt werden, um ein Wiederauftreten des Krebses nach einer Operation zu verhindern oder wenn sich der Krebs über den Hoden hinaus ausgebreitet hat.
HÄUFIG GESTELLTE FRAGEN ZU HODENKREBS
Was sind die Stadien von Hodenkrebs?
Stadium 1: Im Stadium 1 befindet sich der Tumor nur in den Hoden.
Stadium 2: Im Stadium 2 hat sich der Tumor auf die Lymphknoten im Bauchraum ausgebreitet.
Stadium 3: Im Stadium 3 hat sich der Tumor auf die Lymphknoten im Bauchraum und darüber hinaus ausgebreitet (am häufigsten auf die Lunge).
Kann ich nach Hodenkrebs Kinder bekommen?
Wenn nur ein Hoden durch eine Orchidektomie entfernt wird, kommt es in der Regel nicht zu Unfruchtbarkeit oder Erektionsproblemen. Dies liegt daran, dass der andere Hoden mehr Spermien und mehr Testosteronhormone produziert, um den fehlenden Hoden auszugleichen. Chemo- und Strahlentherapien können jedoch die Fruchtbarkeit beeinträchtigen. Wenn beide Hoden und Lymphknoten während der Behandlung entfernt werden, kann die Fruchtbarkeit ebenfalls beeinträchtigt werden.
Kann Hodenkrebs verhindert werden?
Es gibt keine Möglichkeit, Hodenkrebs zu verhindern, aber die Früherkennung ist wichtig. Männer sollten einmal im Monat eine Hodenselbstuntersuchung (HTS) durchführen. Wenn Veränderungen an den Hoden festgestellt werden (Knoten, Verhärtungen, anhaltende Schmerzen, Vergrößerung oder Schrumpfung der Hoden), sollte sofort ein Arzt aufgesucht werden.
Der beste Zeitpunkt für die Selbstuntersuchung der Hoden ist, wenn die Haut des Hodensacks während oder nach dem Baden entspannt ist.
Zur Untersuchung jedes Hodens sollten beide Hände benutzt werden. Zeige- und Mittelfinger sollten unterhalb des Hodens und die Daumen oberhalb des Hodens platziert werden. Die Hoden sollten vorsichtig zwischen den Fingern gedreht werden (es ist normal, dass die Hoden unterschiedlich groß sind).
Vielleicht bemerken Sie eine schnurartige Struktur über und hinter dem Hoden. Diese Struktur wird Nebenhoden genannt. Der Nebenhoden speichert und transportiert Spermien, nicht zu verwechseln mit dem Klumpen.
Jede Verhärtung des Hodens sollte auf eine Masse oder Schwellung untersucht werden. Wird ein Knoten ertastet, sollte ein Arzt aufgesucht werden (Knoten können erbsengroß oder größer sein und sind in der Regel schmerzlos).
Wie ist die Prognose (Heilungschancen) für Männer mit Hodenkrebs?
Diese Krebsart wird in mehr als 95 Prozent der Fälle erfolgreich behandelt. Selbst Männer mit ungünstigen Risikofaktoren haben im Durchschnitt eine 50-prozentige Chance auf Heilung.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST EIN NAGELTUMOR?
Als Nageltumore werden Gebilde bezeichnet, die unter und an den Rändern der Nagelplatte auftreten. Es handelt sich um Tumore, die von den Hauptzellen des Nagels, der Nagelmatrix, und dem Nagelbett, in das die Nagelplatte hineinragt, ausgehen. Die meisten Nageltumore sind gutartig. Einige der Nageltumore sind häufiger an den Händen und einige an den Füßen zu sehen. Sie treten vor allem an den großen Zehen der Füße und Hände auf. Nageltumore, die eine schwere Verformung des Nagels verursachen, sollten operativ entfernt werden. Gutartige (benigne Tumoren) und bösartige (Krebserkrankungen) Tumoren können den Nagel befallen und Veränderungen in der Struktur (Dystrophie) und Farbe (Dicholarisation) des Nagels verursachen.
Gutartige Nageltumore:
Myxoide Tumore
Glamos-Tumore
Pyogene Granulome
Onychomatricoma
Bösartige Nageltumore:
Bowensche Krankheit
Plattenepithelkarzinom
Malignes Melanom
WAS SIND DIE URSACHEN VON NAGELTUMOREN?
Wie bei anderen Hautkrebsarten ist die wichtigste Ursache von Nageltumoren die Sonneneinstrahlung. Genau wie die Haut sollten auch die Nägel vor den schädlichen Auswirkungen der Sonnenstrahlen geschützt werden. Sonnenschutzcremes sollten auch für die Nägel verwendet werden. Vor allem Menschen mit empfindlicher Haut sollten besonders vorsichtig sein.
Andere Ursachen für Nageltumore sind chronische Traumata, chemische Belastungen, Strahlenbehandlungen, Krebsarten, die das Immunsystem unterdrücken, wie Lymphome, Leukämie und Medikamente, die das Immunsystem beeinträchtigen, wie Chemotherapie und Infektionen (AIDS). Abgesehen von diesen Gründen sollte bei allen Arten von chronischen Wunden und Blutungen die Möglichkeit einer Krebserkrankung in Betracht gezogen werden.
WAS SIND DIE SYMPTOME EINES NAGELTUMORS?
Nageltumore sind vor allem an einer Verschlechterung der Nagelstruktur zu erkennen. Nageltumore können sich durch Verformungen wie Risse, Verdickungen, Brüche in der Nagelstruktur und -form, Verdickungen und Schwellungen unter dem Nagel bemerkbar machen. Bei bösartigen Tumoren kann es zu Farbveränderungen des Nagels, Schwellungen unter dem Nagel und Blutungen kommen. Schwarze oder braune Farbveränderungen um die Nagelplatte, das Nagelbett und den Nagel sowie Ausbreitung und nicht heilende Wunden gehören ebenfalls zu den Symptomen von bösartigen Nageltumoren.
Nageltumore werden oft mit Nagelpilz verwechselt. Nageltumore, die nicht richtig diagnostiziert werden können, werden möglicherweise als Nagelpilz behandelt. Die Behandlung eines Nageltumors, der als Nagelpilz angesehen und entsprechend behandelt wird, kann auch in einem frühen Stadium verzögert werden.
Frühzeitige und nicht fortgeschrittene gut- oder bösartige Tumore können leicht behandelt werden, während sich spät erkannter Nagelkrebs ausbreiten und sogar auf innere Organe übergreifen kann. Eine späte Entdeckung von Nageltumoren kann zur Amputation des betreffenden Fingers oder Gelenks führen.
WIE WIRD EIN NAGELTUMOR DIAGNOSTIZIERT?
Nageltumore werden durch Untersuchung, Dermatoskopie und gegebenenfalls Nagelbiopsie diagnostiziert. Ein Facharzt für Dermatologie kann in der Regel nach einer Untersuchung und einer dermatoskopischen Untersuchung mit einem Dermatoskop feststellen, ob ein Nageltumor vorliegt. Bei Krebsverdacht wird zur Bestätigung der Diagnose eine Nagel- und Unternagelbiopsie durchgeführt, und der Tumor wird so bald wie möglich operativ entfernt.
WIE WERDEN NAGELTUMORE BEHANDELT?
Nageltumore werden häufig chirurgisch behandelt. Der Bereich, in dem sich der Tumor befindet, wird örtlich betäubt, und es werden für den Tumor geeignete chirurgische Verfahren durchgeführt. Nageltumore können durch Kürettage, Verbrennung mit Elektrokauter oder Strahlentherapie behandelt werden. Auch wenn die Art des Tumors variiert, ist die erfolgreichste Behandlungsmethode die chirurgische Behandlung von Tumoren.
Myxoidzysten sind durchscheinende Zysten, die Flüssigkeit enthalten. Sie können durch Ablassen der Flüssigkeit behandelt werden, aber es besteht die Möglichkeit, dass sie erneut auftreten. Myxoide Zysten können auch durch chirurgische Entfernung behandelt werden.
Pyogene Granulome sind leicht erhabene, rote, hämorrhagische Massen, die durch Überwucherung von Kapillaren entstehen. Sie verursachen eine Schwellung des umliegenden Gewebes. Diese Tumore neigen leicht zu Blutungen und können durch Kürettage und Elektrokauterisation oder chirurgisch entfernt werden. Pyogene Granulome können manchmal mit der amelanotischen Form des malignen Melanoms verwechselt werden. Aus diesem Grund ist es sinnvoll, den entfernten Tumor pathologisch zu untersuchen.
Glomustumore bestehen aus Zellen in den Gefäßstrukturen, die Glomus genannt werden. Sie können in jedem Bereich auftreten, in dem Gefäße verlaufen. Sie können auch in den Glomusstrukturen der Gefäße in den Zehen- und Fingernägeln auftreten. Je nach Lokalisation können sie schmerzhaft sein. Nagelschwellungen und Nagelverformungen können ebenfalls zu den Symptomen gehören. Sie sind meist gutartig, können aber aufgrund ihrer geringen Größe schwer zu diagnostizieren sein. Die Behandlung besteht in der chirurgischen Entfernung.
Onimatrikom-Tumore werden durch eine übermäßige Keratinproduktion verursacht. Sie erscheinen als dunkle Linie unter dem Nagel und die Nagelplatte verdickt sich. Eine Gelbfärbung des Nagels, Schwellungen, Längslinien und Splitterblutungen sind bei Onychomatrikom-Tumoren ebenfalls zu beobachten. Die Behandlung erfolgt durch chirurgische Entfernung des Tumors.
Die Behandlung von bösartigem Nagelkrebs besteht darin, den Tumor zu biopsieren und ihn so bald wie möglich operativ zu entfernen. Die weiteren Behandlungsmöglichkeiten werden je nach Stadium des Krebses beurteilt.
Das Plattenepithelkarzinom ist ein bösartiger Nagelkrebs. Eine der wichtigsten Ursachen ist eine übermäßige Exposition gegenüber ultravioletten Strahlen. Es ist bei Männern 2-mal häufiger als bei Frauen. Neben den Nägeln kann er auch im Gesicht, an den Händen, Armen und Beinen auftreten.
Die Bowen-Krankheit wird auch als intraepidermales Plattenepithelkarzinom bezeichnet. Es handelt sich um eine frühe Form von Hautkrebs. Es handelt sich um eine Krankheit, die in der Regel die oberen Hautschichten befällt. Wenn er frühzeitig erkannt und der Tumor entfernt wird, verläuft die Behandlung positiv.
Das maligne Melanom ist eine Krebsart, die von Melanozytenzellen ausgeht, die das Pigment Melanin produzieren, das Haut, Haaren und Augen ihre Farbe verleiht. Dunkelhäutige Menschen sind häufiger von dieser Krankheit betroffen. Die häufigste Altersgruppe ist zwischen 40 und 70 Jahre alt.
Es wird als subunguales Melanom bezeichnet, wenn es im Nagelbett auftritt, als unguales Melanom, wenn es unter der Nagelplatte auftritt, und als periunguales Melanom, wenn es in der Nagelplatte und der Haut auftritt. Ein bösartiges Melanom muss chirurgisch entfernt werden.
Die Kontrolle der Nagelveränderungen durch einen Facharzt und regelmäßige ärztliche Untersuchungen gehören zu den besten Maßnahmen gegen Nagelkrebs.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST EINE TYMUSDRÜSE?
Die Thymusdrüse, die sich im Körper hinter dem so genannten Glaubensbrett, vor der Luftröhre, unter der Schilddrüse und vor dem Herzen befindet, wird im Volksmund auch als Schläfendrüse bezeichnet. Die Thymusdrüse, ein kleines, gekapseltes Organ, das dem Buchstaben H ähnelt, ist von rosa-grauer Farbe. Die Thymusdrüse, die bei der Geburt groß ist, kann in der Pubertät schrumpfen und unsichtbar werden. Bei älteren Erwachsenen wiegt sie schätzungsweise etwa 5 Gramm. Die Thymusdrüse, die bei Jungen etwas größer ist als bei Mädchen, kann bei Kindern bis zum Alter von 3 Jahren auf direkten Röntgenaufnahmen gesehen werden. Obwohl die Thymusdrüse nach der Pubertät schrumpft und unsichtbar wird, behält sie ihre Funktionen ein Leben lang bei.
WAS SIND DIE FUNKTIONEN DER THYMUSDRÜSE?
Die Thymusdrüse, eines der wenig bekannten Organe, hat wichtige Funktionen im Körper. Die Thymusdrüse, ein unverzichtbares Organ des Immunsystems, ist bei der Geburt voll entwickelt. Sie produziert T-Zellen, die wichtigsten Elemente des Immunsystems. Die Thymusdrüse produziert Antikörper gegen körpereigene Mikroorganismen. Die Thymusdrüse ist zusammen mit den Mandeln, den Polypen und der Milz Teil des lymphatischen Systems und des endokrinen Systems. Die Thymusdrüse produziert T-Zellen, die dazu beitragen, infizierte oder krebsartige Zellen im Körper zu zerstören. Die von der Thymusdrüse produzierten T-Zellen helfen auch anderen Organen des Immunsystems, richtig zu wachsen.
WAS IST THYMUSDRÜSENKREBS?
Thymusdrüsenkrebs ist eine seltene Krebsart. Es gibt zwei Arten von Krebs in der Thymusdrüse. Die häufigste Krebsart in der Thymusdrüse wird Thymomkrebs genannt. Die andere Krebsart, die in der Thymusdrüse sehr selten vorkommt, wird Thymuskarzinom genannt.
WAS IST EIN THYMUSKARZINOM?
Thymuskarzinome sind die seltenste Krebsart der Thymusdrüse. Thymuskarzinom-Tumoren wachsen schneller. Sie können auch schneller auf andere Teile des Körpers übergreifen. Daher sind Thymuskarzinome schwieriger zu behandeln. Autoimmunerkrankungen sind bei Thymuskarzinomen viel seltener als bei Thymomen.
WAS IST EIN THYMOM-TUMOR?
Das Thymom ist der häufigste Tumor, der von der Thymusdrüse ausgeht, und bei Erwachsenen der häufigste Tumor des Mediastinums selbst. Diese bösartige Erkrankung tritt sehr selten im Kindesalter auf. Thymomtumore, die bei Männern und Frauen gleichermaßen auftreten, treten meist in den 50er und 60er Jahren auf. Da Thymomtumore langsam wachsen, ist die Überlebensrate der Patienten höher als bei anderen Krebsarten.
WIE WIRD EIN TUMOR DIAGNOSTIZIERT?
Da Thymomtumore in der Regel symptomlos verlaufen, werden sie in der Regel zufällig bei der Abklärung einer anderen Krankheit entdeckt. Sofern die Vergrößerung der Thymusdrüse nicht sehr groß ist, ist sie auf dem Röntgenbild des Brustkorbs nicht sichtbar. Wenn die Größe und Form der Thymusdrüse im CT, MRT oder PET/CT, die aus anderen Gründen gemacht wurden, auffällt, wird eine Biopsie durchgeführt und die Diagnose gestellt. Die Biopsie wird durch Feinnadelaspirationsbiopsie, Mediastinotomie und VATS (videovermittelte thorakoskopische Chirurgie) durchgeführt. Da die Feinnadelaspirationsbiopsie eine geringere Trefferquote aufweist, ist die VATS die am häufigsten angewandte Methode.
WELCHE STADIEN GIBT ES BEI THYMOMTUMOREN?
Es gibt 4 Stadien des Thymomtumors.
- Thymomtumor Stadium 1: Im ersten Stadium befindet sich der Thymomtumor noch in der Kapsel.
- Thymomtumor Stadium 2: Im zweiten Stadium kann sich der Thymomtumor auf die Kapsel ausgebreitet haben und auf das umliegende Fettgewebe übergegangen sein.
- Thymomtumor Stadium 3: Im dritten Stadium kann der Thymomtumor das umgebende Gewebe außerhalb der Kapsel, die Luftröhre, die Lunge und die Herzmembran erreicht haben.
- Thymomtumor Stadium 4: Im vierten Stadium kann der Thymomtumor auf das Brustfell und andere entfernte Organe übergreifen.
WIE WERDEN THYMOMTUMORE BEHANDELT?
Die Behandlung von Thymomtumoren richtet sich nach ihrem Stadium. Thymomtumore, die in einem frühen Stadium diagnostiziert werden, werden ausschließlich mit chirurgischen Methoden behandelt. Die Läsion wird durch eine thorakoskopische oder offene Operation entfernt. In fortgeschrittenen Stadien von Thymomtumoren kann eine Chemotherapie oder Chemoradiotherapie mit einer chirurgischen Behandlung kombiniert werden. Thymome, die auf entfernte Organe gestreut haben, werden nicht operiert.
HÄUFIG GESTELLTE FRAGEN ZU SCHILDDRÜSENKREBS
Wodurch entstehen Thymom-Tumore?
Die Ursachen von Thymomtumoren sind noch nicht vollständig bekannt. In einigen Studien wurde festgestellt, dass eine Strahlentherapie und eine Infektion mit dem EBV-Virus in jungen Jahren ein Risiko für Thymomtumoren darstellen können, deren Ursache und mögliche Risikofaktoren nicht vollständig bekannt sind. Es werden Studien durchgeführt, um zu klären, ob es sich bei Thymomtumoren um eine genetische Erkrankung handelt, d. h. um die Beziehung zwischen Thymom und Chromosomen.
Welche Beschwerden verursachen Thymomtumore?
Thymomtumore verursachen bei der Mehrzahl der Patienten keine Beschwerden oder Symptome. Bei 30 bis 35 % der Patienten äußert er sich jedoch mit den folgenden Symptomen:
- Husten
- Schmerzen in der Brust
- Heiserkeit
Das häufigste paraneoplastische Syndrom im Zusammenhang mit einem Thymom ist die “Myasthenia gravis”. Paraneoplastische Syndrome sind Auswirkungen, die nicht direkt durch den Tumor selbst, sondern durch vom Tumor freigesetzte Hormone oder Substanzen verursacht werden. Myasthenia gravis tritt bei 30 bis 50 % der Thymomtumoren auf.
Was ist Myasthenia gravis?
Myasthenia gravis ist eine Erkrankung des nervös-muskulären Systems, die durch eine schnelle Ermüdung der willkürlichen Muskeln gekennzeichnet ist. Das wichtigste Symptom ist eine Muskelschwäche, die bei Ermüdung zunimmt und in Ruhe verschwindet. Die Patienten fühlen sich in der Regel gut, wenn sie am Morgen aufwachen. Der Allgemeinzustand der Patienten verschlechtert sich jedoch im Laufe des Tages. Die Krankheit kann sich auch in Form eines hängenden Augenlids äußern. Die Symptome äußern sich häufiger in Form von Schwierigkeiten in Gesicht, Augen, Mund, Zunge, Kau- und Schluckmuskulatur.
Ist Thymusdrüsenkrebs eine tödliche Krankheit?
Thymomtumore, d. h. Krebs der Thymusdrüse, können unbehandelt tödlich sein. Da der Thymomtumor jedoch ein langsam wachsender Tumor ist, ist die Überlebenszeit des Patienten länger als bei anderen Krebsarten. Vor allem, wenn er im Frühstadium operiert wird, ist die Überlebenszeit des Patienten sehr lang.
Welche Abteilung und welcher Arzt ist für die Diagnose und Behandlung von Thymusdrüsenkrebs zuständig?
Die Diagnose und Behandlung von Thymusdrüsenkrebs wird von Fachärzten für Thoraxchirurgie in der thoraxchirurgischen Abteilung von Krankenhäusern durchgeführt.
Ist Thymusdrüsenkrebs eine Erbkrankheit?
Die genaue Ursache von Thymusdrüsenkrebs ist noch nicht bekannt. Es wird jedoch vermutet, dass Strahlentherapie und Menschen, die in jungen Jahren mit dem EBV-Virus infiziert wurden, höhere Risikofaktoren aufweisen. Es wird untersucht, ob Thymusdrüsentumore eine Erbkrankheit sind.
Ist Thymusdrüsenkrebs häufiger bei Frauen oder Männern zu finden?
Ist Thymusdrüsenkrebs bei Männern und Frauen gleich häufig?
In welchem Alter tritt Thymusdrüsenkrebs häufiger auf?
Krebs der Thymusdrüse, insbesondere Thymomtumore, sind zu selten, um im Kindesalter aufzutreten. Thymomtumore treten häufiger in den 50er und 60er Jahren auf.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST EINE SCHILDDRÜSENENTZÜNDUNG?
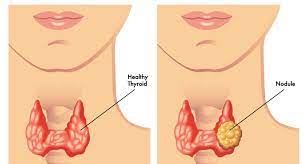
Die Schilddrüse ist im Volksmund als Krankheit bekannt. Tatsächlich aber ist die Schilddrüse ein schmetterlingsförmiges Organ vor der Luftröhre, direkt unter dem so genannten Adamsapfel im Rachen. Die Schilddrüse ist für die Produktion vieler Hormone verantwortlich, die lebenswichtige Funktionen im Körper steuern.
WAS SIND SCHILDDRÜSENKNÖTCHEN?
Die Schilddrüse, d.h. das Schilddrüsengewebe, sind feste oder flüssige normale Strukturen, die in verschiedenen Größen auftreten können. Die meisten Schilddrüsenknoten sind nicht krebsartig und können ohne jegliche Symptome wachsen. Sie können bei routinemäßigen Gesundheitskontrollen oder bei einer Untersuchung zufällig entdeckt werden. Einige Schilddrüsenknoten können jedoch so groß werden, dass sie sichtbar sind und verschiedene Beschwerden verursachen.
WAS IST SCHILDDRÜSENKREBS?
Schilddrüsenkrebs ist ein Schilddrüsentumor, der entsteht, wenn sich normale Schilddrüsenzellen in der Schilddrüse in abnorme Zellen verwandeln und unkontrolliert wachsen.
WAS VERURSACHT SCHILDDRÜSENKREBS?
Schilddrüsenkrebs ist ein Tumor, der von Schilddrüsenknoten ausgeht. Eine familiäre Vorbelastung mit Schilddrüsenkrebs, eine Bestrahlung des Halses aus einem anderen Grund und verschiedene Mutationen auf zellulärer Ebene können dazu führen, dass sich aus Schilddrüsenknoten Krebs entwickelt.
WAS SIND DIE RISIKOFAKTOREN FÜR SCHILDDRÜSENKREBS?
Die Risikofaktoren für Schilddrüsenkrebs lassen sich wie folgt auflisten.
- Schilddrüsenkrebs tritt bei Frauen häufiger auf als bei Männern. Obwohl der Grund für die höhere Inzidenz von Schilddrüsenkrebs bei Frauen nicht genau bekannt ist, geht man davon aus, dass sie mit dem Hormon Östrogen zusammenhängt.
- Eine Strahlentherapie, insbesondere im Kopf- und Halsbereich, kann das Risiko für Schilddrüsenkrebs erhöhen.
- Genetische Faktoren können das Risiko für Schilddrüsenkrebs erhöhen.
WAS SIND DIE SYMPTOME VON SCHILDDRÜSENKREBS?
Das häufigste Symptom von Schilddrüsenkrebs ist eine Vergrößerung und Schwellung im vorderen Teil des Halses, wo sich die Schilddrüse befindet. In einigen Fällen können sich auch Kompressionsbefunde wie ein Stechgefühl beim Schlucken, Schluckbeschwerden, Atemnot, Husten und Heiserkeit entwickeln. Manchmal wird der Krebs auch zufällig beim Abtasten durch den Arzt oder durch bildgebende Untersuchungen, die aus einem anderen Grund durchgeführt werden, entdeckt, ohne dass er Symptome verursacht. Die Symptome von Schilddrüsenkrebs lassen sich wie folgt auflisten:
- Wachstum im Bereich der Schilddrüse
- Anschwellen
- Schwierigkeiten beim Atmen
- Husten
- Heiserkeit
WIE WIRD SCHILDDRÜSENKREBS (KROPF) DIAGNOSTIZIERT?
Die wichtigste Untersuchungsmethode bei der Diagnose von Schilddrüsenkrebs ist die Ultraschalluntersuchung der Schilddrüse. Wird bei der Ultraschalluntersuchung ein Schilddrüsenknoten entdeckt, der verdächtige Merkmale in Bezug auf Krebs aufweist, wird eine Feinnadelaspirationsbiopsie durchgeführt. Die Feinnadelaspirationsbiopsie der Schilddrüse ist weltweit die Goldstandardmethode zur Diagnose von Schilddrüsenkrebs. Wenn die aus der Biopsie gewonnene Probe aufgrund der Bewertung durch den Zytologen verdächtig auf Schilddrüsenkrebs ist, wird die endgültige Diagnose durch die Untersuchung des operativ entnommenen Schilddrüsengewebes durch den Spezialisten für Pathologie gestellt.
WELCHE BEHANDLUNGSMETHODEN GIBT ES BEI KROPFKREBS?
Die primäre Behandlung von Schilddrüsenkrebs ist die chirurgische Entfernung der gesamten Schilddrüse oder der betroffenen Schilddrüsenhälfte. Wenn sich die Krankheit auf die Lymphknoten im Hals ausgebreitet hat, müssen diese ebenfalls operativ entfernt werden. Nach der Operation ist bei einigen Arten von Schilddrüsenkrebs eine zusätzliche Behandlung erforderlich, die so genannte radioaktive Jodtherapie (Atomtherapie). Die Entscheidung über die Notwendigkeit dieser Behandlung trifft der behandelnde Arzt in Abhängigkeit vom Ergebnis der Pathologie und dem Risiko eines Wiederauftretens der Krankheit. In der Regel müssen vor der Behandlung die Schilddrüsenmedikamente abgesetzt und für eine gewisse Zeit eine spezielle Diät eingehalten werden. Die Behandlung erfolgt in einer strahlensicheren Umgebung, da die Möglichkeit einer Strahlenemission besteht, und nach der Behandlung sollten für eine gewisse Zeit Strahlenschutzmaßnahmen ergriffen werden, um eine Beeinträchtigung der umliegenden Personen zu vermeiden. Nach der Schilddrüsenoperation wird lebenslang eine orale Schilddrüsenhormontherapie durchgeführt, um den Bedarf des Körpers an Schilddrüsenhormonen zu decken und ein Wiederauftreten der Krankheit zu verhindern. Abgesehen davon sind andere Behandlungen wie Strahlen- und Chemotherapie in der Nachsorge von Schilddrüsenkrebs nur selten erforderlich.
HÄUFIG GESTELLTE FRAGEN ZU KROPFKREBS
Wie hoch ist die Inzidenz von Schilddrüsenkrebs bei Männern und Frauen?
Ungefähr 5 Prozent aller Schilddrüsenknoten entwickeln Schilddrüsenkrebs. Sie treten bei Frauen viermal häufiger auf als bei Männern.
Wie sollte die Nachsorge bei Schilddrüsenkrebs aussehen?
Schilddrüsenkrebspatienten sollten regelmäßig nachuntersucht werden. Zusätzlich zur körperlichen Untersuchung können in einigen Fällen Bluttests, Ultraschalluntersuchungen des Halses, nukleare Screening-Tests und andere bildgebende Verfahren erforderlich sein. Die Häufigkeit der Nachuntersuchungen und die durchzuführenden Tests sollten von dem Arzt festgelegt werden, der die Nachuntersuchung durchführt.
Kann man Faktoren, die Schilddrüsenkrebs verursachen können, vorbeugen?
Wie bei allen Krebsarten sollten die Betroffenen auf eine gesunde Ernährung und einen aktiven Lebensstil achten. Darüber hinaus sollten die notwendigen Vorkehrungen getroffen werden, um den Halsbereich vor Strahlenbelastung zu schützen.
Wie sollte die Ernährung bei Schilddrüsenkrebs aussehen?
Bei Schilddrüsenkrebspatienten, bei denen nach der Operation eine Behandlung mit radioaktivem Jod geplant ist, wird eine jodarme Ernährung empfohlen. Sofern der Arzt nichts anderes empfiehlt, gibt es jedoch keine speziellen Ernährungsempfehlungen außer einer gesunden Ernährung, die für alle gilt.
Wann sollten sich Menschen, in deren Familie Schilddrüsenkrebs vorkommt, zum ersten Mal untersuchen lassen?
Er sollte so bald wie möglich von einem Endokrinologen untersucht werden, und die notwendigen Tests sollten geplant werden.
Ist Schilddrüsenkrebs tödlich?
Obwohl es verschiedene Arten von Schilddrüsenkrebs gibt, handelt es sich in den meisten Fällen um Schilddrüsenkrebs vom papillären Typ. Papillärer Schilddrüsenkrebs schreitet sehr langsam voran. Obwohl er häufig auf die Lymphknoten im Hals übergreift, spricht die Krankheit sehr gut auf die Behandlung an. Schilddrüsenkrebs ist eine Krebsart, die bei angemessener Behandlung eine sehr hohe Überlebensrate hat.
Kann sich Schilddrüsenkrebs ausbreiten?
Schilddrüsenkrebs kann sich innerhalb des Schilddrüsengewebes entwickeln oder auf nahe gelegene Gewebe und Lymphknoten im Hals übergreifen. Verschiedene Arten von Schilddrüsenkrebs, wie z. B. follikulärer Schilddrüsenkrebs, können auf die Lunge und die Knochen übergreifen.
Ist Schilddrüsenkrebs vollständig geheilt?
Schilddrüsenkrebs kann bei frühzeitiger Diagnose und angemessener Behandlung vollständig geheilt werden. Schilddrüsenkrebs kann jedoch auch wiederkehren.
Ist jede Schilddrüse Krebs?
Die Mehrzahl der Schilddrüsenknoten ist gutartig. Die meisten Schilddrüsenknoten sind Zysten, die mit einer flüssigen oder kolloidalen Form des gespeicherten Schilddrüsenhormons gefüllt sind. Bei festen Knoten ist die Wahrscheinlichkeit höher, dass es sich um Krebs handelt.
Wie viele Stunden dauert eine Operation bei Schilddrüsenkrebs?
Die Dauer einer Schilddrüsenoperation kann je nach Art und Ausprägung des Schilddrüsenkrebses und der anzuwendenden Operationsmethode variieren. Im Allgemeinen kann eine Schilddrüsenkrebsoperation zwischen 2 und 3 Stunden dauern.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST DIE HARNRÖHRE?
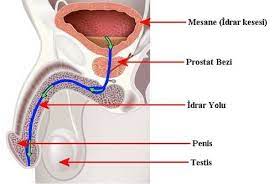
Die Harnröhre ist eine hohle Röhre, die den in der Blase gespeicherten Urin aus dem Körper ableitet. Bei Männern ist die Harnröhre 8 Zoll lang und verläuft von der Blase durch die Prostata bis zur Spitze des Penis. Bei Frauen ist die Harnröhre 1,5 Zoll lang und befindet sich direkt oberhalb der Vagina.
WAS IST HARNRÖHRENKREBS?
Harnröhrenkrebs ist eine Krebsart, die sich in der Harnröhre entwickelt. Harnröhrenkrebs wird durch Krebszellen (bösartige Zellen) im Gewebe verursacht, das die Harnröhre auskleidet, eine enge Röhre, die den Urin von der Blase nach außen leitet. Harnröhrenkrebs ist die seltenste Krebsart unter allen urologischen Krebserkrankungen. Das Risiko für Harnröhrenkrebs, der bei Männern häufiger vorkommt als bei Frauen, ist bei Menschen über 60 Jahren und bei Menschen mit einer Vorgeschichte von Blasenkrebs höher. Darüber hinaus erhöhen auch einige sexuell übertragbare Krankheiten wie häufige Harnwegsinfektionen und HPV (Humanes Papillomavirus) das Risiko für Harnröhrenkrebs, da sie chronische Entzündungen in der Harnröhre verursachen. Harnröhrenkrebs, der zunächst schleichend und ohne Symptome verlaufen kann, äußert sich durch Blut im Urin, häufiges, schwaches oder stoßweises Wasserlassen, Ausfluss aus der Harnröhre oder Lymphknotenbildung um die Harnröhre.
WAS SIND DIE URSACHEN VON HARNRÖHRENKREBS?
Die Ursachen von Harnröhrenkrebs sind, wie bei vielen Krebsarten, noch nicht genau bekannt. Es ist bekannt, dass Harnröhrenkrebs entsteht, wenn gesunde Zellen unkontrolliert zu wachsen beginnen und sich diese Zellen zu einem Tumor zusammenschließen. Es ist jedoch noch nicht genau bekannt, warum diese Zellen schnell wachsen und Harnröhrenkrebs verursachen. Langfristige Untersuchungen an Patienten mit Harnröhrenkrebs legen nahe, dass diese Ursachen das Krebsrisiko erhöhen:
- Menschen über 60 Jahre haben ein höheres Risiko für Harnröhrenkrebs als jüngere Menschen.
- Patienten mit einer Vorgeschichte von Blasenkrebs haben ein hohes Risiko für Harnröhrenkrebs. Darüber hinaus kann sich Harnröhrenkrebs später entwickeln, selbst wenn die Blase bei denjenigen, die wegen Blasenkrebs behandelt werden, entfernt wird.
- Sexuell übertragbare Krankheiten wie HPV (Humanes Papillomavirus) können das Risiko von Harnröhrenkrebs erhöhen.
- Das Risiko, an Harnröhrenkrebs zu erkranken, ist bei Menschen mit häufigen Harnwegsinfektionen höher.
- Eine chronische Entzündung der Harnröhre kann Harnröhrenkrebs verursachen.
- Eine Verengung der Harnröhre kann bei Männern zu chronischen Schwellungen und Entzündungen führen, die das Risiko von Harnröhrenkrebs erhöhen können.
- Eine Masse in der Harnröhre kann das Risiko von Harnröhrenkrebs bei Frauen erhöhen.
- Das Risiko, an Harnröhrenkrebs zu erkranken, ist bei Schwarzen doppelt so hoch wie bei Kaukasiern.
WAS SIND DIE SYMPTOME VON HARNRÖHRENKREBS?
Harnröhrenkrebs ist eine Krankheit, die zunächst ohne Symptome verläuft. Das liegt daran, dass die Krebstumore klein sind. Harnröhrenkrebs kann diese Symptome bei den Patienten hervorrufen, wenn die Tumore wachsen:
- Blut im Urin
- Ausfluss oder Blutungen aus der Harnröhre
- Häufiges Wasserlassen und Harndrang ohne vollständigen Harnabgang
- Probleme beim Urinieren
- Schmerzen beim Wasserlassen oder geringer Harnfluss
- Urininkontinenz
- vergrößerte Lymphknoten in der Leiste
- Ein Knoten oder eine Wucherung im Bereich zwischen den Genitalien und dem Anus
Die meisten der oben genannten Symptome können auch durch eine andere Krankheit verursacht werden. Dennoch sollten diese Symptome nicht vernachlässigt werden, und es ist notwendig, bei einem auf diesem Gebiet erfahrenen Urologen festzustellen, ob Krebs vorliegt. Denn Harnröhrenkrebs kann lebensgefährlich sein, wenn er nicht frühzeitig erkannt und behandelt wird.
WIE WIRD HARNRÖHRENKREBS DIAGNOSTIZIERT?
Da die Symptome von Harnröhrenkrebs häufig den Symptomen anderer Krankheiten ähneln, werden die Patienten oft wegen anderer Krankheiten behandelt. Diese Behandlungen können Harnwegsinfektionen oder eine gutartige Prostatahyperplasie bei Männern sein. Patienten, bei denen diese Behandlungen nicht anschlagen, sollten eingehend untersucht werden. Nachdem Informationen über die Gründe des Patienten für die Inanspruchnahme eines Arztes, über Risikofaktoren und die familiäre Vorgeschichte der Erkrankung eingeholt wurden, wird der Patient körperlich untersucht. Bei Männern erfolgt eine digitale rektale Untersuchung und bei Frauen eine Beckenuntersuchung, um Informationen über Tumore im Bereich der Harnröhre zu erhalten. Darüber hinaus kann Ihr Arzt die folgenden Tests und Verfahren zur endgültigen Diagnose anfordern:
- Urintest
- Bluttest
- Ultraschall
- Endoskopische Untersuchung (Zystoskopie oder Ureteroskopie)
- CT-Untersuchung
- Biopsie
Wie bei den meisten Krebsarten ist der wichtigste Test für die endgültige Diagnose von Harnröhrenkrebs die Biopsie. Nach der endgültigen Diagnose von Harnröhrenkrebs können weitere Tests durchgeführt werden, um mehr über den Krebs zu erfahren. Mit diesen Tests werden das Stadium des Krebses und die Ausbreitung (Metastasierung) des Krebses bestimmt. Nachdem das Stadium des Harnröhrenkrebses vollständig bestimmt ist, beginnt der Arzt so bald wie möglich mit der Behandlung, indem er mit dem Patienten einen Behandlungsplan erstellt.
WIE WIRD HARNRÖHRENKREBS BEHANDELT?
Die Behandlungsmöglichkeiten bei Harnröhrenkrebs richten sich nach der Art des Harnröhrenkrebses, dem Ort, an dem er sich in der Harnröhre befindet, Ihrem Geschlecht, Ihren Untersuchungsergebnissen und dem Stadium des Krebses. Die wichtigsten Behandlungsmethoden für Harnröhrenkrebs sind die folgenden:
Chirurgische Behandlung
Die häufigste Behandlung von Harnröhrenkrebs ist die Operation. Dabei wird der Krebstumor innerhalb oder außerhalb der Harnröhre chirurgisch entfernt. Außerdem werden vom Krebs befallene Lymphknoten um die Harnröhre herum operativ entfernt.
Strahlentherapie
Bei der Strahlentherapie werden die Krebszellen durch intensive Energiestrahlen zerstört. Bei Harnröhrenkrebs wird die Bestrahlung meist in Kombination mit einer Operation oder Chemotherapie eingesetzt.
Chemotherapie
Medikamente zur Vorbeugung von Uratra-Krebstumoren werden eingesetzt, um den Tumor vor der Operation und nach der Operation zu verkleinern und ein Wiederauftreten der Krankheit zu verhindern.
Überwachung
Bei der Behandlung von Harnröhrenkrebs wird der Patient in einigen Fällen nur überwacht. Das bedeutet, dass der Krebs nicht sofort behandelt wird. Mit anderen Worten: Wenn der Tumor dem Patienten keine Probleme bereitet, nicht zum Wachstum oder zur Ausbreitung neigt, wird der Patient vom Arzt mit regelmäßigen Untersuchungen und Tests überwacht. Wenn der Tumor zu wachsen beginnt oder zur Ausbreitung neigt, werden dem Patienten andere Behandlungsmöglichkeiten angeboten.
Nachsorge nach der Behandlung
Bei der Behandlung von Harnröhrenkrebs kann der Tumor vollständig entfernt werden. Dies schließt jedoch die Möglichkeit eines Wiederauftretens des Krebses nicht aus. Aus diesem Grund sollte der Patient von seinem Arzt überwacht werden, um das Risiko eines erneuten Auftretens des Krebses frühzeitig zu erkennen und eine mögliche Ausbreitung zu verhindern.
HÄUFIG GESTELLTE FRAGEN ZU HARNRÖHRENKREBS
Was sind die Nebenwirkungen der Behandlung von Harnröhrenkrebs?
Während der Behandlung von Harnröhrenkrebs kann es aufgrund der Chemotherapie und anderer medikamentöser Behandlungen zu Nebenwirkungen wie Haarausfall, Wunden an verschiedenen Körperstellen, insbesondere im Mund, Erbrechen, Appetitlosigkeit und Nervosität kommen.
Ist Harnröhrenkrebs eine tödliche Krankheit?
Harnröhrenkrebs ist eine heimtückische Krankheit, die zunächst ohne Symptome verlaufen kann. Wenn Harnröhrenkrebs frühzeitig diagnostiziert wird, kann er mit Chirurgie, Chemotherapie und Strahlentherapie behandelt werden.
Kann Harnröhrenkrebs wiederkehren?
Die Wahrscheinlichkeit eines Wiederauftretens nach der Behandlung von Harnröhrenkrebs hängt vom Ausgangsstadium und der Lage des Krebstumors ab. Krebs in einem kleinen Stadium und Krebs in der vorderen Harnröhre haben ein geringeres Rückfallrisiko.
Ist Harnröhrenkrebs häufiger bei Männern oder Frauen?
Die Harnröhre ist bei Männern 8 Zoll und bei Frauen 1,5 Zoll lang. Krebs in der Harnröhre ist bei Männern häufiger als bei Frauen.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST EIERSTOCKKREBS?
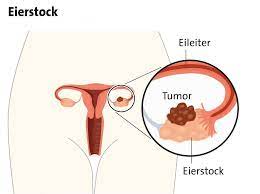
Epithelzellen bilden die Hauptstruktur der Eierstöcke, die viele verschiedene Zellen in ihrem Gewebe haben. Eierstockkrebs kann durch eine unkontrollierte Teilung und Vermehrung von Epithelzellen oder Zellen aus der Embryonalzeit entstehen. 80 Prozent der Eierstockkrebsfälle, die meist nach der Menopause auftreten, entstehen im Epithelgewebe. 60 Prozent der Eierstockkrebsfälle, die unter 20 Jahren auftreten, sind embryonale Tumore.
WAS SIND DIE SYMPTOME VON EIERSTOCKKREBS?
Die Symptome von Eierstockkrebs sind in der Regel nicht sehr ausgeprägt. Obwohl die meisten Symptome im Zusammenhang mit Eierstockkrebs patientenspezifisch sind, gibt es keinen typischen Befund. Als Symptome des Eierstockkrebses, die auch als Symptome vieler anderer Krankheiten gelten, können Bauchschmerzen, Blähungen und Magenbeschwerden genannt werden.
Das wichtigste Symptom des Eierstockkrebses ist eine tastbare Masse im Unterleib, ein Druckgefühl nach unten, Flüssigkeitsansammlungen im Unterleib, Schwellungen im Unterleib, Harn- und Darmbeschwerden aufgrund der Kompression der umliegenden Organe.
Hormonelle Unregelmäßigkeiten können bei einigen Arten von Eierstockkrebs auftreten. Dementsprechend können Menstruationsunregelmäßigkeiten, Haarwuchs mit erhöhter männlicher Hormonausschüttung und männlicher Haarausfall beobachtet werden. Die meisten Beschwerden bei Eierstockkrebs betreffen Unterleibsschwellungen.
Die allgemeinen Symptome von Eierstockkrebs lassen sich wie folgt zusammenfassen;
- Veränderung der Darmgewohnheiten, insbesondere das Auftreten von Verstopfung,
- Veränderung der Blasengewohnheiten, häufiger Harndrang,
- Appetitlosigkeit oder ein schnelles Sättigungsgefühl,
- Blutungen aus der Scheide
- Gewichtsverlust,
- Druckgefühl im Unterleib und Blähungen,
- Völlegefühl oder Schmerzen in der Leiste,
- Länger anhaltende Verdauungsstörungen, Blähungen oder Übelkeit.
WAS VERURSACHT EIERSTOCKKREBS?
Obwohl die Ursachen von Eierstockkrebs nicht eindeutig geklärt sind, kann man sagen, dass einige Risikofaktoren diese Krankheit verursachen. Genetische, umweltbedingte und hormonelle Faktoren können zu den Ursachen von Eierstockkrebs gezählt werden. Wir können die Ursachen für Eierstockkrebs wie folgt auflisten;
- Das Risiko erhöht sich bei Personen mit einer familiären Vorgeschichte von Brust- oder Eierstockkrebs.
- In den letzten Jahren haben Veränderungen in bestimmten Genen zu einem erhöhten Risiko für Eierstockkrebs geführt.
- Das Risiko, an Eierstockkrebs zu erkranken, steigt bei Anwenderinnen ovulationsfördernder Medikamente.
- Die Einnahme der Antibabypille verringert das Risiko, an Eierstockkrebs zu erkranken.
- Das Risiko, an Eierstockkrebs zu erkranken, ist bei Frauen, die noch nie schwanger waren, höher. Bei Frauen, die ein Kind bekommen, sinkt das Risiko.
WIE WIRD EIERSTOCKKREBS DIAGNOSTIZIERT?
Die Früherkennung von Eierstockkrebs ist wie bei allen anderen Krebsarten sehr wichtig. Für eine frühzeitige Diagnose wird empfohlen, dass Frauen ihre jährlichen gynäkologischen Routinekontrollen nicht vernachlässigen. Eine tastbare Masse bei der gynäkologischen Untersuchung oder eine Masse in den Eierstöcken, die bei einer Ultraschalluntersuchung festgestellt wird, bietet die Möglichkeit, bei Krebs frühzeitig einzugreifen.
Nicht jede Zyste in den Eierstöcken bedeutet Krebs. Die meisten Zysten, die vor allem bei Frauen im gebärfähigen Alter auftreten, sind einfache und harmlose Zysten. Diese Zysten, die sich mit der Zeit von selbst zurückbilden, bergen kein Krebsrisiko. Aus diesem Grund wird vom Facharzt festgestellt, ob die per Ultraschall beobachteten Zysten schädlich sind oder keine negativen Auswirkungen auf den Körper haben. Darüber hinaus sind alle Arten von Zysten bei Frauen in den Wechseljahren und jungen Mädchen vor der Menstruation mit einem Tumorrisiko behaftet. Sie müssen in dieser Hinsicht untersucht werden.
In fortgeschrittenen Stadien von Eierstockzysten und Massen mit Tumoreigenschaften werden Tumormarker im Blut untersucht. Einige Tumormarker (insbesondere CA 125) sind bei einigen Arten von Eierstocktumoren erhöht. Hohe Werte von CA125 und anderen Tumormarkern bedeuten jedoch nicht immer, dass es sich um eine Krebsgeschwulst handelt, und niedrige Werte von Tumormarkern schließen Krebs nicht aus. Neben den Tumormarkern kann auch der Doppler-Ultraschall helfen, gutartige von bösartigen Tumoren zu unterscheiden, indem er Veränderungen des Blutflusses aufzeigt. Alle diese Methoden sind Hilfsmethoden. Keines von ihnen reicht aus, um eine endgültige Diagnose zu stellen. In Fällen, die nicht von Zysten und Massen unterschieden werden können, von denen man annimmt, dass sie tumorös sind (ob gut- oder bösartig), liefern eine Operation und die Entnahme einer pathologischen Probe während der Operation eine endgültige Diagnose.
Wenn eine Zyste vorhanden ist, die Tumormarker und Doppleruntersuchungen normal sind, der Ultraschall und die Untersuchung keinen Hinweis auf einen Tumor ergeben und die Zyste kleiner als 8 cm ist, kann sie eine Zeit lang weiter beobachtet werden. Wenn die Zyste während der Nachsorge nicht schrumpft oder verschwindet, wird eine Operation bevorzugt.
WIE WIRD EIERSTOCKKREBS BEHANDELT?
Bei der chirurgischen Behandlung von Eierstockkrebs werden nicht nur die Gebärmutter und die Eierstöcke entfernt, sondern auch alle Gewebe, die im Körper betroffen sein könnten. Nach der chirurgischen Behandlung wird eine Chemotherapie durchgeführt. Die chirurgische Methode wird in allen Stadien des Eierstockkrebses angewandt. Wenn die Entfernung des Tumors bei der Behandlung von Eierstockkrebs das Risiko birgt, lebenswichtige Organe zu schädigen, wird zunächst versucht, den Tumor mit einer Chemotherapie zu verkleinern. Dann wird mit der chirurgischen Methode in die krebsartige Masse und das Gewebe eingegriffen. Wenn der Eierstockkrebs nach der Operation nicht in den Körper gestreut hat, ist eine Chemotherapie möglicherweise nicht erforderlich. Wenn der Eierstockkrebs gestreut hat, sollte eine Chemo- oder Strahlentherapie durchgeführt werden. Die Chemotherapie wird je nach Stadium der Erkrankung über 6-9 Zyklen nach der Operation durchgeführt.
Neue Behandlungsalternativen für Eierstockkrebs werden in unserem Land inzwischen häufig angewandt. Behandlungen mit zielgerichteten Wirkstoffen erhöhen die Heilungswahrscheinlichkeit, verlängern die Überlebenszeit und bieten eine deutliche Linderung der Symptome. Bei der Behandlung von Eierstockkrebs ist der Schutz der Fortpflanzung sehr wichtig. Vor allem bei Keimzellen-Ovarialkarzinomen und Ovarialkarzinomen des Borderline-Typs, die in einem frühen Alter auftreten, wird nur das Krebsgewebe oder der krebsbefallene Eierstock entfernt, während die Gebärmutter und der gegenüberliegende Eierstock erhalten bleiben, so dass eine Empfängnis möglich ist.
HÄUFIG GESTELLTE FRAGEN ZU EIERSTOCKKREBS
Welches sind die Stadien des Eierstockkrebses?
Das Stadium, in dem Eierstockkrebs diagnostiziert wird, ist für die Behandlung von Eierstockkrebs sehr wichtig. Es ist wichtig zu wissen, ob sich der Krebs vom Eierstock auf die umliegenden und angrenzenden Organe ausgebreitet hat. Die Stadieneinteilung bei Eierstockkrebs richtet sich nach dem Grad der Ausbreitung des Krebses.
Stadium 1: Der Krebs befindet sich in einem oder in beiden Eierstöcken, aber nur in einem Eierstock.
Stadium 1a: Der Krebs ist auf einen Eierstock und innerhalb des Eierstocks begrenzt.
Stadium 1b: Der Krebs befindet sich in beiden Eierstöcken, ist aber noch auf die Eierstöcke beschränkt.
Stadium 1c: Der Krebs befindet sich in einem oder beiden Eierstöcken, hat sich aber auch über den Rand des Eierstocks hinaus ausgebreitet. Eine Tumorzyste am Eierstock ist geplatzt, oder es wurden Krebszellen in der Bauchflüssigkeit gefunden.
Stadium 2: Der Krebs hat sich auf andere Organe im Becken, dem von den Beckenknochen umgebenen Bereich, ausgebreitet.
Stadium 2a: Der Krebs hat sich auf die Gebärmutter, die Eileiter oder beides ausgebreitet.
Stadium 2b: Der Krebs hat sich auf die Blase oder den Dickdarm ausgebreitet.
Stadium 2c: Der Krebs hat sich auf eine der in 2a und 2b beschriebenen Arten ausgebreitet. Der Krebs hat sich auch über den Rand des Eierstocks hinaus ausgebreitet, eine Tumorzyste am Eierstock ist geplatzt, oder es wurden Krebszellen in der Bauchflüssigkeit gefunden.
Stadium 3: Der Krebs hat sich in den Unterleib ausgebreitet oder die Lymphknoten befallen.
Stadium 3a: Die Krebszellen haben sich im Bauchraum ausgebreitet, aber nur in so kleinen Herden, dass sie nur unter dem Mikroskop zu sehen sind.
Stadium 3b: Die Krebszellen haben sich in den Bauchraum ausgebreitet, sind aber weniger als 2 Zentimeter groß.
Stadium 3c: Die Krebszellen haben sich in den Bauchraum ausgebreitet und sind größer als 2 Zentimeter oder haben sich auf die Lymphknoten ausgebreitet, oder es liegen beide Bedingungen vor.
Stadium 4: Der Krebs hat sich auf die Leber, die Lunge oder andere entfernte Organe ausgebreitet.
Wie wichtig ist die Frühdiagnose bei Eierstockkrebs?
Das Ansprechen von Eierstockkrebs auf die Behandlung hängt direkt davon ab, wie weit sich der Tumor ausgebreitet hat. Wird Eierstockkrebs in einem frühen Stadium diagnostiziert und angemessen behandelt, kann er zu 80-90 % eliminiert werden. Die Heilungsrate für Eierstockkrebs, der in fortgeschrittenen Stadien diagnostiziert wird, liegt bei 40-50 Prozent. Nach einer
Eierstockkrebsoperation und einer Chemotherapie sollte die Patientin regelmäßig auf ein mögliches Wiederauftreten der Krankheit untersucht werden.
Ist Eierstockkrebs tödlich?
Eierstockkrebs (Ovarialkarzinom) ist eine sehr wichtige Krankheit, die die Gesundheit und das Leben von Frauen ernsthaft bedroht und in jedem Alter auftreten kann. Eierstockkrebs ist die tödlichste aller Krebserkrankungen der weiblichen Geschlechtsorgane. Im Vergleich zu anderen gynäkologischen Krebsarten wird Eierstockkrebs im Frühstadium in der Regel erst sehr spät diagnostiziert, da er so gut wie keine ersten Symptome verursacht. Daher ist die routinemäßige gynäkologische USG für die Frühdiagnose wichtig.
Besteht nach der Menopause ein erhöhtes Risiko für Eierstockkrebs?
Eierstockkrebs wird je nach Art des Gewebes, von dem er ausgeht, in zwei Typen unterteilt. Die Art der Erkrankung verändert die Wahrscheinlichkeit des Auftretens und das Alter des Ausbruchs. Menschen, die noch nie ein Kind geboren haben und in deren Familie Brust- und Eierstockkrebs vorkommt, haben ein erhöhtes Risiko, an der Krankheit zu erkranken. Als wichtigster Risikofaktor gilt jedoch das fortgeschrittene Alter. Allein die Unterstützung durch Östrogenhormone, insbesondere nach der Menopause, gehört zu den Faktoren, die Eierstockkrebs auslösen.
Was ist CA 125?
CA125 ist ein Protein, das sich auf der Oberfläche der meisten Eierstockkrebszellen befindet. Es kann im Blut von Frauen mit Eierstockkrebs deutlich erhöht sein. Geringe Mengen dieses Proteins können auch bei einigen anderen Krebsarten gebildet werden.
Was ist CA 125 bei Eierstockkrebs?
Werte zwischen 0 und 35 im CA 125-Test sind normal. Liegt der Wert zwischen 35 und 50, sollte die Patientin unter Kontrolle sein. Bei Werten über 50 besteht der Verdacht auf Eierstockkrebs. Der CA 125-Wert muss jedoch nicht bei jedem Eierstockkrebs hoch sein.
Wo kann Eierstockkrebs metastasieren?
Eierstockkrebs kann in fortgeschrittenen Stadien auf verschiedene Organe übergreifen. Bei der Behandlung muss festgestellt werden, ob er sich auf den Eierstock und die umliegenden Organe ausgebreitet hat. Das wichtigste Merkmal dieses Krebses ist, dass er sich auf die Bauchorgane ausbreitet. Da er sich in kurzer Zeit auf intraabdominale Organe ausbreiten kann, wird er in der Regel in einem fortgeschrittenen Stadium diagnostiziert. Eierstockkrebs kann in den Dünn- und Dickdarm streuen. Er kann auch in das Bauchfell, das Becken, die Lunge und die Leber metastasieren.
Kann Eierstockkrebs mit anderen Krankheiten verwechselt werden? Da Symptome wie Verdauungsbeschwerden, Schmerzen in der Leistengegend und Verstopfung
bei Eierstockkrebs auftreten können, verschwenden die Patientinnen möglicherweise Zeit in der Gastroenterologie oder der Inneren Medizin mit der Frage, ob ein Problem im Verdauungssystem vorliegt. Manchmal kann die Diagnose von diesen Ärzten gestellt werden. Tritt ein Verdauungsproblem im fortgeschrittenen Alter auf, sollte die Gynäkologie konsultiert werden.
Wird Eierstockkrebs offen operiert?
Bei Flüssigkeitsansammlungen im Unterleib und Tumorausbreitung im fortgeschrittenen Stadium wird eine offene Operation durchgeführt. In einigen Fällen wird eine Laparoskopie durchgeführt, um die Ausdehnung des Tumors zu beobachten, und wenn keine große Ausbreitung vorliegt, können die Tumore in der gleichen Sitzung entfernt werden. Bei diesen Patientinnen können auch die Gebärmutter, die Eierstöcke und die Lymphknoten laparoskopisch oder robotergestützt entfernt werden, und auch der Blinddarm kann in der Gruppe, die es benötigt, entfernt werden. Die Chemotherapie wird
entsprechend der Pathologie geplant.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST STRAHLENTHERAPIE?
Strahlung ist eine besondere Art von Energie, die durch Wellen oder Teilchen übertragen wird. Sie kann durch spezielle Geräte erzeugt oder durch so genannte radioaktive Stoffe freigesetzt werden. Diese Energie wird in der Medizin zu bildgebenden Zwecken und auch zur Behandlung von Krebs und einigen anderen Krankheiten eingesetzt. Um die Strahlung auf das kranke Organ zu richten, sind spezielle Geräte erforderlich. Auf diese Weise wird der Einsatz hoher Dosen von Strahlungsenergie zur Behandlung als “Strahlentherapie” oder “Radiotherapie” bezeichnet.
WIE WIRKT DIE STRAHLENTHERAPIE AUF DEN KÖRPER?
Hohe Strahlendosen haben die Fähigkeit, Zellen abzutöten oder sie an der Teilung und Vermehrung zu hindern. Da sich Krebszellen viel schneller teilen und vermehren als normale Zellen, ist die Strahlentherapie bei Krebszellen wirksamer als bei normalen Zellen. Außerdem ist es für normale, gesunde Zellen viel einfacher, sich zu erholen und zu regenerieren als für Krebszellen. In der so genannten “Planungsphase” werden die notwendigen Zeichnungen angefertigt, um sicherzustellen, dass das kranke Gewebe der maximalen Strahlung und das normale Gewebe der minimalen Strahlung ausgesetzt wird, und die Behandlung wird gezielt eingesetzt.
WAS SIND DIE VORTEILE UND ZIELE DER STRAHLENTHERAPIE?
Die Strahlentherapie wird bei fast allen Krebsarten, die in fast allen Teilen des Körpers auftreten können, und bei etwa 50 % der Krebspatienten eingesetzt. Bei einigen Krebsarten ist die Strahlentherapie die einzige Behandlung. Die Strahlentherapie allein oder in Kombination mit einer Operation und/oder einer medikamentösen Behandlung (“Chemotherapie“) ist eine Behandlungsmethode, die bei vielen Patienten zu einer vollständigen Heilung führen kann.
Strahlentherapie
- Für die einmalige, gezielte, hochdosierte und kurzfristige Behandlung (stereotaktisch)
- Zur Verkleinerung des Tumors vor der Operation (neoadjuvant),
- Zur Entfernung von Krebszellen, die nach der Operation auf mikroskopischer Ebene im Körper verbleiben können (adjuvant),
- Während der Operation (intraoperativ) bei einigen Krebsarten,
- Für die direkte Behandlung ohne Operation, in Kombination mit Chemotherapie (kurativ),
- In einigen Fällen, in denen eine vollständige Heilung der Krankheit nicht möglich ist, kann eine Strahlentherapie eingesetzt werden, um die Beschwerden des Patienten wie Schmerzen und Blutungen zu lindern. Diese Art der Behandlung wird als “palliative Behandlung” bezeichnet.
WER FÜHRT DIE STRAHLENTHERAPIE DURCH?
Der “Strahlenonkologe”, ein auf die Behandlung von Krankheiten mit Strahlen spezialisierter Arzt, bestimmt die Art und den Plan der Behandlung, die der Patient benötigt.
Während der Behandlung arbeiten die Radioonkologen mit einem speziellen Team zusammen. In diesem Team; 0
Strahlenphysiker: Überprüft, ob die Geräte richtig funktionieren und die richtige Strahlendosis abgeben.
Krankenschwester für Strahlentherapie: Erbringt Pflegeleistungen während der Behandlung, hilft bei der Minimierung von Nebenwirkungen, die bei den Patienten auftreten können, und unterstützt sie bei der Ernährung während der Behandlung.
Techniker für Strahlentherapie: Bereitet den Patienten auf die Behandlung vor und führt die täglich geplanten Behandlungen mit den Behandlungsgeräten durch.
WELCHE ARTEN DER STRAHLENTHERAPIE GIBT ES?
Die Strahlentherapie wird auf zwei Arten angewandt. Extern (äußerlich) und intern (innerlich). Bei einigen Patienten können diese beiden Formen nacheinander angewendet werden.
Extern (extern):
Bei den meisten Patienten wird die Strahlentherapie von außen durchgeführt. Sie erfolgt in der Regel in Behandlungszentren und Ambulanzen und wird durchgeführt, indem die Strahlen mit Hilfe von Bestrahlungsgeräten auf das erkrankte Gewebe gerichtet werden. Bis vor einigen Jahren wurden externe Behandlungen in 2 Dimensionen mit sogenannten Kobalt-60- oder Linearbeschleunigern durchgeführt. Da bei zweidimensionalen Behandlungen große Sicherheitsabstände erforderlich waren, um eine ausreichende Dosis an das Zielvolumen abzugeben, waren die Schädigung des normalen Gewebes und die Nebenwirkungen höher. Dank der technologischen Veränderungen bei den Strahlentherapiegeräten in den letzten Jahren können jedoch die dreidimensionale konforme Strahlentherapie, die IMRT (intensitätsmodulierte Strahlentherapie) und die sterotaktische Strahlentherapie (Linac-basiert, Gamaknife, Cyberknife) eingesetzt werden, um sicherzustellen, dass das Zielvolumen eine maximale Dosis erhält, während das normale Gewebe eine minimale Dosis erhält. Wenn eine Strahlentherapie beschlossen wird, entscheidet der Arzt auch, welches Gerät für den Patienten am besten geeignet ist.
Intern:
Bei der inneren Bestrahlung wird das radioaktive Material oder die Strahlenquelle mit dünnen Drähten oder Schläuchen direkt in den Tumor oder in eine Körperhöhle eingeführt. Die Methode, die häufig bei gynäkologischen Tumoren eingesetzt wird, kann auch in der nach einer Operation verbleibenden Höhle angewendet werden.
WIE ERSTELLT DER ARZT DEN BEHANDLUNGSPLAN BEI DER EXTERNEN STRAHLENTHERAPIE?
Bei der Strahlentherapie werden unterschiedliche Strahlenquellen eingesetzt. Der Arzt kann Röntgenstrahlen oder Elektronenstrahlen verwenden. Die Wahl der Strahlenquelle hängt von der Art des Tumors, seiner Lage im Körper und vor allem von seiner Tiefe ab. Hochenergetische Röntgenstrahlen werden zur Behandlung vieler Krebsarten eingesetzt. Mit Elektronenstrahlen können einige Hautkrankheiten behandelt werden.
Vor Beginn der Behandlung wird eine vorbereitende Sitzung mit computergestützter Planungstomographie durchgeführt. Ziel ist es, die Behandlung zu individualisieren und die Bestrahlungstechnik zu bestimmen, die je nach Art und Ausmaß der Krebserkrankung gewählt werden sollte. Die Einzelheiten dieser Vorbereitungssitzung und der Behandlung selbst (insbesondere die Häufigkeit und Dauer der Sitzungen) werden dem Patienten bei der Erstuntersuchung vom Radioonkologen erläutert. Zunächst wird die Position des Patienten im Gerät während der Bestrahlung festgelegt, und dann wird in dieser Position ein CT-Scan durchgeführt. Die CT-Untersuchung des Behandlungsplans ermöglicht es, die Bereiche mit dem höchsten Risiko für Tumore und/oder Tumorausbreitung sowie die normalen Gewebe, die geschützt werden müssen, zu identifizieren. Während der CT-Untersuchung können Immobilisierungsvorrichtungen, Kunststoffmasken oder die Injektion eines Kontrastmittels in eine Vene verwendet werden.
Auf der Haut des Patienten werden Markierungen angebracht, um sicherzustellen, dass das “Zielvolumen” von einer Bestrahlungssitzung zur nächsten unter den gleichen Bedingungen bestrahlt wird. Zu diesem Zweck werden Tintenstifte verwendet, die sich nicht so leicht ablösen, oder es kann eine Tätowierung vorgenommen werden. Da wasserfeste Klebebänder verwendet werden, stellt das tägliche Baden kein Problem dar. Falls Ihre Markierungen gelöscht werden, sollten Sie den Techniker darauf hinweisen und sie nicht selbst ergänzen.
Nach der Bestimmung des Zielvolumens und des Normalgewebes durch Tomographieschnitte wird Ihr Arzt in Absprache mit dem Strahlenphysiker festlegen, wie viel Strahlendosis der Patient benötigt, wie diese Dosis verabreicht wird und wie viele Sitzungen erforderlich sind. Der Planungsprozess kann am selben Tag stattfinden oder einige Tage dauern.
Nach Beginn der Behandlung überwacht der Arzt das Ansprechen des Patienten auf die Behandlung, seinen Allgemeinzustand und mögliche Nebenwirkungen der Behandlung. In der Regel sehen Sie Ihren Radioonkologen einmal pro Woche, aber Sie können ihn auch häufiger sehen, je nach den Bedürfnissen des Patienten. Es ist sehr wichtig, dass die geplanten Behandlungen pünktlich durchgeführt werden. Unterbrechungen der Behandlung und unnötige Pausen können die erwartete Wirksamkeit der Behandlung verringern.
WAS IST EINE HYPERFRAKTIONIERTE STRAHLENTHERAPIE?
Die Strahlentherapie wird je nach Art und Lage des Tumors in Tagesdosen aufgeteilt. Bei der hyperfraktionierten Strahlentherapie wird die Tagesdosis ebenfalls in mehrere kleine Teile aufgeteilt. Sollen an einem Tag mehrere Behandlungen in einem Gebiet durchgeführt werden, so werden diese in der Regel in Abständen von 4-6 Stunden verabreicht.
WAS IST EINE INTRAOPERATIVE STRAHLENTHERAPIE?
Bei der intraoperativen Strahlentherapie werden die Operation und die Strahlentherapie gleichzeitig durchgeführt. Der Chirurg entfernt so viel Tumorgewebe wie möglich. Unmittelbar nach der Operation wird das Tumorbett im Operationssaal bestrahlt, um etwaige im entfernten Bereich verbliebene Tumorzellen zu entfernen.
WAS PASSIERT WÄHREND EINER STRAHLENTHERAPIE?
Vor Beginn der Behandlung zieht der Patient seine Kleidung aus und trägt einen Kittel. Aus diesem Grund wird empfohlen, mit Kleidung zur Behandlung zu kommen, die leicht gewechselt werden kann.
Der Strahlentherapeut nutzt die zuvor auf der Haut des Patienten markierten Linien, um den Behandlungsbereich zu lokalisieren. Der Patient muss auf einem speziellen Stuhl sitzen oder auf der Behandlungsliege liegen. Bei jeder Sitzung bleibt der Patient durchschnittlich 15 Minuten im Behandlungsraum, und die Strahlendosis wird über einen Zeitraum von 1 bis 5 Minuten verabreicht. Die externe Strahlentherapie ist schmerzlos, ähnlich wie die Aufnahme eines Röntgenfilms.
Der Patient muss während der Behandlung nicht die Luft anhalten, es sei denn, es liegen besondere Umstände vor, und es reicht aus, normal zu atmen. Bei der Strahlentherapie ist es wichtig, dass die definierte Dosis so genau wie möglich verabreicht wird, damit die Strahlen die richtige Stelle im Körper erreichen, dass die Position des Patienten während der Behandlung nicht gestört wird, dass bei jeder Behandlung dieselbe Position eingenommen wird und dass die Umgebung immobilisiert wird, um den Komfort des Patienten bestmöglich zu gewährleisten. Bei diesem als Immobilisierung bezeichneten Prozess können je nach dem zu behandelnden Bereich Zubehörteile wie Kopf-Hals-Masken, Vakuumbetten, Unterkniestabilisatoren oder Schulterzuggeräte verwendet werden.
Der Strahlentherapeut verlässt den Raum, bevor der Strahl abgegeben wird. Die Geräte werden von einem kleinen Bereich in der Nähe aus gesteuert. Der Patient kann auch durch einen Monitor oder ein Fenster zusehen. Wenn der Patient spricht, ist seine Stimme über den Lautsprecher zu hören, und es kann eine Kommunikation mit dem Techniker und dem Arzt hergestellt werden. Aufgrund der Größe der Bestrahlungsgeräte kann es zu einer leichten Geräuschentwicklung kommen, da sich die Geräte in verschiedenen Winkeln um den Behandlungsbereich drehen. Die Patienten sollten jedoch bedenken, dass die Geräte von den zuständigen Technikern bedient werden und ihr Betrieb regelmäßig überprüft wird. Wenn Sie Fragen zum Behandlungsraum oder zu den Geräten haben, können Sie sich an den Techniker oder den Arzt wenden.
Die Strahlung kann weder gesehen noch gehört oder gefühlt werden. Tritt während der Behandlung eine Situation ein, in der sich der Patient sehr unwohl fühlt, sollte der Techniker sofort informiert werden. Falls erforderlich, kann der Betrieb der Geräte sofort eingestellt werden.
GIBT ES NEBENWIRKUNGEN DER STRAHLENTHERAPIE?
Bei der externen Strahlentherapie wird der Körper nicht radioaktiviert. Daher muss der Kontakt mit den behandelten Personen nicht vermieden werden. Selbst bei Berührungen wie Umarmungen und Küssen besteht kein Risiko einer Beeinträchtigung anderer Personen.
Die Nebenwirkungen der Strahlentherapie sind in der Regel Beschwerden im behandelten Gebiet. Der Arzt und das Pflegepersonal informieren den Patienten darüber, wie er mit diesen Nebenwirkungen umgehen kann. Der Arzt oder das Pflegepersonal sollte informiert werden, wenn während der Behandlung Beschwerden wie Husten, Fieber, Schwitzen oder ungewöhnliche Schmerzen auftreten. Die Nebenwirkungen verschwinden in der Regel innerhalb weniger Wochen nach Beendigung der Behandlung und können mit Medikamenten oder einer Diät kontrolliert werden. Länger anhaltende Nebenwirkungen können ebenfalls mit einer geeigneten Behandlung in den Griff bekommen werden.
Die Wirksamkeit der Behandlung wird vom Arzt überwacht. Nach der Behandlung ist zu beobachten, dass Schmerzen, Blutungen und ähnliche Beschwerden abnehmen und andere Anzeichen einer Besserung mit der Zeit auftreten. Der Arzt kann zur Überwachung der Wirkung der Behandlung einige Blutuntersuchungen anordnen.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
Was ist Strahlentherapie?
Die Strahlentherapie ist eine der am häufigsten angewandten Methoden im Kampf gegen Krebs. Der deutsche Physiker Wilhelm Röntgen, der mit Kathodenstrahlen arbeitete, nannte diese Strahlen, die er nie zuvor entdeckt und erkannt hatte, Röntgenstrahlen, d.h. unbekannte Strahlen. Röntgenstrahlen mit erhöhter Energie werden auf Krebsgewebe gerichtet. Die Strahlentherapie, die nur auf den Bereich abzielt, in dem sich das Krebsgewebe befindet, wird bei vielen Krebsarten eingesetzt. Das Hauptziel besteht darin, die Struktur der Krebszellen zu zerstören und ihre Fähigkeit zur Teilung zu verringern. Auf diese Weise ist es möglich, die Krankheit zu kontrollieren. Die Strahlentherapie wird zu unterschiedlichen Zwecken eingesetzt (radikal, adjuvant, neoadjuvant, prophylaktisch, palliativ).
Bei welchen Krankheiten wird die Strahlentherapie eingesetzt?
Eine Strahlentherapie kann bei Krebspatienten durchgeführt werden, die dafür geeignet sind. Die Strahlentherapie kann als primäre Krebsbehandlung eingesetzt werden, insbesondere bei Lymphomen und Krebserkrankungen im Kopf- und Halsbereich.
Das National Cancer Institute (NCI) listet die Krebsarten, bei denen eine Strahlentherapie eingesetzt wird, wie folgt auf:
- Brustkrebs
- Lungenkrebs
- Prostatakrebs
- Dickdarmkrebs
- Krebserkrankungen des Kopfes oder Halses
Es wird berichtet, dass die Brachytherapie eine besonders wirksame Behandlung für Krebserkrankungen in bestimmten Körperregionen sein kann.
- Gebärmutterhalskrebs (Krebs des Gebärmutterhalses)
- Gebärmutterkrebs
- Krebs des Enddarms
- Krebserkrankungen von Kopf und Hals
- Augentumore
- Hirntumor
- Lungenkrebs
- Hautkrebs
- Brustkrebs
- Speiseröhrenkrebs
- Krebserkrankungen in der Anusregion
- Harnblasenkrebs
Was sind die Vorteile der Strahlentherapie?
Zwischen 50 und 60 Prozent aller Krebsarten erfordern eine Strahlentherapie. Bei etwa 25 % der Personen, die ihre Gesundheit wiedererlangen, wird dieses Bild durch die Wirkung der Strahlentherapie realisiert. Die Strahlentherapie wird eingesetzt, um Krebszellen zu entfernen, die nach einer chirurgischen Krebsbehandlung möglicherweise noch vorhanden sind. Gleichzeitig wird die Strahlentherapie auch zur Linderung der Krebssymptome eingesetzt.
Die Vorteile der Strahlentherapie sind im Folgenden aufgeführt:
- Bei Krebserkrankungen, die in einem frühen Stadium erkannt werden, kann eine Heilung in kurzer Zeit erreicht werden.
- Die Ausbreitung des Krebses auf andere Teile des Körpers kann gestoppt werden.
- Eine wirksame Behandlung von wiederkehrenden Krebserkrankungen kann erreicht werden
- Bei fortgeschrittenen Krebserkrankungen zu Hause können die Symptome gelindert werden
- Kein Wundsein und keine Schmerzen bei der Anwendung
- Während der Anwendung ist keine Strahlung zu spüren
Wie wird die Strahlentherapie (Radiotherapie) angewendet?
Bei der Strahlentherapie unterscheidet man zwischen externer (äußere Behandlung) und Brachytherapie (innere Behandlung). Im Allgemeinen werden die Anwendungen mit der externen (äußeren) Methode durchgeführt. Während der Behandlung wird der Patient gebeten, bewegungslos auf dem Tisch zu liegen, auf dem die Behandlung durchgeführt wird. Die Strahlentherapie, für die eigene Geräte und Apparate zur Verfügung stehen, wird häufig bei Personen mit Krebsdiagnose sowie bei Personen mit einigen gutartigen Tumoren angewendet. In diesem Raum, in dem spezielle Geräte aufgestellt sind, werden die Behandlungen in Sitzungen durchgeführt. Bei der Strahlentherapie wird der Punkt anvisiert, an dem sich der Krebs gebildet hat. In einem anderen Raum wird die Situation mit Kameras überprüft und die Dauer der Bestrahlung sowie die Genauigkeit des Bestrahlungsbereichs bestätigt. Während der Strahlentherapie werden keine Schmerzen, kein Brennen und kein Schock verspürt. Die Menschen merken nicht, dass sie bestrahlt werden. Es werden Masken und Zubehör verwendet, um die Bewegung während der Strahlentherapie in bestimmten anatomischen Regionen zu reduzieren.
Häufig gestellte Fragen
Was sind die Phasen der Strahlentherapie?
Wie bei jeder anderen Krankheit folgt auch die Behandlung von Krebs einem bestimmten Schema oder Weg. Für die Strahlentherapie ist ein Fahrplan wie folgt vorgesehen:
- Der erste Schritt ist die Beurteilung des Patienten (Stadieneinteilung, Indikation zur Behandlung).
- Simulation (Planung, CT-Scan)
- Zeichnen des zu schützenden Zielgewebes und der Organe mit Hilfe von Computerprogrammen und Erstellung von 3D-Strukturen (Tumorgröße, Lage, Intaktheit, Umgebung, Gewebe)
- Behandlungsplanung (Strahlenarten, Dosisberechnung, Vergleich von Techniken)
Was ist der Unterschied zwischen Strahlentherapie und Chemotherapie?
Die gezielte Bestrahlung des Bereichs, in dem sich Krebszellen bilden, wird als Strahlentherapie oder Radiotherapie bezeichnet. Diese gebietsbezogene Behandlung zielt darauf ab, die Krebszelle in diesem Gebiet zu beseitigen und die erneute Bildung von Krebszellen in demselben Gebiet zu verhindern. Die Behandlungsmethode, die darauf abzielt, Krebszellen im ganzen Körper zu zerstören, und die mit Medikamenten durchgeführt wird, wird Chemotherapie genannt. Die Behandlungsoption wird je nach Art und Stadium des Krebses von Fachärzten festgelegt.
In welchem Stadium einer Krebserkrankung wird eine Strahlentherapie durchgeführt?
Die Strahlentherapie (Radiotherapie) kann bei allen Organerkrankungen, die einen Tumor enthalten, von der Diagnose bis zum Endstadium eingesetzt werden.
Wie viele Sitzungen umfasst die Strahlentherapie?
Dieses Verfahren variiert je nach Stadium des Krebses und den aktuellen Bedingungen. Dieses Verfahren, das unter der Aufsicht von Fachärzten durchgeführt wird, wird in der Regel durch die Verabreichung von kleinen Dosen von Strahlentherapie jeden Tag (außer am Wochenende) für 10 bis 40 Tage abgeschlossen.
Wie lange dauert eine Strahlentherapie?
Bei der Strahlentherapie handelt es sich um eine Behandlung, die täglich etwa 10-20 Minuten dauert, je nach Behandlungsgebiet und Stadium der Erkrankung.
Werden während der Strahlentherapie Schmerzen empfunden?
Während der Strahlentherapie sind weder Schmerzen noch Beschwerden zu spüren. Die Strahlentherapie ist für das Auge unsichtbar. Schmecken, riechen oder hören ist nicht möglich.
Wann ist die Strahlentherapie erfolgreich?
Bei der Strahlentherapie ist in der Regel nicht mit sehr schnellen und unmittelbaren Ergebnissen zu rechnen. Die Strahlentherapie tötet Krebsherde nicht sofort ab. Das Absterben von Krebszellen kann sich über Tage, Wochen oder Monate erstrecken. Diese Zellen sterben auch nach Beendigung der Strahlentherapie weiter ab.
Wie sollte der Patient, der eine Strahlentherapie erhält, ernährt werden?
Es ist wichtig, dass Patienten, die eine Strahlentherapie erhalten, eiweißreiche Nahrungsmittel zu sich nehmen. Während der Behandlungsphase kann Appetitlosigkeit beobachtet werden. Appetitlosigkeit muss nicht bei jedem Patienten auftreten, aber Halsschmerzen, Erbrechen, Müdigkeit, Erschöpfung, Zahn- und Zahnfleischprobleme sowie Geschmacksveränderungen können zu Ernährungsproblemen führen. Neben der Bedeutung des Eiweißverzehrs für die Regeneration des Gewebes ist der Verzehr von Kohlenhydraten, die den Körper mit Energie versorgen, sehr wichtig, um das Gefühl der Schwäche und Müdigkeit in dieser Phase zu bekämpfen. Während der Strahlentherapie sollte auf die Mund- und Zahnpflege und die Darmgesundheit geachtet werden.
Gibt der Patient, der eine Strahlentherapie erhält, Strahlung ab?
Diese Situation gehört zu den weit verbreiteten Irrtümern in der Gesellschaft. Es ist unmöglich, dass Menschen nach einer Strahlentherapie Strahlung abgeben.
Was sollte eine Person, die eine Strahlentherapie erhält, tun?
Zunächst müssen die Empfehlungen des Arztes befolgt werden, der die Krankheit im ersten Stadium überwacht. Im Allgemeinen sollte man das Idealgewicht nicht über- oder unterschreiten. Wie bei allen gesunden Menschen ist es wichtig, dem Körper durch die Zufuhr von Vitaminen, Eiweiß, Kohlenhydraten usw. Energie zuzuführen, insbesondere durch die Aufnahme von Flüssigkeit. Dabei sollte auf den Verzehr von Lebensmitteln geachtet werden, die der Zellerneuerung dienen. Zusätzliche Nahrungsmittel, Kräutertees, Vitamine, spezielle Rezepte, die angeblich heilend wirken sollen, sollten jedoch nie ohne Rücksprache mit einem Facharzt verwendet werden. Es sollte darauf geachtet werden, die Haut vor Sonneneinstrahlung zu schützen, indem Kleidung aus Stoffen gewählt wird, deren Beschaffenheit die Haut nicht reizt. Professionelle psychologische Unterstützung kann in diesem Prozess angeboten werden.
Was sind die Nebenwirkungen der Strahlentherapie?
Wie bei jeder Behandlung können auch bei der Strahlentherapie Nebenwirkungen auftreten. Diese Nebenwirkungen sind je nach Ort und Stadium der Erkrankung unterschiedlich. Da es sich bei der Strahlentherapie um eine lokale Behandlung handelt, sind Nebenwirkungen außerhalb des Anwendungsgebiets nicht zu erwarten. Im Allgemeinen handelt es sich dabei um Reizungen, Haare, Haarausfall in dem Bereich, in dem die Strahlentherapie angewendet wird. Schluckbeschwerden, Geschmacksveränderungen, Brennen im Urin, Erschöpfungsgefühl, Durchfall und Mundtrockenheit können auftreten. Während zum Beispiel bei der Bestrahlung der Brust Hautreizungen und Schluckbeschwerden zu erwarten sind, ist Haarausfall bei dieser Behandlung nicht zu erwarten. Bei der Behandlung von Unterleibskrebs können Durchfall, Bauchschmerzen, Brennen im Urin und häufiges Wasserlassen beobachtet werden. Die Nebenwirkungen, die nach der Behandlung in den einzelnen Regionen auftreten können, können sich also voneinander unterscheiden. Darüber hinaus sollte man wissen, dass das tägliche Leben während der Strahlentherapie problemlos weitergeführt werden kann.
Was passiert, wenn die Strahlentherapie unterbrochen wird?
Bei der Strahlentherapie handelt es sich um eine Behandlung, die je nach Art und Stadium der Krebserkrankung in unterschiedlicher Dosierung und Dauer durchgeführt wird und in der Regel an Wochentagen erfolgt. Für den Erfolg der Behandlung ist es wichtig, dass sie unter diesen Bedingungen kontinuierlich durchgeführt wird, außer aus technischen Gründen. Um die manchmal auftretenden Nebenwirkungen zu verringern, kann jedoch unter der Kontrolle des Arztes eine Pause eingelegt werden, und wenn die Behandlung aufgrund technischer Probleme unterbrochen wird, kann die Behandlungsdauer durch entsprechende Berechnungen unter der Kontrolle des Arztes geändert werden.
Wo wird die Strahlentherapie angewendet?
Die Strahlentherapie wird in fortgeschrittenen Krebszentren angewandt. Krebspatienten können mit multidisziplinären Ansätzen von Teams aus medizinischer Onkologie, Radioonkologie, Nuklearmedizin und verwandten Fachrichtungen behandelt werden.
Welche Geräte werden in der Strahlentherapie eingesetzt?
Moderne Technologien wie Electa Versa Hd, Elecra Versa Signature und TrueBeam STx werden in unserem Land für die Strahlentherapie eingesetzt.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
Was ist eine Strahlentherapie?
Strahlung ist eine besondere Art von Energie, die durch Wellen oder Teilchen übertragen wird. Sie kann durch spezielle Geräte erzeugt oder durch so genannte radioaktive Stoffe freigesetzt werden. Diese Energie wird in der Medizin zu bildgebenden Zwecken sowie zur Behandlung von Krebs und einigen anderen Krankheiten eingesetzt. Um die Strahlung auf das kranke Organ zu richten, sind spezielle Geräte erforderlich. Auf diese Weise wird der Einsatz hoher Dosen von Strahlungsenergie zur Behandlung als “Strahlentherapie” oder “Radiotherapie” bezeichnet.
Bei welchen Krankheiten wird es eingesetzt?
Die Strahlentherapie wird bei fast allen Krebsarten, die in fast allen Teilen des Körpers auftreten können, und bei etwa 50 % der Krebspatienten eingesetzt. Bei einigen Krebsarten ist die Strahlentherapie die einzige Behandlung. Die Strahlentherapie allein oder in Kombination mit einer Operation und/oder einer medikamentösen Behandlung (“Chemotherapie“) ist eine Behandlungsmethode, die bei vielen Patienten zu einer vollständigen Heilung führen kann.
Strahlentherapie
- Zur Schrumpfung des Tumors vor der Operation,
- Zur Entfernung von Krebszellen, die nach der Operation auf mikroskopischer Ebene im Körper verbleiben können,
- Alleine als primäre Behandlung der Krankheit
- Zur direkten Behandlung in Kombination mit einer Chemotherapie, ohne Operation,
- In einigen Fällen, in denen eine vollständige Heilung der Krankheit nicht möglich ist, kann eine Strahlentherapie eingesetzt werden, um die Beschwerden des Patienten wie Schmerzen und Blutungen zu lindern. Diese Art der Behandlung wird als “palliative Behandlung” bezeichnet.
Wie kann man sich bewerben?
Die Strahlentherapie wird auf zwei Arten angewandt. Extern (äußerlich) und intern (innerlich). Bei einigen Patienten können diese beiden Formen nacheinander angewendet werden.
Extern (extern):
Bei den meisten Patienten wird die Strahlentherapie von außen durchgeführt. Sie erfolgt in der Regel in Behandlungszentren und Ambulanzen und wird durchgeführt, indem die Strahlen mit Hilfe von Bestrahlungsgeräten auf das erkrankte Gewebe gerichtet werden. Bis vor einigen Jahren wurden externe Behandlungen in 2 Dimensionen mit sogenannten Kobalt-60- oder Linearbeschleunigern durchgeführt. Da bei zweidimensionalen Behandlungen große Sicherheitsabstände erforderlich waren, um eine ausreichende Dosis an das Zielvolumen abzugeben, waren die Schädigung des normalen Gewebes und die Nebenwirkungen höher. Dank der technologischen Veränderungen bei den Strahlentherapiegeräten in den letzten Jahren können jedoch die dreidimensionale konforme Strahlentherapie, die IMRT (intensitätsmodulierte Strahlentherapie) und die sterotaktische Körperbestrahlung (Linac-basiert, Gamaknife, Cyberknife) eingesetzt werden, um sicherzustellen, dass das Zielvolumen eine maximale Dosis erhält, während das normale Gewebe eine minimale Dosis erhält. Wenn die Entscheidung für eine Strahlentherapie getroffen wird, entscheidet der Arzt auch, welches Gerät für den Patienten am besten geeignet ist.
Intern:
Bei der inneren Bestrahlung wird das radioaktive Material oder die Strahlenquelle mit dünnen Drähten oder Schläuchen direkt in den Tumor oder in eine Körperhöhle eingebracht. Manchmal kann es auch in die nach einer Operation verbleibende Höhle eingebracht werden.
Stereotaktische Strahlentherapie
Bei der Strahlentherapie wird eine ablative (zerstörende) Strahlendosis punktuell verabreicht, wobei das normale Gewebe maximal geschützt wird. Diese Behandlungen werden häufig bei Tumoren mit einer Größe von 3 cm oder weniger am wirksamsten eingesetzt.
Es ist der häufigste Anwendungsbereich bei Patienten, die im Frühstadium von Lungenkrebs nicht operiert werden können. Es kann auch individuell an metastasierten Krankheitsherden angewendet werden.
Die Behandlung wird oft mit 1 bis 3 Anwendungen nach spezieller Planung durchgeführt. Es können sowohl spezielle Geräte als auch bestimmte Linearbeschleuniger verwendet werden.
Es handelt sich um eine schmerzfreie Behandlungsmethode mit minimalen Nebenwirkungen.
Wie sieht der Behandlungsplan und die Vorbereitung auf die Strahlentherapie aus?
- Computergestützte Planungstomographie: Vor Beginn der Strahlentherapie wird eine vorbereitende Sitzung mit computergestützter Planungstomographie durchgeführt. Ziel dieser Sitzung ist es, die Behandlung zu individualisieren und die Bestrahlungstechnik zu bestimmen, die je nach Art und Ausmaß der Krebserkrankung gewählt werden sollte. Die Einzelheiten dieser Vorbereitungssitzung und der Behandlung selbst (insbesondere die Häufigkeit und Dauer der Sitzungen) werden dem Patienten bei der Erstuntersuchung vom Radioonkologen erläutert.
- Identifizierung von Bereichen mit Tumoren oder Tumorausbreitung: Während der Bestrahlungssitzung wird die Position des Patienten im Gerät bestimmt und dann eine CT-Aufnahme in dieser Position gemacht. Die Computertomographie hilft bei der Planung der Behandlung, die risikoreichsten Bereiche für Tumore oder Tumorausbreitung sowie das normale Gewebe, das geschützt werden muss, zu identifizieren. Während der CT-Untersuchung können je nach dem darzustellenden Bereich eine Veneninjektion und manchmal ein Harnkatheter erforderlich sein.
- Anpassung der Strahlendosis: Nachdem der Arzt das Zielvolumen und das normale Gewebe anhand von Tomographieschnitten bestimmt hat, legen er und der Strahlenphysiker gemeinsam fest, wie viel Strahlendosis der Patient benötigt, wie diese Dosis verabreicht wird und wie viele Sitzungen erforderlich sind. Dies dauert in der Regel ein paar Tage.
- Bestimmung der Strahlenquelle: Bei der Strahlentherapie werden unterschiedliche Strahlenquellen eingesetzt. Der Arzt kann Röntgenstrahlen oder Elektronenstrahlen verwenden. Die Wahl der Strahlenquelle hängt von der Art des Tumors, seiner Lage im Körper und insbesondere von seiner Tiefe ab. Hochenergetische Röntgenstrahlen werden zur Behandlung vieler Krebsarten eingesetzt. Mit Elektronenstrahlen können einige Hautkrankheiten behandelt werden.
- Markierung des zu bestrahlenden Bereichs: Der Strahlentherapeut macht Markierungen auf der Haut des Patienten, um sicherzustellen, dass das “Zielvolumen” von einer Bestrahlungssitzung zur nächsten unter den gleichen Bedingungen bestrahlt wird. Zu diesem Zweck werden Tintenstifte verwendet, die sich nicht so leicht ablösen, oder es können Tätowierungen verwendet werden. Es sollte jedoch darauf geachtet werden, dass diese Markierungen beim Waschen nicht entfernt werden. Denn diese Markierungen werden bis zum Ende der Behandlung des Patienten benötigt. Wenn sie gelöscht werden, sollte der Therapeut darüber informiert werden. Der Patient sollte die gelöschten Markierungen nicht selbst ergänzen.
- Überwachung der Wirkung der Behandlung: Sobald die Behandlung begonnen hat, überwacht der Arzt das Ansprechen des Patienten auf die Behandlung, seinen allgemeinen Zustand und mögliche Nebenwirkungen der Behandlung. Diese Kontrolle findet in der Regel einmal wöchentlich statt, kann aber je nach den Bedürfnissen des Patienten variieren. Es ist sehr wichtig, dass die geplanten Behandlungen pünktlich durchgeführt werden. Eine Unterbrechung des Plans kann die erwartete Wirksamkeit der Behandlung beeinträchtigen.
Wie sieht der Behandlungsprozess aus?
Vor Beginn der Behandlung zieht der Patient seine Kleidung aus und trägt einen Kittel. Aus diesem Grund wird empfohlen, mit Kleidung zur Behandlung zu kommen, die leicht gewechselt werden kann.
Der Strahlentherapeut nutzt die zuvor auf der Haut des Patienten markierten Linien, um den Behandlungsbereich zu lokalisieren. Der Patient muss auf einem speziellen Stuhl sitzen oder auf der Behandlungsliege liegen. Jede Sitzung dauert zwischen 15 und 30 Minuten im Behandlungsraum, und die Strahlendosis wird über einen Zeitraum von 1 bis 5 Minuten abgegeben. Die externe Strahlentherapie ist schmerzlos, ähnlich wie die Aufnahme eines Röntgenfilms.
Der Patient muss während der Behandlung nicht die Luft anhalten, es genügt eine normale Atmung. Bei der Strahlentherapie ist es wichtig, dass die definierte Dosis so genau wie möglich verabreicht wird, damit die Strahlen die richtige Stelle im Körper erreichen, dass die Position des Patienten während der gesamten Behandlung nicht gestört wird, dass bei jeder Behandlung die gleiche Position eingenommen wird und dass die Umgebung immobilisiert wird, um den Komfort des Patienten bestmöglich zu gewährleisten. Bei diesem als Immobilisierung bezeichneten Prozess können je nach dem zu behandelnden Bereich Hilfsmittel wie Kopf-Hals-Masken, Vakuumbetten, Stabilisatoren unter den Knien oder Schulterzuggeräte verwendet werden.
Der Strahlentherapietechniker verlässt den Raum, bevor der Strahl abgegeben wird. Die Geräte werden von einem kleinen Bereich in der Nähe aus gesteuert. Der Patient kann auch durch einen Monitor oder ein Fenster zusehen. Wenn der Patient spricht, ist seine Stimme über den Lautsprecher zu hören und der Techniker kann kontaktiert werden. Aufgrund ihrer Größe können die Strahlentherapiegeräte eine laute Umgebung schaffen, da sie sich in verschiedenen Winkeln um den Behandlungsbereich drehen. Die Patienten sollten jedoch bedenken, dass die Geräte von den zuständigen Technikern bedient werden und ihr Betrieb regelmäßig überprüft wird. Bei Fragen zum Behandlungsraum oder zu den Geräten können Sie sich an den Techniker oder den Arzt wenden.
Die Strahlung kann weder gesehen noch gehört oder gefühlt werden. Tritt während der Behandlung eine Situation ein, in der sich der Patient sehr unwohl fühlt, sollte der Techniker sofort informiert werden. Falls erforderlich, kann der Betrieb der Geräte sofort eingestellt werden.
Häufig gestellte Fragen zur Strahlentherapie
WIE WIRKT DIE STRAHLENTHERAPIE AUF DEN KÖRPER?
Hohe Strahlendosen haben die Fähigkeit, Zellen abzutöten oder sie an der Teilung und Vermehrung zu hindern. Da sich Krebszellen viel schneller teilen und vermehren als normale Zellen, ist die Strahlentherapie bei Krebszellen wirksamer als bei normalen Zellen. Außerdem ist es für normale, gesunde Zellen viel einfacher, sich zu erholen und zu regenerieren als für Krebszellen. In der so genannten “Planungsphase” werden die notwendigen Zeichnungen angefertigt, um sicherzustellen, dass das kranke Gewebe der maximalen Strahlung und das normale Gewebe der minimalen Strahlung ausgesetzt wird, und die Behandlung wird gezielt eingesetzt.
WER FÜHRT DIE STRAHLENTHERAPIE DURCH?
Der “Strahlenonkologe”, ein auf die Behandlung von Krankheiten mit Strahlen spezialisierter Arzt, bestimmt die Art und den Plan der Behandlung, die der Patient benötigt.
Während der Behandlung arbeiten die Strahlenonkologen mit einem speziellen Team zusammen. Zu diesem Team gehören
- Strahlenphysiker: Überprüft, ob die Geräte richtig funktionieren und die richtige Strahlendosis abgeben.
- Dosimetrist Bestimmt die Anzahl und die Dauer der Sitzungen bei Behandlungen.
- Krankenschwester für Strahlentherapie: Erbringt pflegerische Leistungen während der Behandlung, hilft, die Nebenwirkungen, die beim Patienten auftreten können, zu minimieren, und unterstützt den Patienten bei der Verträglichkeit der Behandlung.
- Techniker für Strahlentherapie: Bereitet den Patienten auf die Behandlung vor und sorgt für den Betrieb der Behandlungsgeräte.
GIBT ES NEBENWIRKUNGEN DER BEHANDLUNG?
Bei der externen Strahlentherapie wird der Körper nicht radioaktiviert. Daher muss der Kontakt mit den behandelten Personen nicht vermieden werden. Selbst bei Berührungen wie Umarmungen und Küssen besteht kein Risiko einer Beeinträchtigung anderer Personen.
Die Nebenwirkungen der Strahlentherapie sind in der Regel Beschwerden im behandelten Gebiet. Der Arzt und das Pflegepersonal informieren den Patienten darüber, wie er mit diesen Nebenwirkungen umgehen kann. Der Arzt oder das Pflegepersonal sollte informiert werden, wenn während der Behandlung Beschwerden wie Husten, Fieber, Schwitzen oder ungewöhnliche Schmerzen auftreten. Die Nebenwirkungen verschwinden in der Regel innerhalb weniger Wochen nach Beendigung der Behandlung und können mit Medikamenten oder einer Diät kontrolliert werden. Nebenwirkungen, die länger anhalten, können ebenfalls mit einer geeigneten Behandlung in den Griff bekommen werden.
Die Wirksamkeit der Behandlung wird vom Arzt überwacht. Nach der Behandlung wird festgestellt, dass Schmerzen, Blutungen und ähnliche Beschwerden abnehmen und andere Anzeichen einer Besserung mit der Zeit auftreten. Der Arzt kann auch einige Blutuntersuchungen anordnen, um die Wirkung der Behandlung zu überwachen. Es ist normal, dass diese Werte während der Behandlung niedrig sind.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
Was ist Hyperthermie?
Hyperthermie bedeutet “Behandlung mit Wärme”. Die Methode, die auch als Thermotherapie bezeichnet wird, ist eine wichtige Behandlungsoption, bei der die Ganzkörpertemperatur des Patienten durch speziell entwickelte Geräte erhöht wird und die bei vielen Krankheiten bevorzugt eingesetzt wird.
Bei welchen Krankheiten wird die Hyperthermie eingesetzt?
Hyperthermie-Methoden werden bei der Behandlung vieler verschiedener Unterarten von Krebs eingesetzt. Es gibt viele Studien, die zeigen, dass die Methode die Wirkung grundlegender Krebsbehandlungen wie Chemotherapie und Strahlentherapie verstärkt. Somit ist die Hyperthermie eine evidenzbasierte “ergänzende” Methode im Bereich der Krebsbehandlung.
Wie wird die Hyperthermie in der Krebsbehandlung eingesetzt?
Die Hyperthermie wird unter 2 Hauptüberschriften analysiert: “Ganzkörper” und “Regional”.
Krebsbehandlung mit Ganzkörper-Hyperthermie
Ein gesunder Mensch reagiert auf eine drohende Krankheit mit einer erhöhten Körpertemperatur, d.h. mit Fieber. Durch die Erwärmung des gesamten Körpers löst Fieber eine verstärkte Immunreaktion aus. Fieber spielt eine wichtige Rolle bei der Aktivierung und Regulierung des Immunsystems. Man kann es als “natürliches, temporäres immunologisches Sonderprogramm” bezeichnen. Die Hauptaufgabe der Ganzkörper-Hyperthermie in der Krebsbehandlung besteht darin, die Wirksamkeit der begleitenden Chemotherapie zu erhöhen und das Immunsystem zu stärken. Insbesondere bei Patienten mit ausgedehnten Tumoren macht sie die Behandlung effektiver, wenn sie zusammen mit der Chemotherapie angewendet wird, und kann auch eine messbare Steigerung der Immunsystemfunktionen auslösen.
Bei der Ganzkörper-Hyperthermie besteht eines der ältesten Therapieprinzipien darin, das Fieber zu erhöhen, indem hautsichere und tiefenwirksame wassergefilterte Infrarot-A-Strahler direkt auf Bauch und Rumpf gerichtet werden. Während des Verfahrens werden die Vitalfunktionen des Patienten (Blutdruck, Puls, Sauerstoffsättigung, Atemfrequenz und Körpertemperatur) überwacht, um eine kontrollierte und gezielte Erhöhung der Körpertemperatur zu gewährleisten. Da Studien gezeigt haben, dass die optimale Körpertemperatur für die Aktivierung des Immunsystems bei 39 °C – 40 °C liegt, beträgt die Zielkörpertemperatur für die Krebsbehandlung 39 °C – 40 °C, was auch als “moderate” Ganzkörperhyperthermie bezeichnet wird. Obwohl die Behandlung je nach Reaktion des Körpers und der Zeit, die benötigt wird, um die Zieltemperatur zu erreichen, variieren kann, dauert sie im Durchschnitt 4 Stunden.
Krebsbehandlung mit regionaler (lokaler) Hyperthermie
Die regionale Hyperthermie wurde nach langjähriger Forschung auf dem Gebiet der Krebsbehandlung entwickelt. Basierend auf dem Prinzip der Erwärmung des Tumorbereichs mit Radiofrequenzwellen kann diese Methode die Wirksamkeit bestehender Krebsbehandlungen wie Chemo- und Strahlentherapie sicher und wirksam erhöhen. Bei dieser Methode, die auch als “regionale Tiefen-Elektro-Hyperthermie” bezeichnet wird, wird dem Tumorbereich intensive Energie zugeführt, und die Zieltemperatur im Gewebe liegt zwischen 42 °C und 44 °C. Die Tumorzellen werden durch verschiedene zelluläre Mechanismen vor dem Immunsystem verborgen. Durch die Wärme, die bei der regionalen Hyperthermie zugeführt wird, können diese Zellen jedoch sichtbar gemacht werden. Auf diese Weise kann die Hyperthermie die Wirksamkeit der Strahlen- und/oder Chemotherapie erhöhen. In einigen Fällen kann eine Chemo- und/oder Strahlentherapie, die zuvor nicht wirksam war, in Kombination mit Hyperthermie zu besseren Ergebnissen führen.
Unter dem Einfluss der Hyperthermie bilden Krebszellen “Hitzeschockproteine”; diese Proteine erscheinen auf gestörten Zelloberflächen. Das körpereigene Immunsystem erkennt diese Proteine als fremde Zellen. Dies ist ein deutlicher Hinweis für Immunzellen, Krebszellen zu bekämpfen. Unter Hyperthermie kommt es in gesunden Zellen nicht zu einem signifikanten Anstieg der Hitzeschockproteine, und normale Zellen werden durch Hyperthermie nicht geschädigt.
Während der Behandlungen, die durchschnittlich 60 Minuten dauern, liegt der Patient bequem auf der Behandlungsliege. Mit zwei gegenüberliegenden Elektrodenköpfen werden leistungsregulierbare Radiofrequenzwellen auf den Tumorbereich gerichtet und eine hohe Temperatur von 42 °C bis 44 °C erreicht. Diese Temperatur schädigt Krebszellen und Tumorgefäße.
- Primärtumore oder Tumore, die sich ausgebreitet haben (Metastasen)
- Tumore in Organen (Leber, Bauchspeicheldrüse, Nieren, Lunge usw.)
- Tumore des Verdauungssystems
- Tumore in der Hüftregion (Becken)
- Kopf- und Halstumore
- Hirntumore oder Ausbreitung ins Gehirn (Metastasen)
- Brustkrebs (lokales Wiederauftreten von Brustkrebs)
- Prostatakrebs
- Melanom
- Sie wird bei oberflächlichen Tumoren angewendet.
Häufig gestellte Fragen zu Hyperthermie-Anwendungen
Welche Wirkung hat die bei der Hyperthermie angewandte Wärme auf Krebszellen?
Der hitzebedingte Zellstress und die dadurch verursachten Schäden führen dazu, dass die Krebszellen der Apoptose (programmierter Zelltod) unterliegen.
Wie verstärkt die Hyperthermie die Wirkung von Chemo- und Strahlentherapie?
Im Krebsgewebe herrschen Hypoxie (Sauerstoffmangel) und ein saures Milieu. Dadurch wird die Wirkung von Chemo- und Strahlentherapien auf das Krebsgewebe verringert. Mit der Erhöhung der Temperatur steigt die Blutzufuhr zum Tumor, wodurch das saure Milieu verringert wird und andere Behandlungsmethoden eine wirksamere Rolle spielen können.
Wie wirkt sich die Hyperthermie auf die Funktion des Immunsystems aus?
Hitze erhöht die Produktion von “Hitzeschockproteinen” auf zellulärer Ebene. Dies erhöht die Aktivität von Immunzellen, die als “natürliche Killer” bekannt sind. Mit der Hitzeeinwirkung steigen auch die tumorspezifische Antigenproduktion und die extrazelluläre Freisetzung von Antigenen. Mit anderen Worten: Die Masken, die es den Krebszellen ermöglichen, sich vor dem Immunsystem zu verstecken, fallen in gewisser Weise ab. Dadurch wird es für das Immunsystem leichter, den Krebs zu erkennen. Sowohl die Ganzkörper-Hyperthermie als auch die regionale Hyperthermie erleichtern die Passage der Antigen-präsentierenden Zellen, die spezialisierte Zellen des Immunsystems sind, zu den Lymphknoten und die immunologische Antwort der T-Zellen “am Tumorort”.
Welche Veränderungen verursacht die Hyperthermie in der Kapillarstruktur des Tumors?
Die Struktur der Kapillaren, die den Tumor im Krebsgewebe versorgen, unterscheidet sich von den normalen Gefäßen, und insbesondere bei regionaler Hyperthermie kann es in diesen Gefäßen zu einer Mikrothrombose (Gerinnsel) kommen, wodurch die Ernährung des Tumors gestört werden kann.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST PLEURAKREBS (MESOTHELIOM)?WAS IST PLEURAKREBS (MESOTHELIOM)?
In der Brusthöhle befindet sich Lungengewebe. Die Lunge ist von einem sehr dünnen Membrangewebe bedeckt, das einer Zwiebelmembran ähnelt. Dieses Membrangewebe, das die Lunge bedeckt, reicht auch bis zur Innenseite der Rippen. Der Krebs, der in diesem Membrangewebe auftritt, wird als Mesotheliom bezeichnet, d. h. als Krebs des Brustfells.
WAS SIND DIE SYMPTOME VON PLEURAKREBS (MESOTHELIOM)?
Pleurakrebs (Mesotheliom) äußert sich in der Regel durch Flüssigkeitsansammlungen in der Lunge, die als Blasenbildung in der Lunge bekannt sind. Je nachdem, auf welcher Seite sich der Pleurakrebs (das Mesotheliom) entwickelt, sind auf dieser Seite stechende Schmerzen zu spüren. Husten tritt beim Mesotheliom eher selten auf. Die Patienten verspüren Kurzatmigkeit aufgrund von Flüssigkeitsansammlungen in der Lunge. Ein stechendes Gefühl in der Lunge kann ebenfalls ein Anzeichen für Pleurakrebs sein. Symptome im Frühstadium von Pleurakrebs sind selten. Der Lungenmembrankrebs, der sich in vielerlei Hinsicht von Lungenkrebs unterscheidet, weist auch andere Symptome auf. Wenn sich der Pleurakrebs durch Flüssigkeitsansammlungen bemerkbar macht, befindet er sich meist im 2.
Die Symptome von Pleurakrebs (Mesotheliom) sind wie folgt;
- Blasenbildung in der Lunge
- Kurzatmigkeit
- Agri
- Ungeklärter Gewichtsverlust
- In seltenen Fällen ähnlicher Husten wie bei Lungenkrebs
WAS SIND DIE URSACHEN FÜR PLEURAKREBS (MESOTHELIOM)?
Die Fragen “Was verursacht Pleurakrebs (Mesotheliom)?” und “Was sind die Ursachen von Pleurakrebs (Mesotheliom)?” gehören zu den Themen, die sich die Patienten stellen.
Asbest ist die wichtigste bekannte Ursache des Mesothelioms. Obwohl dies unter den Ursachen für Pleurakrebs sehr unwahrscheinlich ist, können auch virusbedingte Entwicklungen beobachtet werden. Obwohl die Asbestexposition der wichtigste Faktor ist, ist das Mesotheliom keine seltene Krankheit. Menschen, die in der Schiffsindustrie, in der Isolierbranche, im Baugewerbe, in Eisenwarengeschäften, in der Auskleidungsbranche, in Tankpalettenfabriken arbeiten, Menschen, die im Investmentbereich tätig waren oder in der Nähe dieser Arbeitsplätze gelebt haben, sind aufgrund des hohen Risikos einer Asbestexposition stärker gefährdet, ein Mesotheliom zu entwickeln.
Damit Pleurakrebs auftritt, müssen 10 Jahre nach der Asbestexposition vergehen. Menschen, die im jungen Erwachsenenalter mit Asbest arbeiten, entwickeln erst nach vielen Jahren Pleurakrebs.
Asbest ist nicht nur in der Industrie anzutreffen. In der Türkei ist Asbest in Provinzen wie Diyarbakır Çermik, Eskişehir, Afyonkarahisar und Nevşehir natürlich im Boden vorhanden. Asbest, eine weiche und wohlriechende Substanz, wird in diesen Regionen häufig zur Verkleidung von Häusern oder zur Herstellung von Melasse verwendet. Das Einatmen von Asbest kann auch zu Lungenkrebs führen.
Das Zusammenleben mit einer asbestexponierten Person kann ebenfalls Pleurakrebs verursachen. Personen, die Asbest ausgesetzt sind, können die Fasern über ihre Haut oder Kleidung nach Hause tragen. Eine derartige Asbestexposition kann das Risiko von Brustfellkrebs erhöhen. Personen, die an ihrem Arbeitsplatz mit viel Asbest arbeiten, können das Risiko, Asbestfasern mit nach Hause zu nehmen, verringern, indem sie duschen und die Kleidung wechseln, bevor sie den Arbeitsplatz verlassen.
Der physische Kontakt mit Asbest verursacht keinen Pleurakrebs. Damit Asbest Pleurakrebs verursachen kann, muss er eingeatmet werden.
WIE WIRD PLEURAKREBS (MESOTHELIOM) DIAGNOSTIZIERT?
“Wie wird Pleurakrebs diagnostiziert?” ist eine der am häufigsten gestellten Fragen von Patienten.
Wenn der Patient Symptome eines Pleurakarzinoms aufweist und über einen längeren Zeitraum mit Asbest in Berührung gekommen ist, wird zunächst eine Computertomographie durchgeführt. Um die Diagnose Pleurakrebs zu klären, wird dem Patienten mittels Thorakoskopie eine Biopsie entnommen und an das Labor geschickt.
WELCHE BEHANDLUNG GIBT ES BEI PLEURAKREBS (MESOTHELIOM)?
“Die Fragen “Gibt es eine Behandlung für Pleurakrebs?”, “Kann Pleurakrebs mit Chemotherapie behandelt werden?”, “Wie wird Pleurakrebs behandelt?”, “Wie wird Pleurakrebs behandelt?”, “Kann Pleurakrebs behandelt werden?” werden häufig von Patienten gestellt.
Eine gute Planung ist bei der Behandlung von Mesotheliomen wichtig. Fachwissen, gute Nachsorge und ein multidisziplinärer Ansatz sind bei der Behandlung von Mesotheliomen wichtig. Obwohl chirurgische Methoden bei der Behandlung von Mesotheliomen im Vordergrund stehen, werden auch Methoden wie Chemotherapie, Strahlentherapie und Immuntherapie eingesetzt.
In der Vergangenheit wurden bei der Mesotheliom-Operation die Lunge und das Rippenfell vollständig entfernt. Aufgrund der in den letzten Jahren durchgeführten Studien ist man jedoch zu der Erkenntnis gelangt, dass es ausreicht, nur das Lungenfell vollständig zu entfernen. Anschließend werden eine Chemotherapie und, falls erforderlich, eine Strahlentherapie durchgeführt. Bei einigen Patienten kann sich die Reihenfolge der anzuwendenden Behandlung ändern. In den letzten Jahren wurde die Immuntherapie, d. h. Behandlungen, die auf das Immunsystem abzielen, wirksam eingesetzt.
HÄUFIG GESTELLTE FRAGEN ZU LUNGENKREBS
Welche Arten von Pleurakrebs (Mesotheliom) gibt es?
Im Allgemeinen werden 3 Arten von Pleurakrebs unterschieden;
- Epitheloid
- Sarkomatoid
- Art der Mischung
Beim Pleurakrebs gibt es keine kleinzelligen oder großzelligen Typen wie beim Lungenkrebs.
Was ist der Unterschied zwischen Mesotheliom und Lungenkrebs?
Die Rippenfellentzündung unterscheidet sich von Lungenkrebs nicht nur durch den Ort, an dem sie auftritt. Die Zellen des Pleurakrebses unterscheiden sich von denen des Lungenkrebses. Während sich der menschliche Körper entwickelt, unterscheiden sich die Stammzellen, aus denen die inneren Organe bestehen. Die Stammzellen, aus denen die Membranbereiche und das Nervengewebe bestehen, unterscheiden sich voneinander.
Es gibt keinen Schmerzsensor im Lungengewebe, aber einen Schmerzsensor in der Lungenmembran.
Ein weiterer Unterschied zwischen Pleurakrebs und Lungenkrebs ist die Art und Weise, wie er entsteht. Da das Rippenfell die gesamte Brusthöhle bedeckt, tritt er nicht wie Lungenkrebs an einer einzigen Stelle auf. Das Rippenfell in der gesamten Brusthöhle ist betroffen und bedeckt eine sehr große Fläche.
Was sind die Stadien des Pleurakrebses (Mesotheliom)?
Die Stadien von Pleurakrebs sind nicht so empfindlich wie die von Lungenkrebs, was die Heilungschancen des Patienten angeht. Sie können von der klassischen Krebseinteilung abweichen. Insbesondere die anderen Stadien als das 1. und 4. Stadium können Unterschiede in Bezug auf die Lebenserwartung aufweisen. Fragen wie “Was ist die Behandlung von Pleurakrebs im Stadium 3?”, “Was sind die Symptome und die Behandlung von Pleurakrebs im Stadium 4?”, “Was sind die Stadien von Pleurakrebs?”, “Letztes Stadium von Pleurakrebs”, “Gibt es eine Behandlung für Pleurakrebs im Stadium 4?”, “Was ist die Behandlung von Pleurakrebs im Stadium 1?” werden häufig von Patienten gestellt.
Im Allgemeinen gibt es 4 Stadien von Pleurakrebs (Mesotheliom),
- Pleurakrebs Stadium 1: Der Tumor ist auf das Rippenfell beschränkt. Die Verdickung der Lungenhaut ist sehr gering.
- Pleurakrebs Stadium 2: Der Tumor hat sich auf die Brustwand, das Herz und die Membran über der Speiseröhre ausgebreitet.
- Pleurakrebs Stadium 3: Der Tumor ist in das Zwerchfell eingedrungen und hat sich auf das Bauchfell ausgebreitet. Die Lymphknoten können befallen sein.
- Pleurakrebs Stadium 4: Der Tumor hat Metastasen in anderen Organen gebildet.
Wie hoch ist die Lebenserwartung bei Pleurakrebs (Mesotheliom)?
Die Lebenserwartung von Patienten mit Pleurakrebs kann je nach Stadium der Erkrankung, der Behandlung und dem Ansprechen des Patienten auf die Behandlung variieren. Die Lebenserwartung bei Pleurakrebs kann von Patient zu Patient unterschiedlich sein. “Wie lange lebt man bei Pleurakrebs?”, “Wie hoch ist die Lebenserwartung bei Pleurakrebs im Stadium 4?”, “Wie lange lebt ein Patient mit Pleurakrebs?”, “Wie lange lebt ein Patient mit Pleurakrebs?”, “Ist Pleurakrebs tödlich?”, “Wie hoch ist die Lebenserwartung bei Pleurakrebs?”, “Wie hoch ist die Lebenserwartung bei Pleurakrebs?”, “Wie hoch ist die Überlebensrate bei Pleurakrebs?”, “Wie viele Jahre lebt man bei Pleurakrebs?”, “Gibt es eine Chance, Pleurakrebs zu überleben?” gehören zu den neugierigsten Fragen.
Ein Patient mit Pleurakrebs;
- 8 Monate, wenn er das Heilmittel nicht nimmt,
- 12-18 Monate mit Chemotherapiebehandlung,
- Die durchschnittliche Lebenserwartung beträgt 24 Monate bei dreifacher Behandlung einschließlich chirurgischer Eingriffe.
Die Ergebnisse bei den einzelnen Patienten sind jedoch unterschiedlich, und insbesondere in den letzten Jahren wurde eine erhebliche Verlängerung der Lebenserwartung bei Pleurakrebs durch eine auf das Immunsystem ausgerichtete Immuntherapie beobachtet.
Die Lebenserwartung kann je nach Ansprechen der Patienten auf die Behandlung variieren.
Für die Behandlung von Pleurakrebs (Mesotheliom) gibt es viele Möglichkeiten. Da das Risiko eines Wiederauftretens des Mesothelioms hoch ist, ist es wichtig, die Behandlungsmöglichkeiten zu staffeln. Anstatt alle Behandlungsmöglichkeiten gleichzeitig anzuwenden, ebnet eine schrittweise Behandlung entsprechend dem Krankheitsverlauf den Weg für das beste Ergebnis.
Wie wird eine Operation bei Pleurakrebs (Mesotheliom) durchgeführt?
Bei Pleurakrebs (Mesotheliom) wird eine chirurgische Methode, die so genannte offene Chirurgie, angewandt.
- Der Patient wird auf dem Operationstisch auf die Seite gelegt, eine der Rippen wird entfernt und die Operation des Rippenfellkrebses wird durchgeführt.
- Bei der Operation wird die gesamte Membran auf der Lunge und in der Brusthöhle entfernt.
- Falls erforderlich, kann bei einer Pleurakrebsoperation auch der Zwerchfellmuskel entfernt werden. Falls erforderlich, kann auch der Herzbeutel entfernt werden.
- Bei der Operation von Pleurakrebs ist es nicht notwendig, die Lunge vollständig zu entfernen.
- Eine Mesotheliom-Operation dauert etwa 3-4 Stunden.
- Nach einer Mesotheliom-Operation bleibt der Patient etwa 1 Woche im Krankenhaus.
- Da bei einer Pleurakrebsoperation eine große Fläche betroffen ist, muss der Patient je nach Zustand und Blutungsrisiko 1-2 Tage intensivmedizinisch betreut werden.
Was kann man tun, um Pleurakrebs (Mesotheliom) zu verhindern?
Da das Rippenfell die gesamte Lunge und die Rippen umgibt, tritt er in einem sehr großen Gebiet auf. Im Gegensatz zu anderen Krebsarten tritt er nicht an einer einzigen Stelle auf, sondern in Form von Tumoren auf dem gesamten Rippenfell in Form von Traubenkernen.
Bevor sich ein Pleurakrebs entwickelt, wird bei Risikopatienten die vollständige Entfernung des Rippenfells in Betracht gezogen. Da es jedoch nicht möglich ist, die Membran der Lunge, die sich über eine sehr große Fläche in Millimetern ausbreitet, vollständig zu entfernen, kann sich bei Patienten, bei denen diese Methode angewandt wird, immer noch ein Pleurakrebs entwickeln.
Es ist wichtig, die Asbestexposition zu vermeiden, um Brustfellkrebs vorzubeugen. Prüfen Sie, ob es am Arbeitsplatz oder im Wohnbereich Asbest gibt.
Es ist wichtig, dass Arbeitnehmer in asbestexponierten Berufen alle Sicherheitsvorkehrungen wie das Tragen von Schutzausrüstung beachten. Auch das Duschen oder Wechseln der Arbeitskleidung vor der Mittagspause oder dem Nachhausegehen sollte nicht vernachlässigt werden, um Kontaktpersonen zu schützen.
Können intelligente Medikamente bei Pleurakrebs (Mesotheliom) eingesetzt werden?
Die Immuntherapie, die in den letzten Jahren bei der Behandlung von Pleurakrebs eingesetzt wurde, hat sich positiv auf die Lebenserwartung der Patienten ausgewirkt. Die Immuntherapie ist vor allem bei sarkomatoiden Pleurakarzinomen des Mischtyps wirksamer.
Gibt es eine pflanzliche Behandlung für Pleurakrebs (Mesotheliom)?
Die Frage “Ist Phytotherapie bei Pleurakrebs sinnvoll?” wird häufig von Patienten gestellt. Wissenschaftlichen Studien zufolge gibt es keine natürliche oder pflanzliche Behandlung des Mesothelioms. Die wichtigste Maßnahme, die ergriffen werden kann, ist die Vermeidung der Asbestexposition. Der Verzehr von Produkten, die auf asbesthaltigem Boden angebaut wurden, ist jedoch unbedenklich.
Wie sollte die Ernährung bei Pleurakrebs (Mesotheliom) sein?
Bei Pleurakrebs ist, wie bei allen Krebsarten, eine eiweißreiche und kohlenhydratarme Ernährung wichtig.
Kann Pleurakrebs (Mesotheliom) metastasieren?
Die Patienten sind neugierig auf Fragen wie “Metastasierender Pleurakrebs”, “Metastasiert der Pleurakrebs?”, “Wo metastasiert der Pleurakrebs?”.
- Vor allem der sarkomatoide Typ metastasiert beim Pleurakrebs. Sarkomatoider Pleurakrebs metastasiert in der Regel in Knochen, Leber, Gehirn, Herz und Bauchfell.
- Das epitheloide Pleurakarzinom wächst in der Regel am Ursprungsort und tritt an derselben Stelle wieder auf. Er kann in den Bauchraum oder in die gegenüberliegende Lunge metastasieren.
- Die Bereiche, in denen Pleurakrebs metastasiert, sind häufig das Peritoneum und der Herzbeutel.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST HAUTKREBS (MELANOM)?
Die Haut, das größte Organ des Körpers, hat viele Funktionen. Sie bedeckt die inneren Organe, schützt den Körper vor möglichen Verletzungen, verhindert übermäßigen Wasser- und Flüssigkeitsverlust und hilft dem Körper, Vitamin D zu bilden. Sie schützt auch vor Keimen wie Bakterien und schädlichen ultravioletten (UV-)Strahlen und hilft bei der Regulierung der Körpertemperatur. Hautkrebs ist eine bösartige Wucherung, die aus verschiedenen Gründen in der Haut auftritt. Die Haut besteht aus 3 Schichten: Epidermis, Dermis und Subkutis.
Epidermis: Die Oberhaut (Epidermis) ist die oberste Schicht der Haut. Die Epidermis ist sehr dünn und etwa 0,05-0,1 mm dick. Sie schützt die unteren Schichten der Haut und die Organe vor äußeren Einflüssen. Keratinozyten sind die wichtigsten Zelltypen der Epidermis. Diese Zellen produzieren ein wichtiges Protein namens Keratin, das der Haut hilft, den Körper zu schützen. Der äußerste Teil der Epidermis wird als Stratum corneum bezeichnet. In diesem Teil werden abgestorbene Keratinozyten durch neue Zellen ersetzt. Die Zellen in dieser Schicht werden aufgrund ihrer flachen Form als Plattenepithelzellen bezeichnet. Lebende Plattenepithelzellen befinden sich unter dem Chorion (Stratum corneum). Diese Zellen wandern vom äußeren Teil der Epidermis zum untersten Teil der Epidermis, der Basalschicht. Die Zellen in der Basalschicht werden Basalzellen genannt. Ihre Aufgabe ist es, sich zu teilen und neue Keratine zu bilden. Auf diese Weise ersetzen sie die älteren Keratinozyten an der Hautoberfläche, die mit der Zeit abnehmen.
Melanozyten sind Zellen in der Epidermis, die sich zu einem Melanom (Hautkrebs) entwickeln können. Diese Hautzellen produzieren braune Pigmente namens Melanin, die der Haut eine bräunliche oder braune Farbe verleihen. Melanin schützt die unteren Hautschichten vor einigen der schädlichen Auswirkungen der Sonne. Bei vielen Menschen produzieren die Melanozyten mehr dieser Pigmente, wenn die Haut der Sonne ausgesetzt ist, was zu einer Bräunung der Haut führt. Die Epidermis ist durch eine Basalmembran von den unteren Schichten der Haut getrennt. Dies ist eine wichtige Struktur. Denn wenn Hautkrebs fortschreitet, entwickelt er sich in Richtung dieser Barriere und der unteren Schichten.
Dermis: Sie ist die mittlere Schicht der Haut und viel dicker als die Epidermis. Sie enthält Haarfollikel, Schweißdrüsen, Gefäße und Nerven, die von dem Protein Kollagen gehalten werden, das der Haut Festigkeit und Elastizität verleiht.
Subkutis Die unterste Schicht der Haut wird als Subkutis bezeichnet. Die Subkutis und der unterste Teil der Dermis bilden ein Netzwerk aus Kollagen und Fettzellen. Die Subkutis trägt zur Aufrechterhaltung der Körpertemperatur bei. Diese Schicht hat auch eine stoßdämpfende Wirkung, die dazu beiträgt, die Körperorgane vor Verletzungen zu schützen.
WELCHE ARTEN VON HAUTKREBS GIBT ES?
Melonom Hautkrebs
Das Melanom ist ein Hautkrebs, der in den so genannten Melanozyten entsteht, die der Haut ihre Farbe verleihen. Es wird als malignes Melanom oder kutanes (von der Haut ausgehendes) Melanom bezeichnet. Da die meisten Melanom-Hautkrebszellen weiterhin Melanin produzieren, ist der Tumor in der Regel braun oder schwarz gefärbt. Es gibt jedoch auch Melanome, die kein Melanin produzieren.
In diesem Fall kann der Krebs rosa, gelblich-braun oder sogar weiß erscheinen. Melanom-Hautkrebs kann auf angeborenen oder erworbenen Muttermalen auf der Haut auftreten und kann überall auf der Haut des Körpers vorkommen, auch auf der Kopfhaut und den Fußsohlen.
Melanom-Hautkrebs tritt bei Männern am häufigsten am Hals und am Rücken auf, bei Frauen an den Beinen, am Hals und im Gesicht. Krebs kann aber auch an den Handflächen, Fußsohlen und Nägeln entstehen. Selten kann er auch im Augen-, Mund-, Genital- oder Analbereich auftreten. Das Melanom, das eine behandelbare Krebsart ist, wenn es in einem frühen Stadium diagnostiziert wird, kann zu einer Krebsart werden, die die Behandlungschancen verringert, wenn es sich schnell ausbreitet.
Andere Arten von Hautkrebs
Basalzell- und Plattenepithelkarzinome treten meist an Stellen auf, die der Sonne ausgesetzt sind, wie Kopf, Hals und Arme. Sie kommen aber auch an anderen Stellen des Körpers vor.
Basalzellkarzinom: Es ist der häufigste Hautkrebs. Es handelt sich um einen Krebs mit kleinen, höckerigen, rosafarbenen oder roten, durchsichtigen, glänzenden, perlengroßen Schwellungen, die meist flach, hart und blass sind oder selbst bei einem kleinen Unfall leicht bluten. Das Zentrum ist eingesunken und der Bereich ist blau, braun oder schwarz. Große Basalzellkarzinome haben einen verkrusteten oder sich ausbreitenden Bereich.
Plattenepithelkarzinom: Dies ist der zweithäufigste Hautkrebs. Es kann wie ein wachsender Klumpen aussehen. Er hat oft eine harte, schuppige oder verkrustete Oberfläche. Es kann auch ein flaches, rot geflecktes Aussehen haben, das sich langsam entwickelt. Beide Hautkrebsarten können sich in einem flachen Bereich entwickeln, der sich kaum von der normalen Haut unterscheidet.
Aknitische Keratose ist auch als solare Keratose bekannt. Sie kann manchmal eine Präkanzerose der Haut sein und wird durch zu viel Sonneneinstrahlung verursacht. Aknitische Keratosen sind kleine, harte oder schuppige Flecken, die in der Regel rosa-rot oder hautfarben sind. Sie treten in der Regel im Gesicht, an den Ohren, den oberen Händen und Armen auf. Sie kann aber auch an anderen Körperstellen auftreten, die der Sonne ausgesetzt sind. Aknitische Keratosen treten in der Regel in mehreren Fällen auf. Einige können sich zu Plattenepithelkarzinomen entwickeln. Andere bleiben unverändert oder entwickeln sich von selbst weiter.
WAS SIND DIE SYMPTOME VON HAUTKREBS?
Das wichtigste Symptom für Hautkrebs ist ein neuer Fleck auf der Haut oder eine Veränderung der Größe, Form oder Farbe des Flecks:
- Nicht heilende und wiederkehrende Wunden
- Die Pigmente ragen über den Fleck hinaus und breiten sich auf der umliegenden Haut aus
- Rote und blaue Muttermale von mehr als 5 mm Größe
- Zunahme der Anzahl und Größe der Mole
- Aufwölbungen, Blutungen oder Veränderungen des Aussehens von Knötchen oder Klumpen auf der Oberfläche des Muttermals
- Rötung oder eine neue Schwellung über die Grenzen hinaus
- Erhöhte Empfindlichkeit, Juckreiz oder Schmerzen
Es kann manchmal schwierig sein, zwischen einem normalen Leberfleck und einem Melanom zu unterscheiden. In diesem Fall ist es am besten, so schnell wie möglich einen spezialisierten Dermatologen aufzusuchen.
WAS SIND DIE RISIKOFAKTOREN FÜR DAS MALIGNE MELANOM (HAUTKREBS)? WAS VERURSACHT HAUTKREBS?
- Exposition gegenüber ultravioletter Strahlung (UV): UV-Strahlen sind einer der Hauptrisikofaktoren für Melanom-Hautkrebs. Sie schädigen die DNA der Hautzellen, und es entsteht Hautkrebs. Sonnenlicht ist die Hauptquelle für ultraviolette Strahlen. Das Solarium ist eine weitere Quelle für UV-Strahlung. Das Risiko vieler Hautkrebsarten, einschließlich des Melanoms, steigt bei Menschen, die übermäßiger UV-Strahlung aus diesen Quellen ausgesetzt sind. Die wichtigsten Risikofaktoren für Hautkrebs lassen sich wie folgt auflisten;
- UVA-Strahlen: Verursacht die Zellalterung und kann die DNA der Zellen schädigen. Es wird angenommen, dass sie langfristige Hautschäden wie Falten verursachen und eine Rolle bei der Entwicklung einiger Hautkrebsarten spielen.
- UVB-Strahlen: Dies ist die Hauptstrahlung, die Sonnenbrand verursacht und die Zell-DNA direkt schädigen kann. Es wird angenommen, dass sie die meisten Hautkrebsarten verursacht.
- UVC-Strahlen: Kann die Atmosphäre nicht durchdringen. Daher ist sie nicht im Sonnenlicht enthalten. Aus diesem Grund verursacht sie keinen Hautkrebs.
- Solarium: Studien zeigen, dass Menschen, die häufig ins Solarium gehen, um sich zu bräunen, ein höheres Risiko für Melanom-Hautkrebs haben. Die UV-Lampen, die in Solarien zum Bräunen verwendet werden, sollten “Ultraviolettlampen” sein und mit dem Hinweis “Kontinuierliche Exposition gegenüber UV-Strahlen kann zu vorzeitiger Hautalterung und Hautkrebs führen” gekennzeichnet werden. Darüber hinaus könnte ein weiteres Etikett mit dem Hinweis “Regelmäßige ärztliche Vorsorgeuntersuchungen für Hautkrebs sind erforderlich” eine Warnung für Benutzer sein, die diesen Strahlen ständig ausgesetzt sind. Auf diese Weise soll die Tendenz zur Verwendung ultravioletter Produkte (Schwarzlichtlampen, Quecksilberdampflampen, Xenon- und Xenon-Quecksilber-Hochdrucklampen, Plasmabrenner und Lichtbogenquellen usw.) verringert werden, insbesondere bei Jugendlichen/Kindern unter 18 Jahren, die einem Hautkrebsrisiko ausgesetzt sind, und bei Personen, in deren Familie Hautkrebs vorkommt.
- Muttermale Muttermale am Körper sind gutartige Tumore und treten nicht nur bei der Geburt, sondern auch im Kindes- und Jugendalter auf. Die meisten Muttermale verursachen keine Probleme. Menschen mit einer großen Anzahl von Muttermalen haben jedoch ein höheres Risiko, an einem Melanom zu erkranken.
- Dysplastischer Nävus Dysplastische Nävi (Nävi ist die Pluralform von Nävus), auch bekannt als ungewöhnliche Nävi, sehen oft ein wenig wie normale Muttermale aus, weisen aber einige Merkmale eines Melanoms auf. Sie sind in der Regel größer als andere Muttermale, haben eine ungewöhnliche Form oder Farbe und entwickeln sich meist nicht zu Krebs.
- Kongenitaler melanozytärer Naevus: Bei der Geburt vorhandene Muttermale werden als kongenitaler melanozytärer Nävus bezeichnet. Es wird geschätzt, dass das Risiko der Entwicklung eines Melanoms bei solchen bei der Geburt vorhandenen Muttermalen zwischen 0 und 0 % liegt, je nach Größe des Nävus. Menschen mit großen kongenitalen melanozytären Nävus haben ein höheres Risiko, ein Melanom zu entwickeln. Ist der kongenitale Naevus beispielsweise kleiner als eine Handfläche, ist das Melanomrisiko geringer. Im Gegensatz dazu ist das Melanomrisiko bei großen kongenitalen Nävi auf dem Rücken oder Gesäß deutlich erhöht.
- Helle Haut, Sommersprossen und helles Haar: Das Melanomrisiko ist bei Menschen mit weißer Haut und hellem Haar zehnmal höher als bei Menschen mit schwarzer Haut. Das Hautkrebsrisiko steigt bei Menschen mit roten und blonden Haaren, weißer Haut, blauen oder grünen Augen oder Sommersprossen.
- Alter: Das Melanom tritt am häufigsten bei jungen Menschen zwischen 15 und 29 Jahren auf, am häufigsten jedoch in der Altersgruppe der 25- bis 29-Jährigen (insbesondere bei jungen Frauen). Es kann aber auch in höherem Alter vorkommen.
- Geschlecht: Hautkrebs wird unter Berücksichtigung der Häufigkeit und der biologischen Unterschiede in maligne Meianome und nicht-melanome Hautkrebse unterteilt. Während er bei jungen Erwachsenen, d. h. bei Männern im Alter von 25 bis 34 Jahren, die vierthäufigste Krebsart ist, ist er bei Frauen nach Brustkrebs und gynäkologischen Krebserkrankungen die häufigste Krebsart.
- Schweißen und Metallbearbeitung: Erhöht nachweislich das Risiko eines Melanoms an den Augen
- Phototherapie (Lichttherapie): Die Exposition gegenüber UV-Strahlen aufgrund der Behandlung von Menschen mit bestimmten Hautkrankheiten wie Psoriasis erhöht das Risiko von Plattenepithelkarzinomen.
WAS SIND DIE GENETISCHEN FAKTOREN FÜR HAUTKREBS?
Menschen mit Melanom-Hautkrebs bei einem oder mehreren Verwandten ersten Grades (Eltern, Geschwister oder Kinder) sind einem höheren Risiko ausgesetzt. Etwa 10 % der Menschen mit Melanom haben die gleiche Krankheit in ihrer Familie.
Ein Grund für das erhöhte Risiko kann eine häufige Sonnenexposition infolge eines ähnlichen Lebensstils in der Familie, das Überwiegen anfälliger hellhäutiger Familienmitglieder oder beides sein. Darüber hinaus kann auch eine Genmutation als Folge einer Veränderung von Genen in der Familie ein Faktor für das Melanomrisiko sein. Eine Genmutation findet sich bei etwa 10-40 % der Menschen mit einer hohen Melanomrate in ihrer Familie.
Xeroderma Pigmentosum (XP): Eine seltene Erbkrankheit, die durch Schäden an Enzymen verursacht wird, die normalerweise die DNA reparieren. Menschen mit XP können an sonnenexponierten Hautstellen viele Hautkrebsarten, einschließlich Melanomen, entwickeln, da sie weniger in der Lage sind, durch die Sonne verursachte DNA-Schäden zu reparieren.
Ungewöhnliche Wunden, Beulen, Flecken, Kratzer oder Veränderungen im Aussehen der betreffenden Hautpartie können ein Anzeichen für ein Melanom oder eine andere Art von Hautkrebs sein oder eine Warnung, dass Krebs auftreten könnte.
Normale Muttermale: Es handelt sich in der Regel um braune, hellbraune oder schwarze Flecken auf der Haut. Sie können flach oder hoch und erhaben, rund oder oval sein und sind normalerweise kleiner als 6 m. Muttermale können angeboren sein oder sich im Kindes- und Jugendalter entwickeln. Neue Muttermale, die im Erwachsenenalter auf dem Körper erscheinen, sollten von einem Arzt auf möglichen Hautkrebs untersucht werden.
Wenn sich ein Leberfleck am Körper entwickelt, bleibt er über Jahre hinweg in Größe, Form und Farbe gleich. Manche Muttermale verschwinden mit der Zeit von selbst. Viele Menschen haben Muttermale, und die meisten dieser Muttermale sind harmlos. Es ist jedoch wichtig, jede Veränderung in Form, Größe oder Farbe des Leberflecks zu bemerken, da sich daraus möglicherweise Hautkrebs entwickelt.
BEDEUTUNG DER FRÜHDIAGNOSE BEIM MELANOM
Hautkrebs ist eine sichtbare Krebserkrankung. Bei Hautkrebs, wie auch bei anderen Krebsarten, kann der Krebs behandelt werden, ohne dass er sich ausbreitet, wenn die Hautveränderungen in einem frühen Stadium bemerkt werden.
Darüber hinaus werden die behandlungsbedingten Nebenwirkungen bei Hautkrebs, der in einem frühen Stadium behandelt wird, minimiert.
SIND FRÜHE ALTERSERSCHEINUNGEN AUF DER HAUT EIN ZEICHEN FÜR HAUTKREBS?
Längerer Aufenthalt in der Sonne erhöht das Risiko von Hautkrebs und vorzeitiger Hautalterung. Dieses Produkt schützt Sie nicht vor Hautkrebs oder vorzeitiger Hautalterung, sondern nur vor Sonnenbrand”, sollte geschrieben werden. Die gleiche Warnung sollte auf Sonnenschutzmitteln stehen, die kein “Breitspektrum” haben.
Auf den Etiketten von Produkten mit niedrigem Lichtschutzfaktor muss ein Warnhinweis angebracht werden. Sonnenschutzmittel mit einem Lichtschutzfaktor von weniger als 15 müssen mit einem Warnhinweis versehen werden. “Wasserfest” bedeutet nicht “wasserdicht”. Keine Sonnencreme ist wasserfest oder “schweißresistent”. Die Hersteller können dies nicht mehr behaupten. Wenn das Etikett auf der Vorderseite des Produkts als wasserfest gekennzeichnet ist, muss darauf stehen, dass die Wirkung beim Schwimmen oder Schwitzen 40 Minuten oder 80 Minuten anhält. Produkte dürfen nicht mehr versprechen, als sie halten. Sonnenschutzmittel dürfen keinen Sofortschutz oder einen Schutz von mehr als 2 Stunden ohne erneutes Auftragen versprechen. Sie dürfen nicht den Begriff “Sonnenschutz” verwenden. Es ist möglich, vorzeitige Hautalterung und Hautkrebs zu verhindern, indem man seine Haut vor Sonnenschäden schützt.
Früherkennungsuntersuchung Empfohlene Altersgruppe;
Es gibt keine bestimmte empfohlene Altersspanne. Früherkennung von Hautkrebs( Die Haut von Männern, Frauen, Jugendlichen und Erwachsenen kann in jedem Alter untersucht werden.
WIE WIRD HAUTKREBS DIAGNOSTIZIERT?
Die wichtigsten Symptome für Hautkrebs sind ein neuer Fleck auf der Haut oder eine Veränderung der Größe, Form oder Farbe des Flecks. Ungewöhnliche und nicht heilende Wunden, Beulen, Flecken, Kratzer oder Veränderungen im Aussehen der Haut, Veränderungen an der Oberfläche des Leberflecks (Beulen, Blutungen oder das Auftreten von Knötchen oder Klumpen), Juckreiz, Zärtlichkeit und Schmerzen können ein Anzeichen für ein Melanom oder eine andere Art von Hautkrebs sein oder eine Warnung, dass Krebs auftreten könnte. Bei solchen Symptomen sollte unverzüglich ein Facharzt aufgesucht werden, damit das früh erkannte Gesundheitsproblem schnell behoben werden kann.
Selbstuntersuchung der Haut bei Hautkrebs: Es ist sehr wichtig, die Haut zweimal im Monat zu untersuchen. Es ist wichtig, die Merkmale von Muttermalen, Flecken und Sommersprossen zu kennen, indem man sich Fotos von Hautflecken ansieht, und den Körper gut genug zu kennen, um einen neuen Leberfleck oder eine neue Stelle zu erkennen. Die Selbstuntersuchung der Haut sollte in einem gut beleuchteten Raum vor einem Ganzkörperspiegel durchgeführt werden, in dem der ganze Körper betrachtet werden kann. Mit einem Handspiegel ist es einfacher, die blinden Flecken des Körpers wie Rücken und Hüften im Ganzkörperspiegel zu sehen. Bei Männern befindet sich 1 von 3 Melanomen auf dem Rücken. Alle Körperteile wie Rücken, Handflächen, Fußsohlen, Kopfhaut, Augen und Nägel sollten untersucht werden.
Anamnese und körperliche Untersuchung: Die körperliche Untersuchung auf Hautkrebs sollte zunächst von einem spezialisierten Dermatologen durchgeführt werden. Mit einer Technik namens Dermatoskopie (auch als Epilumineszenzmikroskopie oder Oberflächenmikroskopie bekannt) werden Flecken oder Muttermale auf der Haut genau untersucht und, falls gewünscht, können Bilder gemacht und eine mögliche Ausbreitung in den Lymphknoten unter der Haut in der Nähe der verdächtigen Stelle beobachtet werden. Einige Hautkrebsarten breiten sich auf die Lymphknoten aus. Wenn dies geschieht, können die betroffenen Lymphknoten vergrößert und härter als normal werden. Diese Untersuchung kann bei der Früherkennung von Hautkrebs sehr wirksam sein. Es ist wichtig, dass Menschen, die an einem dysplastischen Nävus-Syndrom leiden oder bei denen Melanome in der Familie vorkommen, regelmäßig Hautuntersuchungen durchführen lassen.
Dermatoskopie bei der Hautkrebsdiagnose
Die Dermatoskopie ist eine Mikroskopie der Hautoberfläche und wird zur Diagnose von Muttermalen und anderen pigmentierten Läsionen eingesetzt. Bei dieser Methode wird die befeuchtete Hautoberfläche mit einem Dermatoskop untersucht, das eine beleuchtete Vergrößerung bietet. Das Dermatoskop ähnelt dem Otoskop, das bei der Untersuchung der Ohren verwendet wird, und ist seit mehr als 10 Jahren weit verbreitet. Bis vor einigen Jahren wurde die Untersuchung von Muttermalen durch Fotografieren der dermatoskopischen Bilder durchgeführt. Dann wurde diese Methode durch die Computertechnologie ergänzt und die digitale Dermatoskopie entwickelt. Mit dieser Methode wird eine Karte der Muttermale im Körper erstellt und ihre Punktlokalisation bestimmt. Anschließend wird für jeden Leberfleck ein dermatoskopisches Bild aufgenommen und gespeichert. Auf diese Weise ist ein Vergleich mit dem Bild möglich, das bei der nächsten Kontrolle aufgenommen werden soll.
Das Digital Dermatoscope erstellt auch einen Index, der das Risiko eines malignen Melanoms anzeigt, indem es die bei mir beobachteten verdächtigen Veränderungen mathematisch berechnet. Dieser Index ist hilfreich für die Diagnose und die Behandlungsplanung. Während die Chance, ein Melanom im Frühstadium mit bloßem Auge zu diagnostizieren, bei 60 % liegt, steigt sie bei der digitalen dermatoskopischen Untersuchung auf 90 %.
Hautbiopsie: Wenn der Verdacht auf Hautkrebs besteht, wird eine Probe aus diesem Bereich entnommen und im Labor untersucht. Dies wird als Hautbiopsie bezeichnet. Die Hautbiopsie kann auf viele verschiedene Arten durchgeführt werden. Welche Art der Biopsie durchgeführt wird, hängt von der Lage und Größe der verdächtigen Stelle am Körper und der Art des vermuteten Hautkrebses ab. Wenn sich der verdächtige Leberfleck oder die verdächtige Stelle als Krebs oder Krebsvorstufe herausstellt, wird Ihr Arzt möglicherweise weitere Untersuchungen oder eine Behandlung durchführen. Wenn das verdächtige Muttermal oder der verdächtige Fleck klein und lokalisiert ist, kann eine größere Biopsie (zur Entnahme von mehr Gewebe) oder eine Form der Operation durchgeführt werden. Bei gestreutem Hautkrebs sind bildgebende Untersuchungen und eine Behandlung mit Immuntherapie, gezielter Therapie, Chemotherapie und Strahlentherapie erforderlich.
WELCHE BEHANDLUNGSMETHODEN GIBT ES BEI HAUTKREBS (MALIGNES MELANOM)?
Bei der Behandlung von Hautkrebs geht es darum, das gesamte Krebsgewebe rückstandslos zu entfernen. Mit einer chirurgischen Behandlung kann eine sehr hohe Erfolgsquote erzielt werden. Wenn das Krebsgewebe in ausreichender Tiefe und Breite entfernt wird, wird das erneute Auftreten von Krebs verhindert. Bei der Behandlung von Hautkrebs ist es neben der Zerstörung der Krebszellen wichtig, keine ästhetischen Narben zu hinterlassen und keine Funktionseinbußen zu verursachen. Für das Belastungsgebiet, in dem Hautkrebs am häufigsten auftritt, sind das Alter des Patienten, sein Allgemeinzustand, die Größe des Tumors, die Eigenschaften der Haut und die Möglichkeit der Ausbreitung auf die Lymphknoten von Bedeutung.
Bei Hautkrebs gibt es keine einheitliche Behandlung, sondern personalisierte Formen der Behandlung. Chirurgische und strahlentherapeutische Eingriffe sind bei kleinen Tumoren in der Regel unproblematisch. Ein weiterer wichtiger Punkt ist, dass bei der Behandlung von Hautkrebs ein erfahrenes Team die Tumorentfernung durchführt.
Die Strahlentherapie kann als primäre Behandlungsmethode bevorzugt werden, wenn nach einer chirurgischen Behandlung eine übermäßige Narbenbildung vorliegt und der Tumor durch die Bestrahlung ohne schwerwiegende Nebenwirkungen kontrolliert werden kann. Nichtmelanom-Hautkrebs an Wange, Stirn oder Nasenrücken, insbesondere wenn es sich um Basalzellen handelt, wird sehr erfolgreich mit Strahlentherapie behandelt. Bei der Behandlung kleinerer Tumore kann die Kryochirurgie bevorzugt werden. Bei dieser Behandlung, bei der flüssiger Stickstoff auf den Tumor aufgebracht wird, sterben die abnormen Zellen ab. Nach dem Auftauen wird das abgestorbene Gewebe aus dem Körper entfernt. Bei der als Kürettage bezeichneten Behandlungsmethode wird der krebsartige Bereich mit einer löffelförmigen Kürette ausgeschabt, die Blutung wird durch einen von einem speziellen Gerät gelieferten elektrischen Strom gestoppt und die Krebszellen werden abgetötet. Am Ende des Eingriffs bleibt eine flache, weiße Narbe auf der Haut zurück. Bei oberflächlichen Hautkrebsen kommt auch eine lokale Chemotherapie in Form einer Creme oder Lotion in Frage.
WELCHE MÖGLICHKEITEN GIBT ES, HAUTKREBS ZU VERHINDERN?
Ein Schutz ist möglich, indem man die Risikofaktoren, die Hautkrebs und UV-Exposition verursachen, reduziert. Welche Vorkehrungen können also zum Schutz vor der Sonne getroffen werden?
- Bedecken Sie sich. Wenn Sie kein Sonnenbad nehmen, bedecken Sie sich, tragen Sie einen breitkrempigen Hut und schützen Sie Ihre Haut so gut wie möglich. Sie können Ihre Augen schützen, indem Sie eine Sonnenbrille tragen, die mindestens 99 Prozent der UV-Strahlen abschirmt.
- Setzen Sie sich in den Schatten. Nehmen Sie kein Sonnenbad zwischen 10:00 und 16:00 Uhr, wenn die Sonneneinstrahlung am stärksten ist. Beschränken Sie die direkte Sonneneinstrahlung auf die von Experten angegebenen Zeiten.
- Vermeiden Sie das Bräunen in einem Solarium. Es kann zur Entstehung von Hautkrebs beitragen und Ihre Haut langfristig schädigen.
- Achten Sie auf das Verfallsdatum von kosmetischen Produkten.
- Verwenden Sie Breitspektrum-Sonnenschutzmittel mit einem Lichtschutzfaktor von mindestens 30. Achten Sie darauf, alle 2 Stunden, nach dem Schwimmen und Schwitzen Sonnenschutzmittel aufzutragen.
Die US Food and Drug Administration (FDA) hat die Herstellung von Sonnenschutzmitteln durchgesetzt, die nicht nur vor Sonnenbrand, sondern auch vor UVA-Strahlen schützen, die Hautkrebs und vorzeitige Hautalterung auslösen. Außerdem muss auf den Etiketten von Feuchtigkeitscremes, Lippenbalsam und Make-up-Materialien der Schutzfaktor angegeben werden, genau wie bei Sonnenschutzmitteln.
WIE SOLLTE DIE RICHTIGE VERWENDUNG VON SONNENSCHUTZMITTELN ZUM SCHUTZ VOR HAUTKREBS AUSSEHEN?
“Breitspektrum” durch Tests gestützt: Die neuen Vorschriften ermöglichen es dem Verbraucher, beim Kauf von Sonnenschutzmitteln darauf zu achten, dass sie ein “Breitspektrum” aufweisen und sowohl vor UVB- als auch vor UVA-Strahlen schützen. Alle Sonnenschutzmittel schützen vor UVB-Strahlen, die Sonnenbrand verursachen. Jetzt sollen sie auch vor UVA-Strahlen schützen, die zu Hautkrebs und vorzeitiger Hautalterung beitragen. Nur Produkte, die die Tests bestanden haben, dürfen als “Breitspektrum” bezeichnet werden.
IST HAUTKREBS GEFÄHRLICH? IST HAUTKREBS TÖDLICH?
Jeder sollte seinen ganzen Körper untersuchen (von der Kopfhaut bis zu den Füßen vor einem Spiegel, bei schwer sichtbaren Körperteilen (wie dem Rücken)). Die Muttermale auf unserem Körper sollten durch regelmäßige Kontrollen genau überwacht werden, und wir sollten bei Veränderungen oder nicht heilenden, blutenden Hautwunden einen Spezialisten aufsuchen. Bei verdächtigen Läsionen oder bereits diagnostiziertem Hautkrebs wird eine Untersuchung mit einem Dermatoskopiegerät (Oberflächenmikroskopie) empfohlen.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST KEHLKOPFKREBS?
Kehlkopfkrebs, der zu den Krebsarten im Kopf- und Halsbereich gehört, tritt im Bereich des Rachens zwischen dem Zungengrund und der Luftröhre auf, wo sich die Stimmbänder befinden. Kehlkopfkrebs, auch als Larynx- oder Kehlkopfkrebs bezeichnet, ist eine der häufigsten Krebsarten unter den Krebsarten im Kopf- und Halsbereich.
WAS SIND DIE SYMPTOME VON KEHLKOPFKREBS?
- Heiserkeit, die länger als 3 Wochen anhält: Heiserkeit ist eines der häufigsten Symptome von Kehlkopfkrebs. Kehlkopfkrebs ist jedoch nicht die einzige Ursache für Heiserkeit. Eine akute Laryngitis, auch bekannt als Kehlkopfentzündung, zu lautes Schreien, Rauchen, Reflux, laufende Nase, Allergien, Schilddrüsenprobleme und hohes Alter können Heiserkeit verursachen. Neben Heiserkeit sollte man auch auf plötzliche Veränderungen im Tonfall achten.
- Schluckbeschwerden: Schluckbeschwerden können auf unterschiedliche Weise beschrieben werden. Das Gefühl, dass ein Krümel im Hals stecken bleibt, die Unfähigkeit, die Nahrung vollständig zu schlucken, Schmerzen oder ein brennendes Gefühl beim Schlucken, das Gefühl, als ob die Nahrung im Hals stecken bleibt, können als Schluckbeschwerden beschrieben werden.
Nicht jede Schluckstörung ist ein Symptom für Kehlkopfkrebs. Auch harmlose Verengungen der Speiseröhre, so genannte Strikturen, können Schluckbeschwerden verursachen. Es sollte jedoch nicht vergessen werden, dass auch fortgeschrittene Kehlkopftumore Schluckbeschwerden verursachen können.
- Gewichtsverlust Unkontrollierter Gewichtsverlust kann ein Symptom für viele Krebsarten sein, nicht nur für Kehlkopfkrebs. Er tritt häufiger in fortgeschrittenen Stadien von Kehlkopfkrebs auf. Bei einem unkontrollierten Gewichtsverlust von 4-5 kg in kurzer Zeit können Routinekontrollen lebensrettend sein.
- Kurzatmigkeit Kurzatmigkeit oder Keuchen gehört ebenfalls zu den Symptomen von Kehlkopfkrebs. Insbesondere bei fortschreitendem Keuchen und Kurzatmigkeit sollte an Kehlkopfkrebs gedacht werden.
- Gefühl eines Kloßes oder einer Schwellung in der Kehle
- Ermüdung
- Schlechter Atem
- Ohrenschmerzen
- Gewichtsverlust
Viele dieser Symptome können durch andere Gesundheitsprobleme als Krebs verursacht werden. Ähnliche Symptome können insbesondere bei Menschen auftreten, die viele Jahre lang rauchen und Alkohol trinken.
Diese Symptome, die auf Kehlkopfkrebs hindeuten, können auch durch andere Ursachen verursacht werden.
Chronische Kehlkopfentzündung, Rauchen, Reflux, Überanstrengung der Stimme, nicht bösartige, gutartige Tumore, als Kehlkopfknötchen bezeichnete Gewebewucherungen auf den Stimmbändern, warzenartige, durch HPV verursachte Wucherungen im Kehlkopf können mit Kehlkopfkrebs-Symptomen verwechselt werden. Die Beachtung der Symptome und die Durchführung der notwendigen Kontrollen können jedoch lebensrettend sein.
Was sind die Ursachen für Kehlkopfkrebs?
Es gibt Risikofaktoren, die zur Entstehung von Kehlkopfkrebs führen können.
- Tabak- und Alkoholkonsum: Alkohol- und Tabakkonsum ist einer der wichtigsten Risikofaktoren, die das Risiko für Kehlkopfkrebs erhöhen. Der Risikofaktor ist umso höher, je mehr Tabakprodukte und Alkohol konsumiert werden und je länger der Konsum zurückliegt. Menschen, die mehr als 25 Zigaretten pro Tag rauchen oder seit mehr als 30 Jahren rauchen, haben ein etwa 40-mal höheres Risiko, an Kehlkopfkrebs zu erkranken als Nichtraucher. Ebenso sind Langzeit- und regelmäßige Alkoholkonsumenten dreimal so stark gefährdet wie Nichttrinker. Rauchen ist die Ursache für die meisten Kopf- und Halskrebsarten, einschließlich Kehlkopfkrebs. Menschen, die keine Zigaretten oder Tabakerzeugnisse konsumieren und ständig Rauch ausgesetzt sind, haben ein erhöhtes Risiko, an Kehlkopfkrebs zu erkranken.
- Geschlecht: Das Risiko, an Kehlkopfkrebs zu erkranken, ist bei Männern 4-5 mal höher als bei Frauen. Der in den letzten Jahren weit verbreitete Zigarettenkonsum bei Frauen führt jedoch dazu, dass Kehlkopfkrebs bei Frauen häufiger vorkommt.
- Genetische Faktoren: Menschen mit einer familiären Vorgeschichte von Kopf- und Halskrebs oder Kehlkopfkrebs haben ein höheres Risiko, an Kehlkopfkrebs zu erkranken, als Menschen ohne diese Vorgeschichte.
- Alter: Wie bei vielen Krebsarten ist das fortschreitende Alter einer der wichtigsten Risikofaktoren für Kehlkopfkrebs. Unter 40 Jahren ist Kehlkopfkrebs selten.
- Ernährung: Menschen, die viel rotes Fleisch, verarbeitete Lebensmittel oder frittierte Speisen zu sich nehmen, haben ein höheres Risiko, an Kehlkopfkrebs zu erkranken. Es gibt auch Studien, die zeigen, dass eine Ernährung mit einem Mangel an Vitamin A und E ebenfalls eine Ursache für Kehlkopfkrebs ist. Eine Ernährung mit frischem Obst und Gemüse, die so genannte Mittelmeerdiät, und eine ausreichende Zufuhr von Vitamin A und E kann das Risiko für Kehlkopfkrebs verringern.
- HPV-Virus: Es gibt wissenschaftliche Studien, die zeigen, dass das HPV-Virus (Humanes Papilomavirus), das meist sexuell übertragen wird und bei Frauen Genitalwarzen, Gebärmutterhals- und Vaginalkrebs verursacht, auch Kehlkopfkrebs verursachen kann. HPV ist eine weit verbreitete Infektion und kann bei den meisten Menschen ohne Probleme weitergegeben werden.
- Exposition gegenüber Schadstoffen: Langfristige berufliche Exposition gegenüber bestimmten schädlichen oder chemischen Substanzen kann Kehlkopfkrebs verursachen.
- Sägespäne
- Ruß oder Kohlenstaub
- Farbdämpfe
- Formaldehyd wird in vielen Industriezweigen verwendet, z. B. bei der Herstellung von Farben und kosmetischen Produkten
- Nickel
- Isopropylalkohol, der als Reinigungsmittel verwendet wird
- Schwefelsäure-Nebel
- Asbest
- Schlechte Mundhygiene und Refluxkrankheit können ebenfalls Kehlkopfkrebs verursachen.
WIE WIRD KEHLKOPFKREBS DIAGNOSTIZIERT?
Die frühzeitige Diagnose von Kehlkopfkrebs bietet erhebliche Vorteile bei der Behandlung. Es ist wichtig, dass Menschen mit einem oder mehreren der Symptome unverzüglich einen Facharzt für Hals-Nasen-Ohrenheilkunde aufsuchen.
- Ärztliche Untersuchung: Bei der Diagnose von Kehlkopfkrebs kann eine ärztliche Untersuchung Aufschluss über die Erkrankung geben. Bei der Untersuchung bewertet der Arzt die Lebensweise und berufliche Risikofaktoren wie Rauchen und Alkoholkonsum. Da bei Kehlkopfkrebs ein Kloß im Hals vorhanden sein kann, führt der Arzt eine körperliche Untersuchung durch. Bei der körperlichen Untersuchung untersucht der Arzt das Innere des Mundes, einschließlich der Wangen und Lippen, auf Klumpen oder Schwellungen, den Mundboden, den hinteren Teil des Rachens, die Nase und die Ohren. Um die Diagnose Kehlkopfkrebs zu klären, können verschiedene Tests und bildgebende Verfahren eingesetzt werden.
- Nasendoskopie: Dabei handelt es sich um eine Art der Endoskopie, die der Arzt anwendet, um einen besseren Blick auf den Kehlkopf und den Rachen zu erhalten. Ein flexibler Schlauch mit einem Licht und einer kleinen Kamera am Ende wird durch die Nasenlöcher des Patienten eingeführt und das Vorhandensein einer abnormen Struktur im Kehlkopf untersucht. Vor der Nasenspiegelung sind keine Vorbereitungen erforderlich.
- Laryngoskopie: Sie wird in Fällen angewandt, in denen der Kehlkopf mit der Nasenspiegelung nicht ausreichend untersucht werden kann oder wenn eine verdächtige Formation entdeckt wird. Das bei der Laryngoskopie verwendete Endoskop ist länger und das Verfahren wird durch den Mund durchgeführt. Die Einnahme von Blutverdünnern kann vor der Laryngoskopie abgesetzt werden. Das Verfahren wird in der Regel unter Vollnarkose durchgeführt.
- Video-Laryngostroboskopie: Sie kann bei Patienten eingesetzt werden, die für eine Vollnarkose nicht geeignet sind, oder bei der Diagnose von Tumoren im Bereich der Stimmbänder. Das Endoskop ist mit einer Kamera und einem faseroptischen Blitzlicht am Ende ausgestattet. Es kann auch zur Beurteilung der Stimmbänder vor, während und nach der Behandlung eingesetzt werden. Der Eingriff dauert etwa 30 Minuten und kann unter lokaler Anästhesie durchgeführt werden.
- Biopsie Wenn in den bei der Nasenspiegelung oder Laryngoskopie untersuchten Bereichen eine verdächtige Struktur festgestellt wird, kann eine Gewebeprobe entnommen und an das Labor geschickt werden. Bei einer Biopsie kann ein Teil oder das gesamte krebsverdächtige Gewebe chirurgisch entfernt werden. Eine Feinnadelaspirationsbiopsie kann auch durchgeführt werden, wenn ein Knoten im Hals ertastet wird.
- Auch bildgebende Verfahren können bei der Diagnose von Kehlkopfkrebs eingesetzt werden. Bildgebende Verfahren wie Röntgen, Ultraschall, Computertomografie (CT), Magnetresonanztomografie (MRT) und PET geben Aufschluss über die genaue Lage und Größe des Krebses.
WIE WIRD DRÜSENKREBS BEHANDELT?
Die Behandlung von Kehlkopfkrebs hängt von der genauen Lokalisation des Tumors, seinem Stadium, dem Grad und dem allgemeinen Gesundheitszustand des Patienten ab. Im Allgemeinen werden bei der Behandlung von Kehlkopfkrebs eine Operation, eine Strahlentherapie (Radiotherapie) und eine Chemotherapie eingesetzt. Manchmal wird nur eine dieser Optionen zur Behandlung eingesetzt, manchmal kann auch eine Kombination von Behandlungen angewandt werden.
Chirurgische Behandlung von Kehlkopfkrebs
Endoskopische Resektion (Teilentfernung des Kehlkopfes durch endoskopische Laserchirurgie)
- Es handelt sich um eine chirurgische Methode, die für Kehlkopfkrebs im Frühstadium und für Patienten mit lokal fortgeschrittenem Kehlkopfkrebs geeignet ist.
- Die endoskopische Resektionschirurgie, im Volksmund auch als intraorale Laserchirurgie bezeichnet, wird durch den Mund durchgeführt, so dass kein Einschnitt erforderlich ist.
- Da während des Eingriffs ein Laser verwendet wird, ist die Blutung geringer.
- Der Eingriff wird im Operationssaal unter Vollnarkose durchgeführt.
- Die notwendigen chirurgischen Instrumente und der Laser werden durch einen Schlauch vom Mund bis zu den Stimmbändern geführt. Bei der unter dem Mikroskop durchgeführten Operation sieht der Chirurg den Krebstumor deutlich.
- Je nach Zustand des Tumors kann der Chirurg einen Teil des Tumors mit einem Laser herausschneiden oder ihn mit einem Hochenergielaser vollständig zerstören.
- Vor der endoskopischen Laserchirurgie sollte geprüft werden, ob der Patient für diesen Eingriff geeignet ist. Da die Laseroperation durch den Mund durchgeführt wird, müssen die Zähne und die Rachenstruktur des Patienten für diesen Eingriff geeignet sein.
- Die Dauer des Krankenhausaufenthalts nach einer Laseroperation im Mundbereich kann je nach Lage und Größe des Tumors variieren.
- Schwellungen nach endoskopischen Laseroperationen, die in der Regel bei großen Tumoren durchgeführt werden, können zu Problemen bei der Atmung oder der Nahrungsaufnahme führen.
- Intraorale Laseroperationen verursachen in der Regel keine dauerhaften Probleme beim Sprechen und Schlucken. Das Sprechen kann für einige Tage nach der Operation eingeschränkt sein. Bei langfristigen Sprachproblemen kann die Zusammenarbeit mit einem Logopäden zu positiven Ergebnissen führen.
Kehlkopfkrebs Laryngektomie Operation
- Je nach Größe und Lage des Tumors wird der betroffene Teil des Kehlkopfs oder der gesamte Kehlkopf operativ entfernt.
- Die partielle Laryngektomie, bei der nur ein Teil des Kehlkopfes entfernt wird, kann durch einen kleinen Schnitt am Hals oder ohne Schnitt durch den Mund durchgeführt werden.
- Bei der partiellen Laryngektomie wird ein kleines Loch in den Hals geschnitten, damit der Patient atmen kann. Dieses Loch wird in der Regel nach der Operation verschlossen.
- Nach einer partiellen Laryngektomie kann es vorübergehend zu Sprachproblemen kommen. Nach der Genesungsphase sind Sprach- und Atemprobleme jedoch normalerweise nicht mehr zu beobachten.
- Bei der totalen Laryngektomie, bei der der gesamte Kehlkopf entfernt wird, ist die Luftröhre mit dem Loch im Hals verbunden, um ein- und ausatmen zu können.
- Bei einer totalen Laryngektomie, d. h. einer Operation, bei der der gesamte Kehlkopf entfernt wird, ist das Loch im Hals dauerhaft.
- Nach einer totalen Laryngektomie verliert der Patient seine Stimme. Der Patient kann mit Stimmprothesen kommunizieren, die als Sprech- oder Sprachgerät hergestellt werden.
- Nach einer totalen Laryngektomie können neben den Stimmproblemen auch Probleme beim Schlucken, Schmecken und Riechen auftreten.
Halsdissektion Chirurgie
- Kehlkopfkrebs kann manchmal auf die Lymphknoten im Hals übergreifen. Normalerweise streuen die Krebszellen zuerst in die Lymphknoten. Bei der chirurgischen Behandlung von Kehlkopfkrebs ist es manchmal notwendig, einige oder alle Lymphknoten zu entfernen.
- Bei einer Halsdissektion, bei der Lymphknoten entfernt werden, können auch Muskeln, Nerven und umliegendes Gewebe entfernt werden.
- Nicht alle Patienten können sich aufgrund von Nebenwirkungen einer Halsdissektion unterziehen.
- Obwohl die Entfernung von Lymphknoten eine der wichtigsten Maßnahmen ist, um die Ausbreitung von Krebs zu verhindern, kann sie je nach entfernten Lymphknoten Nebenwirkungen wie Taubheitsgefühl im Ohr, Bewegungsverlust der Unterlippe, Bewegungs- und Empfindungsverlust der Zunge, Bewegungsverlust der Schulter, Bewegungsverlust des Halses und des Arms verursachen.
- Eine Strahlentherapie kann nach einer Halsdissektionsoperation durchgeführt werden.
- Bei Schwellungen, Völlegefühl oder Druckgefühl, Schluckbeschwerden oder Stimmveränderungen ist ein Arzt aufzusuchen.
Strahlentherapie zur Behandlung von Kehlkopfkrebs
- Die Strahlentherapie ist die erste Wahl bei Kehlkopfkrebs im Frühstadium. Die Strahlentherapie, bei der Krebszellen mit hoher Energie zerstört werden, kann je nach Lage und Größe des Tumors allein oder in Kombination mit einer Operation und Chemotherapie durchgeführt werden.
- Eine Strahlentherapie kann manchmal nach einer Kehlkopfkrebsoperation durchgeführt werden. Um ein Wiederauftreten des Kehlkopfkrebses zu verhindern, kann eine postoperative Strahlentherapie in Fällen durchgeführt werden, in denen der gesamte Tumor nicht entfernt werden kann, oder bei Tumoren, die entlang der Kehlkopfwand wachsen.
- Bei Patienten mit Kehlkopfkrebs im fortgeschrittenen Stadium kann eine Strahlentherapie zusammen mit einer Chemotherapie durchgeführt werden, um bessere Ergebnisse zu erzielen.
- Eine Strahlentherapie in fortgeschrittenen Stadien von Kehlkopfkrebs kann Schluck- und Atemprobleme verringern.
- Während der Strahlentherapie können Nebenwirkungen wie Müdigkeit, Rötung oder Verdunkelung der Haut, Halsschmerzen, Schluckbeschwerden oder Schwellungen auftreten.
Chemotherapeutische Behandlung bei Kehlkopfkrebs
- Die Chemotherapie bei Kehlkopfkrebs kann vor und nach der Operation durchgeführt werden. Sie wird in der Regel zusammen mit einer Strahlentherapie durchgeführt.
- Mit einer präoperativen Chemotherapie kann der Tumor so weit verkleinert werden, dass er operiert werden kann.
- Mit einer Chemotherapie kann das Wiederauftreten von Kehlkopfkrebs verhindert werden.
- Zielgerichtete intelligente Medikamente sind in den letzten Jahren in den Vordergrund der Chemotherapie gerückt. Zielgerichtete intelligente Medikamente verringern die Nebenwirkungen der Chemotherapie und erhöhen die Wirksamkeit der Behandlung.
HÄUFIG GESTELLTE FRAGEN ZU DRÜSENKREBS
Zu welchem Arzt sollte ich bei Kehlkopfkrebs gehen?
Der Kehlkopf ist Teil der oberen Atemwege und gleichzeitig ein Stimmorgan. Die Erstdiagnose und Behandlung von Kehlkopfkrebs, der auch als Rachenkrebs oder Kehlkopfkrebs bezeichnet wird, wird von HNO-Ärzten durchgeführt. Bei der Wahl eines HNO-Arztes für die Behandlung von Kehlkopfkrebs ist es wichtig, einen auf Kopf- und Halschirurgie spezialisierten Arzt und ein Krankenhaus mit ausreichender Infrastruktur in diesem Bereich zu wählen.
Welche Arten von Kehlkopfkrebs gibt es?
Kehlkopfkrebs wird je nach dem Zelltyp, von dem er ausgeht, in verschiedene Typen eingeteilt.
- Plattenepithelkarzinom des Kehlkopfes: Fast 95 % der Kehlkopfkrebsfälle gehören zu diesem Typ. Er beginnt in flachen, flachen Zellen im dünnen, blattförmigen Lappen am oberen Ende des Kehlkopfs, der Epiglottis genannt wird, oder in Zellen der gleichen Struktur in anderen Teilen des Kehlkopfs.
Kehlkopfkrebs vom Plattenepitheltyp wird auch nach dem Bereich, in dem er sich ausbreitet, in verschiedene Typen unterteilt.
- Glottiskrebs – beginnt in den Stimmbändern
- Supraglottischer Krebs – beginnt an der Spitze der Stimmbänder
- Subglottischer Krebs – beginnt unter den Stimmbändern
- Oropharynxkrebs – beginnt direkt hinter dem Mund
- Nasopharynxkrebs – beginnt im hinteren Teil des Rachens
- Das Adenokarzinom ist eine Krebsart des Kehlkopfes: Obwohl seine Häufigkeit in den letzten Jahren zugenommen hat, ist er viel seltener als Kehlkopfkrebs vom Plattenepitheltyp. Es beginnt in schleimproduzierenden adenomatösen Zellen, die auf der Oberfläche des Kehlkopfes verstreut sind.
Es gibt auch sehr seltene Krebsarten des Kehlkopfs. Es gibt seltene Arten von Kehlkopfkrebs wie kleine Speicheldrüsentumore, Sarkome, Melanome, Non-Hodgkin-Lymphome oder extramedulläre Plasmozytome.
Welche Arten von Kehlkopfkrebs gibt es?
Der Grad des Kehlkopfkrebses hängt mit dem Auftreten der Krebszellen zusammen. Er wird im Allgemeinen in niedriggradigen und hochgradigen Kehlkopfkrebs unterteilt.
- Niedriggradiger Kehlkopfkrebs; die Krebszellen sehen den Zellen, aus denen sie entstanden sind, ähnlich. Niedriggradige Kehlkopfkrebszellen wachsen in der Regel langsam und streuen weniger wahrscheinlich.
- Hochgradiger Kehlkopfkrebs; die Differenzierung der Krebszellen ist hoch. Hochgradige Kehlkopfkrebszellen neigen dazu, sich schneller zu vermehren und streuen eher als niedriggradige Krebszellen.
Was sind die Stadien des Kehlkopfkrebses?
Nach der Diagnose von Kehlkopfkrebs ist die Bestimmung des Stadiums wichtig für die Gestaltung der Behandlung. Das Stadium des Kehlkopfkrebses wird bestimmt, indem festgestellt wird, wie weit sich der Krebs ausgebreitet hat. Kehlkopfkrebs wird je nach der genauen Lage des Tumors, der Ausbreitung auf nahe gelegene Lymphknoten und der Metastasierung in entfernte Organe in verschiedene Stadien eingeteilt.
Es gibt 5 Stadien des Kehlkopfkrebses.
- Stadium 0: Es handelt sich um ein sehr frühes Stadium, in dem sich die abnormen Krebszellen noch nicht auf das umliegende Gewebe ausgebreitet haben. Die Krebszellen befinden sich nur in der inneren Auskleidung des Kehlkopfs.
- Stadium 1 und Stadium 2; Kehlkopfkrebs im Frühstadium. Der Tumor ist klein und ragt nicht über den Kehlkopf hinaus.
- Stadium 3: Der Tumor ist größer und kann eine der Stimmbänder befallen. Bei Kehlkopfkrebs im Stadium 3 kann der Tumor auch in den dünnen, blattförmigen Kehldeckel am oberen Ende des Kehlkopfs oder in die Schilddrüse einwachsen.
- Stadium 4 ist das letzte Stadium des Kehlkopfkrebses. Der Tumor kann sich auf die Schilddrüse, die Luftröhre oder die Speiseröhre ausgebreitet haben.
Ist Kehlkopfkrebs tödlich?
Kehlkopfkrebs ist eine tödliche Krankheit. Die Lebenserwartung hängt von der Art, der Lage, der Größe und der Ausbreitung des Kehlkopfkrebstumors sowie vom Ansprechen des Patienten auf die Behandlung ab.
In allgemeinen Studien wird die 5-Jahres-Überlebenszeit nach angemessener Behandlung wie folgt angegeben.
Kehlkopfkrebs im Stadium 1 90%
Kehlkopfkrebs im Stadium 2 70%
Kehlkopfkrebs im Stadium 3 60
Kehlkopfkrebs im Stadium 4 40
Nach den Ergebnissen der Statistik ist es nicht möglich, eine Aussage über die Lebenserwartung des Patienten zu treffen.
In den ersten zwei Jahren nach der Behandlung sollten die Patienten alle drei bis sechs Monate zum Arzt gehen. 80-90 Prozent der Krebserkrankungen treten innerhalb der ersten 3 Jahre wieder auf.
Wo metastasiert Kehlkopfkrebs?
Krebszellen können sich von der Stelle aus auf andere Teile des Körpers ausbreiten. Kehlkopfkrebs metastasiert zunächst in benachbarte Gewebe. In fortgeschrittenen Stadien kann es auch zu Metastasen in entfernten Organen kommen.
- Entlang des Kehlkopfes
- Weichteile im Nacken
- Schilddrüse
- Stimmbänder
- Zungengrund
- Schwalbe
- Trachea (Luftröhre)
- Zungenmuskeln und Nackenmuskeln
- Speiseröhre
- Lymphknoten
- Er kann Metastasen in der Lunge, der Leber und den Knochen bilden.
Werde ich nach einer Kehlkopfkrebsoperation sprechen können?
- Bei Teiloperationen von Kehlkopfkrebs können die Stimmbänder erhalten werden. Obwohl es unmittelbar nach diesen Operationen, bei denen die Stimmbänder erhalten bleiben, Schwierigkeiten beim Sprechen gibt, kann die Stimme nach einiger Zeit wiederhergestellt werden.
- Nach Operationen, bei denen der gesamte Kehlkopf entfernt wird, verliert der Patient jedoch seine Stimme.
- Nach diesen Operationen können je nach dem Zustand des Patienten verschiedene Sprechtechniken oder -geräte eingesetzt werden. Das so genannte ösophageale Sprechen kann durchgeführt werden, indem Luft durch die Speiseröhre geleitet und dann in den Mund zurückgeführt wird. Dies kann in Zusammenarbeit mit Stimmtherapeuten erfolgen.
- Der Patient kann einen Ton erzeugen, indem er ein kleines Gerät, einen so genannten elektronischen Kehlkopf, an den Hals hält.
- Mit Hilfe von Stimmprothesen, auch Sprachmikrofone genannt, kann der Patient zum Sprechen gebracht werden.
Wie sollte die Ernährung nach Kehlkopfkrebs aussehen?
Während der Behandlung von Kehlkopfkrebs kann es zu Problemen wie Schluckbeschwerden, Schmerzen, Geschmacksstörungen und Gewichtsverlust nach einer Strahlentherapie oder Operation kommen.
Da nach einer Kehlkopfkrebsoperation nicht sofort feste Nahrung zugeführt werden kann, kann eine Sonde durch die Nase, ein Loch im Rachen oder durch die Bauchdecke an den Magen angeschlossen werden. Dabei erhält der Patient flüssige Nährstoffe durch diese Sonde.
Während der Umstellung auf eine normale Ernährung sollten säurehaltige und scharfe Speisen vermieden werden.
Nach einigen Operationen kann es zu Geschmacksverlusten kommen. Um den Geschmacksverlust auszugleichen, können dem Essen starke Soßen oder Kräuter, Knoblauch und Zitronensaft zugesetzt werden, um es zu würzen.
Lebensmittel, die leichter zu kauen und zu schlucken sind, sollten bevorzugt werden. Kommt es trotzdem zu einer Gewichtsabnahme, können in Absprache mit dem Arzt zusätzliche Vitaminpräparate angefordert werden.
Kann Rauchen Krebs im Kehlkopf verursachen?
Rauchen ist einer der Hauptrisikofaktoren für Kehlkopfkrebs. Kehlkopfkrebs, der bei etwa einem von 100.000 Menschen in der Gesellschaft auftritt, ist vor allem bei Männern zu beobachten, die rauchen, während die Häufigkeit von Kehlkopfkrebs bei Frauen in letzter Zeit mit der Zunahme des Rauchens zugenommen hat. Das wichtigste Symptom von Kehlkopfkrebs ist Heiserkeit, und insbesondere bei Heiserkeit, die länger als 2 Wochen anhält, sollte ein HNO-Arzt aufgesucht werden.
Was sollte zur Vermeidung von Kehlkopfkrebs getan werden?
- Es gibt keine erwiesene Möglichkeit, Kehlkopfkrebs zu verhindern. Man kann jedoch Maßnahmen gegen Kehlkopfkrebs ergreifen, indem man Risikofaktoren vermeidet.
- Der wichtigste Risikofaktor für Kehlkopfkrebs ist das Rauchen. Wenn Sie mit dem Rauchen aufhören, verringert sich das Risiko für Kehlkopfkrebs erheblich.
- Eine Ernährung auf der Grundlage von Obst und Gemüse ist wichtig. Stellen Sie sicher, dass Sie die notwendigen Vitamine und Antioxidantien erhalten.
- Da HPV Kehlkopfkrebs verursachen kann, sollte bei Bedarf eine HPV-Impfung durchgeführt werden.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST EIN BRUSTWANDTUMOR?
Die Brustwand ist die Struktur, die an die Wirbel im Rücken, die Rippen an den Seiten und die Muskelschicht, die den Raum zwischen den Rippen bedeckt, das Brustbein, das im Volksmund als Glaubensknochen bezeichnet wird, den Zwerchfellmuskel unten und das Schlüsselbein (Clavicula) oben angrenzt. Die Brustwand ist die Struktur, die dem Brustkorb seine Form und Festigkeit verleiht. Die Muskel- und Knochenstruktur des Brustkorbs trägt zur Atmung bei und wird von den Bauchmuskeln unterstützt. Die Brustwand beherbergt eine Vielzahl von Tumoren, die den Bewegungsapparat und das Bindegewebe betreffen, und die meisten dieser Tumoren sind bösartig.
Die Klassifizierung von Brustwandtumoren lautet wie folgt
- Brustwandtumore werden in primäre und sekundäre Tumore unterteilt.
- Sie ist oft sekundär zu Fernmetastasen (Ausbreitung aus anderen Organen) und regionaler Ausbreitung von Tumoren benachbarter Organe wie Lunge, Rippenfell, Mittelfell und Brust.
- Sarkome sind die häufigsten bösartigen Tumoren, die von der Brustwand selbst ausgehen und die wir als primär bezeichnen. Diese Tumore können in Knochen, Knorpel und Weichteilen lokalisiert sein. Von den Brustwandtumoren, die in Knochen und Knorpel lokalisiert sind, befinden sich 50 % in den Rippen, 30 % im Schulterblatt und 20 % im Brustbein und Schlüsselbein.
WAS SIND DIE ANZEICHEN UND SYMPTOME VON BRUSTWANDTUMOREN?
Brustwandtumoren können asymptomatisch sein, d. h. keine Symptome aufweisen, oder sie können sich auf unterschiedliche Weise manifestieren.
- Agri
- Subkutane Schwellung
- Symptome wie eine Infektion können bei Brustwandtumoren auftreten.
Während Brustwandtumore weichen Ursprungs in der Regel schmerzlos wachsen, können Schmerzen bei Brustwandtumoren knöchernen Ursprungs ausgeprägt sein. Aus diesem Grund kann eine schmerzhafte Schwellung das erste Anzeichen für einen Brustwandtumor sein. Bei einer abnormen Schwellung im Körper und bei Schmerzsymptomen, die vorher nicht vorhanden waren, ist es sinnvoll, die Abteilung für Thoraxchirurgie aufzusuchen, ohne viel Zeit zu verlieren.
WIE WERDEN BRUSTWANDTUMORE DIAGNOSTIZIERT?
- Eine ausführliche Anamnese und eine körperliche Untersuchung sind die ersten wichtigen Methoden bei der Diagnose von Patienten mit Verdacht auf einen Brustwandtumor.
- Was die Bildgebung betrifft, so ist es wichtig, zunächst die Röntgenaufnahme des Brustkorbs zu beurteilen.
- Falls erforderlich, können moderne bildgebende Verfahren wie Computertomographie (CT) und Magnetresonanztomographie (MRT) eingesetzt werden.
- Mit der Computertomographie (CT) lassen sich die Rippenstrukturen und die Schädigung des Knochens besser darstellen, während die Magnetresonanztomographie (MRT) Weichteiltumore und ihre Beziehung zu den mediastinalen Organen und großen Gefäßen besser erkennen lässt.
- PET-CT ist eines der fortschrittlichen bildgebenden Verfahren, mit denen der gesamte Körper nach einem Tumorverdacht mittels Computertomographie oder Magnetresonanztomographie untersucht wird.
Welche Bildgebungsmethode bevorzugt wird, hängt vom klinischen Zustand des Patienten ab.
WIE WIRD EIN BRUSTWANDTUMOR BEHANDELT?
- Bei den meisten Brustwandtumoren ist die wirksamste Behandlung die weitgehende Entfernung des Tumors mit negativen Operationsrändern (kein Tumor in den entfernten Geweberändern).
- Die Bereiche, die operativ entfernt werden, richten sich nach dem Zelltyp des entfernten Tumors und der Art des bösartigen Tumors.
- Chemo- und Strahlentherapie werden bei schnell differenzierenden (hochgradigen) Tumoren eingesetzt. In einigen Fällen, wenn der Verdacht besteht, dass ein Tumor in der entfernten Brustwand verbleibt, wird auch eine Chemotherapie eingesetzt, um diesen Bereich zu kontrollieren.
- Nach der weitgehenden Entfernung eines Brustwandtumors werden spezielle Methoden angewandt, um den Hohlraum zu verschließen und dem Patienten eine freie Atmung zu ermöglichen. Zu diesem Zweck können spezielle Materialien oder Patches (Transplantate) aus anderen Körperteilen wie Muskel, Omentum oder Haut verwendet werden. Bei den verwendeten Spezialmaterialien handelt es sich in der Regel um Materialien, die während der Operation entsprechend der Flexibilität des Körpers geformt werden können. Welches Material verwendet wird, wird vor der Operation je nach Zustand des Patienten und der Erkrankung entschieden.
- Nach einigen Operationen können Organe des Körpers wie Muskeln, Haut usw. verwendet werden. Diese Planung erfolgt in Zusammenarbeit mit anderen Fachrichtungen wie der plastischen Chirurgie, der Orthopädie und der Thoraxchirurgie.
HÄUFIG GESTELLTE FRAGEN ZUM BRUSTWANDTUMOR
Wie lange dauert die Operation bei einem Brustwandtumor?
Die Dauer von Brustwandoperationen hängt von der Art des Tumors, der Größe des entfernten Teils und den zusätzlichen Eingriffen ab, die zum Schließen der Höhle erforderlich sind. Während eine einfache Weichteilexzision in 30 Minuten abgeschlossen werden kann, können Operationen, die die Entfernung eines großen Brustwandtumors erfordern, 5-6 Stunden dauern.
Wie ist der Ablauf nach einer Brustwandtumoroperation?
Nach Operationen an Brustwandtumoren werden häufig Drainageschläuche in die Lungenhöhle sowie in die submuskulären und subkutanen Operationsstellen gelegt, um die vom Körper produzierte postoperative Flüssigkeit abzuleiten, und diese werden überwacht.
Je nach Alter, Allgemeinzustand, Langzeiterkrankungen und Dauer der Anästhesie können die Patienten direkt auf die Station verlegt oder für eine bestimmte Zeit nach der Operation auf der Intensivstation betreut werden.
Nach dem Aufenthalt auf der Intensivstation bleiben die Patienten, bei denen Lungenaufnahmen und Labortests auf der Station durchgeführt werden, durchschnittlich 5-6 Tage im Krankenhaus.
Was ist nach der Operation eines Brustwandtumors zu beachten?
Nach einer Brustwandtumoroperation muss sich der Patient je nach Größe des Eingriffs 1-2 Wochen lang schonen. Das allgemeine Wohlbefinden des Patienten wird beurteilt, und es wird erwartet, dass der Patient nach 1-2 Wochen wieder am gesellschaftlichen und beruflichen Leben teilnehmen kann.
Ist Brustwandkrebs eine häufige Krebsart?
Krebserkrankungen der Brustwand machen 1-2 % aller primären Krebserkrankungen und 5 % aller Brustkrebserkrankungen aus.
Ist Brustwandkrebs eine Erbkrankheit?
Bei Brustwandkrebs gibt es eine genetische Prädisposition. Vor allem bei Sarkomen sind genetische Faktoren in Studien eindeutig nachgewiesen worden.
Wer hat ein höheres Risiko für Brustwandkrebs?
Da die meisten Brustwandtumore durch Metastasen aus anderen Organen verursacht werden und sich regional auf benachbarte Organe ausbreiten, sollten Menschen mit einer Krebsvorgeschichte besonders vorsichtig sein. Allerdings treten Brustwandtumoren bei Männern doppelt so häufig auf wie bei Frauen.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST AUGENKREBS?
Augenkrebs ist ein seltener Tumor, der die äußeren Teile des Auges (z. B. das Augenlid) oder das Innere des Augapfels (intraokularer Krebs) befallen kann. Die häufigsten intraokularen Krebsarten bei Erwachsenen sind das Melanom und das Lymphom, während die häufigste Krebsart bei Kindern das Retinoblastom ist, das in den Zellen der Netzhaut entsteht. Augenkrebs entsteht, wenn abnorme Zellen im Auge unkontrolliert wachsen und sich teilen. Regelmäßige Augenuntersuchungen bieten die Chance, Augenkrebs in seinem frühesten, am besten heilbaren Stadium zu erkennen.
WAS VERURSACHT AUGENKREBS? WAS SIND DIE RISIKOFAKTOREN FÜR AUGENKREBS?
Obwohl nicht genau bekannt ist, warum Augenkrebs entsteht, gibt es einige Faktoren, die das Risiko für Augenkrebs erhöhen können, z. B.
- hellere Augen haben
- Fortschreitendes Alter (Personen über 50 Jahre)
- Zu viele Muttermale auf der Haut
- Verwandte 1. Grades mit Augenkrebs
- Geschwächtes Immunsystem
- Vererbte Erkrankungen der pigmentbildenden Zellen, wie das dysplastische Nävus-Syndrom und die okulodermale Melanozytose (auch Nävus von Ota genannt)
- Kaukasische Rasse: Sie haben ein höheres Risiko für ein Augenmelanom als Menschen anderer Rassen.
Das Retinoblastom bei Kindern ist in etwa 25 bis 30 Prozent der Fälle eine vererbte oder genetisch bedingte Erkrankung, die auf eine Mutation im Retinoblastom-Gen (RB1) zurückzuführen ist. Die vererbte Form des Retinoblastoms tritt in der Regel in einem jüngeren Alter auf und betrifft mit größerer Wahrscheinlichkeit beide Augen als die nicht vererbte Form.
Andererseits wurde auch die ultraviolette (UV-)Strahlung des Sonnenlichts als möglicher Risikofaktor für das Augenmelanom genannt, was jedoch nicht bewiesen ist. Es besteht ein bekannter Zusammenhang zwischen Sonnenexposition und der Entstehung von Melanomen. Obwohl dies noch nicht bewiesen ist, könnte dies auch für Melanome des Auges gelten. Die Amerikanische Krebsgesellschaft empfiehlt daher, bei Aufenthalten im Freien zusätzlich zu Sonnenschutzmitteln und Kleidung eine Sonnenbrille mit UV-Schutz zu tragen.
WAS SIND DIE SYMPTOME VON AUGENKREBS?
Menschen mit Augenkrebs haben in der Regel keine Symptome. Am häufigsten wird Augenkrebs bei einer Routineuntersuchung festgestellt. Wenn Symptome auftreten, kommt es am häufigsten zu einem schmerzlosen Sehverlust.
Jedes der unten aufgeführten Symptome kann auch mit anderen Erkrankungen in Verbindung stehen. Daher sollten Sie bei Veränderungen der Sehkraft oder anderen Augenproblemen einen Arzt aufsuchen.
Einige Symptome von Augenkrebs sind folgende:
- Glaukom (hoher Augeninnendruck)
- Verlust des Sichtfelds
- Verlust des Sehvermögens
- Anschwellen der Augen Anschwellen eines oder beider Augen (Proptosis)
- Sehen von Lichtblitzen
- Veränderung der Irisfarbe
- Sehen von Flecken, Wellenlinien oder schwebenden Objekten
- Im vorderen Teil des Auges sichtbare Masse
Kinder mit Retinoblastom können die folgenden Symptome aufweisen:
- Die Augen scheinen in verschiedene Richtungen zu schauen
- Schmerzen oder Rötung des Auges
- Die Pupille erscheint in Blitzlichtaufnahmen weiß statt rot
Obwohl Augenkrebs selten ist, kann er zu lebensbedrohlichen Komplikationen und zum Tod führen, insbesondere wenn er nicht diagnostiziert und behandelt wird. Wer visuelle Symptome wie Sehschwierigkeiten, den Verlust eines Teils des Gesichtsfelds oder Lichtblitze, dunkle Flecken, Punkte, Wellenlinien oder schwebende Objekte auf der Iris bemerkt, sollte sofort einen Arzt aufsuchen.
WIE WIRD AUGENKREBS DIAGNOSTIZIERT?
Es gibt keine allgemein empfohlene Vorsorgeuntersuchung für Augenkrebs, aber jährliche Augenuntersuchungen (insbesondere bei Personen mit anerkannten Risikofaktoren) können eine wichtige Rolle bei der Früherkennung spielen. Augenkrebs wird häufig bei Routineuntersuchungen entdeckt. Diejenigen, bei denen primärer Augenkrebs diagnostiziert wird, d. h. der Krebs beginnt im Auge und hat noch nicht gestreut, haben eine hohe Überlebensrate.
Wenn der Arzt Augenkrebs vermutet, kann er bildgebende Untersuchungen oder einen Augenultraschall anordnen, um die Diagnose zu unterstützen.
Die optische Kohärenztomografie, auch Augentomografie genannt, ist ein bildgebendes Verfahren, das die Netzhautschichten beleuchtet, um das subtile Vorhandensein von Flüssigkeit, ein Zeichen für Tumoraktivität, zu beurteilen. Auch eine Magnetresonanztomographie (MRT) kann für die Diagnose hilfreich sein. In einigen Fällen kann der Arzt eine Feinnadelbiopsie durchführen, um eine kleine Probe der Tumorzellen zu entnehmen. Der Zytopathologe wird die Probe analysieren, um die Diagnose innerhalb weniger Tage zu bestätigen.
Der Arzt kann auch andere Tests anordnen, um festzustellen, ob sich der Krebs auf andere Teile des Körpers ausgebreitet hat. Ähnliche Tests können sein:
- Bluttests zur Messung der Leberfunktion
- Röntgenaufnahme der Brust
- Computertomographie (CT)
- Magnetresonanztomographie (MRI)
- Abdominaler Ultraschall
- Positronen-Emissions-Tomographie (PET)
WELCHE BEHANDLUNGSMÖGLICHKEITEN GIBT ES BEI AUGENKREBS?
Nach der Diagnose von Augenkrebs wird der Arzt die besten Behandlungsmöglichkeiten besprechen. Die am besten geeigneten Behandlungsmöglichkeiten für Augenkrebs hängen von den folgenden Faktoren ab:
- Art von Krebs
- Ort und Ausmaß des Krebses
- ob sich der Krebs auf andere Bereiche ausgebreitet hat (Metastasen)
- Alter und allgemeiner Gesundheitszustand des Patienten
Ein kleines Melanom des Auges erfordert möglicherweise keine dringende Behandlung. Bei der Strahlentherapie wird hochenergetische Energie wie Protonen oder Gammastrahlen eingesetzt, um Krebszellen abzutöten. Eine Strahlentherapie wird in der Regel bei einigen kleinen und mittelgroßen Augenmelanomen eingesetzt. In einigen Fällen kann auch eine Behandlung mit einem Laser zur Abtötung von Melanomzellen in Frage kommen. Eine Art der Laserbehandlung, die so genannte Thermotherapie, verwendet einen Infrarotlaser (in einigen Fällen wird sie in Kombination mit einer Strahlentherapie eingesetzt).
Bei einigen kleinen Augenmelanomen kann eine Kryotherapie zur Zerstörung der Melanomzellen eingesetzt werden. Eine Chemotherapie wird beim Augenmelanom nur selten eingesetzt; beim Retinoblastom und bestimmten Arten von Orbitallymphomen kann jedoch eine Chemotherapie durchgeführt werden.
Die chirurgischen Verfahren zur Behandlung von Augenkrebs sind wie folgt:
Augenschonende Chirurgie: Generell anwendbar bei Lidtumoren, Bindehauttumoren und Orbitalkarzinomen.
Iridektomie: Die Regenbogenhaut (der farbige Teil des Auges) wird entfernt.
Iridotrabeculectomie: Die Regenbogenhaut und ein kleiner Teil des äußeren Teils des Augapfels werden entfernt.
Rekonstruktive Augenchirurgie: Nach der chirurgischen Entfernung von Augenlid-, Bindehaut- oder Augenhöhlenkrebs kann die Funktion oft wiederhergestellt werden,
Enukleation: Zur Behandlung einiger Arten von Augenkrebs muss das gesamte Auge entfernt werden. Dies wird nur in fortgeschrittenen Fällen bei intraokularen Tumoren wie dem Aderhautmelanom oder dem Retinoblastom durchgeführt.
Orbitalexenteration: Bei diesem chirurgischen Eingriff werden das Auge, die Augenlider, die umgebende Haut, die Orbitalmuskeln, das Fett und die Nerven entfernt. Er ist manchmal bei aggressiven Krebserkrankungen der Augenhöhle oder der Nasennebenhöhlen sowie bei fortgeschrittenen oder wiederkehrenden Krebserkrankungen der Augenlider oder der Bindehaut erforderlich.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
LENF KANSERİ (LENFOMA) NEDİR?
Blutkrebs ist ein Synonym für alle Krebsarten, die ihren Ursprung im Knochenmark haben, wo das Blut produziert wird, oder die ihren Ursprung im Blut haben. Lymphome machen 50 Prozent der Blutkrebserkrankungen aus. Lymphome werden in Hodgkin-Lymphome und Non-Hodgkin-Lymphome unterteilt. Das Non-Hodgkin-Lymphom ist etwa achtmal häufiger als das andere.
Beide Haupttypen von Lymphomkrebs haben Subtypen. Das Non-Hodgkin-Lymphom hat mindestens 40-50 Subtypen. Beim Hodgkin-Lymphom gibt es 6-8 Subtypen. Der klinische Verlauf, das Ansprechen auf die Behandlung und die Medikamente, die bei der Behandlung all dieser Subtypen eingesetzt werden, unterscheiden sich voneinander. Aus diesem Grund sollte nach der Diagnose eines Lymphoms der Subtyp der Krankheit genau bestimmt werden. In dieser Hinsicht ist die Suche nach dem besten Krankenhaus für die Behandlung von Lymphomen sehr wichtig. Krankenhäuser mit onkologischen Zentren, die über erfahrenes und fachkundiges Personal verfügen, sollten bevorzugt werden.
WAS VERURSACHT EIN LYMPHOM?
Obwohl es keine eindeutige Antwort auf die Frage “Was verursacht Lymphome?” gibt, können bestimmte Risikofaktoren genannt werden. Wie bei allen Krebsarten gelten Rauchen und der Konsum anderer Tabakerzeugnisse als eine der wichtigsten Ursachen. Darüber hinaus kann auch die Exposition gegenüber Chemikalien wie Benzol und Pestiziden als Ursache für Lymphdrüsenkrebs genannt werden. Darüber hinaus kann die Krankheit bei rheumatischen Erkrankungen und Immunschwächezuständen häufiger auftreten. Einige Virusinfektionen, die das Immunsystem erheblich beeinträchtigen, sind ebenfalls eine wichtige Ursache für Lymphome. So kann das Lymphom beispielsweise bei einigen Infektionskrankheiten wie Hepatitis C, HTLV 1, HIV und AIDS auftreten.
Alltägliche Umweltfaktoren stehen bei den Lymphom-Ursachen nicht an erster Stelle. Allerdings ist das Lymphom bei landwirtschaftlichen Arbeitnehmern, insbesondere bei Gewächshausbauern, etwas häufiger anzutreffen. Man muss wissen, dass Faktoren wie unkontrolliertes Sprühen, das Herumlaufen in besprühten Gewächshäusern ohne das Tragen von Masken und Kleidung und das Einatmen der versprühten Luft im Gewächshaus wirksam sind. Andernfalls sollte man nicht annehmen, dass das Pestizid auf dem Gemüse, das nach Hause kommt, ein Faktor ist. Das gleiche Risiko besteht auch für Arbeitnehmer in der Farbindustrie, wenn die erforderlichen Vorsichtsmaßnahmen nicht getroffen werden. Auch Bleichmittel, Waschmittel, Deodorants oder Mobiltelefone lassen sich nach dem derzeitigen Kenntnisstand nicht als Ursache ausmachen. Wer ein aktives Leben führt, ohne zuzunehmen, ist in einer vorteilhaften Situation gegenüber vielen Krankheiten. Es gibt jedoch keine Informationen darüber, dass sich Übergewicht direkt auf Lymphome auswirkt. Es sollte nicht vergessen werden, dass Übergewicht ein Risikofaktor für alle Krebsarten ist.
SYMPTOME VON LYMPHDRÜSENKREBS (LYMPHOM)
Das erste, was bei den Symptomen eines Lymphoms auffällt, ist, dass der Patient normalerweise eine wachsende Masse im Körper bemerkt. Diese Masse kann in einigen Bereichen Druck ausüben. Das Lymphom äußert sich als klinisches Symptom meist durch eine pathologische Vergrößerung der Drüsen, die “Lymphknoten” genannt werden. Denn es sind vor allem die Lymphknoten, in denen die Tumormasse wächst. Daher kommt ein großer Teil der Patienten mit vergrößerten Lymphknoten im Hals-, Achsel- und Leistenbereich ins Krankenhaus. Eines der Symptome des Lymphoms ist, dass der Patient grippeähnliche Symptome zeigen kann, weil sein Immunsystem nicht ausreichend funktioniert. Bei der Grippe handelt es sich um eine Krankheit, die innerhalb von höchstens einer Woche nach ihrem Ausbruch abklingen sollte. Bei Nasennebenhöhlenentzündungen und Lungeninfektionen kann sich dieser Zeitraum noch verlängern. Hält die Infektion jedoch über Wochen an und verschlechtert sich das Infektionsbild, sollte ein Facharzt aufgesucht werden.
ARTEN VON LYMPHDRÜSENKREBS (LYMPHOM)
In den letzten Jahren wurden bei hämatologischen Krebserkrankungen sehr wichtige Fortschritte erzielt. Zu diesen Fortschritten gehören ein besseres Verständnis der biologischen Merkmale von Blutkrebs, Verbesserungen bei der Diagnose und Erfolge bei der Behandlung. Eine große Zahl von Arzneimitteln, die zur Behandlung vieler Krankheiten in der Hämatologie eingesetzt werden, haben in neuen klinischen Studien ihre Wirksamkeit unter Beweis gestellt, darunter auch Arzneimittel mit einer sehr interessanten Wirkungsweise, die auf Krebszellen abzielen.
Die häufigsten Krebserkrankungen in der Hämatologie sind Lymphome, also Lymphdrüsenkrebs. Wir unterteilen diese Erkrankungen in zwei große Gruppen: das Hodgkin-Lymphom und das Non-Hodgkin-Lymphom (englisch: Non-Hodgkin’s lymphoma). Bei den Non-Hodgkin-Lymphomen handelt es sich um eine Vielzahl von Krankheiten mit unterschiedlicher Biologie und unterschiedlichem Verlauf, deren Behandlung heute ganz andere Merkmale aufweist.
Hodgkin-Lymphom
Das Hodgkin-Lymphom ist durch eine Vergrößerung der Lymphknoten gekennzeichnet. Bei einigen Patienten treten als Symptome des Hodgkin-Lymphoms Gewichtsverlust, Nachtschweiß und wiederkehrendes Fieber auf. Zur Bestimmung des Krankheitsstadiums sind in der Regel eine Computertomographie und eine Knochenmarksbiopsie erforderlich.
Das Hodgkin-Lymphom gehört heute zu den Krebsarten mit hohen Behandlungserfolgen. In jedem Stadium zielt die Behandlung darauf ab, die Krankheit vollständig auszurotten. Weltweit gibt es einige Gruppen, die sich um die Erfassung der Entwicklungen in der Behandlung des Hodgkin-Lymphoms bemühen und groß angelegte Studien durchführen, eine davon ist die Deutsche Hodgkin-Lymphom Studiengruppe (GHSG). Sogenannte Risikofaktoren sind wichtig für die individuelle Behandlung der Krankheit. Bei Patienten im Frühstadium und ohne ungünstige Risikofaktoren reicht eine kurze Chemotherapie (ABVD) und eine Strahlentherapie aus. Ist die Krankheit jedoch bereits fortgeschritten, kann eine wesentlich wirksamere Behandlung (eskaliertes BEACOPP-Protokoll) erforderlich sein, um die Krankheit vollständig auszurotten und ein Wiederauftreten zu verhindern. Bei einem Rückfall sind eine Hochdosis-Chemotherapie und eine autologe Stammzellentransplantation in der Regel die beste Behandlungsoption, um die Krankheit vollständig zu beseitigen.
Non-Hodgkin-Lymphom
Non-Hodgkin-Lymphome werden in 3 Hauptgruppen unterteilt: indolente (langsam fortschreitende) Lymphome, aggressive (schnell fortschreitende) und sehr aggressive (sehr schnell fortschreitende) Lymphome. Prognose und Behandlung dieser Krankheiten sind sehr unterschiedlich. Die Non-Hodgkin-Lymphome werden auch hinsichtlich des immunologischen Zelltyps in 2 Gruppen unterteilt: B-Zell- und T-Zell-Lymphome. Im Allgemeinen haben T-Zell-Lymphome eine schlechtere Prognose als B-Zell-Lymphome. Daher beinhaltet die moderne Behandlung von T-Zell-Lymphomen eine intensivere und wirksamere Therapie. In der Vergangenheit wurden die meisten Non-Hodgkin-Lymphome mit einem Chemotherapieprotokoll namens CHOP behandelt, während heute wirksamere krankheitsspezifische Behandlungen angewandt werden, die je nach Untergruppe der Krankheit variieren. Einige Arten von Lymphomen können sogar mit Antibiotika ohne Chemotherapie behandelt werden. So können beispielsweise einige Arten und Stadien von Lymphomen im Magen oder im Auge durch eine antibiotische Behandlung vollständig beseitigt werden. Um die für den Patienten am besten geeignete Behandlung zu wählen, müssen die Untergruppe, das Stadium und die prognostischen Faktoren des Lymphoms genau bekannt sein. Die Wahl eines gut ausgestatteten onkologischen Zentrums ist in diesem Sinne sehr wichtig.
Die häufigsten Arten von Non-Hodgkin-Lymphomen
Langsam fortschreitende Lymphome | Schnell fortschreitende Lymphome | Sehr schnell fortschreitende Lymphome |
Follikuläres Lymphom | Diffuses großzelliges B-Zell-Lymphom | Burkitt-Lymphom |
Chronische lymphatische Leukämie | Die Mehrzahl der T-Lymphome | Lymphoblastisches B-Lymphom |
Immunozytom | Mantelzell-Lymphom | Lymphoblastisches T-Lymphom |
Langsam fortschreitende (indolente) Lymphome: Die Krankheit wird in der Regel im Stadium III oder IV diagnostiziert. Wird die Krankheit im Stadium I oder II diagnostiziert, zielt die Behandlung auf die Eradikation der Krankheit durch Strahlentherapie ab. In fortgeschrittenen Stadien wird in bestimmten Fällen eine Chemotherapie durchgeführt; wenn dies nicht erforderlich ist, wird der Patient ohne Behandlung überwacht (“wait and see” auf Englisch), da es in diesen Fällen für den Patienten nicht vorteilhaft ist, die Behandlung früher als nötig zu beginnen. Bei indolenten B-Zell-Lymphomen verstärkt ein Medikament namens Rituximab, das auf das CD20-Molekül auf B-Lymphomzellen abzielt, die Wirkung der Chemotherapie und beeinflusst die Ansprechraten und Ansprechzeiten erheblich.
Schnell fortschreitende (aggressive) Lymphome: Diffuse großzellige B-Zell-Lymphome machen einen erheblichen Anteil der aggressiven Lymphome aus. Die Behandlung besteht aus Rituximab und CHOP-Chemotherapie mit dem Ziel, die Krankheit vollständig auszurotten. Bei aggressiven T-Zell-Lymphomen erhöht die Zugabe von Etoposid zum CHOP-Protokoll (CHOEP-Protokoll) die Erfolgsrate, wie deutsche und skandinavische Studien zeigen. Da die Prognose bei den meisten aggressiven T-Zell-Lymphomen schlecht ist, spielen 6 Zyklen Chemotherapie, gefolgt von einer Hochdosis-Chemotherapie und einer autologen Stammzelltransplantation eine wichtige Rolle bei der dauerhaften Kontrolle der Krankheit.
Das Mantelzell-Lymphom ist eine aggressive Form des Lymphoms, bei der in den letzten Jahren erhebliche Fortschritte erzielt wurden. Bei jungen Patienten wird in erster Linie eine medikamentöse Behandlung verordnet. Bei jungen Patienten führen die Entnahme von Stammzellen des Patienten nach dieser Behandlung, eine Hochdosisbehandlung und eine Stammzelltransplantation zu den besten Ergebnissen. Bei älteren Patienten verlängert die Erhaltungstherapie nach der Chemotherapie die Lebenserwartung.
Sehr schnell fortschreitende Lymphome: Eine weitere Gruppe sind sehr aggressive Lymphome. Die wichtigsten davon sind das Burkitt-Lymphom und die lymphoblastischen Lymphome. Diese Lymphomarten treten meist bei jungen Patienten auf. Das Burkitt-Lymphom ist die am schnellsten fortschreitende Krebsart beim Menschen. Das Ziel der Behandlung dieser Krankheiten ist es, die Krankheit zu eliminieren. Dieses Ziel kann jedoch nicht mit einfachen Behandlungen erreicht werden. Chemotherapien, die aus einer großen Anzahl von Medikamenten bestehen und an die Leukämiebehandlung erinnern, können die Krankheit dauerhaft beseitigen.
DIAGNOSE UND BEHANDLUNG VON LYMPHOMEN
Die Behandlung von Lymphomen beginnt mit der Diagnose eines Lymphoms. Hierfür muss zunächst eine Biopsie entnommen werden. Das Lymphom kann durch die Betrachtung dieser Zellen unter dem Mikroskop diagnostiziert werden. Diese morphologische Beurteilung reicht jedoch nicht aus, um die Krankheit einzugrenzen. Für eine korrekte Diagnose sind verschiedene Tests erforderlich. Darüber hinaus gibt es spezielle Tests, die mit Hilfe spezieller Färbetechniken feststellen, um welche Art von Lymphom es sich handelt.
Genetische Tests für die Lymphom-Behandlung
Genetische Analysen werden auch an der genetischen Struktur der Zellen durchgeführt, bei denen ein Lymphom festgestellt wurde, und der Subtyp wird genau bestimmt. Dieses Ergebnis ist für den Erfolg der Lymphom-Behandlung äußerst wichtig. Nach einer endgültigen Diagnose sollte untersucht werden, ob sich die Krankheit im Körper ausgebreitet hat. Hierfür wird am häufigsten die PET-CT eingesetzt. Mit dieser Untersuchung wird gezeigt, in welchem Teil des Körpers sich das Lymphom ausgebreitet hat.
Patienten können sich in sehr unterschiedlichen Stadien zur Lymphom-Behandlung an den Arzt wenden. Im Allgemeinen wird das Lymphom je nach Häufigkeit in 4 Stadien eingeteilt. Die Lymphomstadien 1 und 2 werden als früh, die Stadien 3 und 4 als fortgeschritten bezeichnet. Nach der endgültigen Diagnose eines Lymphoms wird eine spezielle Untersuchung durchgeführt, um das Stadium der Krankheit zu bestimmen. Mit anderen Worten: Mit diesem Scoring-Verfahren lässt sich feststellen, inwieweit der Patient auf welche Behandlung ansprechen kann. Eine Reihe von Faktoren wie das Alter des Patienten, die LDH-Konzentration im Blut, die Frage, ob sich die Krankheit in einem fortgeschrittenen Stadium befindet oder nicht, und die Frage, ob außer den Lymphknoten noch andere Bereiche befallen sind oder nicht, werden zusammengeführt und ein Scoring vorgenommen. Dementsprechend werden die Patienten in ein niedriges oder hohes Risiko eingeteilt. Wenn das Risikoprofil des Patienten hoch ist, ist die Wahrscheinlichkeit, dass er von den Standard-Lymphom-Behandlungen profitiert, geringer. Daher müssen diese Patientengruppen unter Umständen schwerere Behandlungen erhalten. Ist das Risikoprofil niedrig, werden eher Standardbehandlungen bevorzugt.
Chemotherapie in der Lymphom-Behandlung
Die Chemotherapie nimmt einen wichtigen Platz
in der Behandlung von Lymphomen ein. Wie und in welcher Form die Chemotherapie angewendet wird, hängt vom Zustand der Erkrankung ab. Neben den standardmäßigen, d. h. ambulanten medikamentösen Methoden wird bei Hochrisikopatienten eine Hochdosis-Chemotherapie angewandt, die stationär durchgeführt wird. Die Chemotherapie-Intervalle bei der Lymphom-Behandlung betragen in der Regel 3 bis 4 Wochen, ein definitives Ergebnis wird nach 6 Zyklen erwartet. Während dieses Zeitraums wird das Ansprechen auch mit Zwischenbewertungen beobachtet. Diese Nachuntersuchungen werden nach dem zweiten oder dritten Zyklus durchgeführt.
Die Chemotherapie ist eine der am häufigsten eingesetzten Behandlungsmethoden bei Blutkrebs, insbesondere bei Lymphomen. Für jede Krankheit werden unterschiedliche Medikamentenkombinationen verwendet. Die Intensität der Medikamente steigt auch über die Normen hinaus und wenn hohe Dosen verabreicht werden. Da diese Medikamente auch gesunde Zellen schädigen, können Probleme wie Haarausfall nach der Behandlung, Störungen im Magen-Darm-System, Wunden im Mund, Appetitlosigkeit, Gewichtsverlust, Schwäche und zwischenzeitliche schwere Infektionen auftreten, die bei vielen klassischen Chemotherapien zu beobachten sind. Da die Komplikationen, die bei dieser Art von Behandlung auftreten können, im Voraus absehbar sind, werden die notwendigen Vorsichtsmaßnahmen getroffen und es wird versucht, dass der Patient die Behandlungszeit möglichst risikofrei übersteht. Neben der Chemotherapie wird bei der Behandlung von Lymphomen manchmal auch eine Strahlentherapie eingesetzt. In Fällen, in denen die Krankheit weit verbreitet ist, kann die Strahlentherapie eingesetzt werden, um die Kompression zu lindern, die durch stark vergrößerte Lymphknoten in jedem Gebiet verursacht werden kann, obwohl sie nicht zur Behandlung der Krankheit gedacht ist.
Immuntherapie erhöht den Behandlungserfolg bei Lymphomen!
Neben der Chemotherapie ist die Immuntherapie eine der Behandlungen, die bei der Behandlung von Lymphomen häufig eingesetzt oder mit der Chemotherapie kombiniert wird. Zur Behandlung werden häufig so genannte “monoklonale Antikörper” eingesetzt, die für die Krebszelle entwickelt wurden. Diese Medikamente zeichnen sich dadurch aus, dass sie sich an die Lymphomzellen heften und dann das Immunsystem aktivieren und es dadurch zerstören. Bei der Behandlung von Lymphomen gibt es “monoklonale Antikörper”-Therapien, die zusammen mit einer Chemotherapie eingesetzt werden und sich je nach Art des Lymphoms unterscheiden. Solche Behandlungen erhöhen die Erfolgsaussichten.
Lymphom-Medikamente
Behandlungen für Lymphome gibt es schon seit 10-20 Jahren, aber in den letzten 10 Jahren haben sie an Bedeutung und Anerkennung gewonnen. Zielgerichtete Therapien sind heute nicht mehr auf “monoklonale Antikörper” beschränkt. Eine Reihe anderer Medikamente und Moleküle, die keine monoklonalen Antikörper sind, wurden ebenfalls entwickelt. Diese werden als “zielgerichtete” oder “intelligente Medikamente” bezeichnet. Dank der intelligenten Medikamente stören die zielgerichteten Moleküle bestimmte Mechanismen, die in Krebszellen, nicht aber in gesunden Zellen vorhanden sind. Daher werden bei der Verabreichung der Medikamente an den Patienten die Krebszellen sehr stark angegriffen, während die gesunden Zellen nur minimal betroffen sind. Die
Nebenwirkungen von Medikamenten, die bei zielgerichteten Therapien eingesetzt werden, sind nie die gleichen wie die Nebenwirkungen
klassischer Chemotherapeutika. Bei fast allen Patienten treten Probleme wie Haarausfall, Übelkeit, Erbrechen und Appetitlosigkeit nicht auf. Leichte und gut kontrollierbare Nebenwirkungen werden von den Patienten ebenfalls toleriert.
Die wirksamste Behandlungsoption bei Lymphomen: Knochenmarkstransplantation
Die Knochenmark- oder Stammzellentransplantation wird häufig zur Behandlung von Lymphomen eingesetzt. Es gibt zwei Arten von Knochenmarkstransplantationen: die autologe, die aus den eigenen Stammzellen des Patienten durchgeführt wird, und die allogene, bei der die Stammzellen eines anderen Menschen verwendet werden. Die Ziele der beiden Arten sind unterschiedlich. Im Allgemeinen ist der Hauptzweck der Knochenmark- oder Stammzellentransplantation der folgende: Die Knochenmark- oder Stammzellentransplantation ist keine Erstbehandlung. Eine Knochenmarktransplantation zur Behandlung von Lymphomen kann nicht sofort nach der Diagnose durchgeführt werden. Bei der Behandlung von Lymphomen werden zunächst Chemo-, Immun- und Strahlentherapie eingesetzt, um die Krankheit zu beseitigen oder zu unterdrücken, und dann wird je nach Ansprechen eine Transplantation durchgeführt, wenn dies für notwendig erachtet wird. Bei einigen Krankheiten kommt es selbst bei erfolgreicher Standardbehandlung im Anfangsstadium nach einiger Zeit wahrscheinlich zu einem Rückfall der Krankheit. Bei solchen Patienten wird eine Stammzelltransplantation durchgeführt, um das Risiko eines Rückfalls zu minimieren.
Lymphkrebs Lymphom-Behandlung: Autologe Stammzellentransplantation
Selbst wenn die Krankheit mit der Standardbehandlung ausgerottet wird, bleiben unsichtbare mikroskopisch kleine Krebszellen zurück, die mit einer sehr hoch dosierten Chemotherapie zerstört werden müssen. Diese Behandlung beeinträchtigt auch das Knochenmark, das Blutzellen herstellt. Aus diesem Grund werden vor der Lymphom-Behandlung die körpereigenen Stammzellen des Patienten mit verschiedenen Methoden entnommen und nach speziellen Verfahren in einer Kryokonservierung gelagert. Anschließend erhält der Patient eine sehr hoch dosierte Chemotherapie. Nach Beendigung der Behandlung werden dem Patienten die zuvor eingelagerten eigenen Knochenmarkzellen transplantiert. Diese Zellen siedeln sich im Knochenmark an, vermehren sich dort und beginnen, Blut zu produzieren. Mit anderen Worten: Es wird ein Bypass durchgeführt und diese Zellen werden gerettet. Eine autologe Transplantation ist jedoch nicht immer möglich. Da Patienten mit Knochenmarkbeteiligung kein eigenes Knochenmark transplantiert werden kann, werden zunächst Geschwister oder Eltern mit einer 25-prozentigen Übereinstimmungschance und, falls erforderlich, eine Knochenmarkbank konsultiert.
MORAL IST BEI LYMPHDRÜSENKREBS SEHR WICHTIG
Die Moral ist auch für den Arzt wichtig, da die positive Einstellung des Patienten und sein Glaube an eine Heilung die Behandlung des Lymphoms unterstützen. Die Moral allein ist zwar kein wirksames Mittel zur Überwindung des Lymphoms, aber sie sorgt dafür, dass der Patient die Behandlung einhält. Je mehr sich der Patient an die Lymphom-Behandlung hält und je mehr er/sie an seine/ihre Genesung und sein/ihr Überleben glaubt, desto größer ist natürlich die Chance auf Erfolg.
HÄUFIG GESTELLTE FRAGEN ZU LYMPHOMKREBS
Sind Gewichtsverlust und nächtliches Schwitzen ein Zeichen für Lymphdrüsenkrebs?
Geschwollene Lymphknoten, ein Symptom des Lymphoms, können auch in der Brust- oder Bauchhöhle zu finden sein.
Die Größe der Masse ist möglicherweise nicht direkt spürbar. Der dadurch entstehende Druck kann jedoch bei den Patienten Beschwerden verursachen. Eine Lymphvergrößerung im Brustkorb kann Brustschmerzen, trockenen Husten und Kurzatmigkeit verursachen. Eine wachsende Masse in der Bauchregion beeinträchtigt die Funktion des Magen-Darm-Systems. Unterleibsschmerzen, Durchfall, Verstopfung und Verdauungsstörungen sind ebenfalls Symptome eines Lymphoms. Einige Patienten können auch Beschwerden im Zusammenhang mit den systemischen Auswirkungen des Krebses wie Fieber, Gewichtsverlust und Nachtschweiß haben. Besteht ein klinischer Verdacht auf ein Lymphom, wenn sich der Patient mit diesen Symptomen vorstellt, wird er untersucht, um festzustellen, ob eine wachsende und nachweisbare Masse vorhanden ist. Der Körper des Patienten sollte mit bildgebenden Verfahren auf eine Masse oder Läsion untersucht werden. Ein Lymphom tritt jedoch nicht nur bei vergrößerten Lymphknoten auf. Es kann auch die Leber, die Milz, den Magen-Darm-Trakt und die Lunge befallen. Es kann zu einer Organbeteiligung kommen. Auch das Knochenmark kann von diesen Krankheiten betroffen sein. Denn jedes Gewebe im Körper kann von einem Lymphom betroffen sein.
Symptome des Lymphoms: Allergischer Husten, Asthmaanfälle und Nasennebenhöhlenentzündung können ebenfalls auftreten. Denn keines der Symptome und Anzeichen eines Lymphoms ist einzigartig für diese Krankheit. Die gleichen Symptome können auch bei vielen anderen Krankheiten auftreten. Manchmal können die Symptome von Lymphomen auch denen von rheumatischen Erkrankungen ähneln. Der Patient kann sich mit rheumatischen Beschwerden ins Krankenhaus begeben, und die Situation kann bei den Untersuchungen aufgedeckt werden. Kurz gesagt, ein Lymphom kann jede Krankheit imitieren. Daher sollten die Symptome von Lymphomen berücksichtigt werden.
Eines der Symptome eines Lymphoms ist die Vergrößerung einer der Mandeln und nicht die Schwellung beider Mandeln. Eine asymmetrische Vergrößerung birgt ein höheres Risiko für ein Lymphom. Die Tonsille ist eigentlich ein lymphatisches Gewebe. Wie die Lymphdrüse ist sie ein lymphatisches Gewebe, das sich im inneren Teil des Mundes, des Rachens und eines Organs dieses Systems befindet. Es kann diesen Bereich halten und Wachstum verursachen. Da die Vergrößerung der Mandeln in erster Linie auf eine Infektion hindeutet, erhält der Patient eine Infektionsbehandlung. Tritt trotz der medikamentösen Behandlung in einem Zeitraum von z. B. 10 Tagen keine Besserung ein, sollte nach anderen Ursachen gesucht werden.
Kann der Körper des Patienten die Stammzellen eines anderen Menschen abstoßen?
Die allogene Transplantation, d. h. die Transplantation von Stammzellen, die von einer anderen Person stammen, hat einige Vor- und Nachteile. Obwohl die Grundphilosophie im Vergleich zur autologen Transplantation die gleiche zu sein scheint, können bei der Transplantation von Zellen einer fremden Person die eigenen Gewebe und Organe des Patienten aufgrund von unerkannten Gewebeunverträglichkeiten geschädigt werden, selbst wenn die Gewebeverträglichkeit vollständig ist. Transplantierte Abwehrzellen eines Spenders können das Gewebe des Patienten als fremd wahrnehmen und die Organe schädigen. Dies kann das Leben des Patienten bedrohen. Um dies zu verhindern, müssen über einen langen Zeitraum immunsuppressive Medikamente eingenommen werden. Die Patienten müssen auch mit den Nebenwirkungen dieser Medikamente zurechtkommen. Das Gute an Knochenmarkzellen, die von einer anderen Person entnommen werden, ist, dass diese Lymphoidzellen auch Krebszellen im Patienten erkennen und zerstören können. Deshalb werden bei allogenen Transplantationen eine Reihe von Feinabstimmungen mit diesen Zellen und Medikamenten vorgenommen, um sicherzustellen, dass die transplantierten Zellen die Krebszellen des Patienten zerstören, aber auch um ihre schädlichen Auswirkungen auf den Patienten so weit wie möglich zu verhindern. Wenn dieses Gleichgewicht gut gelingt, verringert sich die Wahrscheinlichkeit eines erneuten Auftretens der Krankheit bei einer sehr erfolgreichen allogenen Transplantation.
Wie hoch ist die Lebenserwartung bei Lymphomen?
Der klinische Verlauf von Lymphomen wird in einen schnellen und einen langsamen unterteilt. Lymphome mit schnellem Verlauf treten in sehr kurzer Zeit auf. Die Masse wächst in sehr kurzer Zeit und kann sich innerhalb von Monaten oder sogar Wochen manifestieren. Bei den langsam verlaufenden Lymphomen wächst die Masse nur sehr langsam. Sie kann sich über einen Zeitraum von Monaten oder sogar Jahren erstrecken. Die Lebenserwartung bei Lymphomen ist ebenfalls unterschiedlich. Wenn schnell fortschreitende Lymphome nicht behandelt werden, kann der Patient innerhalb von Monaten oder Wochen sterben. Bei langsam verlaufenden Lymphomen kann der Patient auch ohne Behandlung noch lange leben, sogar 15-20 Jahre. Aus diesem Grund ist auch der Behandlungsansatz für die Patienten der beiden Lymphomgruppen unterschiedlich. Da es nicht möglich ist, mit schnell fortschreitenden Lymphomen zusammenzuleben, sollte das Ziel darin bestehen, die Krankheit zu beseitigen und eine vollständige Genesung zu erreichen. Bei denjenigen mit einem langsamen Verlauf ist eine regelmäßige Nachsorge oft ausreichend.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST BRUSTKREBS?
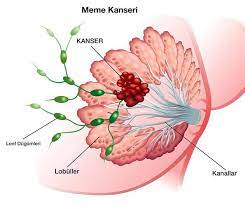
Brustkrebs wird durch die unkontrollierte Vermehrung von milchbildenden Zellen verursacht, die den Milchkanal im Brustgewebe bilden. Brustkrebs ist für 33 % aller Krebserkrankungen bei Frauen verantwortlich. Er bedroht 20 % aller Krebspatienten. Heute lebt 1 von 8 Frauen mit dem Risiko, im Laufe ihres Lebens an Brustkrebs zu erkranken.
Brustkrebs sind Krebszellen, die sich in den Milchgängen des Brustgewebes bilden. 80 Prozent der Brustkrebsfälle sind invasive duktale Karzinome. Invasives duktales Karzinom bedeutet, dass der Brustkrebs in den Milchgängen entsteht. Weitere 20 Prozent der Brustkrebsfälle sind invasive lobuläre Karzinome. Bei diesem Typ entwickelt sich der Brustkrebs in den Milchdrüsen und nicht in den Milchgängen. Die Zellen, die Brustkrebs verursachen, brauchen viel Zeit, um sich zu vermehren und zu wachsen. Wenn sie sich jedoch einmal vermehrt haben, können die Zellen über die Lymphe und das Blut auf andere Organe des Körpers übergreifen. Das Wichtigste bei Brustkrebs ist, den Krebs zu diagnostizieren, bevor er sich über Blut und Lymphe auf andere Organe ausbreitet. Die Heilungsrate ist sehr hoch, wenn die Diagnose in diesem Stadium gestellt wird. Daher ist die Frühdiagnose bei Brustkrebs sehr wichtig.
Bei Brustkrebs, bei dem eine frühzeitige Diagnose den Fortbestand eines gesunden Lebens sichert, ist es sehr wichtig festzustellen, ob sich Brustkrebszellen in die Lymphknoten ausgebreitet haben. Die Lymphknoten, die ein wichtiges Kriterium für den Verlauf dieser Krankheit sind, stellen eine Situation dar, in der sich eine in der Struktur der Brust gebildete Krebszelle ausbreitet. Diese Ausbreitung kann dazu führen, dass sich die Krebszellen auf verschiedene innere Organe ausbreiten, und die Schwere der Erkrankung kann zu negativen Zuckungen führen.
WAS VERURSACHT BRUSTKREBS?
Brustkrebs ist bei Männern im Vergleich zu Frauen sehr selten. Wenn die Krankheit jedoch auftritt, kann die Prognose schneller und schlechter sein als bei Frauen. Einer von 100 Brustkrebsfällen tritt bei Männern auf. Obwohl die Ursache von Brustkrebs nicht genau bekannt ist, können viele Faktoren wie Vererbung, Ernährung, sozioökonomischer Status, Menstruationsstatus, Geburten und Antibabypillen genannt werden.
Die Inzidenz von Brustkrebs nimmt mit dem Alter zu. Das Risiko, an Brustkrebs zu erkranken, der in der Altersgruppe der 50- bis 70-Jährigen am häufigsten vorkommt, steigt, wenn Brustkrebs in der Familie vorkommt. Wenn Brustkrebs bei der Mutter oder Schwester auftritt, erhöht sich das Risiko der Erkrankung um das Dreifache. Aus diesem Grund sollten Personen mit einer familiären Vorgeschichte von Brustkrebs regelmäßig Kontrollen durchführen lassen, insbesondere nach dem 40. Lebensjahr. Menschen mit Mutationen in den Genen BRCA1 und BRCA2 haben ein hohes Risiko, sowohl an Brust- als auch an Eierstockkrebs zu erkranken. Die Einnahme von Hormonpräparaten während der Menopause für mehr als 5 Jahre ist ebenfalls einer der Faktoren, die das Brustkrebsrisiko erhöhen.
WAS SIND DIE RISIKOFAKTOREN FÜR BRUSTKREBS? WER ERKRANKT?
Die wichtigsten Risikofaktoren für Brustkrebs sind Risikofaktoren, die wir nicht ändern können. Insbesondere das Vorhandensein von Brustkrebs in der Familiengeschichte ist einer der wichtigsten Risikofaktoren für Brustkrebs. Brustkrebs bei einer Verwandten ersten Grades vor dem 50. Lebensjahr erhöht das Risiko, an Brustkrebs zu erkranken, um das Dreifache. Brustkrebs bei Verwandten zweiten Grades ist ebenfalls ein wichtiger Risikofaktor für Brustkrebs. Darüber hinaus ist das Risiko umso höher, je mehr Personen in der Familie an Brustkrebs erkrankt sind und je früher die Diagnose gestellt wird. Ein weiterer wichtiger Risikofaktor für Brustkrebs ist dichtes Brustgewebe. Das Brustkrebsrisiko steigt bei Menschen mit weniger Fett im Brustgewebe. Die Dichte des Brustgewebes kann mit mammographischen und sonographischen Methoden gemessen werden. Eine Strahlentherapie, insbesondere bei Lymphompatienten, gehört ebenfalls zu den Risikofaktoren für Brustkrebs. Aus diesem Grund wird empfohlen, dass Patientinnen, die eine Strahlentherapie erhalten, insbesondere Lymphompatientinnen, nach der Behandlung häufig und lebenslang zu Kontrolluntersuchungen gehen sollten.
Auch die frühe Menstruation, die als Risikofaktor für Brustkrebs bei Frauen gilt, sollte in Betracht gezogen werden. Vor allem Frauen, die vor dem 11. Lebensjahr menstruieren, und Frauen, die erst spät in die Wechseljahre kommen, gelten als stärker brustkrebsgefährdet. Auch das Nichtstillen oder eine erste Schwangerschaft nach dem 30. Lebensjahr, übermäßiger Alkoholkonsum und Übergewicht zählen zu den Risikofaktoren für Brustkrebs. Darüber hinaus erhöht das Hormon Östrogen, das vor allem nach der Menopause eingesetzt wird, um die Auswirkungen der Wechseljahre zu mildern, das Brustkrebsrisiko um das 1,5-fache.
Weitere Risikofaktoren für Brustkrebs können wie folgt aufgelistet werden:
- Eine Frau zu sein ist der Risikofaktor ersten Grades für Brustkrebs.
- Menschen, in deren Familie Brustkrebs vorkommt, haben ein höheres Risiko, an Brustkrebs zu erkranken, als andere Menschen.
- Das Risiko, an Brustkrebs zu erkranken, steigt mit zunehmendem Alter.
- Bei weißhäutigen Frauen ist das Risiko um 20 Prozent höher als bei dunkelhäutigen Frauen.
- 5-10 % der Fälle von Brustkrebs sind genetisch bedingt. Er entsteht durch einen Gendefekt (Mutation), der in der Familie weitergegeben wird. Die häufigste Ursache für genetisch bedingten Brustkrebs ist eine Genmutation in den Genen BRCA1 und BRCA2. Das Risiko für Familienmitglieder mit BRCA-Mutation liegt bei 80 Prozent.
- Eine Strahlentherapie vor dem 15. Lebensjahr erhöht das Risiko, im Alter von 40 Jahren an Brustkrebs zu erkranken, um 35 %.
- 2/3 der Frauen im Alter von 55 Jahren und älter haben Brustkrebs, der sich bereits ausgebreitet hat.
- Faktoren wie das Alter oder der Lebensstil können das Brustkrebsrisiko im Laufe der Zeit verändern.
- Langfristiges übermäßiges Rauchen erhöht nachweislich das Risiko von Brustkrebs.
- Eine sitzende Lebensweise ohne körperliche Aktivität und regelmäßigen Sport erhöht das Brustkrebsrisiko.
- Fettleibigkeit verdoppelt das Brustkrebsrisiko bei Frauen im gebärfähigen Alter.
- Bei Personen, in deren Familie Brustkrebs vorkommt, kann die Einnahme der Antibabypille das Krebsrisiko um das Dreifache erhöhen.
WAS KANN MAN TUN, UM BRUSTKREBS VORZUBEUGEN?
Brustkrebs kann nicht vollständig verhindert werden. Die Häufigkeit des Auftretens kann durch veränderbare Faktoren wie den Verzicht auf Rauchen und Alkohol, eine gesunde Ernährung und sportliche Betätigung verringert werden.
WELCHE ARTEN VON BRUSTKREBS GIBT ES?
Die Arten von Brustkrebs werden durch die pathologische Untersuchung des durch Biopsie entnommenen Gewebes bestimmt. Obwohl es viele Arten von Brustkrebs gibt, wird er im Allgemeinen unter zwei verschiedenen Überschriften bewertet:
- Duktales Karzinom, das in den Zellen entsteht, die die Brustkanäle bilden
- Lobuläres Karzinom der Milchdrüsen in der Brust
Duktale und lobuläre Karzinome werden in nicht-invasive/in situ Tumore, die nicht streuen, und invasive Tumore, die streuen, unterteilt.
Was sind die Unterschiede zwischen nicht-invasiven und invasiven Krebsarten?
Krebs wird auf zwei Arten klassifiziert. Krebsarten, die als invasiv und nichtinvasiv eingestuft werden, unterscheiden sich voneinander. Krebsarten, die in dem Gewebe verbleiben, in dem sie sich im Anfangsstadium gebildet haben, und sich nicht im Körper ausbreiten, werden als nichtinvasiver Krebs bezeichnet. Invasiver Krebs verbleibt im Gegensatz zu nicht-invasivem Krebs nicht in dem Gewebe, in dem er im Anfangsstadium entstanden ist, und breitet sich aus. Brustkrebs entwickelt sich häufig in den milchproduzierenden Drüsen oder den Milchkanälen. Wird keine Ausbreitung in den Läppchen, Milchdrüsen oder Milchgängen beobachtet, gilt der Krebs als nicht invasiv. Auch wenn sich ein nicht invasiver Krebs im Anfangsstadium nicht ausbreitet, kann er sich im Laufe der Zeit zu einem invasiven Krebs entwickeln. Gleichzeitig erfordert ein nicht invasiver Krebs, der ein hohes Rückfallrisiko hat, eine langfristige Kontrolle und Beobachtung. Invasiver Krebs bleibt nicht in dem Gewebe, in dem er sich entwickelt, sondern breitet sich auf große Gebiete aus, wodurch der Krebs Metastasen bildet und das Risiko einer lebensbedrohlichen Erkrankung steigt. Nach der Ausbreitung lagern sich die Krebszellen an einer anderen Stelle als der ursprünglichen Tumorstelle an und können zur Bildung eines Sekundärtumors führen. Wie bei allen Krebsarten ist auch bei Brustkrebs eine frühzeitige Diagnose sehr wichtig. Regelmäßige monatliche Brustuntersuchungen für alle Frauen ab dem 20. Lebensjahr verringern das Risiko, in der Zukunft an Brustkrebs zu erkranken. Dank der frühzeitigen Diagnose wird der Verlauf des Krebses bestimmt und die Behandlungsmodalitäten werden von spezialisierten Ärzten individuell angewandt. Methoden wie Immuntherapie, Chemotherapie, Hormontherapie, Bestrahlung, Operation und gezielte medikamentöse Therapie bieten Optionen gegen nicht invasive und invasive Krebsarten.
Duktales Karzinom In Situ
Es handelt sich um eine Krebsart, die bei der manuellen Untersuchung nicht erkannt werden kann und sich bei der Mammographie durch unregelmäßige Strukturen und Verkalkungen bemerkbar macht. Bei dieser Krankheit kann es auch zu Ausfluss aus der Brustwarze kommen.
Lobuläres Karzinom in situ
Es handelt sich um eine wichtige Erkrankung, die das Krebsrisiko in beiden Brüsten um das 8-10fache erhöht. Patientinnen mit dieser Erkrankung werden regelmäßig kontrolliert und engmaschig überwacht. Gleichzeitig erhält die Patientin auch vorbeugende Medikamente.
Bei einigen Patientinnen können Verfahren wie die Entfernung beider Brüste und die Entnahme von Brustgewebe zu Schutzzwecken durchgeführt werden. Chirurgische Eingriffe wie Prothesen und Brustrekonstruktionen, die durchgeführt werden, um kosmetische Probleme zu vermeiden, tragen ebenfalls positiv zum sozialen Leben der Patientinnen bei. Bis vor 10 Jahren konnte Brustkrebs nur in 2 Gruppen eingeteilt werden, heute wird er in 4 verschiedene Untergruppen eingeteilt. Darüber hinaus wurden verschiedene Behandlungsstrategien und tumorspezifische Behandlungsmethoden entwickelt. Während bis vor 10 Jahren Brustkrebs nur in 2 Gruppen eingeteilt werden konnte, wird er heute in 4 verschiedene Untergruppen eingeteilt. Darüber hinaus wurden individuelle und tumorspezifische Behandlungsmethoden mit unterschiedlichen Behandlungsstrategien entwickelt.
Invasives (invasives) Karzinom
Von invasivem Krebs spricht man, wenn sich der Krebs weiter ausbreitet als die oberste Zellschicht, die den Ausgangspunkt des Krebses darstellt. Die meisten Brustkrebse sind invasive Karzinome. Unter den invasiven Karzinomen ist das duktale Karzinom, das aus den Zellen der Brustdrüsen entsteht, die häufigste Form von Brustkrebs.
Entzündlicher Brustkrebs
Er gilt als die schnellste und prognostisch schlechteste Form von Brustkrebs. Die Symptome ähneln denen von entzündlichen Erkrankungen, die die Brust vollständig umschließen. Es treten keine massiven Symptome auf, und manchmal kann es nur zu Symptomen wie Rötung und Steifheit kommen. Bei Brusterkrankungen, die sich trotz Antibiotikabehandlung nicht bessern, sollte untersucht werden, ob eine Krebserkrankung zugrunde liegt, und es sollten die erforderlichen Untersuchungen durchgeführt werden, wobei bis zum Beweis des Gegenteils davon ausgegangen wird, dass die Patientin Krebs hat.
WAS SIND DIE SYMPTOME VON BRUSTKREBS?
Die Kenntnis der Symptome von Brustkrebs ist sehr wichtig, um Brustkrebs in einem frühen Stadium zu erkennen und erfolgreich zu behandeln. Das wichtigste Symptom von Brustkrebs ist eine tastbare Masse in der Brust. Die tastbare Masse kann sich sowohl in der Achselhöhle als auch in der Brust befinden. Wenn die Masse vergrößert ist, ist auch ein Einziehen der Brustwarze ein Symptom für Brustkrebs. Obwohl es sehr selten vorkommt, kann auch blutiger oder unblutiger Ausfluss aus der Brustwarze auf Brustkrebs hinweisen. Wenn der Tumor, der den Brustkrebs verursacht, sehr groß wird, kommt es zu Ödemen in der Brusthaut, die sich durch Schwellungen bemerkbar machen. Gleichzeitig gehören Rötungen und Orangenhaut zu den Symptomen von Brustkrebs. Wenn der Brustkrebs gestreut hat, können auch Beschwerden an der Stelle auftreten, an der er sich ausgebreitet hat. Das Bewusstsein für Brustkrebssymptome ist sehr wichtig, um das Fortschreiten von Brustkrebs zu verhindern. Aus diesem Grund ist es notwendig, die eigene Bruststruktur zu erkennen und die Risikofaktoren zu kennen. Um die Symptome von Brustkrebs zu erkennen, sollte jede Frau ab dem 20. Lebensjahr mit der Brustselbstuntersuchung beginnen. Lebensjahr mit der Brustselbstuntersuchung beginnen. Die Brustselbstuntersuchung sollte 5-7 Tage nach dem Ende der Menstruation durchgeführt werden; Frauen, die nicht menstruieren, sollten sich einmal im Monat untersuchen lassen.
Die Symptome von Brustkrebs sind im Folgenden aufgeführt:
- Tastbare Schwellungen in der Brust, die meist schmerzlos, hart, beweglich oder unbeweglich sind und mit der Zeit wachsen können.
- Sichtbare Veränderung der Brustgröße oder -form, Brustdeformität,
- Rötung, Blutergüsse, Wunden, Gefäßerweiterung, Eindrücken, diffuse kleine Schwellungen, punktuelle Einbuchtungen wie Orangenschalen auf der Brusthaut.
- Veränderungen der Farbe und Form der Brustwarze und ihrer Umgebung, Vergrößerung, Abflachung, Einfallen, Richtungsänderung, Verkrustung, Risse und Wunden an der Brustwarze.
- Blutiger oder blutloser Ausfluss aus der Brustwarze, Ausfluss aus der Brustwarze,
- Schmerzhafte oder schmerzlose Schwellungen, die in der Achselhöhle zu sehen und mit der Hand zu erkennen sind.
Vergessen Sie jedoch nicht, dass das Vorhandensein eines Risikofaktors nicht bedeutet, dass Sie die Krankheit entwickeln werden.
DIAGNOSE BRUSTKREBS
Die Früherkennung von Brustkrebs ist sehr wichtig. Jede Frau sollte ihre Brust ab dem 20. Lebensjahr kennen lernen, sich regelmäßig monatlich untersuchen lassen und ab dem 40. Lebensjahr eine Kontrollmammographie durchführen lassen. 8 von 10 Knoten in der Brust sind gutartig, das heißt, sie sind nicht krebsartig.
Bei früh diagnostiziertem Brustkrebs ist sowohl die Behandlung sehr einfach als auch die Erfolgschance sehr hoch. Bei Brustkrebs im Stadium 0 beispielsweise liegt die Erfolgschance und die Wahrscheinlichkeit, dass die Krankheit nicht wieder auftritt, bei 96 %. Im Stadium I liegt die Erfolgsquote bei 93 Prozent und im Stadium II bei 85 Prozent. Je früher die Krankheit diagnostiziert wird, desto höher ist die Erfolgswahrscheinlichkeit. Zur Früherkennung sollte jede Frau ab dem 20. Lebensjahr einmal im Monat eine Brustselbstuntersuchung vor dem Spiegel durchführen. Zwischen dem 35. und 40. Lebensjahr sollten Frauen ihren ersten Brust-Ultraschall durchführen lassen und ab dem 40. Lebensjahr einmal jährlich eine Mammographie.
Acht von 10 Massen, die bei der Brustkrebsdiagnose festgestellt werden, sind gutartig. Bei den meisten handelt es sich um nicht krebsartige Wucherungen, sogenannte Fibroadenome oder Zysten, die in jungen Jahren auftreten, und um fibrozystische Wucherungen, die im mittleren Alter auftreten. Die Tatsache, dass die Masse in der Brust schmerzhaft oder schmerzlos ist, bedeutet nicht, dass es sich um Krebs handelt. Es ist jedoch unbedingt notwendig, abzuklären, was eine andere Struktur oder Masse, die in der Brust tastbar ist, ist, und einen Arzt aufzusuchen, wenn die Masse bemerkt wird. In den letzten Jahren haben Kampagnen zur Förderung der sozialen Verantwortung und Sensibilisierungsprogramme zur Aufklärung der Gesellschaft über Brustkrebs auf die Bedeutung der Selbstuntersuchung der Brust für die Früherkennung von Brustkrebs hingewiesen.
MAMMOGRAPHIE UND TOMOSYNTHESE-MAMMOGRAPHIE: Digitale Mammographie- und Tomosynthesegeräte werden in Brustkrebsdiagnose- und Screening-Programmen eingesetzt. Bei der Tomosynthese handelt es sich um eine Technologie, bei der Röntgenstrahlen mit geringer Dosis eingesetzt und hochauflösende Bilder gewonnen werden. Dank der Mammographie-Technologien kann Brustkrebs in einem frühen Stadium diagnostiziert und eine entsprechende Behandlungsplanung vorgenommen werden.
USG: Dabei handelt es sich um ein bildgebendes System mit fortschrittlicher technologischer Infrastruktur, das das Brustgewebe mit Hilfe von Schallwellen untersucht, um Krebszellen in der Brust zu erkennen. Dieses System, das keine Vorbereitung vor der Ultraschalluntersuchung erfordert, enthält auch keine Strahlung. Dieses System, das zur Erkennung von Brustkrebs eingesetzt wird, zeigt auch, ob es sich um eine feste oder flüssige Masse handelt. Es ist auch als das bildgebende System bekannt, das häufig in allen Altersgruppen bei der Untersuchung von Anomalien im Brustgewebe eingesetzt wird. Die Ergebnisse liegen kurz nach der Untersuchung vor.
MR: Die Magnetresonanztomographie oder MR ist eines der bevorzugten bildgebenden Verfahren bei Brustkrebsuntersuchungen. Bei Weichteiluntersuchungen wird eine medikamentengestützte Bildgebung durchgeführt. Diese Bildgebungstechnik wird bei Nierenpatienten wegen der medikamentösen Begleitung nicht eingesetzt. Nachdem das Gerät in der Mitte platziert wurde, werden die Brüste in dem Bereich platziert, der durch eine Art Draht aus Platin, die so genannte Spule, definiert ist. Dieses Gerät, das einen starken magnetischen Unterbau hat, erfordert möglicherweise bequeme Kleidung vor der MRT. Halsketten, Ohrringe, Armbänder, Uhren usw. sollten vor der Untersuchung abgelegt werden. Der ideale Zeitpunkt für die Untersuchung des Brustgewebes bei Frauen ist 7 bis 10 Tage vor dem Menstruationszyklus. Diese Aufnahmen können etwa 40 Minuten bis 1 Stunde dauern. Nach der Bildgebung wird empfohlen, viel Wasser zu trinken, da die MRT mit Medikamenten durchgeführt wird. Durch die Einnahme von Wasser soll die Wirkung des Medikaments gebrochen und diese Stoffe aus dem Körper entfernt werden. Je nach der Intensität der Gesundheitseinrichtungen können die Ergebnisse in kurzer Zeit vorliegen. Die Krankenhäuser der Memorial Health Group verwenden 1,5-Tesla-MRT und 3-Tesla-MRT.
PET-CT: PET-CT, eines der fortschrittlichsten bildgebenden Verfahren, kann als die wertvollste radiologische Methode bezeichnet werden, die im Krebsstadium eingesetzt wird, z. B. zum Nachweis von Krebszellen und zur Bestimmung von Behandlungsmethoden. Es ist auch notwendig, um festzustellen, ob die krebsverursachende Masse gutartig oder bösartig ist. Die Größe des Tumors erleichtert die Ausbreitung des Krebses im Körper. Dies ist sehr wichtig für die Bestimmung des Risikoverhältnisses und die Ermittlung der Prävalenz der Krankheit.
Vor der PET-CT-Untersuchung sind einige Vorbereitungen erforderlich. Zu Beginn dieser Vorbereitungen sollte die Nahrungsaufnahme für einen Zeitraum von 6 bis 8 Stunden vor der Untersuchung eingestellt werden.
Brust-Szintigraphie: Die Szintigrafie ist eine schmerzfreie, zuverlässige Untersuchungsmethode mit minimalen Nebenwirkungen und Allergien. Kleine Mengen radioaktiver Substanzen werden oral, intravenös usw. verabreicht. Mit Hilfe der Szintigraphie lässt sich die Ausbreitung von Krebsherden auf verschiedene Organe beurteilen. Bei Brustkrebs dient sie der Erkennung von Wächterlymphknoten und der Entfernung dieser Knoten. Medikamente, die vor der Szintigraphie gegen verschiedene Krankheiten eingenommen wurden, können mit Zustimmung des Arztes abgesetzt werden. Die Aufnahmen sollten in einem nüchternen Zustand von mindestens 6 Stunden durchgeführt werden. Es ist wichtig, dass Sie während der Aufnahmen, die etwa 30 Minuten dauern, ruhig liegen bleiben. Kittel, Kleidung, etc. müssen nicht gewechselt werden.
METHODEN DER FRÜHDIAGNOSE BEI BRUSTKREBS
- Selbstuntersuchung der Brüste
- Jährliche Mammographie
- Ärztliche Untersuchung
- Genetische Tests
Die Brustuntersuchung ist sehr wichtig, um Brustkrebs vorzubeugen und ihn in einem frühen Stadium zu erkennen. Wenn Brustkrebs als kleine Masse in der Brust erkannt wird, kann er mit fast 100 %igem Erfolg behandelt werden. Ein weiteres Merkmal, das Brustkrebs von anderen Krebsarten unterscheidet, ist, dass er im Rahmen von “Krebsvorsorgeprogrammen” untersucht werden kann. Aus diesem Grund sollten Frauen, die keine Beschwerden oder Massen in der Brust haben, auf die Screening-Methoden achten.
WIE WIRD DIE SELBSTUNTERSUCHUNG DER BRUST DURCHGEFÜHRT?
Es ist eine praktische Methode für Frauen, die eigenen Brüste regelmäßig jeden Monat vor dem Spiegel zu untersuchen. Die Brustuntersuchung sollte jeden Monat 4-5 Tage nach dem Ende der Menstruation durchgeführt werden. Frauen in den Wechseljahren und Frauen, die sich einer Operation an der Gebärmutter oder den Eierstöcken unterzogen haben, sollten die Brust regelmäßig einmal im Monat an denselben Tagen untersuchen lassen. Bei der Brustuntersuchung sollte auf die Symmetrie der Brust geachtet werden, auf Ausfluss aus der Brustwarze, auf das Vorhandensein von Missbildungen, auf Hautveränderungen und auf das Ertasten einer Masse.
BRUSTUNTERSUCHUNG IN 3 SCHRITTEN
Untersuchung vor dem Spiegel
Heben Sie die Arme nach oben. Überprüfen Sie beide Brüste auf Unregelmäßigkeiten, Hautschrumpfungen oder -absenkungen, wunde Stellen an den Brustwarzen, Schorf, eingezogene Brustwarzen oder Veränderungen an der Brust. Legen Sie Ihre Hände auf die Taille und drücken Sie kräftig nach unten. Spannen Sie gleichzeitig Ihre Brustmuskeln gut an. Prüfen Sie Ihre Brusthaut im Spiegel auf Schrumpfung. Möglicherweise stellen Sie fest, dass Ihre Brüste nicht gleich groß sind. Das ist normal und sollte nicht als Zeichen einer Krankheit gewertet werden. Wenn Sie jedoch eine verdächtige Formation feststellen, sollten Sie unbedingt einen Arzt aufsuchen.
Untersuchung beim Duschen
Wenn Sie die linke Brust im Stehen untersuchen, halten Sie die linke Hand über den Kopf. Untersuchen Sie mit der rechten Hand Ihre linke Brust, indem Sie von oben nach unten und von unten nach oben drücken. Untersuchen Sie mit der rechten Hand die Außenseite der linken Brust, indem Sie radial oder kreisförmig in Richtung der Brustwarze drücken.
*Führen Sie das gleiche Verfahren mit der linken Hand für die rechte Brust durch. Wenn die Brust eine andere Härte in der Größe einer Haselnuss oder Walnuss aufweist, informieren Sie Ihren Arzt.
Untersuchung in Rückenlage
Legen Sie bei der Untersuchung der rechten Brust ein Kissen unter Ihre rechte Schulter und legen Sie die rechte Hand hinter Ihren Kopf. Untersuchen Sie mit der linken Hand Ihre rechte Brust, indem Sie von oben nach unten und von unten nach oben drücken. Untersuchen Sie mit der linken Hand die Außenseite der rechten Brust, indem Sie radial oder kreisförmig in Richtung der Brustwarze drücken.
*Führen Sie das gleiche Verfahren mit der rechten Hand für die linke Brust durch. Wenn die Brust eine andere Härte aufweist, etwa so groß wie eine Haselnuss oder Walnuss, informieren Sie Ihren Arzt.
Drücken Sie die Brustwarzen beider Brüste sanft zusammen. Prüfen Sie, ob die Brustwarze Ausfluss hat, und wenn ja, ob dieser hell oder blutig ist. Informieren Sie Ihren Arzt über jede Schwellung, Verdickung oder Ausfluss, die Sie feststellen.
Mammographie
Zur Früherkennung von Brustkrebs sollte jede Frau über 40, die keine Veränderungen an ihrer Brust bemerkt, jährlich eine Mammographie durchführen lassen. So ist es möglich, Brustkrebs zu entdecken, bevor er eine tastbare Größe erreicht. Es wird jedoch empfohlen, mindestens eine Mammographie in den 30er Jahren durchzuführen und den Film als Referenz für spätere Mammographien aufzubewahren. Frauen, bei denen Brustkrebs nicht in der Familie vorkommt, sollten ihren ersten Ultraschall nach dem 35. Lebensjahr durchführen lassen, und Frauen, bei denen Krebs in der Familie vorkommt und die ein genetisches Risiko für Brustkrebs haben, sollten ihren ersten Ultraschall nach dem 25. Lebensjahr durchgeführt werden. Diese Personen sollten ab dem Alter der ersten Ultraschalluntersuchung regelmäßig jedes Jahr zur Nachuntersuchung gehen.
Ärztliche Untersuchung
Eine regelmäßige ärztliche Kontrolle ist für die Früherkennung und Diagnose von Brustkrebs sehr wichtig. Auch wenn keine Beschwerden vorliegen, sollten alle Frauen nach dem 40. Lebensjahr einen Arzt aufsuchen und sich untersuchen lassen. Die Frage “Zu welchem Arzt soll ich gehen, um Brustkrebs zu diagnostizieren?” ist eines der am häufigsten untersuchten Themen. Die Diagnose und Behandlung von Brustkrebs wird von Allgemeinchirurgen durchgeführt, die auf Brustkrebs spezialisiert sind. Ihr Arzt, der Ihre Routineuntersuchungen zur Frauengesundheit oder zur allgemeinen Gesundheit durchführt, kann ebenfalls die notwendigen Untersuchungen zur Früherkennung von Brustkrebs veranlassen.
WIE OFT SOLLTE DAS BRUSTSCREENING DURCHGEFÜHRT WERDEN?
Zwischen dem 35. und 40. Lebensjahr sollten Sie einmal eine Mammographie und eine Ultraschalluntersuchung durchführen lassen. Dies wird als “Baseline-Mammographie” bezeichnet. Nach dem 40. Lebensjahr sollten Sie eine Routine-Screening-Mammografie durchführen lassen.
BRUSTKREBS-STADIEN
Brustkrebs ist eine Krebsart, die langsam fortschreitet. Der Tumor, der innerhalb von 5-7 Jahren eine Größe von 1 cm erreicht, kann sich zunächst auf die Lymphbahnen und Achsellymphknoten und dann über das Blut auf entfernte Organe wie Leber und Knochen ausbreiten. Um herauszufinden, in welchem Stadium sich der Tumor befindet und wohin er gestreut hat, wird ein Staging durchgeführt, und die Behandlung wird entsprechend festgelegt. Für die Stadieneinteilung bei Brustkrebs wird ein System namens TNM verwendet. Dabei gibt T den Tumordurchmesser, N die Anzahl der befallenen axillären Lymphknoten und M die Fernausbreitung (Metastasierung) an. Es gibt 4 Stadien von Brustkrebs. Die Stadien I, II und einige Tumore im Stadium III gelten als Brustkrebs im Frühstadium. Einige Tumore im Stadium III und IV werden als fortgeschrittene Stadien von Brustkrebs bezeichnet. Bei der Stadieneinteilung von Brustkrebs werden die Größe des Tumors und die Frage, ob er sich auf die umliegenden Lymphknoten ausgebreitet hat, berücksichtigt. Dementsprechend können wir die Stadien von Brustkrebs wie folgt definieren;
Stadium 0 – DCIS
Stadium I: Der Tumor ist kleiner als 2 cm und hat sich noch nicht auf die Lymphknoten ausgebreitet.
Stadium II : Der Tumor ist zwischen 2 und 5 cm groß und kann sich auf die umliegenden Lymphknoten ausgebreitet haben, muss es aber nicht.
Stadium III: Bedeutet eine weitere Ausbreitung auf die umliegenden Lymphknoten
Stadium IV: Metastasen in anderen Organen (Knochen, Leber, Gehirn, Lunge) oder Knochen, entfernte Lymphknoten.
DIAGNOSE UND BEHANDLUNG VON BRUSTKREBS
In den letzten Jahren haben bedeutende Fortschritte in der Behandlung von Brustkrebs und neue Behandlungsmöglichkeiten dazu geführt, dass die Krankheit bei frühzeitiger Diagnose und Behandlung vollständig beseitigt werden kann.
Mit den bedeutenden Entwicklungen und neuen Behandlungsmöglichkeiten in der Brustkrebsbehandlung ist die Diagnose und Behandlung der Krankheit heute einfacher und erfolgreicher geworden. Im Vordergrund der Brustkrebsbehandlung stehen Behandlungen und Anwendungen, die auf den Erhalt der Brust abzielen. Bei Brustkrebs, der in einem frühen Stadium entdeckt wird, kann durch die frühzeitige Erkennung der Ausbreitung der Krankheit mit fortschrittlichen Techniken Vorsorge getroffen werden, und der Tumor kann direkt und ohne Brustverlust operiert werden. Bei fortgeschrittenem Brustkrebs kann eine Brustrekonstruktion (eine neue Brust) mit Techniken der plastischen Chirurgie durchgeführt werden, wenn eine chirurgische Entfernung der Brust in Frage steht. Dank der Frühdiagnose kann Brustkrebs mit einer Rate von nahezu 100 % behandelt werden.
Die Behandlung von Brustkrebs richtet sich nach dem Stadium der Patientin. Im Stadium 0 ist eine Chemotherapie nach der Operation nicht erforderlich. Häufig wird die Behandlung durch eine Strahlentherapie ergänzt. In den Stadien I und II wird, da die Masse klein ist, entschieden, ob zuerst eine Operation und dann eine Chemotherapie durchgeführt werden soll. Im Stadium III wird zunächst eine Chemotherapie durchgeführt und der Patient dann operiert. Im Stadium IV kann eine Operation in Betracht gezogen werden, wenn sich der Krebs nicht auf zu viele Teile des Körpers ausgebreitet hat. Wenn sich der Krebs jedoch bereits zu weit ausgebreitet hat, ist eine Operation definitiv nicht zu empfehlen. Dann wird nur eine Chemotherapie und manchmal eine Strahlentherapie durchgeführt. Es wird erwartet, dass in naher Zukunft brustkrebsspezifische Impfstoffe bei der Behandlung eingesetzt werden.
Chirurgische Methoden
Das Hauptziel der Brustkrebsoperation ist es, den Tumor so zu entfernen, dass er nicht zurückbleibt, und die Lymphknoten bei Ausbreitung in die Achselhöhle vollständig zu entfernen.
Mastektomie
Einfache Mastektomie: Dieses Verfahren wird auch als totale Mastektomie bezeichnet. Die gesamte Brust, einschließlich der Brustwarzen, wird entfernt, die Lymphknoten in der Achselhöhle oder das Muskelgewebe unter der Brust werden jedoch nicht entfernt. Diese Methode wird heute nicht mehr so häufig angewandt.
Hautsparende Mastektomie: Bei einigen Patientinnen kann die Brust während der Operation rekonstruiert werden. Dieses Verfahren wird als hautsparende Mastektomie bezeichnet. Der größte Teil der Haut über der Brust (einschließlich Warzenhof und Brustwarze) bleibt erhalten.
Radikale Mastektomie: Bei dieser groß angelegten Operation werden die gesamte Brust, die Achselhöhlen und die Brustmuskeln (Brustwand) unter der Brust entfernt. Die radikale Mastektomie ist eine Methode, die in der Vergangenheit recht häufig angewandt wurde.
Brusterhaltende Operation
Wenn Brustkrebs im Frühstadium erkannt wird, wird in der Regel der betroffene Teil der Brust entfernt. Welcher Teil entfernt wird, hängt jedoch von der Größe und Lage des Tumors und anderen Faktoren ab. Bei der Lumpektomie werden nur die Masse in der Brust und das umliegende Gewebe entfernt. Die Strahlentherapie ist eine Behandlungsmethode, die nach der Lumpektomie eingesetzt wird. Wenn die Patientin auch eine adjuvante Chemotherapie erhält, wird die Strahlentherapie in der Regel bis zum Abschluss der Chemotherapie verschoben. Bei einer Quadrantektomie wird ein Viertel der Brust entfernt. Die Strahlentherapie wird in der Regel nach der Operation durchgeführt. Auch bei dieser Methode wird die Strahlentherapie aufgeschoben, wenn eine Chemotherapie durchgeführt werden soll.
Lymphknotenoperation
Um die Ausbreitung des Brustkrebses auf die axillären Lymphknoten festzustellen, werden ein oder mehrere Lymphknoten entfernt und unter dem Mikroskop untersucht. Diese Untersuchung ist wichtig für die Stadieneinteilung des Krebses und die Festlegung der Behandlung und des Ergebnisses. Werden in den Lymphknoten Krebszellen gefunden, ist die Wahrscheinlichkeit groß, dass sich der Krebs über den Blutkreislauf in andere Teile des Körpers ausgebreitet hat. Das Vorhandensein von Krebszellen in den axillären Lymphknoten spielt eine wichtige Rolle bei der Entscheidung, welche Art von Behandlung nach der Operation gegebenenfalls erforderlich ist.
Strahlentherapie-Behandlung
Die Strahlentherapie bei Brustkrebs zielt darauf ab, Krebszellen zu zerstören, die durch die Bestrahlung der Achselhöhle und des Brustbereichs nach der Operation wahrscheinlich zurückbleiben. Die Strahlentherapie in der Brustkrebsbehandlung wird zum Schutz des verbleibenden Brustgewebes eingesetzt, insbesondere bei Patientinnen mit einem hohen Regenerationsrisiko und bei Patientinnen, die sich einer brusterhaltenden Operation unterziehen. TrueBeam STx- und Elekta Versa-Geräte spielen als Strahlentherapie-Technologie eine wichtige Rolle bei der Bekämpfung von Brustkrebs.
Dank dieser Technologien konzentrieren sich die strahlenonkologischen Anwendungen im Bereich Brustkrebs nur auf die Krebszellen und verhindern eine Schädigung der gesunden Zellen.
Medikamentöse Behandlungen
Chemotherapie
Die Chemotherapie bei Brustkrebs wird in der Regel nach der Operation verabreicht. Obwohl nach der Operation keine Krebszellen mehr vorhanden sind, kann die Chemotherapie als vorbeugende Maßnahme noch eine Weile fortgesetzt werden.
Hormontherapie
Ziel der Hormontherapie ist es, die Hormonmenge in Brustkrebs, der auf weibliche Hormone reagiert, zu reduzieren. Einige Krebszellen, die empfindlich auf das Hormon Östrogen reagieren, wachsen und vermehren sich schneller. Diese Behandlungsmethode verhindert, dass sich der Krebs entwickelt, indem sie die Östrogenwirkung ausschaltet.
Intelligente Medikamente
Brustkrebs ist eine Krankheit, die eine individuelle und tumorspezifische Behandlung mit unterschiedlichen Behandlungsstrategien erfordert. Während es in den vergangenen Jahren keine anderen Optionen als die klassischen Chemotherapie-Medikamente und Hormontherapien gab, bringen heute neuere und wirksamere Chemotherapie-Medikamente, zielgerichtete intelligente Medikamente, die intravenös und oral in Form von Tabletten eingenommen werden können, und neue Hormonpräparate gemeinsam erfolgreiche Ergebnisse.
WAS KANN MAN TUN, UM DAS RISIKO, AN BRUSTKREBS ZU ERKRANKEN, ZU VERRINGERN?
Es gibt immer mehr Belege dafür, dass körperliche Aktivität in Form von Sport das Brustkrebsrisiko senkt. Schnelles Gehen für mindestens 1,25 bis 2,5 Stunden pro Woche verringert das Brustkrebsrisiko bei Frauen um 18 Prozent. Wenn dieser Spaziergang 10 Stunden pro Woche beträgt, sinkt das Risiko noch etwas stärker.
Einige Studien deuten darauf hin, dass langfristiges Stillen das Brustkrebsrisiko leicht senken kann. Studien zeigen, dass Frauen, die die Pille nehmen, ein etwas höheres Brustkrebsrisiko haben als Frauen, die die Pille nicht nehmen. Wenn die Pille abgesetzt wird, kehrt das Risiko auf den Normalwert zurück. Frauen, die viele Schwangerschaften hinter sich haben, und Frauen, die in jungen Jahren schwanger werden, haben ein geringeres Brustkrebsrisiko. Das liegt daran, dass der Menstruationszyklus während der Schwangerschaft ausbleibt. Bei der Entscheidung über die Behandlung ist es sehr wichtig zu wissen, mit welcher Untergruppe von Brustkrebs man es zu tun hat, um den Erfolg der Behandlung zu beurteilen.
LEBEN NACH BRUSTKREBS
Es ist sehr wichtig, ein an der körperlichen Lebensqualität orientiertes Behandlungsmodell für den Patienten zu planen. Bei den meisten Patienten treten nach der Operation (Entfernung der axillären Lymphknoten) Schulterbeschwerden und manchmal Lymphödeme auf. Dank der rechtzeitig geplanten Bewegungs- und Rehabilitationsprogramme können diese Probleme der Patienten beseitigt werden. Dank lebenslanger Nachsorgeprogramme kann die Möglichkeit einer dauerhaften Schultereinschränkung und eines Lymphödems stark reduziert werden.
Sexuelle und psychologische Probleme, die bei fast 70 % der Überlebenden von Brustkrebs beobachtet werden, können von Fachleuten behandelt werden, und Probleme, die sich in dieser Richtung entwickeln, können beseitigt werden. Übungen, die während der gesamten Erkrankung durchgeführt wurden, sollten kurz nach der Operation wieder aufgenommen und regelmäßig fortgesetzt werden. Die meisten Brustkrebsrezidive treten innerhalb der ersten 3 Jahre auf. Aus diesem Grund ist es wichtig, dass die Patientinnen ihre Gesundheitskontrollen 3 Jahre lang nach Abschluss der Behandlung genauestens verfolgen. Da die Rezidivrate bei Brustkrebs 30 % an der Operationsstelle und 70 % in entfernten Organen beträgt, sollte sie nicht vernachlässigt werden. Übungen, die während der gesamten Erkrankung durchgeführt wurden, sollten kurz nach der Operation wieder aufgenommen und regelmäßig fortgesetzt werden.
Bei den Nachuntersuchungen werden die Beschwerden der Patienten erfragt und der Patient eingehend untersucht. Bei Patienten ohne Beschwerden oder verdächtigen Befunden ist keine Untersuchung erforderlich. Bei Patientinnen mit verdächtigen Befunden werden jedoch ausführliche Untersuchungen durchgeführt, um diese abzuklären. Mit der Behandlung von Brustkrebs sollten die Patientinnen zunächst einmal für sich selbst eine neue Seite aufschlagen und ohne Sorgen leben. Im Verlauf der Brustkrebsbehandlung kann es bei der Entfernung der Achsellymphknoten zu einer Schultereinschränkung und manchmal zu Lymphödemen kommen. Diese Probleme können durch rechtzeitig geplante Bewegungs- und Rehabilitationsprogramme beseitigt werden.
Bei sexuellen Problemen, die bei 70 % der Überlebenden von Brustkrebs auftreten, sollte fachkundige Hilfe in Anspruch genommen werden. Sport wie Bewegung, Yoga, Walking sollte nach einer Brustkrebsoperation fortgesetzt werden. Innerhalb der ersten 3 Jahre besteht das Risiko eines Wiederauftretens von Brustkrebs. Aus diesem Grund sollten die Gesundheitskontrollen nach der Überwindung der Krankheit nicht unterbrochen werden. Da die Rückfallquote von Brustkrebs im Operationsgebiet 30 % und in entfernten Organen 70 % beträgt, sollte sie nicht vernachlässigt werden.
HÄUFIG GESTELLTE FRAGEN ZU BRUSTKREBS
Brustkrebs-Statistik
- Im Jahr 2012 wurden weltweit 1,7 Millionen neue Fälle von Brustkrebs diagnostiziert.
- Die drei Länder mit der höchsten Brustkrebsinzidenz sind Belgien, Dänemark und Frankreich.
- Die Türkei gehört nicht zu den 20 Ländern, in denen Brustkrebs am häufigsten vorkommt.
- Brustkrebs macht 12 Prozent aller Krebserkrankungen aus.
- Brustkrebs macht 25 Prozent aller Krebserkrankungen bei Frauen aus.
Was sind Brustwarzen und Zysten?
Bei einer tastbaren Masse in der Brust kann es sich um eine Zyste oder um eine feste Masse handeln. Insbesondere Fibroadenome und Fibrozysten sind sehr häufige Massen in der Brust. Münzförmige Brustgeschwülste sind gutartige Tumore, die sich nicht zu Krebs entwickeln. Frauen können nicht erkennen, ob es sich bei diesen Massen, die sie bei der Selbstuntersuchung der Brust feststellen, um Brustkrebs oder um eine harmlose Fibroadenom-Masse handelt. Fibroadenome sind vor allem bei Frauen unter 30 Jahren aufgrund der hormonellen Umstellung sehr häufig. Die Beschaffenheit der Masse in der Brust lässt sich durch einen Brustultraschall feststellen. Aus diesem Grund sollten Frauen so schnell wie möglich einen Facharzt aufsuchen, wenn sie eine Veränderung oder eine Masse in ihrer Brust bemerken. Ein Brustultraschall und gegebenenfalls eine Mammographie können Aufschluss über die Masse in der Brust geben.
Worauf deuten die Schmerzen in der Brust hin?
Schmerzen in der Brust, insbesondere wenn sie in beiden Brüsten auftreten, sind in erster Linie ein Hinweis auf hormonelle Veränderungen und den Menstruationszyklus. Auch Fibroadenome und Fibrozysten können Schmerzen in der Brust verursachen. Bei schwangeren Frauen können Schmerzen in der Brust auf hormonelle Veränderungen zurückzuführen sein, während bei stillenden Frauen Schmerzen in der Brust aufgrund des Stillens auftreten können. In fortgeschrittenen Stadien von Brustkrebs kann es aufgrund des Tumorwachstums zu Ödemen und dann zu Schmerzen in der Brust kommen. Schmerzen in der Brust gelten jedoch nicht als Anzeichen für Brustkrebs.
Was wird getan, wenn eine Masse in der Brust entdeckt wird?
Wenn bei der Selbstuntersuchung der Brust eine Veränderung in der Brust festgestellt wird, ist es notwendig, sofort einen Facharzt aufzusuchen. Die Diagnose sollte gestellt werden, indem untersucht wird, worum es sich bei dieser Masse handelt.
Wird bei Brustkrebs jede Masse erkannt?
Acht von 10 Massen, die bei der Brustkrebsdiagnose festgestellt werden, können gutartig sein. Es kann sich um nicht krebsartige Massen handeln, die in jungen Jahren als Zysten bezeichnet werden, sowie um Fibroadenome und fibrozystische Massen, die im mittleren Alter auftreten können. Die Tatsache, dass jede Masse in der Brust schmerzhaft oder schmerzlos ist, bedeutet nicht, dass es sich um Krebs handelt.
Wie sollte die Ernährung bei Brustkrebs aussehen?
Die Ernährung bei Brustkrebs wirkt sich positiv auf die Brustkrebsbehandlung aus. Nach der Diagnose Brustkrebs erwarten Brustkrebspatientinnen vom Arzt eine Ernährungsliste, um nicht erneut an Krebs zu erkranken oder schnell zu genesen und das Abwehrsystem zu stärken, und sie sind enttäuscht, wenn eine solche Liste nicht gegeben wird. Die Patientinnen erwarten von ihren Ärzten, dass sie ihnen bestimmte Kräuter empfehlen und ihnen einzelne Nahrungsmittel und deren Mengenverhältnisse vorschreiben, wobei sie sich auf die irreführenden Informationen stützen, die von falschen Nachrichten, einigen privaten Organisationen, die Produkte der Alternativmedizin vermarkten, und Einzelpersonen verbreitet werden.
Untersuchungen zufolge führen spezielle Nahrungsergänzungen nach der Krebsdiagnose nur zu Appetitlosigkeit, unzureichender Ernährung und Gewichtsverlust. Abgesehen davon ist das von Ernährungswissenschaftlern für alle Personen empfohlene Ernährungsmodell, das auf Gemüse und Obst basiert und bei dem der Anteil an weißem Fleisch erhöht und der Anteil an rotem Fleisch verringert wird, für viele Krebspatienten, die sich in einem guten Allgemeinzustand befinden und gut essen können, ausreichend. Studien haben gezeigt, dass spezielle Nahrungsergänzungsmittel, die nach der Krebsdiagnose eingenommen werden müssen, nur zu Appetitlosigkeit, unzureichender Ernährung und Gewichtsverlust führen.
In Fällen wie Gewichtsverlust, Unfähigkeit, Nahrung über den Mund aufzunehmen, wunde Stellen im Mund, anhaltender Durchfall, anhaltende Übelkeit und Erbrechen, behandlungs- und krankheitsbedingter Vitaminmangel während der Brustkrebsbehandlung sollten spezielle Ernährungsteams mit speziellen Nahrungsmitteln und Vitaminen intravenös oder oral unterstützt werden. Krebspatientinnen sollten übermäßiges Essen und salzige Speisen vermeiden! Brustkrebspatientinnen im Frühstadium sollten vor allem während der Behandlung übermäßiges Essen und salzige Speisen vermeiden und sich vor den appetitsteigernden, gewichts- und ödembildenden Wirkungen von Kortison in Acht nehmen, das vor der Behandlung zur Verringerung allergischer Nebenwirkungen eingesetzt wird.
Darüber hinaus können kalorienreiche Nahrungsmittel wie Honig und Melasse, die in dieser Zeit verzehrt werden, um nicht schwach und kraftlos zu bleiben, bei den Patienten eine übermäßige Gewichtszunahme verursachen, die unerwünscht und später nur schwer wieder abzubauen ist. Bei der Behandlung von Brustkrebs und allen anderen Krebsarten gibt es kein pflanzliches Produkt, das es geschafft hat, als wissenschaftlicher Beweis in die onkologische Fachliteratur aufgenommen zu werden, mit Ausnahme des nachgewiesenen Nutzens der oralen Einnahme von 0,5-1 mg Ingwer als Tablette gegen Übelkeit und Erbrechen. Pflanzliche Produkte können Patienten schaden. Die Verwendung von Vitaminen, die in den letzten 20 Jahren populär geworden sind, hat ein intensives Anwendungsgebiet gefunden mit der Annahme, dass sie “uns jung halten, unsere Haut geschmeidig halten und uns mit ihren antioxidativen Eigenschaften vor den Nebenwirkungen von Krebsbehandlungen schützen”. In den letzten fünf Jahren wurde jedoch in umfangreichen Studien festgestellt, dass Vitamine, die unnötigerweise und ohne ärztliche Empfehlung eingenommen werden, dem Körper mehr schaden als nützen und sogar zu einer Zunahme bestimmter Krebsarten führen. Daraufhin haben der Markt für alternative Medizin und die Vermarkter in der Welt und in unserem Land ihre Aufmerksamkeit auf pflanzliche Produkte gerichtet. Die unerwünschten Wechselwirkungen dieser scheinbar natürlichen Produkte, insbesondere mit Chemotherapie und anderen medizinischen Behandlungen, bringen jedoch viele Patienten und den behandelnden Arzt in eine schwierige Lage.
Kann körperliche Aktivität das Brustkrebsrisiko senken?
Bewegung stärkt das Immunsystem und hilft, das Gewicht unter Kontrolle zu halten. Eine Frau, die nur drei Stunden pro Woche oder etwa 30 Minuten pro Tag Sport treibt, kann ihr Brustkrebsrisiko verringern.
Verursacht der Konsum von zu viel Zucker und zuckerhaltigen Lebensmitteln Brustkrebs?
Zucker steht nicht in direktem Zusammenhang mit Brustkrebs. Um Brustkrebs vorzubeugen, genügt es, auf unser Idealgewicht zu achten.
Sollte ich während der Brustkrebsbehandlung belebte Orte meiden?
Während der Brustkrebsbehandlung sollten Sie überfüllte Umgebungen nicht meiden, sondern sich in Umgebungen aufhalten, in denen Sie eher Kontakte knüpfen und Moral finden können. Es ist nicht möglich, sich während der Behandlung in einer überfüllten Umgebung mit Keimen anzustecken.
Verursachen Parfüm, Deodorant, Laserepilation und Permanent Make-up Brustkrebs?
Laserepilation, Permanent Make-up, Parfüm und Deodorant verursachen keinen Brustkrebs.
Wann ist der beste Zeitpunkt für eine Brustuntersuchung?
Die Brustuntersuchung sollte 4-5 Tage nach dem Ende der Menstruation durchgeführt werden.
In meiner Familie ist Brustkrebs aufgetreten. Wann sollte ich die erste Vorsorgeuntersuchung durchführen lassen?
Ab dem Alter von 25-26 Jahren sollten Sie jährliche Routine-Ultraschallkontrollen durchführen lassen. Bei genetisch bedingtem Brustkrebs liegt das Alter für die erste Mammographie bei 26 Jahren. Wenn bei Ihnen ein familiäres Brustkrebsrisiko besteht, sollten Sie ab dem Alter von 32-34 Jahren mammografisch untersucht werden.
Hat die Mammographie einen Einfluss auf die Krebsentwicklung?
Der Nutzen der Mammographie überwiegt bei weitem den Schaden. Daher sollte die von der Mammographie ausgehende Strahlung niemals als Schaden für den Körper angesehen werden. In den 1960er Jahren wurde festgestellt, dass der Schaden der Mammographie viel geringer war als der Nutzen der Mammographie bei Patientinnen, die 30 Jahre lang mammographisch überwacht wurden, und zwar mit Technologien, die eine sehr hohe Strahlenbelastung aufwiesen. Mammogramme geben 10-mal weniger Strahlung ab als die damaligen Verfahren. Da die MRT keine Strahlung enthält, hat sie keine Nebenwirkungen für den Patienten.
Ist Brustkrebs ansteckend?
Krebs ist nicht ansteckend. Die Tatsache, dass viele Mitglieder einer Familie an Krebs erkrankt sind, kann der Grund für diesen Irrglauben sein. Eine Person kann Krebs nicht auf eine andere Person übertragen. Einige Krebsarten wie Gebärmutterhalskrebs und Leberkrebs werden jedoch durch Viren verursacht.
Verringert eine gesunde und ausgewogene Ernährung das Risiko von Brustkrebs?
Besondere Aufmerksamkeit sollte dem Verzehr von frischem Obst und Gemüse gewidmet werden, das reich an Vitamin A und C ist, tierische Fette sollten vermieden und eher breiige Lebensmittel bevorzugt werden, geräucherte, salzige und konservierte Lebensmittel sollten nicht konsumiert werden, Rauchen und Alkohol sollten vermieden werden, und Übergewicht sollte vermieden werden. Das Brustkrebsrisiko kann durch Maßnahmen wie Sport, vorbeugende Medikamente bei Frauen mit hohem Brustkrebsrisiko, Entleerung beider Brüste bei Frauen mit hohen Risikofaktoren, Anfertigung von Brüsten mit Silikon oder aus eigenem Gewebe und Verzicht auf Tabletten, Cremes und Gele, die unter dem Namen “Brustvergrößerung” auf dem Markt verkauft werden, verringert werden.
Kann ich Sport treiben, um das Brustkrebsrisiko zu senken?
Sie sollten die richtige Sportart für sich selbst im täglichen Leben wählen. Der Sport, der für viele Menschen geeignet ist, ist ein regelmäßiger und zügiger Spaziergang. Außerdem können Sie sich für Übungen wie Schwimmen, Radfahren, Pilates oder Yoga entscheiden, die Sie in einer Gruppe oder allein durchführen können.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST DER NASOPHARYNX?
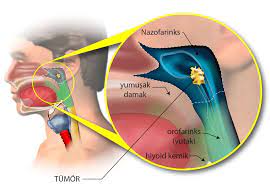
Der Übergangsbereich zwischen der Nasenhöhle und der Mundhöhle wird als Nasopharynx bezeichnet. Es ist der Hohlraum, der sich von beiden Seiten mit der Eustachischen Röhre zum Mittelohr öffnet. Da dieser Bereich nicht mit bloßem Auge durch die Nase betrachtet werden kann, wird er mit einem Endoskop durch die Nase sichtbar gemacht. Oder sie kann mit einem Spiegelgerät durch den Mund betrachtet werden. Adenoide, die bei Kindern häufig vorkommen, befinden sich ebenfalls im Bereich des Nasen-Rachen-Raums. Adenoide sind gutartiges lymphatisches Gewebe, das als Abwehrmechanismus des Körpers gebildet wird und bei jedem Kind vorkommt. Adenoides Gewebe, das bei Kindern bis zu einem bestimmten Alter auftritt, ist im Erwachsenenalter nicht zu erwarten, und wenn bei einem Erwachsenen lymphatisches Gewebe im Nasenrachenraum beobachtet wird, sollte eine Biopsie entnommen und zur pathologischen Untersuchung eingesandt werden.
WAS IST NASOPHARYNGEALER KREBS?
Krebserkrankungen, die im Nasen-Rachen-Raum auftreten, werden als Nasopharynxkrebs bezeichnet. Er gehört zu den häufigsten Krebsarten. Im Nasen-Rachen-Raum können gutartige (benigne) und bösartige (maligne) Tumore auftreten. Bei erwachsenen Patienten ist in diesem Bereich keine Polypenbildung zu erwarten. Wird bei einem erwachsenen Patienten eine Läsion oder Masse im Nasen-Rachen-Raum festgestellt, sollte eine Untersuchung durchgeführt werden. Nasopharynxkarzinome sind in der Gruppe der Erwachsenen häufig anzutreffen. Auch Lymphome und Leukämien können bei Erwachsenen häufig in dieser Region vorkommen. Im Gegensatz zu Erwachsenen können bei Kindern auch Weichteilkrebs (Raptomyosarkom) oder gutartige Angiofibrome oder Plasmozytome in der Nasopharynxregion vorkommen.
Es gibt 3 Arten von Nasopharynxkrebs.
Typ 1 Plattenepithelkarzinom des Nasen-Rachen-Raums (SCC)
Typ 2 Nicht-keratinisierendes, gut differenziertes Nasopharynxkarzinom
Typ 3 Indifferentes Nasopharynxkarzinom
Nasopharynxkarzinom Typ 3 spricht am besten auf die Behandlung an. Es ist unwahrscheinlich, dass er nach der Behandlung wieder auftritt. Das Plattenepithelkarzinom des Nasopharynx vom Typ 1 kann nach der Behandlung erneut auftreten.
Auch Leukämie- und Lymphomkarzinome können häufig im Nasen-Rachen-Raum vorkommen. Aus diesem Grund sollten verdächtige Gewebe im Nasen-Rachen-Raum entnommen und pathologisch untersucht werden, um festzustellen, ob es sich um gutartiges Gewebe oder um Gewebe mit Krebsrisiko handelt.
WAS SIND DIE URSACHEN VON NASOPHARYNXKREBS?
Bei Krebserkrankungen des Nasen-Rachen-Raums können mehrere Faktoren eine Rolle spielen. Zu diesen Faktoren gehören Umweltfaktoren (Luftverschmutzung, Exposition gegenüber chemischen Dämpfen), genetische Veranlagung und Viren.
Das Nasopharynxkarzinom, das am häufigsten in der Adoleszenz im Durchschnittsalter von 40-50 Jahren auftritt, betrifft eher Männer.
Auch eine familiäre Vorbelastung mit Nasopharynxkrebs erhöht das Risiko.
Das Epstein-Barr-Virus (EBV) steht in engem Zusammenhang mit Nasopharynxkrebs. Bei EBV-positiven Personen sollte eine nasopharyngeale Untersuchung durchgeführt werden.
Auch die Inzidenz von Nasopharynxkrebs ist bei Rauchern höher.
Auch die Ernährungsgewohnheiten zählen zu den Ursachen von Nasopharynxkrebs. Schlechte Essgewohnheiten, übermäßiger Verzehr von geräucherten Lebensmitteln, Kochen auf Holzfeuer erhöhen die Wahrscheinlichkeit dieser Krankheit.
WAS SIND DIE SYMPTOME VON NASOPHARYNXKARZINOM?
Zu den häufigsten Symptomen gehören Ansammlungen im Nacken. Eine einseitige Mittelohrentzündung gehört ebenfalls zu den häufigsten Symptomen bei Erwachsenen. Die Eustachische Röhre öffnet sich von beiden Seiten zum Nasen-Rachen-Raum. Wenn die Masse einen dieser Bereiche verschließt, kann es zu einer einseitigen Mittelohrentzündung kommen, weil die Belüftung des Ohrs beeinträchtigt ist. Bei einseitigen Ohrentzündungen bei Erwachsenen sollte der Nasenrachenraum untersucht und geprüft werden, ob sich in diesem Bereich eine Masse befindet. Generell sollten die Patienten auf Nasopharynxkrebs untersucht werden;
Lymphknoten, Masse am Hals
Nasenverstopfung
Nasenbluten
Anhaltende Mittelohrentzündung
Ohrensausen und Ohrverstopfung
Die Patienten können einen Arzt aufsuchen, wenn sie über Sehstörungen und Schmerzen aufgrund einer Hirnnervenbeteiligung klagen.
WIE WIRD NASOPHARYNGEALER KREBS DIAGNOSTIZIERT?
Bei einem Verdacht im Nasen-Rachen-Raum wird zunächst eine körperliche Untersuchung durchgeführt. Dann kommen gegebenenfalls auch bildgebende Verfahren wie Tomographie, MRT und Pet-CT zum Einsatz.
Der Nasen-Rachen-Raum kann mit einem Endoskop durch die Nase oder mit einem Spiegel durch die Mundhöhle betrachtet werden. Normalerweise ist der Nasopharynx
Region hat eine flache Struktur. Wenn sich in diesem Bereich eine Masse, eine Schwellung oder eine Veränderung zeigt, sollte der HNO-Arzt eine Biopsie aus diesem Bereich entnehmen. Nasopharynxkrebs kann manchmal auch den Hals betreffen. Diese Beteiligungen lassen sich durch eine medikamentöse Tomographie oder PET-CT eindeutig feststellen. Die endgültige Diagnose eines Nasopharynxkarzinoms wird durch eine Biopsie gestellt. In der Biopsie wird der Typ der Masse bestimmt. Die Behandlung von Nasopharynxgeschwülsten richtet sich nach der Art der Geschwulst; gutartige Tumore können operativ entfernt oder weiterverfolgt werden, bei einem Nasopharynxkarzinom besteht die Behandlungsmöglichkeit in erster Linie in einer Strahlentherapie + Chemotherapie.
WIE WIRD NASOPHARYNXKARZINOM BEHANDELT?
Die Behandlung der Masse, deren Typ durch die Biopsie bestimmt wird, erfolgt entsprechend. Die Behandlung von Nasopharynxkarzinomen erfolgt in der Regel mit Strahlentherapie + Chemotherapie. Insbesondere das indifferente Karzinom vom Typ 3 spricht schnell auf eine Strahlentherapie an. Eine Behandlung mit frühzeitiger Diagnose und regelmäßiger Nachsorge führt zu erfolgreichen Ergebnissen.
Auch Lymphome und Leukämieerkrankungen können den Nasen-Rachen-Raum befallen. Bei der Behandlung dieser Krankheiten werden auch Strahlen- und Chemotherapie eingesetzt.
Wenn Nasopharynxkrebs nicht frühzeitig erkannt und behandelt wird, kann er in späten Stadien Metastasen bilden. Da der Nasopharynx in der Nähe des Gehirns liegt, sind Schädelbasis und Nerven häufig betroffen. Insbesondere die Nerven 6, 3, 4 und 5 können betroffen sein. Wenn die Metastasen die Schädelbasis und die Nerven erreichen, kann der Patient doppelt sehen oder stürzen.
Das Alter und das Geschlecht des Patienten gehören zu den Faktoren, die den Verlauf der Behandlung beeinflussen. Beim Nasopharynxkarzinom, das eher Männer betrifft, können fortgeschrittenes Alter, Lymphknotenbefall im Halsbereich, Nervenbefall im Schädelbereich und Krebsarten, die nicht durch das Epstein-Bar-Virus verursacht werden, den Behandlungsverlauf negativ beeinflussen.
HÄUFIG GESTELLTE FRAGEN ZU NASOPHARYNXKREBS
Wie lange dauert die Behandlung des Nasopharynx?
Die Behandlung des Nasopharynx erfolgt durch Operation, Strahlen- oder Chemotherapie, je nachdem, ob es sich um einen gutartigen oder bösartigen Tumor handelt. Die Behandlung wird von HNO-Ärzten und Onkologen festgelegt. Nach diesen Behandlungen sollte der Patient regelmäßig von HNO- und Onkologie-Fachärzten nachkontrolliert werden. Die ersten 5 Jahre nach der Behandlung sind sehr wichtig.
Was ist der nasale (nasopharyngeale) Bereich?
Der Übergangsbereich zwischen der Nasenhöhle und der Mundhöhle wird als Nasopharynx bezeichnet. Es ist der Hohlraum, der sich von beiden Seiten mit der Eustachischen Röhre zum Mittelohr öffnet.
Was ist ein Adenoid?
Adenoide kommen im Bereich des Nasen-Rachen-Raums vor und sind bei Kindern häufig. Als Adenoide werden gutartige, lymphatische Gewebe bezeichnet, die als Abwehrmechanismus des Körpers gebildet werden. Diese Gewebe, die bei Kindern bis zu einem bestimmten Alter auftreten, gelten als normales Gewebe.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST EIN TUMOR DER WIRBELSÄULE UND DES RÜCKENMARKS?
Nach dem Austritt aus dem Schädel verläuft das Rückenmark in den Wirbelknochen bis zum Steißbein im unteren Rücken. Gutartige oder bösartige Tumore können im Rückenmark selbst oder in der umgebenden Membran entstehen. Fragen wie “Was ist ein Tumor im Rückenmark?”, “Was ist ein Tumor des Rückenmarksbulbus?”, “Was ist ein Tumor des Spinalnervs?” gehören zu den Themen, auf die die Patienten neugierig sind. Tumore des Rückenmarksbulbus sind Tumore, die sich im Gegensatz zu Tumoren der Wirbelsäule und des Rückenmarks im Inneren des Gehirns entwickeln. Bei Tumoren der Wirbelsäule und des Rückenmarks kann es sich um gut- oder bösartige Tumoren handeln. Die meisten Tumore in der Wirbelsäule, die das Rückenmark umgeben, sind Tumore, die durch Metastasen entstanden sind. Brustkrebs, Lungenkrebs und Prostatakrebs sind die häufigsten Krebsarten, die in die Wirbelsäule metastasieren.
WAS SIND DIE SYMPTOME VON WIRBELSÄULEN- UND RÜCKENMARKSTUMOREN?
Fragen wie “Was sind die Symptome von Wirbelsäulen- und Rückenmarkskrebs?”, “Wie treten die Auswirkungen von Wirbelsäulen- und Rückenmarkstumoren auf?”, “Was sind die ersten Symptome von Wirbelsäulen- und Rückenmarkstumoren?”, “Wie sind die Symptome von Wirbelsäulen- und Rückenmarkstumoren zu verstehen?”, “Wie ist der Tumor im Rücken zu verstehen?”, “Wie ist der Tumor in der Taille zu verstehen?” gehören zu den Themen, die die Patienten interessieren.
Die Symptome von Tumoren, die von der Wirbelsäule und dem Rückenmark ausgehen, können plötzlich auftreten oder langsam fortschreiten.
- Das erste Symptom eines Tumors der Wirbelsäule und des Rückenmarks kann eine Schwäche in den Beinen sein. Bei Tumoren, die sich im Rückenmark selbst oder in Form von Metastasen in der Wirbelsäule entwickeln, tritt die Schwäche in den Beinen zu einem großen Teil durch die Kompression des Rückenmarks auf. Diese Schwäche kann bei unbehandelten Patienten fortschreiten.
- Das Symptom eines plötzlich auftretenden Tumors der Wirbelsäule und des Rückenmarks ist ein plötzliches Gefühl der Schwäche. Symptome wie Lähmungen und Beinschwäche können sehr schnell auftreten.
- Toilettenprobleme wie Harninkontinenz und großer Stuhlgang können ein Anzeichen für einen Tumor der Wirbelsäule und des Rückenmarks sein. Die ersten Symptome eines Tumors der Wirbelsäule und des Rückenmarks können oft übersehen werden, da sie denen eines Bandscheibenvorfalls ähneln.
- Bei den langsam fortschreitenden Symptomen von Wirbelsäulen- und Rückenmarkstumoren steht der Schmerz im Vordergrund. Die Schmerzen im unteren Rücken des Patienten können von Tag zu Tag zunehmen. Bei unzureichend untersuchten Kreuzschmerzen können Wirbelsäulen- oder Rückenmarkstumoren übersehen werden.
- In Fällen, in denen die Symptome von Tumoren der Wirbelsäule und des Rückenmarks langsam fortschreiten, kann der Tumor sogar 5 Jahre zurückliegen.
- Zusätzlich zu diesen Symptomen können bei metastasierenden Tumoren, die in der Regel an der Wirbelsäule auftreten, auch Symptome auftreten, die sich auf den Schwerpunkt der Krebserkrankung beziehen. Symptome wie Gewichtsverlust, Übelkeit – Erbrechen, Appetitlosigkeit können je nach Krebsart, die die Metastasen verursacht, unterschiedlich sein.
- Wenn bei Wirbelsäulentumoren die Knochen betroffen sind, können Symptome wie Schmerzen und Schwäche aufgrund einer verminderten Festigkeit der Wirbelsäule auftreten.
- Ein Taubheitsgefühl aufgrund der Kompression des Tumors auf das Rückenmark kann ein Symptom für einen Tumor der Wirbelsäule und des Rückenmarks sein.
Die Symptome von Wirbelsäulen- und Rückenmarkstumoren bei Kindern sind im Allgemeinen wie folgt:
Da Kinder ihre Beschwerden nicht so deutlich ausdrücken können wie Erwachsene, sollten Beschwerden wie Schmerzen und Schwäche berücksichtigt werden. Allerdings sollte nicht jeder Schmerz oder jede Schwäche, die von Kindern berichtet werden, als Wirbelsäulen- oder Rückenmarkstumor angesehen werden;
- Wenn ein Kind, das auf der Toilette trainiert wurde, wieder einnässt, ist es wichtig, die notwendigen Untersuchungen durchzuführen, da dies ein Anzeichen für einen Wirbelsäulen- und Rückenmarkstumor ist. .
- Wenn ein Kind, das normal läuft, rennt und spielt, anfängt zu stürzen und schwankend geht, kann dies auch ein Anzeichen für einen Tumor der Wirbelsäule und des Rückenmarks sein.
Schmerzen bei Kindern können mit Wachstumsschmerzen verwechselt werden.
WAS SIND DIE URSACHEN VON TUMOREN DER WIRBELSÄULE UND DES RÜCKENMARKS?
Fragen wie “Warum tritt ein Wirbelsäulen- und Rückenmarkstumor auf?”, “Warum tritt ein Wirbelsäulen- und Rückenmarkstumor auf?”, “Was sind die Ursachen für einen Wirbelsäulen- und Rückenmarkstumor?”, “Wie tritt ein Wirbelsäulen- und Rückenmarkstumor auf?” gehören zu den spannenden Themen. Die Ursachen von Rückenmarkstumoren sind nicht genau bekannt. Obwohl ihre Physiopathologie nicht vollständig bekannt ist, geht man davon aus, dass sie genetisch bedingt sind. Bei den meisten Wirbelsäulentumoren handelt es sich um metastatische Tumore. Die häufigsten Metastasen sind Lungen- und Brustkrebs.
WIE WIRD EIN WIRBELSÄULEN- UND RÜCKENMARKSTUMOR DIAGNOSTIZIERT?
“Wie kann man einen Tumor der Wirbelsäule und des Rückenmarks erkennen?” ist eine der Fragen, die von Patienten gestellt werden. Im Allgemeinen werden Wirbelsäulen- und Rückenmarkstumore durch radiologische Bildgebung und biochemische Bluttests diagnostiziert.
Um einen Tumor der Wirbelsäule und des Rückenmarks zu diagnostizieren, kann der Arzt nach der Untersuchung eine radiologische Untersuchung anordnen,
- Radiographie, d.h. Röntgenstrahlen
- Knochenszintigraphie
- Computertomographie (CT)
- Magnetische Resonanz (MR)
- In Fällen, in denen der Tumor nahe der Oberfläche liegt, kann eine Nadelaspiration durchgeführt werden, um festzustellen, aus welchem Gewebe er stammt oder ob Metastasen vorhanden sind. Das mit dieser Methode entnommene Stück kann an die Pathologie geschickt werden und die Behandlung kann gestaltet werden.
- Bei Patienten mit Symptomen von Tumoren der Wirbelsäule und des Rückenmarks werden Blutuntersuchungen durchgeführt, um das Vorhandensein anderer Tumoren festzustellen.
Radiologische Untersuchungen mit einem speziellen Medikament, dem so genannten Kontrastmittel, können die Lage des Tumors sowie seine Größe und die Nerven, auf die er drückt, deutlich sichtbar machen.
Für die Diagnose von Wirbelsäulen- und Rückenmarkstumoren bei Kindern sollte eine Sedierung oder Vollnarkose durchgeführt werden. Diese Methode wird bevorzugt, da es für Kinder schwierig ist, bei der Magnetresonanztomographie (MRT) oder Computertomographie (CT) ruhig zu bleiben.
WIE WIRD DIE BEHANDLUNG VON WIRBELSÄULEN- UND RÜCKENMARKSTUMOREN DURCHGEFÜHRT?
Fragen wie “Ist Wirbelsäulen- und Rückenmarkskrebs heilbar?”, “Wie ist die Behandlung von Wirbelsäulen- und Rückenmarkstumoren?”, “Welche Behandlungen gibt es für Wirbelsäulen- und Rückenmarkstumoren?”, “Gibt es eine Behandlung für Wirbelsäulen- und Rückenmarkskrebs?” gehören zu den interessanten Themen.
- Bei der Behandlung von Tumoren der Wirbelsäule und des Rückenmarks kommen in der Regel Operation, Strahlen- und Chemotherapie zum Einsatz. Die Behandlungsmöglichkeiten und die Reihenfolge der Behandlung können je nach Patient, Art des Tumors und seiner Lage variieren. Vor Beginn der Behandlung ist die Planung sehr wichtig. Die Behandlung kann je nach Zustand des Patienten, Größe und Lage des Tumors gestaltet werden. Während bei einigen Patienten zunächst eine Strahlen- und Chemotherapie durchgeführt wird, steht bei anderen Patienten die chirurgische Behandlung im Vordergrund.
- Die Behandlung von Wirbelsäulen- und Rückenmarkstumoren erfolgt in einem multidisziplinären Ansatz, an dem verschiedene Fachrichtungen beteiligt sind, darunter medizinische Onkologie, Strahlenonkologie, Neurochirurgie, interventionelle Radiologie und in der Neurochirurgie erfahrene Anästhesisten.
- Zu Beginn der Behandlung eines Tumors der Wirbelsäule und des Rückenmarks sollte die Integrität der Wirbelsäule des Patienten beurteilt werden. Der Tumor kann Brüche in der Wirbelsäule verursachen, und sowohl das Tumorgewebe als auch der Bruch können Druck auf das Rückenmark ausüben. In erster Linie muss die Wirbelsäulenstruktur des Patienten stabilisiert werden. Um die Wirbelsäule zu stabilisieren und dem Patienten zu ermöglichen, sein soziales Leben so reibungslos wie möglich fortzusetzen, kann eine Schraubenoperation durchgeführt werden, die gemeinhin als Platin bekannt ist, das eigentlich aus Titan besteht.
- Bei metastasierenden Wirbelsäulentumoren sollte geprüft werden, ob der Primärkrebs des Patienten unter Kontrolle ist. Wenn der Patient eine hohe Lebenserwartung hat, können wirksamere Behandlungen für Tumore, die in der Wirbelsäule und im Rückenmark entstehen, in Betracht gezogen werden.
- Bei einer kleinen Gruppe von Wirbelsäulentumoren, die meist als Metastasen auftreten, kann der gesamte Tumor entfernt werden. Bei metastasierten Wirbelsäulentumoren, die nicht vollständig entfernt werden können, können Methoden wie Strahlen- und Chemotherapie eingesetzt werden, um das soziale Leben des Patienten zu erleichtern.
- Bei Tumoren, die vom Rückenmark selbst ausgehen, ist die Lage des Tumors sehr wichtig und nicht, wie aggressiv der Tumor ist. Es besteht ein großer Unterschied zwischen der Operation eines Rückenmarkstumors im Halsbereich und der Operation eines Rückenmarkstumors im Steißbeinbereich. Operationen in der Nähe des Halses bergen schwerwiegende Risiken wie z. B. eine Atemlähmung.
- Bei der Behandlung von Wirbelsäulen- und Rückenmarkstumoren können Strahlentherapiegeräte modernster Technologie vor oder nach der Operation eingesetzt werden. Im Allgemeinen können positive Ergebnisse bei der Verlangsamung der Entwicklung, dem Wachstumsstopp und der Rückbildung von gutartigen Tumoren erzielt werden.
- Die Chirurgie von Wirbelsäulen- und Rückenmarkstumoren ist sehr heikel. Da sich in dieser Region die Nerven befinden, die den gesamten Körper steuern, sollte bei der Operation von Rückenmarkstumoren fortschrittliche Technologie eingesetzt werden. Das Neuromonitoring, das bei solch riskanten Operationen eingesetzt wird, kann mögliche Komplikationen minimieren.
- Bei der Operation von Tumoren der Wirbelsäule und des Rückenmarks ist es nicht immer möglich, den gesamten Tumor zu entfernen. Wenn die Entfernung des gesamten Tumors dem Patienten schaden würde, sollte die Entfernung des gesamten Tumors vermieden werden. Optionen wie Strahlen- und Chemotherapie sollten in Betracht gezogen werden, indem der Tumor so weit wie möglich entfernt wird.
HÄUFIG GESTELLTE FRAGEN ZU TUMOREN DER WIRBELSÄULE UND DES RÜCKENMARKS
Welche Arten von Wirbelsäulen- und Rückenmarkstumoren gibt es?
Tumoren der Wirbelsäule und des Rückenmarks lassen sich nach den Geweben einteilen, aus denen sie stammen.
- Tumore, die von Neuronen (Nerven) ausgehen, sind Tumore, die vom Rückenmark selbst ausgehen.
- Tumoren, die von den Geweben und Membranen ausgehen, die das Rückenmark umgeben.
- Es kann sich um Tumore handeln, die von der Wirbelsäule, d.h. von der Knochenstruktur ausgehen.
Tumoren, die vom Rückenmark selbst ausgehen, werden im Allgemeinen in zwei Kategorien unterteilt
- Astrozytom
- Ependymom
Wo treten Tumore der Wirbelsäule und des Rückenmarks auf?
Nach dem Austritt aus dem Gehirn verläuft das Rückenmark in der Wirbelsäule bis zum Steißbein. Tumore der Wirbelsäule und des Rückenmarks können überall entlang dieser Achse auftreten. Tumore der Wirbelsäule und des Rückenmarks können an der Halswirbelsäule oder am Halsmark, an den Wirbeln, die den Brustkorb umgeben, und an den Spinalnerven in diesem Bereich sowie in der Lendengegend bis zum Steißbein auftreten. Die meisten Tumore an der Wirbelsäule sind die Folge von Metastasen. Einige der Rückenmarkstumore treten in bestimmten Regionen häufiger auf. Während einige Arten von Rückenmarkstumoren bei Erwachsenen häufiger in der Halsregion auftreten, können sie bei Kindern im Brust- und Lendenbereich auftreten.
Wie wird die Operation von Wirbelsäulen- und Rückenmarkstumoren durchgeführt?
- Wirbelsäulen- und Rückenmarkstumoroperationen werden als offene Operation mit Mikrochirurgie durchgeführt. Die endoskopische Methode wird in der Wirbelsäulen- und Rückenmarkstumorchirurgie nicht bevorzugt. Da bei endoskopischen Eingriffen zweidimensionale Bilder gewonnen werden und nur ein sehr kleiner Bereich betroffen ist, führt die offene Chirurgie bei Operationen an der Wirbelsäule und am Rückenmark zu erfolgreicheren Ergebnissen.
- Befindet sich der Tumor der Wirbelsäule oder des Rückenmarks in einem zugänglichen Bereich, wird zunächst eine Biopsie durch Nadelaspiration durchgeführt. Diese gibt Aufschluss über die Art des Tumors.
- Die Festigkeit der Wirbelsäule wird überprüft. Ein eventueller Druck auf das Rückenmark wird beurteilt. Falls erforderlich, wird eine Methode namens Wirbelsäulenverschraubung angewendet, um die Stabilität der Wirbelsäule zu gewährleisten.
- Das größte Problem von Patienten mit Wirbelsäulentumor-Metastasen sind Schmerzen. Bei manchen Patienten ist es nicht möglich, den Tumor zu operieren. In diesen Fällen können chirurgische Methoden eingesetzt werden, um die Schmerzen des Patienten zu lindern.
- Bei Tumoren, die vom Rückenmark selbst ausgehen, wird der Tumor in einer offenen Operation mit mikrochirurgischen Methoden entfernt. Bei der Operation von Wirbelsäulen- und Rückenmarkstumoren sollen die Risiken, die auftreten können, durch den Einsatz modernster Technik minimiert werden. Das bei diesen Operationen eingesetzte Neuromonitoring-Gerät warnt den Neurochirurgen während des Eingriffs vor Risikobereichen.
- Das bei der Operation von Tumoren der Wirbelsäule und des Rückenmarks entnommene Gewebe wird zur Bestimmung der Behandlung in die Pathologie geschickt.
Wie viele Stunden dauert eine Operation von Wirbelsäulen- und Rückenmarkstumoren?
Die Operation eines Rückenmarkstumors dauert etwa 4-5 Stunden. Bei einigen Tumoren können chirurgische Methoden wie die Entfernung der Wirbelsäule und ihre erneute Stabilisierung angewandt werden. Je nach Lage, Größe und Art des Tumors kann die Dauer der Operation bis zu 12-15 Stunden betragen. Je nach Lage und Größe des Tumors können die Neurochirurgen von Herzchirurgen, Allgemeinchirurgen oder Urologen begleitet werden.
Welche Risiken gibt es bei der Operation von Wirbelsäulen- und Rückenmarkstumoren?
- Tumore der Wirbelsäule und des Rückenmarks sind anfällig für Blutungen. In einigen Fällen können Fachärzte für Interventionelle Radiologie vor der Operation vaskuläre Verfahren durchführen, um Blutungen während des chirurgischen Eingriffs zu verringern. .
- Wie bei allen Operationen besteht auch bei Wirbelsäulen- und Rückenmarkstumoroperationen das Risiko einer Infektion.
- Vor allem bei ausgedehnten Tumoren besteht die Gefahr der Schädigung innerer Organe, der Schädigung großer Gefäße, der Verletzung der Nieren oder der Harnwege.
- Lähmungen gehören zu den Risiken, die bei Operationen von Wirbelsäulen- und Rückenmarkstumoren auftreten können. Dieses Risiko wird jedoch durch die moderne Technologie, die bei den Operationen eingesetzt wird, minimiert.
- Durch die Beeinträchtigung der Nerven kann es zu Problemen wie Harninkontinenz und Inkontinenz bei der großen Blasenentleerung kommen.
Gibt es Schmerzen nach Operationen an Rückenmark und Rückenmarkstumoren?
Nach einer Operation von Wirbelsäulen- und Rückenmarkstumoren können die Patienten starke Schmerzen haben. Dies wird jedoch vor der Operation berücksichtigt und der Einsatz starker Schmerzmittel ist geplant.
Was passiert, wenn ein Tumor der Wirbelsäule und des Rückenmarks nicht operiert wird?
Wenn ein Tumor der Wirbelsäule und des Rückenmarks nicht operiert wird oder andere Behandlungen aufgeschoben werden, kann der Tumor fortschreiten. Die Symptome eines Tumors der Wirbelsäule und des Rückenmarks schreiten von Tag zu Tag voran. Zunächst macht sich der Tumor durch Schmerzen in einem Bein bemerkbar, später kann er auch das andere Bein betreffen. Die tumorbedingten Beschwerden treten nacheinander auf, und der Prozess kann bis zur Lähmung fortschreiten. Je nach Lage des Tumors können die Lähmungen den Nacken oder den unteren Rücken betreffen.
Gibt es eine pflanzliche Behandlung von Tumoren der Wirbelsäule und des Rückenmarks?
Es gibt keine wissenschaftlich belegte pflanzliche oder natürliche Behandlung von Tumoren der Wirbelsäule und des Rückenmarks.
Was ist nach einer Wirbelsäulen- und Rückenmarkstumoroperation zu beachten?
- Nach der Operation von Wirbelsäulen- und Rückenmarkstumoren sollte die Art des Tumors durch eine pathologische Untersuchung bestimmt und ein entsprechendes Behandlungsprotokoll für den Patienten erstellt werden. Es ist wichtig, die Kontrollen nach dem chirurgischen Eingriff nicht zu vernachlässigen.
- Die Medikation sollte nicht vernachlässigt werden.
- Bei der Ernährung sollte auf einen ausgewogenen Anteil an Eiweiß, Kohlenhydraten und Fett geachtet werden.
- Die Wundpflege und das Sauberhalten der Wunde sind wichtig für das Infektionsrisiko.
In welche Abteilung sollte ich mich für die Operation von Wirbelsäulen- und Rückenmarkstumoren begeben?
Eine weitere Frage, die sich Patienten stellen, ist die nach der richtigen Abteilung für Operationen von Wirbelsäulen- und Rückenmarkstumoren. Die Symptome von Wirbelsäulen- und Rückenmarkstumoren können oft mit Bandscheibenvorfällen verwechselt werden. Aus diesem Grund wenden sich die Patienten aufgrund der bereits aufgetretenen Symptome an die Abteilung für Gehirn-, Nerven- und Wirbelsäulenchirurgie. Dies ist die gleiche Abteilung, die auch für die Operation von Wirbelsäulen- und Rückenmarkstumoren aufgesucht werden sollte. Um die Probleme, die während und nach der Operation von Wirbelsäulen- und Rückenmarkstumoroperationen auftreten können, zu minimieren, sollten gut ausgestattete Krankenhäuser bevorzugt werden.
Wie lange dauert die Genesung nach einer Rückenmarkstumoroperation?
Die Genesung nach einer Wirbelsäulen- und Rückenmarkstumoroperation kann je nach Art des Tumors, der Lage des Tumors und dem Ansprechen des Patienten auf die Behandlung variieren. Im Allgemeinen können die Patienten etwa 3 Wochen nach einer Wirbelsäulen- und Rückenmarkstumoroperation wieder am gesellschaftlichen Leben teilnehmen.
Wie wird ein gutartiger Rückenmarkstumor behandelt?
Chemo- und Strahlentherapie werden bei der Behandlung von gutartigen Rückenmarkstumoren nicht eingesetzt. Die meisten gutartigen Rückenmarkstumore können chirurgisch vollständig entfernt werden. Bei diesen Patienten kann das normale Leben nach der Operation fortgesetzt werden, ohne dass eine weitere Behandlung erforderlich ist. Bei Tumoren der Wirbelsäule und des Rückenmarks, die durch bestimmte genetische Erkrankungen verursacht werden, können jedoch mehrere Tumoren auftreten. In solchen Fällen kann die Zahl der Tumore im Laufe der Jahre zunehmen. Selbst wenn der Tumor chirurgisch entfernt wird, kann er nach einer gewissen Zeit wieder auftreten.
Sind Tumore der Wirbelsäule und des Rückenmarks gefährlich?
Fragen wie “Ist ein Wirbelsäulen- und Rückenmarkstumor tödlich?”, “Besteht bei einem Wirbelsäulen- und Rückenmarkstumor ein Sterberisiko?”, “Wie viele Jahre lebt man bei Wirbelsäulen- und Rückenmarkskrebs?”, “Ist ein Wirbelsäulen- und Rückenmarkstumor tödlich?”, “Wie hoch ist die Lebenserwartung bei Wirbelsäulen- und Rückenmarkskrebs?” gehören zu den Themen, die die Patienten interessieren.
Bei Wirbelsäulentumoren handelt es sich in der Regel um Metastasen einer anderen Krebsart. Das Ansprechen auf die Behandlung dieser Patienten ist von Patient zu Patient unterschiedlich.
Bei einer raschen Ausbreitung von Hirntumoren kann der Patient sterben, aber Rückenmarkstumoren unterscheiden sich in dieser Hinsicht von anderen Tumoren. Befindet sich der Rückenmarkstumor in der Nähe des Gehirns, des Herzens oder des Atmungszentrums, kann ein Todesrisiko bestehen. Ansonsten führen Rückenmarkstumore zwar nicht zum Tod des Patienten, können aber unbehandelt mit der Zeit zu Lähmungen führen. Der Patient kann sein Leben auch mit einem Rückenmarkstumor fortsetzen, aber wenn er nicht die notwendigen Behandlungen erhält, besteht die Gefahr, dass er seine Gliedmaßen nicht mehr rechtzeitig benutzen kann und je nach Lage des Tumors vom Hals oder von der Taille abwärts gelähmt wird.
Kann ein Rückenmarkstumor metastasieren?
Tumore, die sich im Rückenmark entwickeln, metastasieren normalerweise nicht. Wenn einige Hirntumore im Kindesalter in der Liquorstrombahn liegen, kann es zu einem Tumorfluss in Richtung Rückenmark kommen. Tumore, die vom Rückenmark selbst ausgehen, metastasieren jedoch in der Regel nicht.
Verursacht ein Tumor der Wirbelsäule und des Rückenmarks Beinschmerzen?
Das erste Symptom eines Tumors der Wirbelsäule und des Rückenmarks sind in der Regel Beinschmerzen oder Schwäche in den Beinen. Bleibt die notwendige Behandlung aus, kann sich das Problem mit der Zeit auf beide Beine ausweiten.
Verursacht ein Tumor der Wirbelsäule und des Rückenmarks Kopfschmerzen?
Die von Tumoren der Wirbelsäule und des Rückenmarks verursachten Symptome hängen in der Regel mit dem Bereich zusammen, der betroffen ist. Daher verursachen Tumore der Wirbelsäule und des Rückenmarks keine Kopfschmerzen.
Was sind die Stadien von Rückenmarkskrebs?
Die Stadieneinteilung von Wirbelsäulen- und Rückenmarkstumoren erfolgt wie bei anderen Krebsarten in der Regel in 4 Stufen.
Verursacht ein Tumor der Wirbelsäule und des Rückenmarks Lähmungen?
Tumore der Wirbelsäule und des Rückenmarks können Lähmungen verursachen. Tumore der Wirbelsäule und des Rückenmarks, die unbehandelt bleiben oder deren Behandlung sich verzögert, können im Laufe der Zeit Lähmungen verursachen, oder sie können sich plötzlich entwickeln und Lähmungen verursachen. Je nach Lage des Wirbelsäulen- und Rückenmarkstumors können sich die Lähmungen vom Hals abwärts oder von der Taille abwärts entwickeln.
Wird Physiotherapie bei Tumoren der Wirbelsäule und des Rückenmarks eingesetzt?
Die Physiotherapie kann die Behandlung von Tumoren der Wirbelsäule und des Rückenmarks unterstützen. Wenn Patienten nach einer Operation Funktionseinbußen in Händen oder Füßen erlitten haben, können mit Physiotherapie positive Ergebnisse erzielt werden.
Kann eine Strahlentherapie bei Tumoren der Wirbelsäule und des Rückenmarks eingesetzt werden?
Die Strahlentherapie, d. h. die Bestrahlung, kann bei der Behandlung von Tumoren der Wirbelsäule und des Rückenmarks eingesetzt werden. Dies kann je nach Zustand des Patienten und des Tumors variieren. Bei einigen Patienten kann die Strahlentherapie vor dem chirurgischen Eingriff eingesetzt werden, während sie bei anderen Patienten nach der Operation bevorzugt wird. Mit modernsten Strahlentherapiegeräten können gute Ergebnisse erzielt werden.
Werden Wirbelsäulen- und Rückenmarkstumore mit Medikamenten behandelt?
Bei der Behandlung von Wirbelsäulen- und Rückenmarkstumoren ist der Einsatz von Medikamenten in zweierlei Hinsicht möglich. Wenn in der Behandlungsplanung eine Chemotherapie vorgesehen ist, können neben den von einem spezialisierten Onkologen verordneten Medikamenten auch Medikamente gegen die auftretenden Schmerzen eingesetzt werden.
Kann ein Tumor der Wirbelsäule und des Rückenmarks durch einen Bluttest nachgewiesen werden?
Wirbelsäulentumore, die in der Regel Metastasen bilden, können durch Blutuntersuchungen nachgewiesen werden, Tumore, die vom Rückenmark selbst ausgehen, können jedoch nicht durch Blutuntersuchungen nachgewiesen werden. Für die Diagnose dieser Tumore werden radiologische Verfahren wie die Magnetresonanztomographie (MRT) und die Computertomographie (CT) eingesetzt.
Treten Tumore der Wirbelsäule und des Rückenmarks immer wieder auf?
Einige gutartige Rückenmarkstumore mit einer genetischen Veranlagung treten immer wieder auf. Auch bösartige Tumore können im selben Gebiet wiederkehren.
Was kann man gegen Schmerzen bei Patienten mit Tumoren der Wirbelsäule und des Rückenmarks tun?
Bei Tumoren der Wirbelsäule und des Rückenmarks werden sowohl vor als auch nach der Operation starke Schmerzmittel eingesetzt, um die Schmerzen zu kontrollieren. Bei einigen Patienten können jedoch chirurgische Verfahren, die auf der Durchtrennung des schmerzverursachenden Nervs beruhen, bei Schmerzen angewandt werden, die mit Schmerzmitteln nicht zu lindern sind. In diesem Fall kann der Patient sein normales Leben weiterführen, spürt aber die Schmerzen nicht.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST SPEISERÖHRENKREBS?
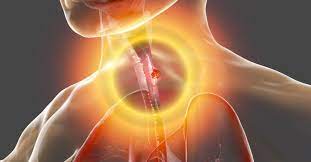
Krebserkrankungen, die in der Speiseröhre auftreten, die etwa 25-30 cm lang ist und sich vom Hals bis zum Magen erstreckt, werden als Speiseröhrenkrebs oder Ösophaguskarzinom bezeichnet.
WAS SIND DIE SYMPTOME VON SPEISERÖHRENKREBS?
Das wichtigste Symptom von Speiseröhrenkrebs sind Schluckbeschwerden. Zu den Symptomen von Speiseröhrenkrebs gehören ein Gefühl des Eingeschlossenseins und Schluckbeschwerden. Wenn der Tumor nicht 60-70 % der Speiseröhre bedeckt, verursacht er in der Regel keine Symptome. Da die Symptome von Speiseröhrenkrebs erst sehr spät auftreten, kann der Tumor bei den meisten Patienten erst in fortgeschrittenen Stadien entdeckt werden. Bei älteren Menschen können nächtliches Sabbern auf das Kopfkissen und Schmerzen beim Schlucken die ersten Symptome von Speiseröhrenkrebs sein.
Die Symptome von Speiseröhrenkrebs können je nach Lokalisation des Tumors unterschiedlich sein.
Dysphagie ist ein häufiges Symptom von Speiseröhrenkrebs in allen Regionen.
- Ein weiteres Symptom von Speiseröhrenkrebs, der in der Nähe des Halses auftritt, kann Heiserkeit sein.
- Husten kann ein Symptom für Speiseröhrenkrebs sein, der in der Mitte der Brust auftritt.
- Das Symptom von Speiseröhrenkrebs, der im unteren Bereich in der Nähe des Magens auftritt, kann ein starker Reflux sein.
Zu den Symptomen von Speiseröhrenkrebs gehören manchmal auch Blutungen, die allerdings sehr selten auftreten. Diese Blutungen werden als Darmblutungen und nicht als Blut aus dem Mund wahrgenommen.
Speiseröhrenkrebs kann je nach Stadium unterschiedliche Symptome hervorrufen.
- Speiseröhrenkrebs im Stadium 1 verursacht möglicherweise keine Symptome. Die Entdeckung von Speiseröhrenkrebs im Stadium 1 erfolgt in der Regel zufällig oder durch eine Untersuchung.
- Das Symptom von Speiseröhrenkrebs im Stadium 2 kann sich in Form von Schluckbeschwerden äußern. Obwohl dies unter den Symptomen von Speiseröhrenkrebs in diesem Stadium selten ist, können ein Stechgefühl und Darmblutungen auftreten.
- Bei Speiseröhrenkrebs im Stadium 3 ist das Symptom eine schwere Schluckstörung. Der Patient ist nicht mehr in der Lage, feste Nahrung zu sich zu nehmen. Speichelfluss kann vor allem bei älteren Menschen auftreten.
- Die Symptome von Speiseröhrenkrebs im Stadium 4 können je nach Ort der Metastasierung variieren. Bei Speiseröhrenkrebs im Stadium 4 ist starker Gewichtsverlust eines der ersten Symptome. Wenn der Tumor die Luftröhre befallen hat, kann Husten auftreten. Hat er sich auf die Leber ausgebreitet, können Seitenschmerzen beobachtet werden. Wenn er sich auf die Knochen ausgebreitet hat, können Knochenschmerzen auftreten.
WAS SIND DIE URSACHEN VON SPEISERÖHRENKREBS?
Je nach Zelltyp sind auch die Ursachen der Ösophagitis unterschiedlich.
Das Plattenepithelkarzinom gehört zu den Ursachen von Speiseröhrenkrebs;
- Alkohol und Rauchen
- Konsum von übermäßig heißen Getränken
- Der Verzehr von verbrannten, geräucherten Lebensmitteln kann gezählt werden.
Adenokarzinome der Speiseröhre werden in der Regel durch Reflux verursacht. Reflux tritt bei etwa 20 % der Bevölkerung auf, aber das bedeutet nicht, dass jeder Refluxpatient auch Speiseröhrenkrebs entwickelt. Langfristiger Reflux (Säure und Galle) in Verbindung mit Alkohol und Rauchen kann zu Barrett-Ösophagus (BARRETT) führen. Der Barrett-Ösophagus ist ein wichtiger Risikofaktor für Speiseröhrenkrebs.
Ein großer Teil der Ursachen für Speiseröhrenkrebs sind vermeidbare Faktoren. Abgesehen davon sind einige Krankheiten und genetische Faktoren sehr selten.
Zu den Risikofaktoren für Speiseröhrenkrebs, aber auch für Magen- und Dickdarmkrebs gehören eine fleischlastige Ernährung und der Verzehr von viel Gegrilltem.
DIAGNOSE VON SPEISERÖHRENKREBS
Wie erkennt man Speiseröhrenkrebs?
Speiseröhrenkrebs wird durch eine endoskopische Untersuchung diagnostiziert. Mit der endoskopischen Bildgebung kann der Arzt das Innere der Speiseröhre für die Diagnose sehen. Um die Diagnose Speiseröhrenkrebs zu bestätigen, ist jedoch eine pathologische Untersuchung des entfernten Stücks erforderlich.
Die endoskopische Ultraschalluntersuchung (EUS) dient zur Bestimmung des Stadiums des Speiseröhrenkrebses, d. h. wie weit er in der Speiseröhrenwand fortgeschritten ist. Die EUS liefert wichtige Informationen zur Bestimmung des Stadiums von Speiseröhrenkrebs.
Außerdem sollte jeder Patient, der sich wegen Speiseröhrenkrebs einer Behandlung oder Operation unterziehen muss, eine Computertomographie und eine Pet-CT-Untersuchung erhalten.
WAS IST DIE BEHANDLUNG VON SPEISERÖHRENKREBS?
Die Behandlung von Speiseröhrenkrebs ist je nach Stadium und Lokalisation unterschiedlich.
Bei Speiseröhrenkrebs mit Adenokarzinom oder Plattenepithelkarzinom im Stadium 3 wird in erster Linie die so genannte Chemoradiotherapie eingesetzt, bei der eine Chemotherapie mit einer nicht zu hohen Strahlendosis kombiniert wird. Mit dieser Behandlung werden signifikante Erfolge erzielt. Eine Operation des Speiseröhrenkrebses wird bei Patienten durchgeführt, die nach einer Chemoradiotherapie für eine Operation geeignet sind.
Bei Speiseröhrenkrebs im Stadium 4 ist eine Operation in der Regel nicht möglich. Diese Patientengruppe wird mit Chemotherapie und Strahlentherapie behandelt.
Bei Speiseröhrenkrebs im Stadium 1-2-3 wird die Behandlung in dem Bereich geplant, in dem sich der Tumor befindet.
Behandlung von Speiseröhrenkrebs in der Halsregion
Befindet sich der Krebs in der Halsregion der Speiseröhre, werden die Patienten in der Regel nicht operativ behandelt. Studien haben gezeigt, dass es bei Speiseröhrenkrebs in der Halsregion keinen Unterschied zwischen einer chirurgischen und einer chemoradiotherapeutischen Behandlung gibt. Bei Speiseröhrenkrebsen in der Halsregion führt die Chemoradiotherapie bei einem großen Teil der Patienten zu einem signifikanten Erfolg.
Die Operation wird jedoch bevorzugt, wenn Chemo- und Strahlentherapie nicht ausreichend sind.
Da die im Halsbereich der Speiseröhre gebildeten Tumore hinter dem Kehlkopf liegen, werden bei diesen Operationen auch der Kehlkopf, die Schilddrüse, ein Teil des Rachens und ein Teil der Luftröhre entfernt, und die Patienten müssen für den Rest ihres Lebens durch den Hals atmen.
Bei der Speiseröhrenkrebs-Operation kann nur ein Teil der Speiseröhre entfernt und eine Speiseröhre aus dem Dünn- oder Dickdarm hergestellt werden, damit der Patient durch den Mund ernährt werden kann. Manchmal kann die Speiseröhre auch vollständig entfernt und eine Speiseröhre vom Magen bis zur Zungenwurzel angelegt werden.
Behandlung von Speiseröhrenkrebs im Thoraxbereich
Bei der Behandlung von Tumoren, die im Brustbereich, d. h. in der Mitte der Speiseröhre, auftreten, hängt die Behandlung davon ab, ob der Tumor oberhalb oder unterhalb der Zweiteilung der Luftröhre liegt. Befindet sich der Tumor oberhalb der Luftröhre, wird eine Chemoradiotherapie bevorzugt. Befindet sich der Tumor unterhalb der Luftröhre, wird eine Operation bevorzugt.
Bei der Operation von Speiseröhrenkrebs im Brustbereich wird die gesamte Speiseröhre zusammen mit den Lymphknoten (mindestens 16) entfernt. Anschließend wird aus dem Magen eine Speiseröhre hergestellt und der Patient kann durch den Mund ernährt werden.
Behandlung von Speiseröhrenkrebs in der Nähe des Magens
In den magennahen Regionen, d. h. bei den unteren Speiseröhrenkrebsen, richtet sich die Behandlung nach der Ausbreitung des Tumors auf den Magen.
Wenn sich der Tumor 2 cm oder mehr in den Magen ausgebreitet hat, muss ein großer Teil der Speiseröhre und der gesamte Magen entfernt werden. Bei diesen Patienten muss eine neue Speiseröhre aus dem Dünn- oder Dickdarm hergestellt werden. Diese Patienten müssen ein spezielles Diätprogramm einhalten und immer weniger Nahrung zu sich nehmen. Es ist jedoch möglich, fast alles zu essen.
HÄUFIG GESTELLTE FRAGEN ZU SPEISERÖHRENKREBS
Wer hat ein höheres Risiko, an Speiseröhrenkrebs zu erkranken?
Speiseröhrenkrebs steht an 7. Stelle der häufigsten Krebsarten. Während in unserem Land jedes Jahr 30-40 Tausend neue Patienten mit dem häufigsten Lungenkrebs diagnostiziert werden, werden jedes Jahr 4-5 Tausend neue Patienten mit Speiseröhrenkrebs diagnostiziert.
In der Türkei ist Speiseröhrenkrebs vom Plattenepitheltyp, der als Plattenepithelkarzinom bezeichnet wird, aufgrund der Ernährungsgewohnheiten in östlichen Regionen wie Erzurum, Ağrı, Kars, Van, Bitlis und Muş häufiger anzutreffen. Das Trinken von sehr heißem Tee und eine fleischlastige, gemüsearme Ernährung spielen eine wichtige Rolle für das Auftreten von Speiseröhrenkrebs in dieser Region. Plattenepithelkarzinome der Speiseröhre treten häufiger in der Region auf, die im Osten der Türkei beginnt und sich bis nach China erstreckt, einschließlich der so genannten Türkischen Republiken. Da die Region gebirgig und kalt ist, ist der übermäßige Konsum von heißen Getränken ein wichtiger Faktor. Wenn zum Konsum von Heißgetränken noch Rauchen und Alkohol hinzukommen, steigt die Inzidenz von Speiseröhrenkrebs.
Im Allgemeinen ist Speiseröhrenkrebs eine Krankheit, die erst ab einem Alter von 60 Jahren auftritt, unter diesem Alter ist er weniger häufig. Obwohl er häufiger bei Männern auftritt, kann er bei Frauen in unseren östlichen Provinzen aufgrund von heißem Teetrinken fast genauso häufig vorkommen. Speiseröhrenkrebs, der in der jungen Bevölkerung selten ist, tritt häufiger bei Menschen auf, in deren Familie Speiseröhrenkrebs und Dickdarmkrebs vorkommen.
Welche Arten von Speiseröhrenkrebs gibt es?
Speiseröhrenkrebs wird nach dem Zelltyp und dem Ursprungsort eingeteilt. Speiseröhrenkrebs wird im Allgemeinen in Plattenepithelkarzinom (Plattenepithelkarzinom) und Adenokarzinom (Adenokarzinom) unterteilt.
- Plattenepithelkarzinom der Speiseröhre: Dabei handelt es sich um eine Krebserkrankung, die von dem dünnen, aus flachen Zellen bestehenden Membrangewebe ausgeht, das die Speiseröhre von innen auskleidet. Plattenepithelkarzinom der Speiseröhre kommt in der Türkei häufiger vor.
- Das Adenokarzinom ist ein Krebsgeschwür in der Speiseröhre: Wenn die Schleimhaut (d. h. die innere Membranschicht) im unteren Teil der Speiseröhre mit Magensäure und Galle in Berührung kommt, verändert sie ihre Form und beginnt, Drüsen und der inneren Auskleidung des Magens zu ähneln. Es handelt sich um Krebs, der durch Zellen verursacht wird, die sich in diese Form verwandeln. In den westlichen Ländern ist Speiseröhrenkrebs vom Typ Adenokarzinom häufiger als Speiseröhrenkrebs vom Typ Plattenepithel.
Abgesehen von diesen beiden Arten von Speiseröhrenkrebs sind andere Arten, die vom Muskelgewebe ausgehen, sehr selten.
Neben der Unterscheidung von Speiseröhrenkrebs nach den Zellen, von denen er ausgeht, kann man ihn auch nach seiner Lage in der Speiseröhre differenzieren.
- Am Hals
- In der intra-thorakalen Speiseröhre
- Unteres Ende – Mageneingang
Adenokarzinom Speiseröhrenkrebs tritt in der Regel am Mageneingang oder im unteren Teil der Speiseröhre auf, weil die Schäden durch Magensäure und Gallenrückfluss in der Nähe des Magens liegen. Das Plattenepithelkarzinom der Speiseröhre tritt im oberen oder mittleren Teil der Speiseröhre auf.
Kann Speiseröhrenkrebs durch einen Bluttest nachgewiesen werden?
Speiseröhrenkrebs lässt sich nicht durch einen Bluttest nachweisen.
Was sollte zur Früherkennung von Speiseröhrenkrebs getan werden?
In der Türkei gibt es kein Screening-Programm zur Früherkennung von Speiseröhrenkrebs. Eine der wichtigsten Maßnahmen, die man persönlich ergreifen kann, ist jedoch die Durchführung endoskopischer Kontrollen.
Bei Patienten mit Barrett-Ösophagus (BARRETT) aufgrund von Reflux ist es wichtig, jährlich eine Endoskopie durchzuführen, um Speiseröhrenkrebs, der sich entwickeln kann, frühzeitig zu erkennen.
Endoskopische Routinekontrollen sind für die Frühdiagnose in den östlichen Provinzen, in denen Plattenepithelkarzinome der Speiseröhre häufig vorkommen, unerlässlich.
Welche Stadien von Speiseröhrenkrebs gibt es?
Speiseröhrenkrebs wird in 4 Stadien unterteilt.
- Speiseröhrenkrebs im Stadium 1: Speiseröhrenkrebs im Stadium 1 ist sehr schwer zu diagnostizieren, da die Symptome von Speiseröhrenkrebs erst sehr spät auftreten. Die Krankheit befindet sich nur in der inneren Auskleidung der Speiseröhre. Sie hat die Muskelstruktur noch nicht erreicht. Bei der Behandlung von Speiseröhrenkrebs im Stadium 1 ist es möglich, nur die erkrankte Membran zu entfernen, indem man mit einem Endoskop in den Mund eindringt, anstatt die Speiseröhre vollständig zu entfernen.
- Speiseröhrenkrebs zu Hause 2: Im Stadium 2 des Speiseröhrenkrebses hat die Krankheit die Membran überschritten und das Muskelgewebe erreicht.
- Speiseröhrenkrebs im Stadium 3: Der Tumor ist nicht sehr klein. Die Krankheit befindet sich in der Speiseröhre, hat sich aber auch auf die umliegenden Lymphknoten ausgebreitet. Bei der Behandlung von Speiseröhrenkrebs im Stadium 3 werden zunächst Chemo- und Strahlentherapie eingesetzt. Ziel ist es, die Krankheit im Tumor und in den Lymphknoten zurückzubilden. Wenn eine Rückbildung erreicht ist, sollte der Tumor operativ entfernt werden.
- Speiseröhrenkrebs im Stadium 4: Bei Speiseröhrenkrebs im Stadium 4 hat der Tumor Metastasen in entfernte Teile des Körpers gebildet. Speiseröhrenkrebs streut am häufigsten in die Leber, die Knochen, die Lunge und die Lymphknoten am Eingang des Magens. In diesem Stadium gibt es kaum noch Möglichkeiten für eine Operation. Es erfolgt eine Behandlung mit Chemotherapie.
Welche Abteilung und welchen Arzt sollte man bei Speiseröhrenkrebs aufsuchen?
Ein erheblicher Teil der Patienten mit Speiseröhrenkrebs unterliegt einem Behandlungsprozess, bei dem viele Abteilungen zusammenarbeiten. Bei Speiseröhrenkrebs, der einen multidisziplinären Behandlungsansatz erfordert, können neben der Thorax- und Speiseröhrenchirurgie auch die Gastroenterologie, die medizinische Onkologie, die Radioonkologie und die Allgemeinchirurgie zusammenarbeiten. Die Unterstützung durch die Abteilung für Diätetik und Ernährung ist dabei sehr wichtig. In Fällen, die spezielle mikrochirurgische Eingriffe erfordern (z. B. die Herstellung einer Speiseröhre aus dem Dünndarm), wird auch die Abteilung für Ästhetische, Plastische und Rekonstruktive Chirurgie hinzugezogen. Da es bei der Behandlung von Speiseröhrenkrebs sehr spezielle chirurgische Ansätze gibt, ist es wichtig, Krankenhäuser mit erfahrenen Ärzten und angemessener Infrastruktur zu bevorzugen.
Wie wird die Operation von Speiseröhrenkrebs durchgeführt?
Wie bei der Darmchirurgie kann ein Teil der Speiseröhre nicht durchtrennt und mit dem Rest der Speiseröhre verbunden werden. Anstelle der durch die Operation entfernten Speiseröhre muss eine neue Speiseröhre konstruiert werden. Das Hauptziel besteht darin, die Kontinuität des Darms zu gewährleisten. Wenn die Speiseröhre entfernt wird, können der Magen, der Dünn- und der Dickdarm oder, in seltenen Fällen, der Speiseröhrenkrebs durch die Haut durchgeführt werden.
In sehr seltenen Fällen, in denen der Tumor nicht entfernt wird, kann die Kontinuität des Darms gewährleistet werden und der Patient kann durch den Mund essen. Dank der sich entwickelnden Technologie kann diese Situation jetzt durch Stenting gelöst werden.
In Fällen, in denen ein vollständig blockierter Tumor nicht entfernt werden kann und ein Stent nicht eingesetzt werden kann, kann eine Sonde (Gastrostomie) in den Magen gelegt werden, um die Ernährung sicherzustellen, und die Nahrung kann direkt in den Magen geleitet werden.
Wie wird eine geschlossene Speiseröhrenkrebsoperation durchgeführt?
Die meisten Operationen bei Speiseröhrenkrebs (80-90 %) werden in unserem Zentrum für Speiseröhrenkrankheiten geschlossen durchgeführt. Weltweit werden geschlossene Speiseröhrenkrebs-Operationen durch 6 Löcher im Brustkorb und 4 Löcher im Bauchraum durchgeführt. Im Zentrum für Speiseröhrenkrankheiten des Memorial Ataşehir Hospitals kann die geschlossene Speiseröhrenkrebs-Operation durch 3 Löcher im Bauchraum und ein einziges Loch im Brustkorb durchgeführt werden. Der abdominale Teil der Operation dauert 45 Minuten bis 1 Stunde und der Brustteil 1 bis 1,5 Stunden. Die geschlossene Speiseröhrenkrebs-Operation reduziert die Blutung, die Operationszeit und das Trauma und verringert die möglichen Komplikationen, die auftreten können.
Was sind die Risiken einer Speiseröhrenkrebsoperation?
Die Operation von Speiseröhrenkrebs ist eine der wichtigsten Operationen im Körper. Das größte Risiko ist die Leckage an der Verbindungsstelle zwischen Speiseröhre und Magen oder Darm, also der neuen Speiseröhre. Bei Operationen an Speiseröhrenkrebs besteht auch das Risiko einer Heiserkeit. Dieses Risiko beträgt jedoch weniger als 10 Prozent, und die Heiserkeit ist in der Regel vorübergehend. Bei langfristiger Heiserkeit kann die Heiserkeit mit einem kleinen Eingriff beseitigt werden. Als Folge einer größeren Operation können Lungenentzündung, Herzrhythmusstörungen und Lymphabfluss auftreten.
Ist Speiseröhrenkrebs tödlich?
Krebs ist in den Köpfen der Menschen mit dem Tod verbunden. Aus diesem Grund wird Ärzten oft die Frage gestellt: “Ist Speiseröhrenkrebs tödlich?”. Ein großer Teil der Patienten im Stadium 1, 2 und einige im Stadium 3, die operiert werden können, haben eine Chance, von der Krankheit zu genesen. Speiseröhrenkrebs ist jedoch eine Krankheit, die ohne Symptome fortschreitet. Erst im 4. Stadium treten Symptome auf.
Es gibt keine allgemeine Antwort auf die Frage, ob Speiseröhrenkrebs tödlich ist. Jede Krankheit hat ihre eigenen Bedingungen. Die Lebenserwartung hängt von vielen Kriterien ab, wie der Art des Tumors, dem Tumorstadium und der Lage des Tumors sowie dem Alter des Patienten und dem Vorhandensein von Begleiterkrankungen.
In unabhängigen Studien wurden folgende 5-Jahres-Überlebensraten für Speiseröhrenkrebs ermittelt;
Speiseröhrenkrebs im Stadium 1 80-90
Speiseröhrenkrebs im Stadium 2 50-60 Prozent
Speiseröhrenkrebs im Stadium 3 30-40
Speiseröhrenkrebs im Stadium 4 5 %
Wenn die Krankheit in den ersten 2-3 Jahren nicht zurückkehrt, tritt sie in der Regel auch nicht wieder auf. Daher sind die ersten 2-3 Jahre nach der Behandlung sehr wichtig.
Gibt es eine pflanzliche Behandlung für Speiseröhrenkrebs?
Es gibt keine pflanzliche Behandlung für Speiseröhrenkrebs. Es ist jedoch sehr wichtig, sich pflanzlich zu ernähren, und der Verzehr von Lebensmitteln wie Zwiebeln, Knoblauch und Kurkuma, die zu den entzündungshemmenden Pflanzen gehören, kann den Kampf gegen den Krebs unterstützen.
Es ist notwendig, Lebensmittel wie Melasse, Honig, zuckerhaltige Süßigkeiten und Brausebonbons zu vermeiden. Stattdessen ist es wichtig, proteinhaltige und pflanzliche Lebensmittel zu verzehren.
Was ist nach einer Speiseröhrenkrebsoperation zu beachten?
Nach einer Speiseröhrenkrebsoperation sollten die Patienten auf ihre Ernährung achten. Neben dem Verzehr von entzündungshemmenden Lebensmitteln und dem Verzicht auf Zucker sollten auch guter Schlaf, Bewegung und regelmäßige Gesundheitskontrollen nicht vernachlässigt werden.
Nach Speiseröhrenkrebs sollten säurehaltige Getränke vermieden werden. Die Patienten sollten lebenslang gastroprotektive Medikamente einnehmen.
Da die postoperative Nahrung direkt in den Magen gelangt, kommt es bei den Patienten zu einem Gewichtsverlust von 10 % aufgrund von Resorptionsproblemen und manchmal zu plötzlichem Durchfall, je nach Art der Nahrung. Um Probleme zu vermeiden, sollten Nahrungsmittel wie Honig, Melasse oder sirupartige Desserts vermieden werden. Es ist notwendig, wenig und oft zu essen. Die Patienten sind in der Regel eher in der Menge eingeschränkt als in der Nahrung.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST EIN PENIS UND WOZU DIENT ER?
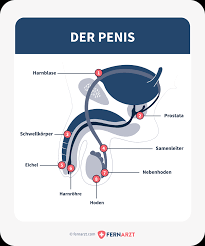
Der Penis ist Teil des männlichen Fortpflanzungssystems und des Harnsystems. Die wichtigsten Strukturen des männlichen Fortpflanzungssystems sind die Hoden, Nebenhoden, Samenblasen, Prostata und Penis. Die inneren Teile des männlichen Fortpflanzungssystems befinden sich in der unteren Beckenhöhle zwischen den Hüftknochen. Der Penis hängt vor dem Hautsack (Hodensack), in dem sich die Hoden befinden. Der Penis besteht aus drei Hauptteilen: der Wurzel, dem Schaft und der Eichel, die das kegelförmige Ende des Penis darstellt. Die Eichel ist mit einer Hautschicht, der Vorhaut, bedeckt. Wenn der Penis stimuliert wird, erweitern sich die Penisarterien und die Muskeln ziehen sich zusammen. Dadurch kommt es zu einer Erektion, die für den Geschlechtsverkehr notwendig ist. Die Harnröhre ist auch ein Teil des Harnsystems. Sie transportiert den Urin von der Blase nach außen in den Körper. An der Peniswurzel befindet sich ein Ventil (Schließmuskel), das, wenn es entspannt ist, den Urin aus der Harnröhre und aus dem Körper fließen lässt.
WAS IST PENISKREBS?
Krebs, der in den Zellen des Penis entsteht, wird Peniskrebs genannt. Bei der überwiegenden Mehrheit der Fälle von Peniskrebs (etwa 95 Prozent) handelt es sich um Plattenepithelkarzinome. Das bedeutet, dass der Krebs in den Plattenepithelzellen des Penis entsteht. Die meisten Plattenepithelkarzinome des Penis beginnen in der Vorhaut oder der Spitze des Penis (Glans). Plattenepithelkarzinome des Penis wachsen in der Regel langsam. Eine frühzeitige Erkennung führt zu einer hohen Erfolgsquote bei der Behandlung. Andere Arten von Peniskrebs sind Basalzellkarzinome, Sarkome, Melanome oder Harnröhrenkarzinome. Peniskrebs, der zu den seltenen Krebsarten gehört, tritt in der Regel bei unbeschnittenen Männern auf, vor allem in Afrika, Südostasien und Südamerika.
WAS SIND DIE RISIKOFAKTOREN FÜR PENISKREBS?
Zu den Risikofaktoren für Peniskrebs gehören im Allgemeinen die folgenden:
- Nicht beschnitten zu sein: Peniskrebs tritt bei unbeschnittenen Männern häufiger auf als bei beschnittenen Männern. Das Risiko, an Peniskrebs zu erkranken, kann durch eine Neugeborenen-Beschneidung fast vollständig beseitigt werden.
- Alter: Die meisten Fälle von Peniskrebs treten bei Männern zwischen 50 und 70 Jahren auf. Ungefähr ein Drittel der Fälle tritt bei Männern unter 50 Jahren auf.
- Rauchen-Tabakkonsum
- Humanes Papillomavirus (HPV): HPV 16 und HPV 18 werden mit Peniskrebs in Verbindung gebracht.
- Phimose: Die Phimose ist ein Faktor, der das Zurückziehen der Vorhaut erschwert. Mit anderen Worten: Die Vorhaut kann nicht bis zur Eichel zurückgezogen werden. Dies kann zu einer Ansammlung von Körperfett, Bakterien und anderen Ablagerungen führen, die als Smegma bezeichnet werden.
- UV-Lichttherapie bei Schuppenflechte: Eine UV-Lichttherapie bei einigen Hautkrankheiten wie Schuppenflechte kann das Risiko der Entwicklung von Peniskrebs erhöhen.
- AIDS (erworbenes Immunschwächesyndrom)
WAS SIND DIE SYMPTOME VON PENISKREBS?
Zu den häufigsten Symptomen von Peniskrebs gehören Veränderungen der Farbe oder Dicke der Haut, ungewöhnlicher Ausfluss, Geschwüre, Schmerzen und Schwellungen an der Penisspitze. Die Symptome von Peniskrebs können zwar von Person zu Person variieren, aber zu den allgemeinen Symptomen gehören zusammenfassend die folgenden:
- Veränderungen an der Haut des Penis, Schmerzen an der Penisspitze
- Schmerzhafte oder schmerzlose warzenartige Wucherung oder Läsion
- Offene Wunde, die nicht heilt
- Blutungen unter der Vorhaut
- Rötlicher Ausschlag
- Kleine Knollen
- Flacher, bläulich-brauner Wuchs
- Anhaltender, geruchsintensiver Ausfluss unter der Vorhaut
- Geschwollene Lymphknoten in der Leiste, wenn sich der Krebs ausgebreitet hat
WIE WIRD PENISKREBS DIAGNOSTIZIERT?
Wenn der Arzt Peniskrebs vermutet, wird er eine Biopsie anordnen. Denn die endgültige Diagnose von Peniskrebs wird durch eine Biopsie gestellt. Bei einer Biopsie wird Gewebe aus dem Penis oder den Lymphknoten entnommen und in einem Labor untersucht.
Es gibt drei Arten von Biopsieverfahren, die durchgeführt werden können;
Bei der Inzisionsbiopsie wird nur ein Teil des abnormen Gewebes entfernt. Sie wird in der Regel bei größeren Läsionen, Wunden, Geschwüren und Läsionen, die sich im Gewebe zu vertiefen scheinen, durchgeführt.
Bei der Exzisionsbiopsie wird die gesamte Läsion oder abnorme Wucherung entfernt. Eine Exzisionsbiopsie wird in der Regel durchgeführt, wenn der abnorme Bereich klein ist.
Eine Lymphknotenbiopsie wird in der Regel durchgeführt, wenn der Peniskrebs in das Gewebe im Inneren des Penis eingedrungen ist. So kann der Arzt herausfinden, ob sich der Krebs über das Penisgewebe hinaus ausgebreitet hat. In der Regel wird eine Lymphknotenbiopsie mittels Feinnadelaspiration (FNA) durchgeführt, einem Verfahren, bei dem der Arzt eine dünne Nadel in den/die Lymphknoten einführt und Zellen und Flüssigkeit entnimmt, um festzustellen, ob sich in dem/den Lymphknoten Krebs befindet. In einigen Fällen werden alle Lymphknoten chirurgisch entfernt, um sie auf Krebs zu untersuchen.
Bildgebende Untersuchungen können den Ärzten auch bei der Diagnose von Peniskrebs und der Bestimmung des Stadiums helfen. Einige der bildgebenden Tests, die zur Diagnose von Peniskrebs und zur Bestimmung des Krebsstadiums eingesetzt werden, sind:
- CT-Scan (Computertomographie)
- MRI (Magnetresonanztomographie)
- Ultraschall
WIE SIEHT DIE STADIENEINTEILUNG BEI PENISKREBS AUS?
Die Stadieneinteilung bei Peniskrebs ist wie folgt:
Phase 0
Nur die oberste Hautschicht des Penis weist Anzeichen von Krebs auf. Mit anderen Worten: Er ist oberflächlich und breitet sich nicht aus.
Phase 1
Der Krebs ist in das Gewebe unter der obersten Hautschicht des Penis eingewachsen. Die Lymph- und Blutgefäße sind jedoch nicht befallen.
Phase 2
In diesem Stadium breitet sich der Krebs weiter aus als die Haut und das Gewebe des Penis. Er befindet sich in den Nerven, Lymphgefäßen oder Blutgefäßen.
Phase 3
Im Stadium 3 kann sich der Krebs auf die schwammartigen Schwellkörper des Penis ausgebreitet haben. Der Krebs kann sich auch auf die Lymphknoten in der Leiste ausgebreitet haben.
Phase 4
In diesem Stadium kann sich der Krebs auf den Hodensack, die Prostata, das Schambein und andere Strukturen in der Leiste ausgebreitet haben. Der Krebs kann auch in den Lymphknoten vorhanden sein.
WELCHE BEHANDLUNGSMETHODEN GIBT ES BEI PENISKREBS?
Zu den Behandlungsmethoden für Peniskrebs gehören in der Regel chirurgische Eingriffe, Strahlentherapie und Chemotherapie. Diese Behandlungsmethoden können je nach Krankheitsstadium, Art des Krebses und allgemeinem Gesundheitszustand des Patienten allein oder in Kombination angewandt werden.
Chirurgisches Verfahren
Die wichtigste Behandlung für Peniskrebs ist die Operation. Bei dem chirurgischen Eingriff werden der Tumor und ein Teil des umgebenden gesunden Gewebes (Rand) entfernt. Der Umfang und die Art der Operation hängen von der Lage, der Art und dem Stadium des Tumors ab. In den meisten Fällen können körperliche Veränderungen am Penis, die nach dem chirurgischen Eingriff auftreten, durch eine rekonstruktive Operation korrigiert werden.
Photodynamische Therapie (PDT)
Bei der photodynamischen Therapie werden spezielle Medikamente, so genannte Photosensibilisatoren, in Kombination mit Licht eingesetzt, um Krebszellen abzutöten. Die Medikamente wirken erst, nachdem sie durch Licht aktiviert oder eingeschaltet wurden.
Kryochirurgie
Bei der Kryochirurgie wird flüssiger Stickstoff verwendet, um Krebszellen einzufrieren und abzutöten.
Strahlentherapie
Bei der Strahlentherapie werden hochenergetische Röntgenstrahlen eingesetzt, um Krebszellen zu zerstören. Der Vorteil der Strahlentherapie ist, dass die anatomische Struktur des Penis erhalten bleibt. Der Nachteil ist, dass Peniskrebs relativ resistent gegen Strahlentherapie ist und viele Komplikationen wie Fisteln, Ödeme, Hautnekrosen und Schmerzen verursachen kann.
Chemotherapie
Unter Chemotherapie versteht man den Einsatz von Medikamenten zur Abtötung von Krebszellen oder zur Verlangsamung ihres Wachstums. Die Chemotherapie spielt bei der Behandlung von Peniskrebs eine begrenzte Rolle: Eine Chemotherapie wird meist dann eingesetzt, wenn sich der Krebs auf die Lymphknoten und andere Gewebe ausgebreitet hat. Eine primäre neoadjuvante Chemotherapie kann bei Patienten mit festen Leistenmetastasen, von denen etwa 50 Prozent entfernt werden können, sinnvoll sein.
Andererseits können die Beschneidung und die Laserchirurgie bei sehr kleinen Vorhautläsionen therapeutisch sein. Die Laserbehandlung bietet zwar den Vorteil, dass der Penis erhalten bleibt, aber die Eindringtiefe des Lasers ist gering.
HÄUFIG GESTELLTE FRAGEN ZU PENISKREBS
Wie wirkt sich der Peniskrebs auf die Sexualität des Mannes aus?
Ein Mann, bei dem Peniskrebs diagnostiziert wurde, kann sich einer teilweisen (Entfernung eines Teils des intakten Penisgewebes zusammen mit dem Krebsgewebe im Penis) oder vollständigen Penisektomie (Entfernung des gesamten Penis) unterziehen. Die Nebenwirkungen eines chirurgischen Eingriffs zur Behandlung von Peniskrebs können schwer zu verkraften sein. Ein Mann braucht möglicherweise psychologische Unterstützung, um mit dem Verlust eines Teils oder des gesamten Penis fertig zu werden.
Verhindert die Beschneidung Peniskrebs?
Peniskrebs tritt bei neugeborenen beschnittenen Männern fast nie auf. Die Inzidenz von Peniskrebs ist höher, wenn die Beschneidung bis nach der Pubertät hinausgezögert wird. Die Beschneidung im Erwachsenenalter schützt nicht vor Peniskrebs.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS SIND SPEICHEL UND SPEICHELDRÜSEN?
Speichel ist eine Art Flüssigkeit, die im Mund produziert wird und aufgrund der darin enthaltenen Stoffe wie Wasser, Natrium, Chlorid, Kalzium, Kalium, Bikarbonat, Immunglobulin A, Albumin, Ptyalin und Muzin wichtig für unseren Körper ist. Der Speichel hält den Mund ständig feucht, schmiert die Nahrung im Mund und löst einige Moleküle in der Nahrung auf, damit sie die Geschmacksknospen erreichen können. Er erleichtert das Schlucken und erleichtert auch das Sprechen, indem er die Bewegungen der Zunge und der Lippen ermöglicht. Sie hält die Zähne und das Innere des Mundes sauber, indem sie sie ständig spült.
Der Speichel wird von den Speicheldrüsen abgesondert. Neben den 400-600 kleineren Speicheldrüsen, die sich in den Schleimhäuten der Mundhöhle, der Nase, der Nasennebenhöhlen, des Rachens, des Kehlkopfs, der Luftröhre und der Bronchialschleimhaut befinden, haben wir auch große Speicheldrüsen, die sich auf jeder Seite unseres Gesichts befinden und über kleine Kanäle mit der Mundhöhle verbunden sind. Insgesamt sind es 6, eine vor jedem Ohr (Ohrspeicheldrüse), eine unter dem Kinn (Unterkieferdrüse) und eine unter der Zunge (Unterzungendrüse).
WELCHE AUFGABE HAT DIE SPEICHELDRÜSE?
Speicheldrüsen produzieren Speichel. Es ist bekannt, dass ein gesunder Mensch täglich 1000-1500 ml Speichel produziert. Die Speicheldrüsen sorgen dafür, dass der Mund sauber ist und dass Säure und Nahrung in den Magen gelangen. Der Speichel, der viele Aufgaben hat, von Mundgeruch bis zur Verdauung, ist sehr wichtig für die Gesundheit.
WAS IST SPEICHELDRÜSENKREBS?
Speicheldrüsenkrebs ist eine Erkrankung, die durch ein krebsartiges Wachstum einer der Speicheldrüsen in unserem Mund entsteht, die wir große (drei Paare) und kleine (etwa tausend) Speicheldrüsen nennen, die Speichel absondern.
WELCHE ARTEN VON SPEICHELDRÜSENTUMOREN GIBT ES?
Tumore werden in gutartige (benigne) und bösartige (maligne) eingeteilt. Gutartige Tumore wachsen langsamer und metastasieren (streuen) nicht in umliegende oder entfernte Organe. Bösartige Tumore wachsen schneller und haben das Potenzial, in regionale Lymphknoten und entfernte Organe (Lunge, Leber, Gehirn, Knochen usw.) zu metastasieren (streuen).
WAS SIND DIE SYMPTOME VON SPEICHELDRÜSENKREBS?
Langsam wachsende, gutartige Tumore sind oft von einer dünnen, häutigen Hülle, einer so genannten Kapsel, umgeben und dringen nicht in das umliegende Gewebe ein. Sie wachsen in der Regel, indem sie das umliegende Gewebe verdrängen und sich selbst Platz verschaffen. Dieses Wachstum vollzieht sich über Monate oder sogar Jahre. Gutartige Tumore verursachen keine Schmerzen, die Patienten klagen selten über Schmerzen. Die Schmerzen sind in der Regel auf indirekte Ursachen zurückzuführen und nicht auf den Tumor selbst.
Bösartige Tumore wachsen schneller und haben das Potenzial, in regionale Lymphknoten und entfernte Organe (Lunge, Leber, Gehirn, Knochen usw.) zu metastasieren (zu streuen). Sie breiten sich auf das umliegende Gewebe aus und entwickeln sich, indem sie dessen Funktion stören. Wenn sie z. B. die benachbarten Nerven erreichen, stören sie deren Funktion. Bösartige Tumore verursachen ab einer bestimmten Größe auch Schmerzen. Diese Schmerzen können dadurch entstehen, dass der Tumor in Strukturen wie Knochen und Kiefergelenke eindringt, oder sie können direkt im Kopf und im Gesicht auftreten oder die Nerven erreichen, die das Schmerzempfinden übertragen.
WAS SIND DIE URSACHEN FÜR SPEICHELDRÜSENKREBS?
Obwohl die Ursachen für Speicheldrüsenkrebs nicht bekannt sind, geht man davon aus, dass einige Bedingungen dieses Risiko erhöhen. Die wichtigste davon ist, dass gutartige Tumore lange Zeit in der Speicheldrüse verbleiben. Selbst wenn der Tumor als gutartig bekannt ist, wird er daher vorzugsweise aus der Speicheldrüse entfernt. Strahlenbelastung ist ebenfalls einer der Gründe, die die Wahrscheinlichkeit von Speichelkrebs erhöhen. Da Rauchen die Wahrscheinlichkeit der meisten Krebsarten erhöht, erhöht es auch die Wahrscheinlichkeit von Speicheldrüsenkrebs.
WIE WIRD SPEICHELDRÜSENKREBS DIAGNOSTIZIERT?
Die Frühdiagnose von Speicheldrüsenkrebs richtet sich in der Regel nach den Beschwerden des Patienten. Die Krankheit kann durch eingehende Untersuchungen diagnostiziert werden, die durchgeführt werden, wenn ein Arzt aufgrund von Beschwerden wie Schwellungen oder Schmerzen im Kopf- und Halsbereich konsultiert wird.
Nach einer ausführlichen Anamnese wird der Patient untersucht. Bei der körperlichen Untersuchung wird geprüft, ob Schwellungen und Vergrößerungen der Speicheldrüsen vorliegen, und wenn dies der Fall ist, werden die Größe und die Grenzen der Schwellungen untersucht. Die bilaterale Untersuchung sollte mit der bilateralen Untersuchung verglichen werden.
Bildgebende Verfahren werden auch bei Speicheldrüsenkrebs eingesetzt. Insbesondere die Computertomographie (CT) und die Magnetresonanztomographie (MR) werden zur Untersuchung des Tumorgewebes und des umliegenden Gewebes eingesetzt. Für die endgültige Diagnose von Speicheldrüsenkrebs wird eine histopathologische Untersuchung durchgeführt. Die Diagnose wird durch eine Biopsie gestellt, d. h. durch Entnahme einer Gewebeprobe und deren Untersuchung. Nach der Diagnose von Speicheldrüsenkrebs ist die MRT auch für die Stadieneinteilung des Krebses nützlich.
WIE WIRD SPEICHELDRÜSENKREBS BEHANDELT?
Der Behandlungsplan wird entsprechend dem Stadium der Krankheit erstellt. Bei der Stadieneinteilung der Krankheit sind Bedingungen wie der Durchmesser des Tumors, die Ausbreitung auf umliegende Gewebe, die Ausbreitung der Lymphknoten und die histologische Art des Tumors von Bedeutung. Anhand des so ermittelten Stagings wird der Behandlungsplan erstellt. Als Behandlungsmöglichkeiten stehen Operation, Strahlentherapie und Chemotherapie zur Verfügung. Bei Patienten werden diese Behandlungsmethoden meist gemeinsam angewendet.
HÄUFIG GESTELLTE FRAGEN ZU SPEICHELDRÜSENKREBS
Sind Speicheldrüsentumore gefährlich?
Speicheldrüsentumore sind im Allgemeinen gutartig. Ohrspeicheldrüsentumoren sind die häufigsten Tumoren der Speicheldrüsen. Diese Tumore sind gutartig. Sie haben keinen aggressiven Verlauf und streuen nur selten in andere Regionen. Bei unbehandelten gutartigen Tumoren besteht eine sehr geringe Wahrscheinlichkeit, dass sie bösartig werden, d. h. Krebs entwickeln. Daher ist es wichtig, die Tumorbildung in der Speicheldrüse zu beurteilen und die Behandlung mit der geeigneten Behandlungsoption zu beginnen. Bei bösartigen Speicheldrüsenkrebsen mit bösartigem Verlauf wird der Erfolg der Behandlung durch eine frühzeitige Diagnose und einen frühzeitigen Behandlungsbeginn erheblich gesteigert. Aus diesem Grund ist es sehr wichtig, sich so früh wie möglich im Krankenhaus vorzustellen, insbesondere bei Beschwerden wie Schwellungen im vorderen Bereich des Ohrs, unter dem Kiefer, Schluckbeschwerden, Taubheitsgefühl und Taubheitsgefühl im Gesicht.
Ist Speicheldrüsenkrebs tödlich?
Speicheldrüsentumore sind in der Regel gutartig. Die Überlebensrate dieser Tumore liegt nach der Behandlung bei 95 Prozent. Bei bösartigen Speicheldrüsenkrebsen mit schlechter Prognose, also bei späten oder unbehandelten bösartigen Speicheldrüsenkrebsen, liegt die Erfolgsquote bei etwa 50 Prozent.
Welche Speicheldrüsen sind am häufigsten von Krebs betroffen?
Der häufigste gutartige Tumor der großen und kleinen Speicheldrüsen ist das pleomorphe Adenom, das 50 Prozent aller Speicheldrüsentumore und 65 Prozent aller Ohrspeicheldrüsentumore ausmacht. Der häufigste bösartige Tumor der großen und kleinen Speicheldrüsen ist das Mukoepidermoidkarzinom, das 10 Prozent aller Speicheldrüsentumore und 35 Prozent aller bösartigen Speicheldrüsentumore ausmacht. Dieser Tumor tritt am häufigsten in der Ohrspeicheldrüse auf.
Ist jeder Tumor in den Speicheldrüsen Krebs?
Nicht jeder Tumor in der Speicheldrüse ist krebsartig. Nicht jede Schwellung ist bösartig. Eine beträchtliche Anzahl von ihnen, vor allem in den Speicheldrüsen vor dem Ohr (Ohrspeicheldrüse), sind gutartige Schwellungen. Deshalb ist es wichtig, darauf zu achten, ob die Schwellung gut- oder bösartig ist.
Was sind die Risikofaktoren für Speicheldrüsenkrebs?
Die Exposition gegenüber ionisierender Strahlung ist der am häufigsten angeführte ätiologische Faktor bei Speicheldrüsenkrebs. Ein erhöhtes sekundäres Risiko besteht auch bei Beschäftigten in der Kautschukindustrie, in asbestexponierten Bergwerken, bei Klempnern und in der Holzverarbeitung.
Was bedeutet gutartiger Speicheldrüsentumor?
Tumore, die von der Speicheldrüse ausgehen, treten meist als langsam wachsende Massen im Alter von 50-70 Jahren auf. Neben der Untersuchung und den radiologischen Untersuchungen spielt die Feinnadelbiopsie eine wichtige Rolle bei der Diagnose. Anhand der Nadelbiopsie wird unterschieden, ob es sich um einen gut- oder bösartigen Tumor handelt, und der Behandlungsplan wird entsprechend gestaltet.
Bei den meisten gutartigen Speicheldrüsentumoren handelt es sich um gemischte Tumore oder pleomorphe Adenome, die häufiger bei Frauen im Alter von 30-60 Jahren auftreten. Im Allgemeinen werden alle gutartigen Tumore chirurgisch behandelt. Bei dieser Operation wird die Speicheldrüse, in der sich der Tumor befindet, als Ganzes entfernt. Bei gutartigen Ohrspeicheldrüsentumoren wird, wenn der tiefe Lappen nicht vom Tumor befallen ist, nur der oberflächliche Lappen operativ entfernt.
Was bedeutet ein bösartiger Speicheldrüsentumor?
Bösartige Tumore werden nach dem klinischen Verhalten des Tumors, der Ausbreitungsgeschwindigkeit und dem Grad der strukturellen Veränderung in niedrig-, mittel- und hochgradige Tumore eingeteilt. Hochgradige Tumore sind aggressiver, neigen zur Ausbreitung auf umliegendes Gewebe und Halslymphknoten und haben ein hohes Risiko der Fernmetastasierung. Die erste Option bei der Behandlung von bösartigen Speicheldrüsentumoren ist die Operation. Bei der Operation sollte der Tumor weitgehend entfernt werden, einschließlich des normalen Gewebes um den Tumor herum. Wichtige Nerven wie der Gesichtsnerv und der Zungennerv, die durch das Operationsgebiet verlaufen, sollten erhalten werden, es sei denn, der Tumor ist nicht betroffen. Bei Tumoren mit Ausbreitung in die Halslymphknoten und hohem Risiko einer Metastasierung in die Halslymphknoten werden bei der Operation auch die benachbarten Lymphknoten entfernt, selbst wenn kein offensichtlicher Befall vorliegt (neck dissection surgery). Eine Strahlentherapie wird bei kleinen Tumoren nur selten als Hauptbehandlung gewählt. Bei großen Tumoren mit hohem Streuungsrisiko wird nach der Operation eine Strahlentherapie an der Operationsstelle durchgeführt, um ein Wiederauftreten des Tumors in demselben Gebiet zu verhindern.
Eine medikamentöse Behandlung (Chemotherapie) kann bei Patienten, die aufgrund anderer gesundheitlicher Probleme für eine Operation nicht geeignet sind, sowie bei Patienten mit fortgeschrittener regionaler Ausbreitung und/oder Fernmetastasierung des Tumors bevorzugt werden.
Wie hoch ist die Inzidenz von Speicheldrüsenkrebs?
Bösartige Speicheldrüsentumore machen 3-4 Prozent der bösartigen Tumore im Kopf- und Halsbereich aus. Am häufigsten werden bösartige Speicheldrüsentumore in der Ohrspeicheldrüse (75-80 %), in der submandibulären Speicheldrüse (20 %) und selten in den sublingualen oder kleinen Drüsen beobachtet. Die Mehrzahl der Patienten mit bösartigen Speicheldrüsentumoren ist zwischen 60 und 70 Jahre alt. Sie sind häufiger bei Männern anzutreffen.
Kann Speicheldrüsenkrebs eine Gesichtslähmung verursachen?
Der Gesichtsnerv, der unsere Gesichtsmuskeln steuert, verläuft in der Ohrspeicheldrüse, unserer großen Speicheldrüse. Wenn sich bösartige Tumore der Ohrspeicheldrüse auf den Kühllappen ausbreiten und den Gesichtsnerv befallen, kann eine Gesichtslähmung auftreten.
Welcher Arzt sollte bei einem Verdacht auf Speicheldrüsenkrebs konsultiert werden?
Er sollte einen Hals-Nasen-Ohren-Arzt aufsuchen.
Wie wird eine Biopsie bei Speicheldrüsenkrebs durchgeführt?
Dieses Verfahren kann durch offene Biopsie, Feinnadelaspirationsbiopsie (FNAB), Kernbiopsie und Schnellschnittbiopsie durchgeführt werden. Derzeit ist die FNAB die gängigste Biopsiemethode für Massen in den Ohrspeicheldrüsen und den Unterkieferdrüsen. Bei kleineren Speicheldrüsen wird die offene Biopsie (Inzision) mit einer Zange bevorzugt.
Führt die Feinnadelaspirationsbiopsie bei Speicheldrüsenkrebs zu einer Tumorausbreitung?
Die Nadelbiopsie ist ein diagnostisches Verfahren, das seit vielen Jahren bei Millionen von Patienten in aller Welt durchgeführt wird und auch heute noch Anwendung findet. Bisher gibt es keine wissenschaftlichen Beweise dafür, dass sie eine Tumorausbreitung verursacht. Daher wird sie von Ärzten sicher angewendet.
Kann Speicheldrüsenkrebs verhindert werden?
Leider sind die Ursachen von Speicheldrüsenkrebs noch nicht bekannt. Daher kann auch nichts darüber gesagt werden, wie er verhindert werden kann. Zwar gibt es einen kausalen Zusammenhang zwischen Rauchen und Kehlkopf- oder Lungenkrebs, so dass eine Vorbeugung möglich ist, aber für Speicheldrüsenkrebs gibt es diesen Zusammenhang nicht. Die einzige Maßnahme, die bei Speicheldrüsenkrebs ergriffen werden kann, besteht darin, den Tumor in der Speicheldrüse unverzüglich durch einen chirurgischen Eingriff aus dem Körper zu entfernen.
Kann Speicheldrüsenkrebs frühzeitig diagnostiziert werden?
Wenn der Patient eine Schwellung oder Masse vor dem Ohr, unter dem Kiefer oder im Mund- und Rachenraum bemerkt, beginnt nach einiger Zeit der diagnostische Prozess. Der Arzt, der bei der Untersuchung einen Speicheldrüsentumor vermutet, greift in der Regel auf bildgebende Verfahren wie Ultraschall, MRT (Magnetresonanztomographie) oder CT (Computertomographie) zurück. Dies ist der zweite Schritt nach der Untersuchung zur Sicherung der Tumordiagnose. Manchmal ist eine Nadelbiopsie zur Entnahme einer Zell- oder Gewebeprobe aus der Masse erforderlich, um die Diagnose zu bestätigen und die genauesten Vorbehandlungspläne zu erstellen.
Kann Speicheldrüsenkrebs metastasieren?
Bösartige Tumore (maligne, bösartig) wachsen schneller und haben das Potenzial, in regionale Lymphknoten und entfernte Organe (Lunge, Leber, Gehirn, Knochen usw.) zu metastasieren (streuen). Sie dringen in das umliegende Gewebe ein (Invasion) und entwickeln sich durch Störung ihrer Funktionen.
Bleibt nach einer Speicheldrüsenkrebsoperation eine Narbe im Gesicht zurück?
Bei Operationen an der Ohrspeicheldrüse wird ein Schnitt von der Vorderseite des Ohrs über die Rückseite des Kiefers bis unter das Kinn geführt. Am Ende der Operation wird dieser Schnitt mit subkutanen Nähten verschlossen, die wir als ästhetische Nähte bezeichnen, und die Heilung wird mit einer minimalen Narbe beobachtet. Durch die Platzierung dieses Schnittes hinter dem Ohr kann die Möglichkeit einer Narbenbildung stark reduziert werden. In ähnlicher Weise wird bei Operationen an der Unterkieferdrüse ein etwa 3 cm langer Schnitt unter dem Kinn gesetzt und mit subkutanen Nähten verschlossen. Die nach der Heilung verbleibende Narbe ist vernachlässigbar.
Welche Folgen hat die Entfernung der Speicheldrüsen nach einer Speicheldrüsenoperation?
Die einseitige Entfernung der Ohrspeicheldrüse und der Unterkieferdrüsen verursacht keine Probleme wie Speichelfluss und Mundtrockenheit. Die Speicheldrüsen und mikroskopisch kleinen Speicheldrüsen auf der anderen Seite des Gesichts übernehmen die Funktion der fehlenden Drüse. In der Spätphase der Speicheldrüsenoperation sind Funktionen wie Ernährung und Sprache nicht beeinträchtigt.
Wie lange dauert eine Speicheldrüsenkrebsoperation?
Bei der Untersuchung von Speicheldrüsenkrebs und -tumoren wird zunächst untersucht, wo sich das Krebsgewebe befindet. Zweitens wird versucht zu unterscheiden, ob dieser Tumor gutartig oder bösartig ist. Danach werden die Behandlungsmöglichkeiten erörtert und die für den Patienten am besten geeignete und am wenigsten schädliche Behandlung gefunden. Diese Behandlung sollte diejenige sein, die dem Patienten das geringste Organ, den geringsten Verlust an Arbeitskraft und das geringste Leid zufügt, kurz gesagt, eine Behandlung, die die Lebensqualität nur minimal beeinträchtigt.
Bei den anschließenden Untersuchungen wird versucht festzustellen, wie weit sich der Tumor in dem Gebiet, in dem er sich befindet, ausgebreitet hat, ob er auf die Umgebung, insbesondere die Halslymphknoten, übergegriffen hat und ob er sich auf andere Körperteile ausgebreitet hat. Nach Erhalt dieser Informationen wird unter Berücksichtigung des Allgemeinzustands des Patienten ein Behandlungsplan erstellt.
Wie lange dauert der Krankenhausaufenthalt bei einer Speicheldrüsenkrebsoperation?
Je nach Art des Eingriffs beträgt die durchschnittliche Dauer des Krankenhausaufenthalts in der Regel 2-4 Tage.
Was ist nach der Operation zu beachten?
Nach der Operation wird ein Schlauch, eine sogenannte Drainage, eingeführt, um Blut und Flüssigkeit aus dem Operationsgebiet abzuleiten. Die Drainage wird in der Regel nach 24 bis 48 Stunden entfernt. Ein Verband verbleibt jedoch für 3 bis 4 Tage, um eine Ansammlung von Flüssigkeit im Operationsgebiet zu verhindern. Wenn Fäden auf der Haut vorhanden sind, werden sie je nach Wunsch des Arztes am 5. bis 7. Tag entfernt.
Während dieser Zeit sind insgesamt 3 oder 4 Verbände ausreichend. Wenn der Hautschnitt mit speziellen selbstschmelzenden Fäden diskret verschlossen wird, müssen die Fäden nicht entfernt werden. In der Woche nach der Operation kann der Patient die meiste Zeit ein Bad nehmen. Im Falle einer Infektion kann es angebracht sein, für 3-4 Tage Antibiotika zu verabreichen.
Nach dem Aufwachen von der Operation erhält der Patient für einen Zeitraum von 3-4 Stunden keine Nahrung oder Flüssigkeit über den Mund, bis die Betäubung nachlässt. Am Tag der Operation wird der Patient in den folgenden Stunden in der Regel mit weicher, flüssiger Nahrung gefüttert und beginnt in der Regel am nächsten Tag mit der normalen Nahrungsaufnahme. Vor allem nach umfangreichen Operationen wegen bösartiger Tumore kann es jedoch länger dauern, bis sich der Patient erholt hat und zu seiner normalen Ernährung zurückkehrt.
Im Allgemeinen werden bei Operationen im Gesichts- und Halsbereich die Schnittführung und der postoperative Verschluss mit besonderer Sorgfalt und unter Berücksichtigung kosmetischer Gesichtspunkte durchgeführt. Um jedoch Narbenbildung (Narbengewebe) zu vermeiden, die in der Spätphase auftreten kann, werden die Patienten gebeten, den Schnittbereich bis zu einem Jahr lang nicht der Sonne auszusetzen. Wenn sie ins Freie gehen, wird ihnen geraten, sich mit Cremes mit hohem Lichtschutzfaktor oder Accessoires wie Schals und Tüchern zu schützen. Darüber hinaus können einige Cremes und Gele das Narbengewebe weniger auffällig machen.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
Gastrointestinale onkologische Chirurgie
- Erkrankungen der Speiseröhre (Speiseröhrenkrebs, Reflux, Hiatushernie, Achalasie, Ösophagusdivertikel…)
- Magen- und Zwölffingerdarmkrankheiten (Magen- und Zwölffingerdarmkrebs, morbide Adipositas, metabolische Adipositaschirurgie, Tumore…), Dünn- und Dickdarmerkrankungen (Colitis ulcerosa, Morbus Crohn, Dickdarmkrebs…)
- Erkrankungen des Anus und des Analkanals (Analfissur, Analfistel, Hämorrhoiden, Analpolypen, anale Inkontinenz, Analprolaps, Analabszess und Analkrebs…)
- Lebererkrankungen (Krebs, Riesenhämangiom, Hydatidenzyste, Metastasen…)
- Erkrankungen der Bauchspeicheldrüse (Krebs, Pseudozysten und Zysten der Bauchspeicheldrüse),
- Erkrankungen der Gallenblase und der Gallenwege (Gallenblasen- und Gallenwegssteine, Gallenblasenkrebs)
- Peritonealkrebs und Metastasen (Peritonealchirurgie)
Fortgeschrittene laparoskopische – robotergestützte Anwendungen
– Laparoskopisch-robotergestützte Adipositas-Operationen
Zu den chirurgischen Eingriffen, die eine rasche Behandlung der Fettleibigkeit ermöglichen, gehören Stoffwechsel- und Diabetesoperationen wie die Sleeve-Gastrektomie, der Magenbypass (Mini-Magenbypass und Roux n Y-Magenbypass), die Transit-Bipartition, SADI-S, SAGI-S, der Duodenal-Switch, die biliopankreatische Diversion, die ileale Interposition und der jejunoileale Bypass. Diese chirurgischen Eingriffe werden mit laparoskopischen und robotergestützten Methoden durchgeführt, was sowohl für den Chirurgen als auch für den Patienten einen angenehmen Operationsverlauf bedeutet. Der Patient kann nach diesen Eingriffen schon nach kurzer Zeit zur Arbeit und ins gesellschaftliche Leben zurückkehren.
– Laparoskopische – robotergestützte Operationen bei gastroösophagealem Reflux, Achalasie und Hiatushernie
Reflux, der durch den Austritt von Mageninhalt in die Speiseröhre aufgrund einer Störung der Struktur zwischen Speiseröhre und Magen im Verdauungssystem entsteht, Achalasie, bei der Nahrung in der Speiseröhre stecken bleibt, und Hernien, die sich im Zwerchfellmuskel bilden können (Hiatushernie), werden mit modernen laparoskopisch-robotischen Anwendungen der Gastroenterologie behandelt.
– Laparoskopisch-robotergestützte Kolektomie bei Dickdarmkrebs – TKME, anterior und low anterior bei Rektumkarzinomen – Ta-TME – intersphinkterisch – Cecil-Operationen – Chirurgische Techniken, die mit natürlichen Mitteln wie NOSE durchgeführt werden
Bei entzündlichen Darmerkrankungen (Morbus Crohn oder Colitis ulcerosa) kann eine chirurgische Entfernung des Darms erforderlich sein, wenn Komplikationen auftreten oder die Behandlung nicht anspricht. In diesen Fällen ermöglichen die laparoskopisch-robotische Dünndarm-Dickdarm-Resektion, die totale Proktokolektomie und andere Eingriffe eine wesentlich schnellere Genesung als offene chirurgische Verfahren.
– Laparoskopisch-robotergestützte Splenektomie (Operation von Milzerkrankungen)
Die Entfernung der Milz aufgrund von hämatologischen Erkrankungen oder Verletzungen wird als Splenektomie bezeichnet. Bei Splenektomien, die mit modernen laparoskopisch-robotischen Anwendungen durchgeführt werden, wird im Vergleich zu offenen Operationen ein viel kleinerer Schnitt gesetzt und der Krankenhausaufenthalt verkürzt.
– Laparoskopische Appendektomie
Die Blinddarmentzündung, eine häufige und akute Erkrankung, erfordert eine dringende Operation. Die Appendektomie, die früher als offene Operation durchgeführt wurde, wird heute per Laparoskopie und geschlossener Methode durchgeführt, und die Patienten können innerhalb von 1 bis 2 Tagen in ihr tägliches Leben zurückkehren.
– Laparoskopisch-Robotische Adrenalektomie (Operation bei Nebennierenerkrankungen)
Nebennieren sind Drüsen, die oberhalb der Niere liegen. Gutartige und bösartige Tumore und hormonproduzierende Tumorläsionen in den Nebennieren können mit einer laparoskopischen Adrenalektomie durch eine geschlossene Methode entfernt werden.
– Laparoskopische – robotergestützte Cholezystektomie (Operation von Gallenblasenerkrankungen)
In Fällen wie Sand und Steinen in der Gallenblase und damit verbundenen Entzündungen, Verstopfungen und Gelbsucht ist die einzige und endgültige Lösung eine Cholezystektomie. Die Cholezystektomie, bei der die Gallenblase entfernt wird, kann durch das Öffnen kleiner Schnitte mit der laparoskopisch-robotischen Methode schnell durchgeführt werden.
Multidisziplinäre Anwendungen
In der Abteilung für fortgeschrittene onkologische Chirurgie des Memorial Bahçelievler Hospitals wird die Diagnose und Behandlung aller Erkrankungen der Verdauungsorgane mit multidisziplinären Ansätzen durchgeführt.
GASTROINTESTINALE ONKOLOGISCHE CHIRURGIE
- Abteilung für gastroenterologische Chirurgie
- Abteilung Gynäkologie -Onkologische Chirurgie
- Radiologie, Abteilung für Interventionelle Radiologie
- Abteilung für Gastroenterologie und Abteilung für fortgeschrittene gastroenterologische Interventionen
- Pathologie – Zytologiezentrum
- Abteilung für medizinische Onkologie
- Abteilung für Strahlenonkologie
- Zentrum für Nuklearmedizin
- Abteilung Endokrinologie
- Abteilung für Psychiatrie
- Ernährungsberatungsstelle
- Psychologische Behandlungseinheit
- Einheit zur Unterstützung der Ernährung
Die Leistungen werden in Zusammenarbeit mit Spezialisten und Teams erbracht. Unser erfahrenes und spezialisiertes akademisches Personal führt offene, laparoskopische und robotergestützte Operationen in den Bereichen Speiseröhren- und Magenchirurgie, Leber-, Bauchspeicheldrüsen- und Gallenchirurgie, Dickdarm- und Enddarmchirurgie sowie Adipositas- und Stoffwechselchirurgie durch. Darüber hinaus werden alle Krebsarten wie Magen-, Dickdarm-, Mastdarm-, Bauchspeicheldrüsen-, Leber-, Speiseröhren-, Gallenblasen-, Dünndarm-, Bauchfell- und intraabdominale Krebserkrankungen behandelt.
Krankheiten, die im Zentrum für gastrointestinale onkologische Chirurgie behandelt werden:
– Gutartige und bösartige Tumore der Speiseröhre
Tumore in der Speiseröhre können gut- oder bösartig sein, in den meisten Fällen müssen sie jedoch aufgrund ihrer Gefährlichkeit durch einen chirurgischen Eingriff entfernt werden. Dieser Eingriff wird von Fachärzten in unserer Abteilung für fortgeschrittene onkologische Chirurgie durchgeführt.
– Gutartige und bösartige Tumore des Magens
Tumore, die sich in der Magenschleimhaut bilden, können gutartig oder bösartig sein. Magentumore werden von unserem Team in der Abteilung für fortgeschrittene onkologische Chirurgie entfernt, nachdem die Art, die Größe und die Neigung zu Krebs untersucht wurden.
– Chirurgische Eingriffe bei Zwerchfellhernie und Refluxkrankheit
Zwerchfellbrüche und gastroösophageale Refluxkrankheiten, die in allen Altersgruppen zu beobachten sind, können mit Hilfe von chirurgischen Eingriffen vollständig beseitigt oder ihre Auswirkungen minimiert werden.
– Chirurgische Erkrankungen des Dünndarms
Die chirurgischen Eingriffe dienen der Behandlung von Obstruktionen, Verwachsungen, Geschwüren, Tumoren, Fisteln, Divertikeln und Hernien im Dünndarm. Die Chirurgie dieser Krankheiten wird von den Ärzten der Abteilung für fortgeschrittene onkologische Chirurgie durchgeführt.
– Robotik – Laparoskopische und offene Operationen von Dickdarm- und Enddarmtumoren
Gutartige Tumore, die im Dick- und Enddarm entdeckt werden, werden in der Regel auf Empfehlung des Arztes und unter Berücksichtigung ihrer Größe operativ entfernt. Bösartige Tumore werden unabhängig von ihrer Größe mit Hilfe von chirurgischen Eingriffen entfernt. Nach dem Eingriff wird auch untersucht, ob sich der Tumor auf andere Gewebe ausgebreitet hat, und es werden gegebenenfalls zusätzliche Behandlungen durchgeführt.
– Chirurgische Eingriffe bei entzündlichen Darmerkrankungen (Morbus Crohn und Colitis ulcerosa)
Bei entzündlichen Darmerkrankungen wie Morbus Crohn und Colitis ulcerosa richtet sich die Behandlung nach vielen Faktoren wie dem Ort der Erkrankung, den Symptomen des Patienten und seinem Alter. In einigen Fällen kann es erforderlich sein, einen Teil des Dünndarms und den gesamten Dickdarm zu entfernen. Zu diesem Zweck werden bei chirurgischen Eingriffen laparoskopische und robotergestützte Methoden eingesetzt.
– Behandlung von Hämorrhoiden, Analfissuren, Analfisteln und Pilonidalsinus
Pilonidalsinus, auch als eingewachsene Haare bekannt, Analfistel, die zwischen dem letzten Teil des Dickdarms und der Haut entsteht, Analfissur, die als Riss im Anus definiert wird, und Hämorrhoiden, im Volksmund auch Hämorrhoiden genannt, sind Krankheiten, die in den Bereich der Abteilung für fortgeschrittene onkologische Chirurgie fallen und mit Hilfe von chirurgischen Eingriffen behandelt werden können.
– Chirurgie von Zysten und Tumoren der Bauchspeicheldrüse
In der Bauchspeicheldrüse kann eine Vielzahl von Zysten und Tumoren auftreten. In einigen Fällen können diese Zysten unter Beobachtung gehalten werden, wenn sie keine Gefahr für die Patienten darstellen. Bei der Mehrzahl dieser Zysten und Tumore handelt es sich jedoch um Läsionen, die chirurgisch entfernt werden müssen.
– Behandlung der akut-chronischen Pankreatitis und ihrer Komplikationen
Bei akuter und chronischer Bauchspeicheldrüsenentzündung können zusätzlich zu den endoskopischen Methoden chirurgische Eingriffe zur Behandlung der Krankheit und ihrer Komplikationen erforderlich sein.
– Chirurgische Behandlung aller Arten von Lebertumoren
Lebertumore sind häufig vorkommende Gebilde, die in manchen Fällen keine Probleme bei den Patienten verursachen, in manchen Fällen können sie jedoch ernsthafte Probleme verursachen, da sie dazu neigen, bösartig zu werden. Diese Tumore werden mit Hilfe eines chirurgischen Eingriffs entfernt, wenn dies als notwendig erachtet wird, wobei ihre Größe und die Frage, ob sie bösartig sind oder nicht, berücksichtigt werden.
– Chirurgische Eingriffe bei zystischen Erkrankungen der Leber
Parasitäre (infektiöse) Zysten und nichtparasitäre (strukturelle oder krebsbedingte) Zysten in der Leber werden chirurgisch entfernt, wenn sie eine Gefahr darstellen oder der Arzt dies für notwendig hält.
– Chirurgische Behandlung von Steinen und Tumoren der Gallenblase und der Gallengänge
Steine in der Gallenblase können Entzündungen in der Gallenblase und den Gallengängen verursachen und durch Verstopfung der Gallenwege zu Infektionen führen. Außerdem können sich in der Gallenblase und den Gallengängen Tumore bilden. Chirurgische Eingriffe werden von den Spezialisten der Abteilung für fortgeschrittene onkologische Chirurgie bei Erkrankungen durchgeführt, die durch Tumore und Steine in der Gallenblase oder den Gallenwegen verursacht werden.
– Chirurgische Behandlung von hämatologischen, zystischen und tumorösen Erkrankungen der Milz
Zu den Erkrankungen, die sich in der Milz zeigen können, gehören hämatologische Erkrankungen, zystische und tumoröse Probleme. Bei diesen Erkrankungen werden in der Abteilung für fortgeschrittene onkologische Chirurgie chirurgische Eingriffe durchgeführt, wenn dies für notwendig erachtet wird. Der häufigste dieser Eingriffe ist die Entfernung der Milz, die sogenannte Splenektomie.
– Robotisch-Laparoskopische Chirurgie bei Bauchwand- und Operationsbrüchen
Anwendungen der gastroenterologischen Chirurgie werden bei der Behandlung von Verwachsungen und ähnlichen Problemen in der Bauchwand sowie bei chirurgischen Leistenbrüchen eingesetzt. Bei diesen Eingriffen können robotergestützte Chirurgie und Laparoskopietechniken eingesetzt werden, wenn der Gesundheitszustand und die Erkrankung des Patienten dies zulassen.
ENDOSKOPIE-ANWENDUNGEN
– Diagnostische Gastroskopie und Koloskopie
Gastroskopie- und Koloskopie-Anwendungen werden für die Diagnose und Behandlung bestimmter Krankheiten benötigt. Die Gastroskopie wird bevorzugt bei der Untersuchung von Magenkrankheiten eingesetzt, während die endoskopischen Anwendungen, die Koloskopie, bei der Untersuchung von Dickdarmerkrankungen bevorzugt werden.
– Perkutane endoskopische Gastrostomie (PEG), Jejunostomie (PEJ)
Die perkutane endoskopische Gastrostomie (PEG) oder perkutane endoskopische Jejunostomie (PEJ) wird in der Abteilung für gastroenterologische Chirurgie durchgeführt, um Patienten, die nicht essen können und nicht über den Mund ernährt werden sollen, eine gesunde und angemessene Ernährung zukommen zu lassen, und es wird eine Ernährungssonde gelegt, die direkt in den Magen führt.
– Endoskopische Stentplatzierung
Bei Erkrankungen, die mit einer Verengung des Magen-Darm-Trakts einhergehen, kann die Verengung durch Einsetzen eines Stents in den betreffenden Bereich mit Hilfe endoskopischer Methoden beseitigt werden. Dieses Verfahren kann in der Abteilung für fortgeschrittene onkologische Chirurgie unter geeigneten Bedingungen durchgeführt werden.
HYPEC (HEISSCHEMOTHERAPIE) UND PIPAC (AEROSOL-DRUCKCHEMOTHERAPIE)
HIPEC (Hypertherme Intraperitoneale Chemotherapie) ist eine Behandlungsform mit der Bezeichnung “Hypertherme Intraperitoneale Chemotherapie”, die in den letzten Jahren häufig in der Krebsbehandlung eingesetzt wird.
Heutzutage werden in der Krebsbehandlung viele verschiedene Methoden eingesetzt, und es werden bedeutende Erfolge erzielt. Die intraabdominale heiße Chemotherapie, HIPEC genannt, ist einer der wichtigsten Schritte in diesem Bereich, um sowohl die Lebenszeit des Patienten zu verlängern als auch seine Lebensqualität zu verbessern.
Bei einigen Krebsarten, die von intraabdominalen Organen ausgehen, kann eine systemische Chemotherapie, die intravenös vor (neoadjuvante Behandlung) oder nach (adjuvante Behandlung) oder sowohl vor als auch nach einer chirurgischen Behandlung verabreicht wird, nicht die erwartete Reaktion hervorrufen. Wenn in diesem Fall das gewünschte Ansprechen auf die Behandlungen ausbleibt, schreitet die Krankheit allmählich fort, und schließlich kann das Leben des Patienten gefährdet sein.
Behandlungsmöglichkeit für intra-abdominale Krebserkrankungen im fortgeschrittenen Stadium: HIPEC
An dem Punkt, an dem eine Krebsbehandlung nicht mehr die gewünschte Wirkung zeigt, kommt die “intraabdominale heiße Chemotherapie – HIPEC” zum Einsatz, eine Methode, die sowohl die Lebenserwartung des Patienten verlängert als auch sein Wohlbefinden verbessert. Das Ziel der intraabdominalen Chemotherapie ist wie folgt: Die intra-abdominalen Organe und der Bauchraum sind mit einer Schicht bedeckt, die “Bauchfellmembran” genannt wird. Diese Struktur bedeckt sowohl die Oberfläche der intra-abdominalen Organe als auch die innere Oberfläche der Bauchwand. Diese dünne Schicht, die den Bauchraum bedeckt, sorgt mit der geringen Menge an Flüssigkeit, die sie absondert, für die Schmierung der Organe. Während sich der Krebs in dem Organ, von dem er ausgeht, weiter entwickelt, breitet er sich im weiteren Verlauf der Erkrankung auf andere Organe und Bereiche aus.
Wie wird die HIPEC-Behandlung durchgeführt?
Krebs kann sich über das Blut, die Lymphknoten und die Bauchhöhle ausbreiten. Daher kann der Tumor in fortgeschrittenen Stadien von intraabdominalen Krebserkrankungen auch auf das Bauchfell übergreifen. In diesem Fall, der im letzten Stadium der Krebserkrankung auftritt, erreichen die intravenös verabreichten Medikamente das Bauchfell möglicherweise nicht in der gewünschten Menge und die Behandlung kann unzureichend sein. Das dicht mit Tumoren bedeckte Peritoneum sollte jedoch philosophisch als Organ betrachtet werden, und durch Spülen des Peritoneums und des oder der betroffenen Organe sollte die intraabdominale Höhle mikroskopisch so weit wie möglich tumorfrei gemacht werden. Dieses Verfahren wird als “SRC (zytoreduktive Chirurgie+Peritonektomie)” bezeichnet. Im Anschluss an diese Eingriffe werden mit einem speziellen Gerät tumorzerstörende Medikamente mit einer Temperatur von 42-43 Grad in die Bauchhöhle verabreicht. Der intraabdominale Waschvorgang dauert zwischen 60 und 90 Minuten. Während dieser Zeit sollen die Tumorzellen auf mikroskopischer Ebene zerstört werden.
Warum werden Chemotherapeutika erhitzt?
Intra-abdominale Erhitzung von Krebsmedikamenten;
- Wärme erleichtert das Eindringen des Medikaments in das Gewebe und erhöht die krebszellenabtötende Wirkung des ausgewählten Chemotherapeutikums.
- Die Wärme selbst hat eine tumorhemmende Wirkung, und die Wärme trägt zur gleichmäßigen Verteilung des Medikaments auf allen Oberflächen im Bauchraum bei.
- Bei der HIPEC werden die Tumorzellen mechanisch von der Oberfläche des Dünndarms und von den Gerinnungs-Fibrin-Schichten entfernt.
Bei welchen Krankheiten wird die HIPEC eingesetzt?
Bei Patienten mit Peritonealbeteiligung im fortgeschrittenen Krebsstadium beginnt sich Flüssigkeit (Aszites) im Bauchraum anzusammeln. Diese Flüssigkeit kann dazu führen, dass der Bauch des Patienten allmählich anschwillt und die Atmung und der Kreislauf durch den Druck und die Spannung, die sie erzeugt, problematisch werden. Manchmal breitet sie sich so stark aus, dass sie sogar das Liegen des Patienten verhindert. Sie führt auch dazu, dass sich die Krebszellen auf andere Bereiche des Bauches ausbreiten. Obwohl es möglich ist, die Flüssigkeit durch die Kanüle abzuleiten, um den Patienten zu entlasten, kommt es im weiteren Verlauf der Pathologie erneut zu Flüssigkeitsansammlungen. Patienten mit fortgeschrittenem Krebs sind diejenigen, die alle Behandlungsmöglichkeiten hinter sich gelassen haben, und in solchen Fällen kommt die HIPEC-Behandlung, die das Leben des Patienten verlängert und ihm Lebenskomfort bietet, auf die Tagesordnung. Mit diesem Verfahren werden erfolgreiche Ergebnisse bei Krebserkrankungen des Bauchfells selbst, Blinddarmkrebs und Eierstockkrebs bei Frauen erzielt. Darüber hinaus wird es inzwischen auch bei Dickdarm-, Magen- und neuerdings auch bei Bauchspeicheldrüsenkrebs eingesetzt.
Einige Komponenten sollten bei der Durchführung solcher Behandlungen nicht außer Acht gelassen werden. Es ist sinnvoll, wenn alle Phasen der Behandlung gemeinsam durchgeführt werden.
In welchen Fällen ist die HIPEC-Behandlung nicht anwendbar?
HIPEC wird nicht durchgeführt, wenn Metastasen außerhalb des Abdomens vorhanden sind. Gehirn, Knochen, Lungenmetastasen…). Wenn drei oder weniger Metastasenherde in der Leber vorhanden sind, kann eine HIPEC durchgeführt werden, indem diese entfernt werden. Bei ausgedehnten Lebermetastasen ist eine HIPEC jedoch nicht angezeigt. Ein weiteres wichtiges Organ ist der Dünndarm. Da der Dünndarm das Organ der Nährstoffaufnahme im Verdauungssystem ist, sind ausgedehnte Dünndarmresektionen nicht mit dem Leben vereinbar. Daher ist es wenig sinnvoll, bei Patienten mit ausgedehntem Dünndarmbefall eine HIPEC durchzuführen. Die meisten dieser Patienten haben Krebs im fortgeschrittenen Stadium und ihre Lebenserwartung ist auf wenige Monate begrenzt. Dieses wichtige Detail sollte nicht außer Acht gelassen werden, und es sollte berücksichtigt werden, dass die Krankheit nicht vollständig geheilt und beseitigt werden kann, aber der Lebenskomfort und die Lebenserwartung können verlängert werden.
PIPAC – DRUCK-AEROSOL-CHEMOTHERAPIE
PIPAC-Ära bei der Behandlung von Unterleibskrebs
Bei der PIPAC-Methode handelt es sich um eine “Druck-Aerosol-Chemotherapie”, die bei Krebserkrankungen des Bauchfells eingesetzt wird und das Problem beseitigt, dass intravenöse Chemotherapeutika die natürlichen Falten des Körpers nicht erreichen. Mit dieser Methode wird der Tumor in der idealen Patientengruppe kontrolliert und die Lebenserwartung und Lebensqualität des Patienten erhöht.
Was ist die Definition von intra-abdominalem Krebs?
Die “Peritonealschicht”, die die Bauchwand vollständig umgibt und auch die intraabdominalen Organe bedeckt, wird als eigenes Organ anerkannt. Zu den Krebserkrankungen in dieser Region gehören Tumoren, die vom Bauchfell selbst ausgehen, sowie Metastasen von Krebserkrankungen des Dick- und Enddarms, der Eierstöcke, der Gebärmutter und des Magens. Durch das Fortschreiten dieser bereits bestehenden Krebserkrankungen können Krebszellen über das Blut oder die Lymphe in die Umgebung, in der sie sich befinden, metastasieren, und es kann zu einer Erkrankung kommen, die die intraabdominalen Organe umfassend betrifft. Nach einer intra-abdominalen Metastasierung kommt es in dieser Region zu einer Flüssigkeitsansammlung, die als Aszites bezeichnet wird. Ein Bild, das zeigt, dass der Patient von keiner Behandlung profitieren kann, bildet die Gruppe der fortgeschrittenen Krebsfälle. In solchen Fällen erhält der Patient eine intravenöse Chemotherapie, die als systemische Chemotherapie bezeichnet wird. Es kann auch eine Strahlentherapie durchgeführt werden, aber manchmal geht die Chemotherapie nicht über einen bestimmten Punkt hinaus. Das Medikament erreicht das Peritoneum, kann aber nicht in dieses eindringen. Denn diese Membran, die keine eigenen Gefäße hat, wird durch Diffusion gespeist. Daher kann die Streuung im Bauchfell durch die Behandlung nicht beseitigt werden. Der Tumor breitet sich aus wie eine Handvoll Bulgur.
Wie wird die PIPAC-Methode bei intra-abdominalen Krebserkrankungen angewendet?
Die SRC (Peritonektomie und zytoreduktive Chirurgie), die bei Patienten mit metastasierten Tumoren durchgeführt wird, bedeutet eine Verkleinerung des Tumors. Bei der Auswahl der Patientengruppe, die diese Behandlung erhält, werden bestimmte Kriterien berücksichtigt. Bei einem Patienten mit Dickdarmkrebs wird die Peritonealmembran vollständig abgeschält und entfernt, wenn die Tumorausbreitung nicht die Leber erreicht hat, sondern weit auf das Peritoneum verteilt ist. Der Chirurg entfernt alle zugänglichen Tumore chirurgisch oder durch Kauterisation. Nach der Reinigung wird das Medikament in einer Dosis von 1/10 mit der PIPAC genannten heißen Druckchemotherapiemethode in den Bauchraum verabreicht. Mit anderen Worten: Wenn der Patient bei der systemischen Chemotherapie 10 Gramm des Medikaments intravenös erhält, kann der gleiche Erfolg mit 1 Gramm des Medikaments in PIPAC erzielt werden. Auf diese Weise wird die zytotoxische Wirkung der krebszerstörenden Medikamente auf die gesunden Zellen des Patienten reduziert und eine hohe Wirksamkeit erreicht.
Für welche Patientengruppe ist das Verfahren geeignet?
Die Patienten können bereits einen Tag nach der PIPAC-Anwendung entlassen werden. Bei günstigem Behandlungsverlauf kann das Verfahren vier Wochen später wiederholt werden. Das Verfahren, das mit dieser Eigenschaft einen wichtigen Vorteil bietet, gibt Patienten Hoffnung, denen gesagt wird, dass “nichts getan werden kann”.
Welchen Beitrag leistet das PIPAC-Verfahren zur Lebenserwartung und -qualität des Patienten?
Bei der laparoskopischen PIPAC-Behandlung wird der Bauchraum durch zwei Schnitte von 1 cm und 0,5 cm betreten. Das zu verabreichende Medikament wird je nach Art des Organs, von dem der Tumor ausgeht, ausgewählt. Das unter hohem Druck stehende, erhitzte Chemotherapeutikum wird mit einem stiftähnlichen Gerät durch die Trokare, die in den Bauchraum eindringen, über die gesamte Fläche verteilt. Mit dieser Methode kann das Medikament alle Bereiche erreichen. Während des Eingriffs werden an bestimmten Stellen Triangulationsmarkierungen gesetzt, so dass die Behandlung bei Bedarf nach vier Wochen wiederholt werden kann. Diese Behandlung, die bei Bedarf nach vier Wochen wiederholt werden kann, kann sieben bis acht oder sogar bis zu zehn Mal durchgeführt werden. Bei der dritten oder vierten Behandlung ist ein fast vollständiges Verschwinden des Tumors an den markierten Stellen zu beobachten. Die Lebenserwartung von ein bis zwei Monaten kann manchmal um das Zehnfache erhöht werden. Hierfür sind jedoch der allgemeine Gesundheitszustand des Patienten, die Zellstruktur, der Tumortyp und die genetische Struktur von großer Bedeutung.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
Interventionelle Neuroradiologie
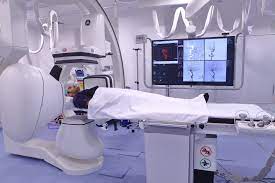
In welchen Bereichen wird die Interventionelle Neuroradiologie eingesetzt?
Angiographie des Gehirns und der Wirbelsäule;
Die Angiographie der Hirn- und Halsgefäße ist das Standardverfahren. Dabei wird ein röntgendichtes Kontrastmittel in das Blutgefäß gespritzt. Während der Injektion des Kontrastmittels wird ein Durchleuchtungsgerät (Angiographie) verwendet, um das Bild zu betrachten und aufzuzeichnen. Der Eingriff beginnt mit einer örtlichen Betäubung an der Eintrittsstelle des entsprechenden Blutgefäßes. Eine Schleuse wird in die Vene eingeführt. Ein Katheter wird in die zu untersuchenden Gefäße eingeführt und die Anatomie und Pathologien dieses Gefäßes werden sichtbar gemacht. Insbesondere werden Gefäßblasen und -verschlingungen sichtbar gemacht und die Behandlung geplant.
Embolisation von Aneurysmen (Blasen);
Ein Aneurysma ist eine anormale fokale Vergrößerung einer Arterie, die durch eine Schwächung der inneren Muskelschicht (Intima) der Wand eines Blutgefäßes verursacht wird. Es tritt am häufigsten im Alter zwischen 35 und 45 Jahren auf. Diese Vergrößerung kann sich verdünnen und ohne Vorwarnung reißen. Im Falle einer Ruptur besteht die Gefahr eines Schlaganfalls, da der Blutfluss eingeschränkt oder vollständig blockiert wird. Die geplatzte Blase kann auch zu einer Blutung zwischen den Hirnhäuten (Subarachnoidalblutung) führen. Die meisten Aneurysmen sind weniger als 2,5 cm groß; Aneurysmen, die größer sind, werden als Riesenaneurysmen bezeichnet. Bei Riesenaneurysmen ist die Wahrscheinlichkeit einer Ruptur größer und die Behandlung schwieriger.
Risikofaktoren: Bluthochdruck, Rauchen, genetische Defekte (Ehler-Danlos, tuberöse Sklerose, MKS, Kleinfelter-Krankheit, Alpha-1-Antitirpsin-Mangel), Alkoholkonsum, Drogenkonsum, Traumata und Infektionen können die Bildung von Hirnaneurysmen verursachen. Eine familiäre Vorbelastung, weibliches Geschlecht und ein höheres Alter sind häufiger anzutreffen.
Typen: Saccular (bubble) type sind kuppelförmige Ausstülpungen, die in den Verzweigungsbereichen des Gefäßes auftreten. Sie können einen schmalen oder breiten Hals haben. Fusiforme Aneurysmen sind Erweiterungen in einem kurzen Abschnitt des Gefäßes. Blasenartige Aneurysmen sind Aneurysmen in Form eines Rosendorns.
Ein Hirnaneurysma ist selten symptomatisch, es sei denn, es reißt. Sehr große Aneurysmen können Kompressionssymptome verursachen. Sehverlust, Doppeltsehen, Schmerzen über dem Auge, Taubheitsgefühl auf einer Gesichtshälfte können durch die Kompression entstehen. Wenn ein Aneurysma reißt, kann es zu starken Kopfschmerzen (Kopfschmerzen, die als nie zuvor erlebt beschrieben werden), Übelkeit, Erbrechen, Unfähigkeit, Licht zu sehen, Bewusstlosigkeit, Krampfanfällen und einseitiger Schwäche kommen, die auf einen Schlaganfall hinweist. Das wichtigste Merkmal dieser Befunde ist ihr plötzliches Auftreten.
Diagnose: Hirnaneurysmen werden in der Regel durch eine Tomographie oder MRT nach dem Riss entdeckt. Bei Verdacht auf ein Aneurysma wird eine Angiografie durchgeführt, die den Goldstandard in der Diagnose darstellt. Dabei wird die Struktur des Aneurysmas beurteilt und ein Behandlungsplan erstellt. Mit den neuen Entwicklungen in der Tomographie können Bilder erzielt werden, die der Angiographie nahe kommen. Außerdem werden Probleme, die bei der Angiographie auftreten können, nicht gesehen. Die MRT hilft auch bei der Lokalisierung und Diagnose eines Aneurysmas.
Behandlung: Die endovaskuläre Aneurysma-Behandlung ist eine gute Option für zerebrale Aneurysmen. Die endovaskuläre Behandlung gilt heute als erste Option für die Behandlung von Aneurysmen. Die Behandlungen unterscheiden sich für blutende und nicht blutende Aneurysmen. Bei dem Behandlungsverfahren wird das Innere der Blase mit Coils gefüllt, Stents werden…
AVM-Embolisation
Es handelt sich um abnorme Verknotungen von Blutgefäßen im Gehirn oder Rückenmark. Die Ursache von AVMs ist nicht klar. Die meisten Menschen werden mit ihnen geboren, aber sie können auch später im Leben auftreten. AVMs treten bei einigen Menschen mit hereditärer hämorrhagischer Teleangiektasie (HHT) auf, auch bekannt als Osler-Weber-Rendu-Syndrom. HHT beeinflusst die Art und Weise, wie sich Blutgefäße in verschiedenen Teilen des Körpers, einschließlich des Gehirns, bilden.
Was geschieht bei Vorliegen einer AVM? Das Herz schickt sauerstoffreiches Blut durch die Arterien zum Gehirn und Rückenmark. Die Arterien werden dünner, bis hin zu den kleinsten Blutgefäßen (Kapillaren), und ihre Fließgeschwindigkeit verlangsamt sich. Sie geben sauerstoffreiches Blut an die Gehirnzellen ab. Bei AVMs hingegen gibt es in der Struktur der AVM keine Kapillaren, und das einströmende Blut fließt schnell zum Herzen zurück, wodurch die Ernährung des Gehirns dort gestört wird.
Bei Menschen mit AVM im Gehirn können Kopfschmerzen oder Krampfanfälle auftreten. Bei manchen Menschen wird die AVM aus anderen Gründen oder nach einer Blutung in der Bildgebung des Gehirns entdeckt. Sobald eine AVM im Gehirn diagnostiziert wurde, muss sie behandelt werden, um Komplikationen wie Hirnschäden oder Schlaganfälle zu verhindern. Das Risiko einer AVM-Blutung im Gehirn liegt bei etwa 2 % bis 3 % pro Jahr. Das Blutungsrisiko kann bei einigen Arten von AVM oder bei Personen mit einer früheren AVM-Ruptur höher sein. Hirnblutungen werden durch die Ausdünnung der Wände der betroffenen Arterien und dünnen Gefäße aufgrund von übermäßigem Druck verursacht, wodurch sie platzen können. Diese Blutungen bleiben manchmal unentdeckt, weil sie keine Hirnschäden und keine Anzeichen oder Symptome verursachen. Bei diesen Patienten kommt es zu potenziell lebensbedrohlichen Blutungsepisoden.
Die Behandlung wird in Abhängigkeit davon geplant, ob die AVM blutet oder nicht, wie hoch das Blutungsrisiko ist, wie nahe sie an wichtigen Strukturen liegt und wie groß sie ist. Während des Eingriffs werden diese Gefäßverästelungen aufgesucht und Verschlußmittel verabreicht.
AVF Embolisation
Eine arteriovenöse Fistel (AVF) ist eine abnormale Verbindung zwischen einer Arterie (Schlagader) und einer Vene (Vene). Die Verbindung zwischen einer Arterie mit hohem Druck und einer Vene mit niedrigem Druck kann den Blutfluss in diesem Bereich erhöhen, wodurch sich oft sowohl die Arterie als auch die Vene erweitern. AVFs sind manchmal schon bei der Geburt vorhanden (angeboren) oder entwickeln sich nach der Geburt und sind manchmal die Folge einer Verletzung (erworben).
Arteriovenöse Fisteln im Gesicht oder am Hals verursachen Schwellungen und abnorme Pulsationen oder Herzgeräusche. In extremen Fällen können sie bei Säuglingen zu einer Überlastung des Herzens führen. Selten verursachen sie ernsthafte Probleme mit der Gehirnentwicklung. Manchmal treten die Symptome schon bei der Geburt auf, manchmal wird die Erkrankung erst in der späten Kindheit deutlich. Große Fisteln können bei der Geburt ein Herzversagen verursachen. Kleinere Fisteln können einen erhöhten Druck in den Gefäßen im Kopf verursachen, was zu einem Hydrozephalus oder einer Vergrößerung der Hirnventrikel (Hohlräume im Gehirn, die Flüssigkeit aufnehmen) führt. Fisteln, die sich im Rückenmark entwickeln, können das Rückenmark zusammendrücken und Taubheit und/oder Schwäche verursachen.
Diagnose: Der erste Schritt zur Fisteldiagnose ist die MRT und MRA. Im Zweifelsfall werden CTA oder klassische Angiographieverfahren durchgeführt.
Behandlung: Die endovaskuläre Embolisation ist die häufigste Form der Behandlung einer AVF. Sie wird in der Regel durch Einführen eines Katheters in die zuführende Arterie oder die fistulierte Vene durchgeführt. Um den Blutfluss zu stoppen, werden verschiedene Arten von Gefäßstöpseln wie Coils, abnehmbare Ballons, Embolisationskleber, Embolisationspartikel und Embolisationsmaterial (Onyx genannt) verwendet. Nach dem Verschluss der Verbindung zwischen Arterie und Vene heilt die AVF aus und tritt in der Regel nicht wieder auf. Eine weitere Behandlungsmöglichkeit besteht darin, die Fistel chirurgisch zu verschließen.
Stenting der Halsschlagader: Die Verengung der Halsschlagader ist eine schwerwiegende Erkrankung, die zu Schlaganfällen führen kann. Stenosen über 70 % ohne Beschwerden und Stenosen über 50 % mit wiederkehrendem Schlaganfall erfordern eine Behandlung. Stentverfahren werden vor allem in Fällen angewandt, in denen die Risiken einer chirurgischen Behandlung der Halsschlagader hoch sind, und in Fällen, in denen die Stenose nach der Operation fortbesteht. Die Eingriffe werden in der Regel im Wachzustand und mit leichten Beruhigungsmitteln durchgeführt. Nach lokaler Anästhesie in der Leiste wird die Arterie mit einer Nadel punktiert und die Halsschlagader mit dünnen Schläuchen (Katheter) zugänglich gemacht. Der Eingriff erfolgt unter Durchleuchtung (Angiographie), wobei Kontrastmittel in die Vene gespritzt wird und Bilder aufgenommen werden. Die Verengung in der Halsschlagader wird mit dünnen Drähten überbrückt, und ein Filter wird hinter der Verengung platziert, um eine Gerinnung während des Eingriffs zu verhindern. Die Stenose wird durch Aufblasen über den Filterdraht aufgeweitet. Ein Stent wird in die Stenose eingebracht, und Ballon und Stent werden an die Wand geklebt. Der Eingriff wird durch die Entnahme von Kontrollen abgeschlossen. Zu den Risiken des Verfahrens gehören Blutungen in der Leiste, ein falsches Aneurysma oder ein Gerinnsel im Hirngefäß. Diese treten in weniger als 5 Prozent der Fälle auf.
Behandlung von Schlaganfällen: Der Schlaganfall ist eine der häufigsten Ursachen für Tod und Behinderung in der Welt. Es handelt sich um eine plötzliche Unterbrechung des Blutflusses in einem beliebigen Teil des Gehirns. Die endovaskuläre Behandlung des Schlaganfalls besteht in der Entfernung des Blutgerinnsels, das sich innerhalb der ersten 6 Stunden nach dem Schlaganfall in einem Gefäß gebildet hat (Thrombektomie). Wenn das Blutgerinnsel nicht entfernt werden kann, werden auflösende Medikamente verabreicht (Thrombolyse). Liegt eine Verengung der Gefäße vor, kann auch ein Stent eingesetzt werden.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
Medizinische Onkologie

KEMOTHERAPIE
Was ist eine Chemotherapie?
Chemotherapie ist die Behandlung eines Tumors mit Medikamenten. Sie ist zusammen mit der Operation und der Strahlentherapie ein sehr wichtiger Teil der Tumorbehandlung. Die Chemotherapie wird eingesetzt, um Tumorzellen abzutöten oder das Wachstum des Tumors zu stoppen. Manchmal wird ein einzelnes Medikament, manchmal werden mehrere Medikamente auf unterschiedliche Weise verabreicht.
Wer verabreicht die Chemotherapie?
Der Wissenschaftszweig, der sich mit der Chemotherapie befasst, heißt “Medizinische Onkologie” oder “Medizinische Onkologie”, und der in diesem Bereich tätige Arzt wird “Medizinischer Onkologe” genannt. Die medizinische Onkologie ist ein eigenes Fachgebiet; ein medizinischer Onkologe ist ein Facharzt für Innere Medizin, der auf die Behandlung von Tumoren spezialisiert ist. Die Tumorbehandlung ist eine Teamarbeit und muss in Zentren durchgeführt werden, in denen alle Mitglieder dieses Teams anwesend sind. Zu diesem Team sollten ein auf Tumorchirurgie spezialisierter Chirurg, ein Radioonkologe für die Strahlentherapie und ein medizinischer Onkologe für die Chemotherapie und die Betreuung der Patienten (supportive care) gehören.
Was ist der Zweck einer Chemotherapie?
Eine Chemotherapie kann aus verschiedenen Gründen angewandt werden, z. B. wegen der Art des Tumors und der Merkmale des Patienten.
- Um den Tumor vollständig zu zerstören und den Patienten zu heilen,
- Um die Ausbreitung des Tumors zu verhindern,
- Das Wachstum des Tumors soll gestoppt oder verlangsamt werden,
- Die Chemotherapie wird eingesetzt, um die durch den Tumor verursachten Symptome zu lindern.
Obwohl sie eine wirksame Behandlungsmethode ist, kann sie in manchen Fällen den Tumor nicht vollständig zerstören, sondern nur die Symptome lindern und ein angenehmes Leben ermöglichen. Bei einigen Tumoren ist die Chemotherapie die einzige Behandlungsmethode. In anderen Fällen wird die Chemotherapie gleichzeitig oder nacheinander mit anderen Behandlungen (Operation und Strahlentherapie) durchgeführt. So kann die Chemotherapie beispielsweise vor der Operation verabreicht werden, um den Tumor zu verkleinern, und nach der Operation, um seine Ausbreitung zu verhindern. Dieselben Anwendungen können vor und nach einer Strahlentherapie durchgeführt werden, oder die Chemotherapie kann mit verschiedenen Methoden gleichzeitig mit der Strahlentherapie verabreicht werden.
Wie häufig und wie lange ist die Chemotherapie?
Die Dauer und Häufigkeit der Behandlung richtet sich nach dem Chemotherapieschema, das je nach Krankheit und Zustand des Patienten individuell ausgewählt wird. Die Dauer und Häufigkeit der Behandlung kann vom Arzt je nach Ansprechen auf die Behandlung und den Nebenwirkungen geändert werden. Die häufigsten Intervalle sind 3 oder 4 Wochen, aber einige Behandlungsprogramme sehen auch wöchentliche oder vierzehntägige Intervalle vor. Das Wichtigste, ja sogar das Entscheidende an der zeitlichen Planung der Chemotherapie ist, dass die Behandlung so regelmäßig wie möglich und so rechtzeitig durchgeführt werden sollte, wie es die Nebenwirkungen erlauben. Wenn die Behandlungsintervalle unnötig verlängert werden, besteht die Gefahr, dass sich der Tumor erholt, gegen die Medikamente resistent wird und dadurch stärker wird. Auf diese Weise wächst der Tumor weiter und breitet sich aus, und die Chance auf einen Behandlungserfolg sinkt. Die Patienten sollten die von ihrem Arzt empfohlenen Termine für die Chemotherapie nie überschreiten.
Bevor Sie die Behandlung aus irgendeinem Grund abbrechen, sprechen Sie mit Ihrem Arzt über Ihre Probleme und bitten Sie ihn um Hilfe.
Halten Sie sich unbedingt an die Behandlungstage. Ändern Sie Ihren Behandlungstag niemals aus eigenem Antrieb, weil Sie sich nicht wohl fühlen.
Stellen Sie sicher, dass Sie alle Medikamente, die Sie zu Hause einnehmen müssen, auch einnehmen.
Andernfalls kann es zu Behandlungsfehlern aufgrund einer unvollständigen Behandlung kommen.
Wo wird die Chemotherapie verabreicht?
Die Chemotherapie muss in Zentren durchgeführt werden, in denen auf diesem Gebiet ausgebildetes Personal arbeitet. Eine Chemotherapie sollte niemals in einem Krankenhaus oder zu Hause von einer medizinischen Fachkraft, die keine Erfahrung mit Chemotherapie hat, ohne Wissen und Genehmigung des Arztes verabreicht werden.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST LEUKÄMIE (BLUTKREBS)? WAS IST LEUKÄMIE?
Leukämie, die in der Gesellschaft als eine der Arten von Blutkrebs bekannt ist, liegt vor, wenn eine der blutbildenden Stammzellen, die aus dem Knochenmark stammen, in einem Stadium ihrer Entwicklung aufgrund der Kombination verschiedener Faktoren pausiert und beginnt, sich unkontrolliert zu vermehren. Leukämie (Blutkrebs), auch als Leukämie bekannt, befällt zunächst das Knochenmark und dann alle Organe. Blutkrebs, der das Knochenmark und das Lymphsystem, das Blutproduktionssystem des Körpers, befällt, gehört zu den bösartigen Krebsarten, die unbehandelt einen progressiven Verlauf nehmen. Leukämie hat einen chronischen und langsamen Verlauf, wenn sie aufgrund einer unkontrollierten Vermehrung der reifen weißen Blutkörperchen auftritt. Diejenigen, die sich aufgrund einer unkontrollierten Vermehrung unreifer weißer Blutkörperchen entwickeln, werden als akut, d. h. mit einem schnellen Verlauf, definiert. Blutkrebs mit raschem Verlauf tritt oft plötzlich auf und zeigt klinische Anzeichen und Symptome vor allem innerhalb von 1-2 Monaten. Daher sollte die Diagnose schnell gestellt und die Behandlung so bald wie möglich eingeleitet werden.
Obwohl die genaue Ursache von Leukämie nicht bekannt ist, weiß man, dass die Exposition gegenüber Strahlung, Chemikalien wie Benzol und Pestiziden das Leukämierisiko erhöht. Leukämie, eine der häufigsten Blutkrebsarten, kann mit gezielten, intelligenten Medikamenten sowie mit patientenspezifischen Stammzellentransplantationen erfolgreich behandelt werden.
WELCHE ARTEN VON LEUKÄMIE (BLUTKREBS) GIBT ES?
Leukämien werden in zwei Gruppen unterteilt: akute (plötzlich auftretende, schnell fortschreitende) und chronische (langsam fortschreitende, chronische). Akute Leukämien werden in akute lymphatische Leukämie (ALL) und akute myeloblastische Leukämie (AML) eingeteilt. Chronische Leukämien werden in chronische lymphatische Leukämie (CLL) und chronische myeloische Leukämie (CML) unterteilt.
Unter den Leukämiearten ist die akute Leukämie eine äußerst aggressive und schnell fortschreitende Krankheit. Wird die akute Leukämie nicht rechtzeitig diagnostiziert und behandelt, kann sie innerhalb von Tagen oder Wochen zum Tod führen. Die chronische Leukämie hingegen kann lange Zeit unbemerkt bleiben und einen sehr langsamen Verlauf nehmen, der sich über Jahre hinziehen kann.
WAS IST EINE AKUTE LEUKÄMIE?
Die Inzidenzrate der akuten Leukämie unter den Blutkrebsarten liegt bei 15-20 %. Die akute Leukämie ist die häufigste Krebsart bei Kindern und schreitet sehr schnell voran. Die akute Leukämie kann in jedem Alter auftreten, wobei die Inzidenzrate mit zunehmendem Alter steigt. Die akute Leukämie, die sich innerhalb kürzester Zeit durch Symptome und Anzeichen bemerkbar macht, entsteht durch eine unkontrollierte und schnelle Vermehrung von Stammzellen im Knochenmark, die für die Produktion von Blutzellen zuständig sind. Bei der akuten Leukämie breiten sich die Krebszellen sehr schnell zunächst im Knochenmark und dann im ganzen Körper aus. Da bei Patienten mit akuter Leukämie keine weißen Blutkörperchen, so genannte Leukozyten, gebildet werden können, kann es häufig zu schweren Infektionen kommen. Da die für die Blutgerinnung verantwortlichen Blutplättchen nicht gebildet werden können, kann es zu Hautblutungen, Blutungen aus dem Magen-Darm-Trakt oder schweren Blutungen in lebenswichtigen Organen kommen. Anämie, das wichtigste Symptom der akuten Leukämie, ist eines der am leichtesten erkennbaren Symptome für die Patienten. Da sich die Leukämie auch auf andere Organe des Körpers ausbreitet, kann sie auch als Störung eines beliebigen Organs auftreten.
Die akute Leukämie wird in zwei Hauptgruppen unterteilt: die akute myeloblastische Leukämie (AML) und die akute lymphoblastische Leukämie (ALL), die zahlreiche Subtypen aufweisen. Eine frühzeitige Diagnose, Typisierung und rasche Behandlung dieser Tumorarten, die alle sehr schnell fortschreiten, ist sehr wichtig. Wenn Symptome auftreten, sollte die Diagnose von Fachärzten in spezialisierten onkologischen Zentren gestellt und eine angemessene Behandlung geplant werden.
WAS IST CHRONISCHE LEUKÄMIE?
Die chronische Leukämie ist eine Form der Leukämie, die langsamer voranschreitet als die akute Leukämie. Die chronische Leukämie führt jedoch zu besseren Ergebnissen. Es gibt zwei Hauptuntergruppen der chronischen Leukämie, die chronische lymphatische Leukämie (CLL) und die chronische myeloische Leukämie (CML), die entstehen, wenn reife Zellen die ihnen zugedachten Aufgaben nicht erfüllen und sich abnormal vermehren.
WAS IST LYMPHOZYTÄRE LEUKÄMIE (KLL)?
Lymphozytäre Leukämie (CLL) tritt auf, wenn sich leukämische Zellen, die wie reife normale Lymphozyten aussehen und den Körper vor Infektionen schützen, aber funktionsunfähig sind, im Knochenmark vermehren. CLL-Zellen siedeln sich im Knochenmark, in den Lymphknoten und im Blut an, was zu einer Schwellung der Lymphknoten und einer Vergrößerung der Milz führt. Die CLL, die meist in der Altersgruppe der 60- bis 70-Jährigen auftritt, macht 30 % aller Leukämien aus. Da die Krankheit sehr langsam fortschreitet, können die Patienten lange Zeit leben, ohne dass die Diagnose gestellt wird. Nach der Diagnose benötigen einige Patienten keine Behandlung, es sei denn, die CLL verursacht Probleme. Die CLL wird durch den Nachweis einer für die Krankheit spezifischen genetischen Veränderung mit speziellen Methoden diagnostiziert. Diese Krankheit, die früher mit Chemotherapie und Knochenmarktransplantation sehr schwer zu behandeln war, kann heute sehr einfach behandelt werden.
WAS SIND DIE URSACHEN VON LEUKÄMIE (BLUTKREBS)?
Obwohl die genaue Ursache der Leukämie nicht bekannt ist, gehen Wissenschaftler davon aus, dass virale, genetische, umweltbedingte oder immunologische Faktoren eine Rolle spielen. Einige dieser Faktoren sind die folgenden;
- Exposition gegenüber hohen Strahlungswerten
- Exposition gegenüber Industriechemikalien wie Benzol und Formaldehyd
- Einige der Chemotherapeutika
- Einige Erbkrankheiten (Down-Syndrom usw.)
- Viren
Diese Risikofaktoren erklären jedoch nur einen sehr kleinen Teil der Leukämieerkrankungen. Bei der Mehrheit der Leukämiepatienten sind keine Risikofaktoren nachgewiesen worden.
Andere Ursachen der Leukämie;
- Lange Nutzungszeiten von technischen Geräten wie Tablets und Handys durch Kinder
- Luftverschmutzung
- Zusatzstoffe in Lebensmitteln
- Chemische Stoffe
- Verdorbene Lebensmittel
WAS SIND DIE SYMPTOME VON LEUKÄMIE (BLUTKREBS)?
Die Symptome einer Leukämie sind je nach Typ unterschiedlich. Die Symptome von Blutkrebs können gemeinsame Merkmale mit einigen Befunden aufweisen, die bei anderen Blutkrebsarten beobachtet werden. Je nach Anämie;
- Blässe
- Ermüdung
- Ermüden Sie nicht so schnell,
- Symptome wie Kurzatmigkeit werden bei körperlicher Anstrengung beobachtet.
Zu den Symptomen einer Leukämie (Blutkrebs) gehören unerwartete Blutungen unter dem Zahnfleisch, der Nase, dem Zahnfleisch und der Haut, Blutergüsse und stecknadelkopfgroße rote Ausschläge, die bei Druck nicht abklingen, als Folge von Infektionen, die durch ein geschwächtes Immunsystem verursacht werden. Diese Befunde stechen bei den Symptomen der akuten Leukämie hervor;
- Blässe, Schwäche,
- Appetitlosigkeit, Gewichtsverlust,
- Nächtliche Schweißausbrüche
- Häufig wiederkehrendes Fieber und Infektionen, die mit einer geeigneten Behandlung nicht in den Griff zu bekommen sind,
- Schmerzen in den Knochen
- Blutungen unter der Haut (rote, stecknadelkopfgroße Ausschläge, leicht auftretende Blutergüsse)
- Nasen- und Zahnfleischbluten, Schwellung des Halses und der Achsellymphknoten, Schwellung des Bauches, Schwellung des Zahnfleisches.
Die Symptome von Blutkrebs können mit den Symptomen vieler Krankheiten übereinstimmen. Leukämie, die sich auf alle Organe des Körpers ausbreiten kann, kann ähnliche Symptome aufweisen wie rheumatische Erkrankungen, Infektionskrankheiten, hämorrhagische Erkrankungen, Lymphome, Myelome und andere Blutkrebsarten.
WAS SIND DIE SYMPTOME EINER LEUKÄMIE BEI KINDERN?
Betrachtet man alle Krebserkrankungen im Kindesalter, so stellt man fest, dass etwa 30 Prozent davon Leukämie sind. Krebserkrankungen im Kindesalter und Leukämie treten häufig im Alter von 2-5 Jahren oder 5-10 Jahren auf. Obwohl Leukämie bei Kindern sehr umfassende klinische Befunde aufweist, sollten einige Symptome vermutet werden. Wir können sie wie folgt auflisten;
- Schnelle Gewichtsabnahme
- Appetitlosigkeit
- Entfärbung
- Blutergüsse oder unerwartete Drüsen am Körper bleiben lange bestehen oder vergrößern sich allmählich
- Schwellung des Abdomens
- Gelenkschmerzen
- Anhaltendes Fieber, das lange Zeit anhält und länger als 5 Tage andauert
Neugeborene können das Immunsystem, das sie von ihrer Mutter erhalten, 6-8 Monate lang aufrechterhalten. Danach baut es sein eigenes Immunsystem bis zum Alter von 2 Jahren auf. Bis zu diesem Zeitraum können sie 5 Infektionen pro Jahr haben. Es sollte nicht vergessen werden, dass Virusinfektionen Leukämiekrebs auslösen können.
Vitamin-D-Mangel ist eine der Ursachen für Leukämie bei Kindern. Es gibt zahlreiche Studien, die zeigen, dass Rachitis in jungen Jahren und der daraus resultierende Vitamin-D-Mangel sich auf Krebs auswirken. Aus diesem Grund ist es für Kinder sehr wichtig, bei günstigen Wetterbedingungen und zu den von Fachleuten empfohlenen Zeiten in die Sonne zu gehen. Die Bedeutung genetischer Faktoren bei Leukämie sollte nicht außer Acht gelassen werden.
WIE WIRD LEUKÄMIE (BLUTKREBS) DIAGNOSTIZIERT? WELCHE DIAGNOSEMETHODEN GIBT ES?
Eine frühzeitige Diagnose ist bei Leukämie sehr wichtig. Leukämie beeinträchtigt die Vermehrung und Funktion von Blutzellen, indem sie Zellen im Knochenmark zu Erythrozyten, Leukozyten oder Blutplättchen heranreifen lässt. Bei Leukämie vermehren sich die leukämischen Zellen (Blasten) unkontrolliert und unterdrücken die Entwicklung der normalen Blutzellen. Bei schwerwiegenden Beschwerden wie Infektionen und Blutungen, die durch die Unfähigkeit zur Blutbildung verursacht werden, werden Blut- und Knochenmarksproben entnommen und für die Diagnose analysiert. Ein einfaches Blutbild und die Untersuchung der Zellen im Blut unter dem Mikroskop sind in der Regel für die Diagnose ausreichend. Die endgültige Diagnose wird jedoch durch eine Knochenmarksbiopsie gestellt.
Etwa 95 % der Leukämien sind akute Leukämien. Bei 85 % der akuten Leukämien handelt es sich um akute lymphatische Leukämien und bei 15 % um myeloblastische Leukämien. Von diesen sprechen die akuten lymphatischen Leukämien am besten auf die Behandlung an. Da die Lebenserwartung bei Kindern länger ist, ist eine frühzeitige Diagnose und Behandlung von großer Bedeutung, da die Erfolgsquoten im Vergleich zu Krebserkrankungen bei Erwachsenen höher sind.
Um eine Leukämie (Blutkrebs) zu diagnostizieren, sollte die Krankengeschichte des Patienten abgefragt werden. Zusätzlich zur Untersuchung sollten Untersuchungen mit fortschrittlichen Diagnosemethoden durchgeführt werden.
Inspektion:
Eine Person mit Verdacht auf Leukämie (Blutkrebs) sollte zunächst gut körperlich untersucht werden (Lymphknotenschwellung, vergrößerte Leber, vergrößerte Milz).
Geeignete Blutuntersuchungen:
Blutbild und notwendige biochemische Untersuchungen
Knochenmarksbiopsie:
Das Knochenmark aus dem Hüftknochen sollte untersucht werden. Knochenmarksbiopsie und pathologische Untersuchung der auf Glas aufgetragenen Knochenmarkflüssigkeit.
Genetische Untersuchungen:
Genetische Analyse von Leukämiezellen aus Knochenmark- oder Blutproben
WIE WIRD EINE AKUTE LEUKÄMIE DIAGNOSTIZIERT?
Die Diagnose einer akuten Leukämie ist nicht sehr schwierig. Eine akute Leukämie kann mit einem einfachen vollständigen Blutbild diagnostiziert werden. Bei einem vollständigen Blutbild kann Leukämie leicht diagnostiziert werden, indem man eine Abnahme der Zahl der normalen Blutzellen und eine Zunahme der Zahl der Krebszellen, der so genannten Blasten, feststellt. Eine Biopsie aus dem Knochenmark kann ebenfalls zeigen, dass das Knochenmark von Krebszellen befallen ist. Der schwierige Teil der Leukämie-Diagnose besteht darin, die Art des Krebses zu bestimmen. Die “immunphänotypische” Methode kann mit verschiedenen zytogenetischen und molekularen Tests zwischen verschiedenen Arten von akuten Leukämien unterscheiden.
Die Bestimmung des Subtyps der Leukämie ist sehr wichtig, da sie in direktem Zusammenhang mit dem Behandlungsprozess steht. Denn für alle Subtypen von Leukämie gibt es unterschiedliche Behandlungsmethoden. Wenn bei einem Patienten eine akute Leukämie diagnostiziert wird, wird versucht, die Risikobedingungen zu ermitteln. Wenn eine akute Leukämie bei Erwachsenen diagnostiziert wird, weiß man, dass mehr als 70-80 % der Patienten in die Hochrisikogruppe fallen. Das bedeutet, dass die Leukämie, auch wenn sie unter Kontrolle ist, innerhalb kürzester Zeit wieder auftreten kann.
WIE WIRD LEUKÄMIE (BLUTKREBS) BEHANDELT?
An der Behandlung von Leukämie sind viele Disziplinen beteiligt. Sie wird von Hämatologen für Erwachsene und Kinder in voll ausgestatteten Krankenhäusern behandelt. Das onkologische Zentrum, in dem Leukämie behandelt wird, sollte über ein gut ausgebildetes Team von Krankenschwestern und -pflegern für die Chemotherapie, eine gut ausgestattete Blutbank, die rund um die Uhr zur Verfügung steht, einen Spezialisten für Infektionskrankheiten, einen Radioonkologen, der bei Bedarf eine Strahlentherapie durchführt, und eine hoch entwickelte Laborinfrastruktur verfügen.
Leukämie ist eine behandelbare Krankheit, und die Erfolgsquote der Behandlung steigt von Tag zu Tag, da in den letzten Jahren viele neue Methoden entdeckt wurden. Die Entdeckung neuer Chemotherapeutika, die Einführung zielgerichteter molekularer Medikamente und biologischer Arzneimitteltherapien in den täglichen Gebrauch, die Entwicklung fortschrittlicher Strahlentherapiegeräte und die Entwicklungen im Zusammenhang mit der Knochenmarktransplantation haben zu großen Fortschritten bei der Verlängerung der Lebenserwartung der Patienten und der vollständigen Behandlung der Krankheit geführt.
Die erste Behandlungsmethode, die bei der Behandlung von Leukämie in Frage kommt, ist die Chemotherapie. Art, Dosis und Art der Verabreichung der Chemotherapeutika können je nach Art der Leukämie variieren. Neben der Chemotherapie, die etwa 24 Monate dauert, ist die Knochentransplantation eine weitere Methode, die bei der Behandlung einiger Leukämiearten in Frage kommt. Die Erfolgsquoten bei der Behandlung von Leukämie in unserem Land liegen sowohl bei der Chemotherapie als auch bei der Knochenmarktransplantation auf Weltniveau.
Die chronische myeloische Leukämie ist seit dem Jahr 2000 weitgehend heilbar. Da die Krankheit gut erkannt ist, werden Medikamente eingesetzt, die den Mechanismus stören. Diese Behandlung, die so genannte zielgerichtete Therapie, verhindert, dass myeloische Zellen, die sich im Knochenmark ständig vermehren, heranreifen oder ausreifen und ins Blut gelangen. Bei Patienten, die mit Medikamenten nicht kontrolliert werden können, ist die wirksamste Behandlungsmethode die “allogene Stammzellentransplantation”. Die Stammzelltransplantation wird mit Hilfe von Stammzellen durchgeführt, die von gewebegleichen Geschwistern, nahen Verwandten oder nicht verwandten freiwilligen Spendern stammen. Bei der chronischen lymphatischen Leukämie (CLL), einer Leukämieart mit langsamem Verlauf, werden in den frühen Stadien nur unterstützende Behandlungen durchgeführt. In fortgeschrittenen Stadien oder bei Hochrisikopatienten können Medikamente oder gezielte Antikörper (Immuntherapie) eingesetzt werden. Obwohl die chronische lymphatische Leukämie eine Krankheit des höheren Lebensalters ist, kann sie auch schon vor dem 50. Bei diesen Hochrisikopatienten ist die allogene Stammzelltransplantation eine der Behandlungsmöglichkeiten.
WAS SIE ÜBER LEUKÄMIE WISSEN SOLLTEN
- Leukämie tritt bei Männern häufiger auf als bei Frauen.
- Sie ist bei der weißen Rasse häufiger anzutreffen als bei der schwarzen und gelben Rasse.
- Die Inzidenz von Leukämie ist bei Erwachsenen mehr als zehnmal so hoch wie bei Kindern, und das Risiko steigt mit dem Alter.
- Leukämie im Kindesalter tritt häufiger im Alter von unter 4 Jahren auf.
- Bei einigen Leukämien spielt eine genetische Veranlagung eine wichtige Rolle.
- Es ist bekannt, dass akute Leukämieformen bei genetischen Erkrankungen wie dem Down-Syndrom häufiger auftreten.
- Auch die Exposition gegenüber Strahlung und Chemikalien wie Benzol kann an der Entstehung der CML beteiligt sein.
- Eine Chemotherapie wegen einer anderen Krebserkrankung, Rauchen und das Vorliegen bestimmter Blutkrankheiten gehören ebenfalls zu den Ursachen für Leukämie.
- In den USA erkrankt alle 4 Minuten eine Person an Blutkrebs.
- Im Jahr 2016 wurden allein in den USA 60.000 neue Leukämiepatienten diagnostiziert.
- Die akute Leukämie ist mit einer Rate von 35 % die häufigste Krebsart im Kindesalter.
- Die Wahrscheinlichkeit, dass bei einem Mann oder einer Frau im Laufe ihres Lebens eine Leukämie diagnostiziert wird, wird auf 1,5 % geschätzt.
- Heute ist die Überlebensrate von Patienten, bei denen Leukämie seit mehr als 10 Jahren diagnostiziert wird, im Vergleich zu den 70er Jahren um das Vierfache gestiegen.
- Zwischen 2006 und 2012 lag die 5-Jahres-Überlebensrate von Leukämiepatienten bei 60 %.
- Acht von 10 Kindern, bei denen Leukämie diagnostiziert wird, können vollständig geheilt werden.
WAS IST AKUTE LYMPHOBLASTISCHE LEUKÄMIE?
Die akute lymphoblastische Leukämie (ALL) ist eine Krebsart, die das Blut und das Knochenmark befällt. Sie schreitet schnell und aggressiv voran und muss dringend behandelt werden. Kennzeichnend für die ALL ist eine Überproduktion von unreifen weißen Blutkörperchen, den so genannten Lymphoblasten oder leukämischen Blasten. Das Knochenmark produziert Stammzellen, die die Fähigkeit haben, sich zu drei wichtigen Blutzelltypen zu entwickeln: rote Blutkörperchen, weiße Blutkörperchen und Blutplättchen. Normalerweise gibt das Knochenmark die Stammzellen erst dann an das Blut ab, wenn sie sich zu voll entwickelten Blutzellen entwickelt haben. Bei der akuten lymphoblastischen Leukämie werden jedoch große Mengen weißer Blutkörperchen freigesetzt, bevor sie reif sind. Diese werden als Blastzellen bezeichnet. Während die Zahl der Blastenzellen zunimmt, nimmt die Zahl der roten Blutkörperchen und Blutplättchen ab. Da das Knochenmark nicht genügend rote Blutkörperchen, normale weiße Blutkörperchen und Blutplättchen produzieren kann, werden Menschen mit ALL anfälliger für Blutarmut, wiederkehrende Infektionen und leichte Blutergüsse und Blutungen. Die Blastzellen können dann aus dem Knochenmark in den Blutkreislauf ausgeschieden werden und sich in verschiedenen Organen ansammeln, darunter in den Lymphknoten (Drüsen), der Milz, der Leber und dem zentralen Nervensystem (Gehirn und Rückenmark).
Die ALL kann in jedem Alter auftreten, tritt aber häufiger bei Kleinkindern (0-14 Jahre) auf, auf die etwa 60 Prozent aller Fälle entfallen. Die ALL ist die häufigste Form der Leukämie im Kindesalter und die häufigste Krebserkrankung im Kindesalter. Jungen sind etwas häufiger betroffen als Mädchen. Mit einer Behandlung können die meisten Kinder mit ALL heute geheilt werden, während die Heilungsraten bei Erwachsenen stärker schwanken.
HÄUFIG GESTELLTE FRAGEN ZU LEUKÄMIE (BLUTKREBS)
Wie wird die Stammzelltransplantation bei Leukämie durchgeführt?
Bei der Behandlung von Leukämie wird die Stammzelltransplantation bevorzugt, wenn bei Patienten, deren Krankheit in der Frühphase durch eine medikamentöse Therapie unter Kontrolle ist, ein hohes Risiko für ein Wiederauftreten der Krankheit besteht. Die Stammzelltransplantation wird mit Stammzellen durchgeführt, die dem Patienten selbst (autolog) oder gewebeverwandten Geschwistern, anderen nahen Verwandten oder nicht verwandten freiwilligen Spendern (allogen) entnommen werden. Für die Stammzelltransplantation werden die Stammzellen unter Betäubung des Spenders aus dem Hüftknochen oder nach Anwendung von stammzellstimulierenden Medikamenten mit speziellen Geräten aus der Vene entnommen. Vor der Stammzellentransplantation erhält der Patient hochdosierte Medikamente und/oder eine Strahlentherapie. Ziel dieser Phase ist es, die Krebszellen, die möglicherweise im Körper des Patienten verbleiben, zu zerstören und die Zellen im Knochenmark des Patienten zu entleeren. Anschließend wird die Transplantation durchgeführt. Die “autologe Transplantation” kann bei Patienten durchgeführt werden, die keinen geeigneten Stammzellenspender finden, die wirksamste Behandlung ist jedoch die allogene Stammzellentransplantation. Die Patienten müssen unter Umständen viele Jahre lang nach der Transplantation weiterbehandelt werden, um ernsthafte Probleme zu vermeiden.
Seit kurzem kann die Stammzelltransplantation von teilweise kompatiblen (50-80 % kompatiblen) Verwandten, die so genannte “haploidentische” Transplantation, auch bei Patienten durchgeführt werden, die keinen geeigneten Stammzellspender finden können und ein hohes Rezidivrisiko haben. Je nach Krankheitsrisiko kann die haploidentische Transplantation bei etwa der Hälfte der Patienten eine Krankheitskontrolle und ein Überleben von mehr als einem Jahr ermöglichen. Wenn jedoch das Immunsystem von Patienten dieser Gruppe aufgrund von Gewebeunverträglichkeiten unterdrückt wird, ist eine engmaschige Überwachung in gut ausgestatteten und erfahrenen Zentren erforderlich.
Wer sollte eine Stammzelltransplantation erhalten?
Bei der Durchführung einer Stammzellentransplantation sollten einige Punkte beachtet werden. Dazu gehören das Alter des Patienten, die Frage, ob der Patient zusätzliche gesundheitliche Probleme hat, und die Frage, ob der Patient zur mittleren oder hohen Risikogruppe gehört. Manche Patienten sprechen später auf die Behandlung an oder ihre Krankheiten treten schneller wieder auf. Bei diesen Patienten kann das Risiko eines erneuten Auftretens der Krankheit durch das Vorhandensein bestimmter Genveränderungen bestimmt werden. Aufgrund der Untersuchung der Genveränderungen sollte bei Patienten, die zur Hochrisikogruppe gehören, eine allogene Transplantation durchgeführt werden (wenn sie jung sind und keine zusätzlichen Erkrankungen haben). Bei Patienten mit geringem Rezidivrisiko wird eine Stammzelltransplantation in der ersten Phase aufgrund der zahlreichen und manchmal lebensbedrohlichen Nebenwirkungen nicht empfohlen. Eine Stammzelltransplantation wird jedoch durchgeführt, wenn die Krankheit wieder auftritt. Bei Blutkrebs, der auf die Erstbehandlung nicht anspricht, kann eine allogene Transplantation als Behandlungsoption eingesetzt werden.
Wie wird eine akute Leukämie behandelt?
Die erste Stufe bei der Behandlung von akutem Blutkrebs ist die Chemotherapie. Die Behandlung wird je nach Art der Erkrankung in zwei oder drei Stufen durchgeführt. Zu Beginn der Behandlung besteht das Ziel darin, die Zahl der Krebszellen zu verringern, die Zahl der normalen Zellen zu erhöhen und die Symptome der Krankheit zu beseitigen. Dies ist die wichtigste Phase. Auch wenn diese Phase erfolgreich abgeschlossen ist, können sich bei einem Großteil der Patienten die Krebszellen wieder vermehren, und die Krankheit kehrt zurück. Nachdem die Krankheit unter Kontrolle gebracht wurde, werden Behandlungen durchgeführt, die als Verstärkung bezeichnet werden, um ein Wiederauftreten der Krankheit zu verhindern. Die Verstärkungsbehandlung wird auch mit Chemotherapeutika oder Stammzellentransplantation durchgeführt. Darüber hinaus gibt es bei der Behandlung von Patienten mit akuter lymphatischer Leukämie (ALL) eine Erhaltungsbehandlung, die 2-3 Jahre dauern kann, um ein Wiederauftreten der Krankheit zu verhindern. Während dieser Phasen müssen die Patienten engmaschig überwacht werden. Die Nachsorge der Patienten sollte von einem Team von Spezialisten in voll ausgestatteten Kliniken und sterilen Räumen durchgeführt werden.
Tritt eine akute Leukämie immer wieder auf?
Akute Leukämie kann in einigen Fällen wiederkehren. Die Krankheit wird durch eine hochdosierte Chemotherapie unterdrückt, die bei der Behandlung der akuten Leukämie eingesetzt wird. Allerdings kann die Leukämie innerhalb des ersten Jahres erneut auftreten, da die meisten Patienten zur Hochrisikogruppe gehören. Um ein Wiederauftreten der Leukämie zu verhindern, wird eine allogene Knochenmarktransplantation mit Stammzellen empfohlen. Zunächst werden die Geschwister des Patienten untersucht, und wenn sie kompatibel sind, werden ihre Stammzellen transplantiert. Wenn keine kompatiblen Geschwister gefunden werden, werden Knochenmarkbanken konsultiert und Spender gesucht. Ziel der allogenen Stammzelltransplantation ist es, das Risiko eines erneuten Auftretens der Krankheit in der Zukunft zu verringern. Heute werden kompatible Transplantationen auch dann durchgeführt, wenn kein vollständig kompatibler Stammzellenspender gefunden werden kann. Darüber hinaus können bei älteren Patienten Minitransplantationen mit niedrig dosierten Medikamenten durchgeführt werden, um ihnen eine Chance auf eine Stammzelltransplantation zu geben.
Wie wird die Behandlung der chronischen Leukämie (CLL) durchgeführt?
Nicht bei jedem Patienten, bei dem eine CLL diagnostiziert wird, muss sofort mit der Behandlung begonnen werden. Denn die meisten Patienten mit CLL benötigen viele Jahre lang keine Behandlung. Bei dem verbleibenden Teil schreitet die Krankheit einige Jahre lang fort, bis eine Behandlung erforderlich wird. Wichtige Kriterien für den Beginn einer Behandlung sind das Fortschreiten der Krankheit, verschiedene Symptome und das Fehlen einer Organbeteiligung. Die Symptome der Krankheit haben keinen wesentlichen Einfluss auf die Behandlung. Die Risikofaktoren der Krankheit werden durch spezielle Laboruntersuchungen ermittelt, und es wird eine personalisierte Behandlung geplant. Das Ziel der Behandlung der chronischen Leukämie ist es, die Krankheit zu unterdrücken und zu verhindern, dass sie dem Patienten schadet. Neben der Chemotherapie werden heute häufig intelligente Medikamente bevorzugt, da sie nur die Krebszellen angreifen. Da Smart Drugs gesunde Zellen nur wenig beeinträchtigen, haben sie weniger Nebenwirkungen als eine Chemotherapie. Intelligente Medikamente sind bei der CLL, die im fortgeschrittenen Alter häufiger auftritt, sehr viel nützlicher.
Wie wird die CML behandelt?
In den frühen 2000er Jahren gab es bahnbrechende Entwicklungen bei der Behandlung der CML, der zweithäufigsten Form der chronischen Leukämie. Bei CML-Patienten wird die Leukämie durch eine genetische Veränderung namens BCR/ABL-Mutation verursacht, die später in den Stammzellen auftritt. Der Nachweis dieser Veränderung hat die Diagnose von CML vereinfacht und die Entwicklung von Medikamenten gegen dieses gestörte System ermöglicht. Darüber hinaus wurde mit dem Einsatz von Trozinkinaseinhibitoren (TKI) eine wirksame Behandlungsmethode gegen die Krankheit entwickelt. Dank des Einsatzes oraler TKI können die meisten CML-Patienten heute ein Leben führen, das ihrer normalen Lebenserwartung nahe kommt.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
WAS IST DAS MULTIPLE MYELOM?
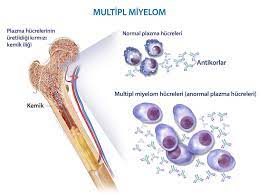
Das Multiple Myelom ist eine Krebsart, die Plasmazellen im Knochenmark befällt, die Proteine produzieren, die dem Körper helfen, Infektionen zu bekämpfen. Die Krankheit wird als multiples Myelom bezeichnet, weil sie in der Regel die Wirbelsäule, den Schädel, das Becken, den Brustkorb, die Schultern und die Hüften befällt. Plasmazellen sind eine Art von weißen Blutkörperchen, die im Knochenmark vorkommen und Blutzellen produzieren. Gesunde Plasmazellen produzieren Antikörper, die unseren Körper vor Krankheiten und Infektionen schützen. Wenn sich eine abnorme Plasmazelle im Knochenmark entwickelt und schnell vermehrt, verursacht sie multiplen Myelomkrebs. Wie die gesunden Blutzellen versuchen auch die Krebszellen, Antikörper zu produzieren. Sie können jedoch nur abnormale Antikörper, so genannte monoklonale Proteine oder M-Proteine, produzieren. Wenn sich diese schädlichen Antikörper im Körper ansammeln, können sie zu Nierenschäden und anderen ernsten Problemen führen.
WAS SIND DIE URSACHEN DES MULTIPLEN MYELOMS?
Die genaue Ursache des Multiplen Myeloms ist noch nicht bekannt. Es ist jedoch bekannt, dass der Krebs durch eine abnorme Plasmazelle verursacht wird, die sich im Knochenmark viel schneller vermehrt als sie sollte. Ohne einen normalen Lebenszyklus teilen sich die Myelomzellen unaufhörlich weiter. Dadurch kann die Produktion gesunder Zellen gestört werden.
WER KANN EIN MULTIPLES MYELOM BEKOMMEN?
Die genaue Ursache für multiplen Myelomkrebs ist nicht bekannt. Es ist jedoch bekannt, wer gefährdet ist. Mit zunehmendem Alter steigt das Risiko, an einem Multiplen Myelom zu erkranken. Das Multiple Myelom tritt in der Regel bei Menschen über 60 Jahren auf, selten auch bei Menschen unter 35 Jahren. Personen mit einem erhöhten Risiko für das Multiple Myelom sind:
- Alter: Das Multiple Myelom tritt meist bei Menschen über 60 Jahren auf. Mit zunehmendem Alter steigt daher das Risiko eines Multiplen Myeloms.
- Rasse: Das Risiko eines Multiplen Myeloms ist bei Schwarzen höher als bei anderen Rassen. Der Grund für diesen Unterschied zwischen den Rassen ist nicht bekannt.
- Männer Männer haben ein höheres Risiko, an Multiplem Myelom zu erkranken als Frauen. Es ist noch nicht bekannt, warum diese Krankheit bei Männern häufiger vorkommt.
- Vorgeschichte einer monoklonalen Gammopathie unklarer Bedeutung (MGUS): MGUS ist eine gutartige Erkrankung, bei der abnorme Plasmazellen M-Proteine produzieren. In der Regel treten keine Symptome auf, und der abnorme M-Proteinspiegel wird durch einen Bluttest festgestellt. Manchmal entwickeln Menschen mit MGUS bestimmte Krebsarten, wie z. B. das Multiple Myelom. Es gibt keine Heilung, aber bei Menschen mit MGUS werden regelmäßig (alle 1 bis 2 Jahre) Labortests durchgeführt, um einen Anstieg der M-Proteinwerte festzustellen. Regelmäßige Untersuchungen werden auch durchgeführt, um die Entwicklung von Symptomen zu überprüfen.
- Familienanamnese des Multiplen Myeloms: Das Multiple Myelom ist keine Erbkrankheit. Studien haben jedoch gezeigt, dass Menschen, die einen nahen Verwandten mit Multiplem Myelom haben, ein höheres Risiko haben, die Krankheit zu entwickeln.
WAS SIND DIE SYMPTOME DES MULTIPLEN MYELOMS?
Das Multiple Myelom kann ohne jegliche Symptome verlaufen. Die Symptome der Krankheit können je nach Person unterschiedlich sein. Die Symptome des Multiplen Myeloms lassen sich wie folgt auflisten:
- Knochenschmerzen (meist im Rücken und in den Rippen)
- Knochenbrüche (meist an der Wirbelsäule)
- Schwächegefühl und große Müdigkeit
- Sehr durstig sein
- Häufige Infektionen
- Feuer
- Appetitlosigkeit
- Gewichtsverlust
- Übelkeit
- Verstopfung
- Häufiges Wasserlassen
WAS SIND DIE STADIUMSYMPTOME DES MULTIPLEN MYELOMS?
Bei einem Patienten mit Verdacht auf ein Multiples Myelom werden verschiedene Untersuchungen durchgeführt. Der Patient, bei dessen Biopsie ein multiples Myelom festgestellt wird, sollte mit seinem Arzt einen Behandlungsplan erstellen. Der Grad der Ausbreitung (Stadium) der Krankheit erfordert zusätzliche Untersuchungen. Für die endgültige Diagnose des Multiplen Myeloms werden folgende Untersuchungen durchgeführt:
- Blutuntersuchungen Blutuntersuchungen wie Albumin und Beta-2-Mikroglobulin sind erforderlich, um das Stadium des Multiplen Myeloms zu bestimmen.
- CT-Scan: Mit einem computergestützten Röntgengerät werden detaillierte Bilder von den Knochen gemacht.
- MRT: Mit einem starken Magneten, der an einen Computer angeschlossen ist, werden detaillierte Bilder von Ihren Knochen erstellt.
Ärzte können das Multiple Myelom als asymptomatisch, Stadium I, Stadium II oder Stadium III bezeichnen. Bei der Stadieneinteilung wird berücksichtigt, ob der Krebs Probleme mit Ihren Knochen oder Nieren verursacht. Das asymptomatische Multiple Myelom ist das frühe Stadium der Krankheit, in dem noch keine Symptome auftreten. Zum Beispiel gibt es keine Knochenschäden. Das frühe Stadium der Krankheit mit Symptomen (z. B. Knochenschäden) ist Stadium I. Die Stadien II oder III sind weiter fortgeschritten und es befinden sich mehr Myelomzellen im Körper.
WIE WIRD DAS MULTIPLE MYELOM DIAGNOSTIZIERT?
Das Multiple Myelom kann manchmal durch einen Routine-Bluttest diagnostiziert werden. Der Verdacht auf ein Multiples Myelom wird häufig nach einer Röntgenaufnahme geäußert, die wegen eines Knochenbruchs angefertigt wurde. Oft gehen Patienten zum Arzt, weil sie andere Symptome haben. Um herauszufinden, ob solche Probleme durch ein Multiples Myelom oder eine andere Erkrankung verursacht werden, wird Ihr Arzt nach einer Anamnese und einer körperlichen Untersuchung die folgenden Tests anordnen:
- Blutuntersuchungen Einige Blutuntersuchungen werden im Labor durchgeführt:
- Das Multiple Myelom verursacht hohe Eiweißkonzentrationen im Blut. In einem Labortest wird der Gehalt an vielen verschiedenen Proteinen überprüft, darunter das M-Protein und andere Immunglobuline (Antikörper), Albumin und Beta-2-Mikroglobulin.
- Das Myelom kann auch Anämie und eine niedrige Zahl von weißen Blutkörperchen und Blutplättchen verursachen. Im Labor wird ein komplettes Blutbild erstellt, um die Anzahl der weißen Blutkörperchen, der roten Blutkörperchen und der Blutplättchen zu messen.
- Das Labor prüft auch, ob der Kalziumspiegel hoch ist.
- Das Kreatinin wird gemessen, um zu prüfen, ob die Nieren gut arbeiten.
- Urinuntersuchungen Der Urin wird auf Bence-Jones-Protein, eine Art M-Protein, untersucht. Die Menge des Bence-Jones-Proteins wird im 24-Stunden-Urin gemessen. Wenn in Ihrer Urinprobe ein hoher Wert an Bence-Jones-Protein festgestellt wird, wird Ihr Arzt Ihre Nieren überwachen. Bence-Jones-Protein kann die Nieren blockieren und Schäden verursachen.
- Röntgenaufnahme: Es kann ein Film angefertigt werden, um Ihre gebrochenen oder verdünnten Knochen zu überprüfen. Es kann eine Aufnahme Ihres gesamten Körpers gemacht werden, um zu sehen, wie viele Knochen das Myelom beschädigt hat.
- Biopsie Ihr Arzt entnimmt eine Gewebeprobe, um nach Krebszellen zu suchen. Eine Biopsie ist die einzige sichere Methode, um festzustellen, ob sich Myelomzellen in Ihrem Knochenmark befinden. Vor der Entnahme der Probe wird der Bereich mit einem Lokalanästhetikum betäubt. Dies hilft, die Schmerzen zu verringern. Ihr Arzt entnimmt etwas Knochenmark aus Ihrem Hüftknochen oder einem anderen großen Knochen. Der Pathologe untersucht das Gewebe mit einem Mikroskop auf Myelomzellen.
- Es gibt zwei Möglichkeiten, wie Ihr Arzt Knochenmark entnehmen kann. Bei manchen Menschen werden beide Verfahren in der gleichen Sitzung durchgeführt:
- Knochenmarkaspiration: Der Arzt entnimmt mit einer dicken Hohlnadel eine Probe des Knochenmarks.
- Knochenmarksbiopsie: Der Arzt verwendet eine dickere Hohlnadel, um ein kleines Stück Knochen und Knochenmark zu entnehmen.
WELCHE BEHANDLUNGSMETHODEN GIBT ES BEIM MULTIPLEN MYELOM?
Wenn Sie an einem Multiplen Myelom erkrankt sind und keine Symptome haben, wird Ihr Arzt vor Beginn der Behandlung genau beobachten, ob die Krankheit fortschreitet. Es werden regelmäßig Blut- und Urinuntersuchungen durchgeführt, der Krankheitsverlauf wird überwacht und über die Behandlung entschieden.
Es gibt Behandlungen, die dem Patienten helfen können, Schmerzen zu lindern, Komplikationen zu verringern und das Fortschreiten der Krankheit zu verlangsamen. Diese Behandlungen werden auch eingesetzt, wenn die Krankheit fortschreitet. Folgende Behandlungsmöglichkeiten werden bei der Behandlung des Multiplen Myeloms üblicherweise eingesetzt:
Zielgerichtete Therapie: Bei der zielgerichteten Therapie, die zur Behandlung des Multiplen Myeloms eingesetzt wird, zerstören Medikamente, die dem Patienten intravenös oder in Tablettenform verabreicht werden, die Proteine in den Myelomzellen und bringen die Krebszellen zum Absterben.
Chemotherapie Eine Chemotherapie, die intravenös oder in Tablettenform verabreicht wird, wird in der Regel in hohen Dosen vor einer Stammzellentransplantation durchgeführt. Die Chemotherapie ist eine aggressive medikamentöse Behandlung zur Zerstörung des Myeloms und anderer schnell wachsender Zellen.
Kortikosteroide: Eine Behandlungsform, die in Tablettenform oder intravenös verabreicht wird, um Entzündungen im Körper zu reduzieren, das Immunsystem auszugleichen und Myelomzellen zu behandeln.
Strahlentherapie: Starke Strahlungsenergie und Strahlen werden eingesetzt, um das Wachstum zu stoppen, die Myelomzellen zu schrumpfen und zu zerstören.
Autologe Knochenmarkstransplantation: Nach der Behandlung des erkrankten Knochenmarks werden dem Patienten selbst Stammzellen entnommen, dann eine hochdosierte Chemotherapie durchgeführt und die entnommenen Stammzellen dem Patienten zurückgegeben. Auf diese Weise können die Stammzellen in Ihren Körper transplantiert werden, wo sie zu den Knochen transportiert werden und das Knochenmark zu regenerieren beginnen.
WAS KANN MAN TUN, UM DEM MULTIPLEN MYELOM VORZUBEUGEN?
Da die genaue Ursache des Multiplen Myeloms unbekannt ist, ist auch die Vorbeugung der Krankheit unbekannt.
HÄUFIG GESTELLTE FRAGEN ZUM MULTIPLEN MYELOM
Kann das Multiple Myelom frühzeitig diagnostiziert werden?
Dank der fortschreitenden Medizintechnik kann das Multiple Myelom heute frühzeitig diagnostiziert werden.
Wie hoch ist das Sterberisiko beim Multiplen Myelom?
Wie bei jeder Krebserkrankung ist das Sterberisiko hoch, wenn das Multiple Myelom unbehandelt bleibt.
Wie lange lebt ein Patient mit Multiplem Myelom?
Patienten mit Multiplem Myelom können dank neu entwickelter Chemotherapeutika länger leben.
Ist das Multiple Myelom eine Erbkrankheit?
Menschen mit einer familiären Vorgeschichte des Multiplen Myeloms haben ein höheres Risiko für diese Krankheit. Man geht jedoch davon aus, dass es sich bei dieser Krankheit nicht um eine Erbkrankheit handelt.
Wie sollte ein Patient mit Multiplem Myelom ernährt werden?
Multiple-Myelon-Patienten sollten ihre Ernährungsprogramme unter der Kontrolle des behandelnden Arztes erstellen. Sie sollten sich entsprechend den Empfehlungen ihres Arztes proteinreich ernähren.
Ist das Multiple Myelom Krebs?
Das Myelom, auch bekannt als multiples Myelom, ist eine Krebserkrankung des Knochenmarks, die von Plasmazellen ausgeht.
Gibt es eine pflanzliche Behandlung für das Multiple Myelom?
In wissenschaftlichen Artikeln heißt es, dass Ingwer gut für Patienten mit Multiplem Myelom ist, die sich einer Chemotherapie unterziehen.
Erfolgt beim Multiplen Myelom eine Chemotherapie?
Wie bei anderen Krebsarten wird auch beim Multiplen Myelom die Chemotherapie intravenös oder in Tablettenform verabreicht.
Wie hoch sind die Heilungschancen beim Multiplen Myelom?
Die Behandlungsmethoden, die angewandt werden, um das Fortschreiten des Multiplen Myeloms und die Ausbreitung der Krankheit zu verhindern, können erfolgreiche Ergebnisse erzielen
Wird beim Multiplen Myelom eine Knochenmarktransplantation durchgeführt?
Eine autologe Knochenmarktransplantation wird bei Patienten mit multiplem Myelom durchgeführt.
Wie sieht das Leben nach einer Knochenmarktransplantation beim Multiplen Myelom aus?
Patienten mit Multiplem Myelom können etwa 6 Monate nach einer autologen Knochenmarktransplantation zu einem normalen Leben zurückkehren.
Kann sich ein Patient mit Multiplem Myelom einer Stammzelltransplantation unterziehen?
Eine autologe Knochenmarktransplantation wird bei Patienten mit multiplem Myelom durchgeführt.
Kann das Multiple Myelom Metastasen bilden?
Das Multiple Myelom metastasiert meist in den Knochen.
Tritt das Multiple Myelom häufiger bei Männern oder Frauen auf?
Das Multiple Myelom tritt bei Männern häufiger auf als bei Frauen.
Kann eine Frau mit Multiplem Myelom schwanger werden und besteht ein Risiko für sie und das Kind?
Eine Frau mit Multiplem Myelom kann schwanger werden. Allerdings muss ihre Krankheit unter Kontrolle sein und sie darf keine Chemotherapie erhalten.
Wo tritt das Multiple Myelom in der Türkei am häufigsten auf?
Es gibt keine statistischen Informationen über die Prävalenz des Multiplen Myeloms in der Türkei.
In welchem Alter tritt das Multiple Myelom häufiger auf?
Das Multiple Myelom ist eine seltene Krebsart. Die Krankheit, die in der Regel im Alter von über 60 Jahren auftritt, kann auch selten bei Menschen unter 35 Jahren vorkommen.
Ist das Multiple Myelom eine ansteckende Krankheit?
Das Multiple Myelom ist keine ansteckende Krankheit.
Welcher Arzt behandelt das Multiple Myelom?
Patienten mit Multiplem Myelom werden von Hämatologen behandelt.
Kann das Multiple Myelom durch die Einnahme von Vitamin D verhindert werden?
Das Multiple Myelom kann durch die Einnahme von Vitamin D nicht verhindert werden.
Verursacht das Multiple Myelom Nierenversagen?
Das Multiple Myelom kann im Stadium III zu Nierenversagen führen.
Wann liegen die Ergebnisse der Tests zum Multiplen Myelom vor?
Es gibt viele Arten von Tests auf multiples Myelom. Daher dauert es bei jedem Test unterschiedlich lange, bis er abgeschlossen ist.
Kann das Multiple Myelom in Blut- und Urintests nachgewiesen werden?
Das Multiple Myelom wird manchmal durch eine Routineuntersuchung von Blut und Urin nachgewiesen.
Ist das Multiple Myelom ein Knochenmarkskrebs?
Das Multiple Myelom ist eine Form von Knochenmarkkrebs, die immer häufiger auftritt.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
Was ist eine Knochenmarktransplantation?
Die für die Blutbildung im menschlichen Organismus verantwortlichen Zellen sind Stammzellen im Knochenmark. Die Transplantation dieser Zellen mit hochspezialisierten Funktionen wird allgemein als “Knochenmarktransplantation” bezeichnet.
Wie wird eine Knochenmarktransplantation durchgeführt?
Das Knochenmark produziert Blutzellen. Stammzellen sind unreife Zellen im Knochenmark, aus denen alle verschiedenen Blutzellen bestehen. Hämatopoetische Stammzellen werden bei Transplantationen verwendet. Die Stammzellen werden über eine Vene auf den Patienten (Empfänger) übertragen. Zu diesem Zweck werden in der Regel intravenös eingeführte Geräte, so genannte zentrale Venenkatheter, verwendet. Nach der Transplantation leben die unreifen Zellen im Knochenmark und entwickeln sich zu verschiedenen reifen Blutzellen, darunter
- Sauerstofftransportierende rote Blutkörperchen
- Blutplättchen, die die Blutgerinnung unterstützen
- Weiße Blutkörperchen, die bei der Bekämpfung von Infektionen helfen
Bei einer Knochenmarktransplantation werden geschädigte Stammzellen durch gesunde Zellen ersetzt. Dies hilft dem Körper, genügend weiße Blutkörperchen, Blutplättchen oder rote Blutkörperchen zu bilden, um Infektionen, Blutungsstörungen oder Blutarmut zu vermeiden.
Es gibt verschiedene Arten der Blutstammzelltransplantation. Die Art der Transplantation hängt von der Blutstammzellquelle ab.
- Bei der Knochenmarktransplantation (BMT) werden Blutstammzellen aus dem Knochenmark entnommen.
- Bei der peripheren Blutstammzelltransplantation (PBSCT) werden Blutstammzellen aus dem Blutkreislauf entnommen.
- Bei der Nabelschnurbluttransplantation (CBT) werden Blutstammzellen verwendet, die aus der Plazenta und der Nabelschnur eines Neugeborenen gewonnen werden.
Bei welchen Krankheiten wird eine Knochenmarktransplantation durchgeführt?
Eine Knochenmarktransplantation wird durchgeführt, wenn das Knochenmark des Patienten nicht mehr gesund genug ist, um richtig zu funktionieren. Dies kann auf chronische Infektionen, verschiedene Krankheiten oder Krebsbehandlungen zurückzuführen sein. Eine Knochenmarktransplantation kann Menschen mit den folgenden Krankheiten helfen:
- Akute Leukämie
- Adrenoleukodystrophie
- Aplastische Anämie
- Syndrome des Knochenmarkversagens
- Chronische Leukämie
- Hämoglobinopathien
- Hodgkin-Lymphom
- Immundefizite
- Angeborene Störungen des Stoffwechsels
- Multiples Myelom
- Myelodysplastische Syndrome
- Neuroblastom
- Non-Hodgkin-Lymphom
- Plasmazellerkrankungen
- POEMS-Syndrom
- Primäre Amyloidose
- Therapierefraktäre oder rezidivierende Tumore fester Organe
Welche Zellen werden im Knochenmark produziert?
Der Spender kann nach einer Beobachtungszeit von 24 Stunden nach der Entnahme entlassen werden. Das entnommene Knochenmark wird durch spezielle Filter geleitet, um Fett und kleine Knochensplitter abzuscheiden, die mit dem Knochenmark vermischt sein können. Wenn es nicht sofort verwendet wird, wird es in eine spezielle Flüssigkeit gelegt und eingefroren. Wenn es verwendet werden soll, wird es aufgetaut und dem Patienten ähnlich wie bei einer Bluttransfusion verabreicht. Diese Blutstammzellen, die in den Körper des Patienten gelangen, siedeln sich im Knochenmark an und beginnen in der Regel innerhalb von 2 bis 4 Wochen, Blutzellen zu produzieren.
Welche Arten von Knochenmark gibt es?
Es gibt zwei Arten der Knochenmarkstransplantation (Stammzellentransplantation): autolog oder allogen.
Was ist eine autologe Stammzelltransplantation?
Das Ziel der autologen Transplantation ist es, eine hämatologische Erholung nach einer Hochdosistherapie zu ermöglichen. Die Zellen werden vor der Chemotherapie aus dem eigenen Knochenmark des Patienten entnommen und nach der Krebsbehandlung ersetzt. Mit anderen Worten: In einigen Fällen wird bei der Krebsbehandlung eine hochdosierte, intensive Chemo- oder Strahlentherapie eingesetzt. Eine Krebsbehandlung kann unsere Stammzellen und unser Immunsystem schädigen. Die Ärzte sorgen dafür, dass die eigenen Stammzellen des Patienten vor Beginn der Krebsbehandlung gesammelt und eingefroren werden. Nach der Krebsbehandlung werden diese eingelagerten Stammzellen dem Patienten zurückgegeben. Dieser Vorgang wird als Stammzellenrettung bezeichnet. Die autologe Stammzelltransplantation wird meist zur Behandlung von Krankheiten wie Lymphomen, soliden Tumoren bei Kindern und multiplem Myelom bei Erwachsenen eingesetzt. Bei der autologen Stammzelltransplantation ist die Wahrscheinlichkeit, dass der Empfänger die Stammzellen abstößt, und das Risiko einer Gewebeabstoßungskrankheit (GVHD) sehr gering. Daher ist die autologe Stammzelltransplantation sicherer als die allogene Transplantation.
Was ist eine allogene Stammzelltransplantation?
Bei der allogenen Stammzelltransplantation werden Stammzellen von einem Geschwisterkind, einem Verwandten oder einem nicht verwandten Spender des Patienten, der die Stammzelltransplantation erhalten soll, transplantiert. Bei der allogenen Transplantation wird im Gegensatz zur autologen Transplantation eine neue Reaktion des Immunsystems zur Krebsbekämpfung erzeugt. Mit anderen Worten: Während des Transplantationsprozesses werden Zellen des Immunsystems zusammen mit den Stammzellen des Spenders transplantiert. Wenn die Lymphozyten des Spenders, die bei der allogenen Transplantation auf den Patienten übertragen werden, einige Zellen des Patienten als fremd wahrnehmen, beginnen sie einen Krieg gegen sie, was zu einer “Transplantat-gegen-Wirt”-Krankheit führen kann, die die Organe des Empfängers schwer schädigt. Um das Risiko einer allogenen Stammzelltransplantation zu verringern, werden dem Patienten unmittelbar nach der Transplantation immunsuppressive Medikamente verabreicht, um die Kampfkraft der Lymphozyten des Spenders zu unterdrücken. Nach einer allogenen Stammzelltransplantation sollten der Patient und der Spender so weit wie möglich gewebegleich sein, damit es nicht zu einem Krieg aufgrund von Gewebeunterschieden kommt.
Welche Risiken bestehen bei einer Knochenmarktransplantation?
Nach einer Knochenmarktransplantation (Stammzelltransplantation) kann es lange dauern, bis sich das Immunsystem erholt hat und neue gesunde Blutzellen produzieren kann. Die Erholung des Immunsystems nach einer Transplantation hängt von vielen Variablen ab. So kann die Erholung des Immunsystems bis zu fünf Jahre dauern, abhängig von der verwendeten Stammzellquelle, den immunsuppressiven Maßnahmen, den verschiedenen Problemen, die sich entwickeln, und den Zellsubtypen, die sich zu unterschiedlichen Zeiten erholen können. Knochenmarktransplantationspatienten sind in dieser Zeit infektionsgefährdet und sollten Vorsichtsmaßnahmen ergreifen. Darüber hinaus kann der Rückgang der Blutzellen zu Blutarmut, übermäßigen Blutungen, Blutergüssen und einem erhöhten Infektionsrisiko führen. Einige Patienten benötigen möglicherweise eine Zeit lang Bluttransfusionen.
Welche Komplikationen sind bei einer Knochenmarktransplantation möglich?
- Graft-versus-Host-Krankheit (nur bei allogener Transplantation)
- Versagen von Stammzellen (Transplantaten)
- Organschäden
- Infektionen
- Grauer Star
- Unfruchtbarkeit
- Neue Krebsarten
Transplantat-gegen-Wirt-Krankheit (GVHD): Die Graft-versus-Host-Krankheit tritt bei allogenen Transplantaten auf, wenn die transplantierten Zellen beginnen, andere Zellen in Ihrem Körper anzugreifen. Es handelt sich dabei um ein komplexes klinisches Syndrom, das infolge einer schweren immunologischen Reaktion, die durch gesunde T-Lymphozyten des Spenders, die dem Patienten zusammen mit Stammzellen verabreicht werden, ausgelöst wird, zu einer Organfunktionsstörung führt und als wichtigste Ursache für Mortalität und Morbidität nach einer allogenen Stammzelltransplantation gilt. Eine GVHD kann unmittelbar nach der Transplantation oder mehr als ein Jahr später auftreten.
Es gibt zwei Arten von GVHD: akute und chronische. Die akute GVHD tritt in der Regel früher in den ersten Monaten nach der Transplantation auf. Sie betrifft in der Regel die Haut, das Verdauungssystem oder die Leber. Eine chronische GVHD kann viele Organe schwer schädigen.
Zu den Anzeichen und Symptomen einer chronischen GVHD gehören:
- Gelenk- oder Muskelschmerzen
- Kurzatmigkeit
- Anhaltender Husten
- Veränderungen der Sehkraft
- Hautveränderungen unter der Haut, einschließlich Narbenbildung oder Verhärtung der Haut
- Hautausschläge
- Gelbfärbung der Haut oder des Weißen in den Augen (Gelbsucht)
- Wunden im Mund
- Diarrhöe
- Übelkeit, Erbrechen
Was wird vor einer Knochenmarktransplantation getan?
Sie werden sich einer Reihe von Tests und Verfahren unterziehen, um Ihren allgemeinen Gesundheitszustand zu beurteilen und um sicherzustellen, dass Sie körperlich für die Transplantation bereit sind. Die Untersuchung kann mehrere Tage oder länger dauern. Darüber hinaus wird ein Chirurg oder Radiologe einen langen, dünnen Schlauch (intravenöser Katheter) in eine große Vene in Ihrer Brust oder Ihrem Hals einführen. Der Katheter, der oft als zentraler Zugang bezeichnet wird, bleibt in den meisten Fällen für die Dauer der Behandlung an Ort und Stelle. Ihr Transplantationsteam verwendet den zentralen Zugang, um die transplantierten Stammzellen, Medikamente und Blutprodukte in Ihren Körper zu infundieren.
Häufig gestellte Fragen zur Knochenmarktransplantation (Stammzellentransplantation)
Was ist eine Knochenmarkstransplantation bei Kindern?
Blutkrankheiten und Krebserkrankungen gehören zu den lebensbedrohlichsten Krankheiten im Kindesalter. Eine erfolgreiche Behandlung von Blutkrankheiten im Kindesalter und pädiatrische Knochenmarktransplantationen erfordern eine gut ausgestattete Infrastruktur und die Qualität der Dienstleistungen in den Zentren. Unsere zu diesem Zweck eingerichteten pädiatrischen Knochenmarktransplantationszentren in den Krankenhäusern Memorial Şişli, Bahçelievler und Ankara bieten unseren Kindern Diagnose- und Behandlungsmöglichkeiten auf hohem Niveau. Die Knochenmarkstransplantation spielt eine wichtige Rolle bei der Behandlung von Thalassämie, aplastischen Anämien, Immundefekten, Stoffwechselerkrankungen, Leukämien, Lymphomen und einigen soliden Tumoren im Kindesalter. Unsere Zentren verfügen über ein erfahrenes Ärzte- und Pflegepersonal und speziell für die Knochenmarktransplantation konzipierte Dienste.
In unseren pädiatrischen Stammzelltransplantationseinheiten werden verschiedene Maßnahmen ergriffen, um Infektionen zu verhindern, die von der äußeren Umgebung auf unsere pädiatrischen Patienten übertragen werden könnten.
Diese Maßnahmen
- Am Eingang jedes Patientenzimmers, zwischen Zimmer und Flur, befindet sich ein spezieller Bereich, in dem sowohl das Transportpersonal als auch die Begleitpersonen vor Infektionen geschützt werden, die sie von außen mitbringen könnten.
- Während des Transplantationszeitraums wird die von den Patienten gewünschte Nahrung unter besonderen Bedingungen zubereitet.
- Hepafilter-Systeme, die luftgetragene Partikel entfernen, werden in der gesamten Transplantationseinheit eingesetzt, um sie vor Infektionen zu schützen.
In der Transplantationseinheit können alle Arten von Knochenmarktransplantationen, einschließlich autologer, allogener (verwandter und unverwandter) und haploidentischer Transplantationen, bei Patienten im Alter von 0-18 Jahren durchgeführt werden. Dabei ist zu bedenken, dass jeder Patient auf seine eigene Art und Weise besonders ist und der Transplantationsprozess auf dieser Grundlage durchgeführt werden sollte.
Bei welchen Krankheiten wird die allogene Stammzelltransplantation am häufigsten im Kindesalter durchgeführt?
Die allogene Transplantation wird bei bösartigen oder meist vererbten nicht bösartigen Erkrankungen im Kindesalter durchgeführt. Unter diesen Krankheiten können die am häufigsten transplantierten Krankheiten wie folgt aufgeführt werden
- Leukämien
- Myelodysplastisches Syndrom
- Aplastische Mutter
- Paroxysmale nächtliche Hämoglobinurie
- Fanconi-Aplastische Anämie
- Thalassämie
- Sichelzellenanämie
- Schwere kombinierte Immundefizienzen
- Wiskott-Aldrich-Syndrom
- Hämophagozytische Lymphohistiozytose
- Kostmann-Krankheit
- Chronische granulomatöse Erkrankung
- Osteopetrose
- Mukopolysaccharidose
- Adrenoleukodystrophie
- Metachromatische Leukodystrophie (MLD)
- Globoidzell-Leukodystrophie (Krabbe)
- Wolmansche Krankheit
- Mannosidose
- Strukturelle aplastische Anämien; Dyskeratosis Congenita, Scwachman-Diamond-Syndrom, amegakaryozytäre Thrombozytopenie
- Diamant-Schwarzfan-Anämie
Diese Krankheiten werden durch eine Knochenmarkspunktion und/oder -biopsie zusätzlich zu einer ausführlichen Anamnese und körperlichen Untersuchung diagnostiziert.
Bei welchen Krankheiten wird die autologe Stammzelltransplantation am häufigsten im Kindesalter durchgeführt?
Die Krankheiten, bei denen eine autologe Knochenmarktransplantation durchgeführt wird, können wie folgt aufgelistet werden:
- Akute myeloische Leukämie
- Non-Hodgkin-Lymphom
- Hodgkin-Lymphom
- Neuroblastom
- Ewing-Sarkom
- Medulloblastom (Hirntumore)
- Weichteiltumore
- Keimzelltumore
- Wilm’scher Tumor (Nierentumor)
- Retinoblastom (Augentumor)
- Einige Autoimmunkrankheiten
Wann beginnt das transplantierte Knochenmark zu arbeiten?
Nach einer Knochenmarktransplantation (Stammzelltransplantation) dauert es in der Regel 10-15 Tage, bis die Stammzellen wieder Blutzellen produzieren. Während dieser Zeit erhält der Patient Blutzellenergänzungen von außen. Der Grund dafür ist, dass der Patient in dieser Zeit Transfusionen von roten Blutkörperchen und Blutplättchen benötigt, bis das Knochenmark beginnt, selbst genügend gesunde Zellen zu produzieren. Die Patienten müssen zu Nachuntersuchungen kommen, bei denen Bluttests durchgeführt werden, um die Reaktion auf das Transplantat zu beurteilen. Die Patienten müssen unter Umständen noch viele Jahre nach der Transplantation nachbeobachtet werden, um ernsthafte Probleme zu vermeiden.
Ist eine halbwegs passende Stammzellentransplantation erfolgreich?
In Ermangelung vollständig übereinstimmender Geschwister und Spender aus Knochenmarkbanken ist die Transplantation von haploidenten Verwandten und Nabelschnurblut derzeit die wichtigste Option. Die Transplantation von halbverwandten Spendern ist eine wichtige therapeutische Option, die in den letzten zehn Jahren weltweit immer häufiger eingesetzt wird. Zwischen 50 % und 80 % der HLA-Gene von halbverwandten Spendern sind mit dem Patienten kompatibel. Während die Wahrscheinlichkeit, dass ein Geschwisterteil halb-konjugiert ist, 50 % beträgt, sind alle Kinder, Mutter und Vater des Patienten halb-konjugiert mit dem Patienten. Es kann zwei bis drei Monate dauern, bis ein Spender von der Knochenmarkbank gefunden ist, dann wird das HLA des Spenders mit hoher Auflösung bestätigt, und die Stammzellen werden entnommen. Patienten mit rezidivierendem Blutkrebs haben möglicherweise nicht so viel Zeit zum Warten. Außerdem nimmt die Gewinnung von Stammzellen aus halbkonjugierten Verwandten nicht viel Zeit in Anspruch, da sie leicht zugänglich sind. Tritt die Krankheit nach einer allogenen Transplantation erneut auf, kann sie durch die Gabe von Lymphozyten desselben Spenders behandelt werden, was bei der Verwendung von Nabelschnurblut jedoch nicht möglich ist. Bei Fremdtransplantationen kann es einige Zeit dauern, bis wieder Zellen gesammelt werden können. Bei quasi übereinstimmenden Transplantaten ist es sehr einfach, erneut Zellen zu gewinnen, wenn der Spender noch gesund ist. Bei Patienten mit akuter Leukämie in China wurde kein signifikanter Unterschied in den Behandlungsergebnissen zwischen quasi-abgestimmten und ausländischen, vollständig abgestimmten Transplantaten festgestellt.
Wie werden Stammzellen aus dem Knochenmark gewonnen?
Das Knochenmark befindet sich in den schwammartigen Knochen im Inneren der Knochen. Am häufigsten befindet sich das Knochenmark im Becken (Beckenknochen) des menschlichen Körpers. Die Entnahme von Knochenmark beim Spender erfolgt unter Vollnarkose und in einer sterilen Umgebung.
Wie werden Stammzellen aus peripherem Blut gewonnen?
Normalerweise ist die Menge der Stammzellen im zirkulierenden Blut gering. Aus diesem Grund nehmen die Spender vor der Entnahme Medikamente ein, um die Menge der Stammzellen zu erhöhen (G-CSF). Diese Medikamente werden als Wachstumsfaktoren bezeichnet. Die peripheren Stammzellen werden mit speziellen Geräten aus dem Blut des Spenders abgetrennt. Bis auf die abgetrennten Stammzellen wird das restliche Blut der Person zurückgegeben. Dieser Vorgang dauert 4-6 Stunden. Je nach der Menge der für den Patienten benötigten Stammzellen muss der Vorgang möglicherweise an mehreren Tagen hintereinander wiederholt werden. Bei der so genannten autologen Transplantation ist der periphere Stammzellenspender der Patient selbst. Diese Blutstammzellen gelangen in den Körper des Patienten und siedeln sich im Knochenmark an. Bei dieser Art der Transplantation setzt die Produktion von transplantiertem Blut früher ein als im Knochenmark und erfolgt in einem Zeitraum von 10-20 Tagen.
Wie werden Stammzellen aus Nabelschnurblut gewonnen?
Nabelschnurblut wird nach der Geburt des Babys aus der Nabelschnur oder der Plazenta gewonnen. Dieses Blut ist reich an blutbildenden Zellen. Das gespendete Blut wird auf verschiedene Weise getestet und zur späteren Verwendung aufbewahrt, wenn es benötigt wird. Die zu diesem Zweck eingerichteten Lagerungseinheiten werden “Nabelschnurblutbanken” genannt. Bei Bedarf wenden sich die Ärzte an diese Banken und suchen nach einer passenden Gewebegruppe. Wird ein passendes Nabelschnurblut gefunden, wird das Transplantationsverfahren in ähnlicher Weise wie bei den anderen Verfahren durchgeführt.
Wer kann eine Nabelschnurbluttransplantation erhalten?
Nabelschnurblut wird meist für Kinder verwendet, da es eine begrenzte Anzahl von Stammzellen enthält. Manchmal werden zwei oder mehr Nabelschnurblute kombiniert und bei Menschen mit hohem Körpergewicht transplantiert. Die ideale Stammzellquelle ist diejenige, die in Bezug auf die Gewebegruppen kompatibel ist. Bei der Nabelschnurbluttransplantation kann die Transplantation jedoch auch dann durchgeführt werden, wenn die Gewebegruppen weniger kompatibel sind. Nabelschnurblut wird gelagert und zur Verfügung gestellt, und Nabelschnurblut wird bevorzugt, wenn eine dringende Transplantation erforderlich ist. Das Transplantationsteam sollte entscheiden, welche Stammzellquelle die geeignetste Option ist.
Wie werden die Stammzellen für die autologe Knochenmarktransplantation gewonnen?
Wenn eine Transplantation mit Ihren eigenen Stammzellen (autologe Transplantation) geplant ist, wird ein Verfahren namens Apherese (af-uh-REE-sis) durchgeführt, um Blutstammzellen zu sammeln. Vor der Apherese erhalten Sie täglich Injektionen mit Wachstumsfaktoren, um die Stammzellproduktion zu erhöhen und die Stammzellen in Ihr zirkulierendes Blut zu bringen, damit sie entnommen werden können. Bei der Apherese wird Ihnen Blut aus einer Vene entnommen und durch eine Maschine zirkuliert. Die Maschine trennt Ihr Blut in verschiedene Teile, darunter auch die Stammzellen. Diese Stammzellen werden gesammelt und für die spätere Verwendung im Transplantationsverfahren eingefroren.
Wie werden die Stammzellen für die allogene Knochenmarktransplantation gewonnen?
Die Stammzellen können aus dem Blut oder dem Knochenmark Ihres Spenders stammen. Ihr Transplantationsteam wird je nach Ihrer Erkrankung entscheiden, was für Sie am besten geeignet ist. Diese Zellen können auch aus Nabelschnurblut stammen, das nach der Geburt der Plazenta entnommen und in speziellen Nabelschnurblutbanken zur späteren Verwendung gelagert wird. Das Blut aus diesen Nabelschnüren wird eingefroren und in einer Nabelschnurblutbank aufbewahrt, bis es für eine Knochenmarktransplantation benötigt wird.
Gibt es Risiken für die Gesundheit des Knochenmarkspenders?
Die Stammzellenspende schadet der Gesundheit des Spenders in keiner Weise. Der Spender erhält 5 Tage lang ein bestimmtes Medikament, damit die Stammzellen in den Blutkreislauf übergehen können. Wenn die Anzahl der Stammzellen im Blut den gewünschten Wert erreicht, wird es wie bei einer Blutentnahme aus einer Armvene entnommen.
Gibt es eine Altersgrenze für Knochenmarkspender?
Handelt es sich bei dem Stammzellspender um einen Verwandten des Empfängers, wird keine Altersspanne berücksichtigt. Menschen, die der Gewebebank Stammzellen spenden wollen, müssen jedoch zwischen 18 und 55 Jahre alt sein.
Kann die Stammzelltherapie bei Gelenkschmerzen eingesetzt werden?
Die Stammzelltherapie wird im Bereich der Orthopädie auf unterschiedliche Weise eingesetzt. Sie kann bei Gelenken wie Schulter, Hüfte und Knie angewandt werden, die einen Knorpelschaden aufweisen, bei schmerzhaften Gelenken, die noch nicht für eine chirurgische Behandlung geeignet sind, oder bei Patienten, die sich nicht operieren lassen wollen. Die Stammzelltherapie wird jedoch nicht als Behandlungsoption bei fast vollständigem Verlust der Gelenkknorpelkapazität eingesetzt.
Darf ich nach einer Knochenmarktransplantation Sport treiben?
Wenn die Knochenmarkstransplantation erfolgreich abgeschlossen ist, können Sie mit dem Sport beginnen. Die Intensität der Bewegung sollte schrittweise gesteigert werden, und Sie sollten sich nicht auf einmal übermäßig anstrengen. Ihr Arzt wird Ihnen helfen, einen auf Ihre Bedürfnisse und Anforderungen zugeschnittenen Trainingsplan zu erstellen.
Was macht das Knochenmark?
Das Knochenmark produziert Blutzellen. Stammzellen sind unreife Zellen im Knochenmark, aus denen sich alle verschiedenen Blutzellen zusammensetzen.
Was passiert, wenn das Knochenmark nicht funktioniert?
Eine krankheitsbedingte Funktionsstörung des Knochenmarks führt zu einem Mangel an lebenswichtiger Blutproduktion.
Warum wird eine Knochenmarkuntersuchung durchgeführt?
Die Knochenmarkuntersuchung wird durchgeführt, um die Art, die Menge und den Reifegrad der Blutzellen, die Struktur des Knochenmarks und das Vorliegen bestehender Krankheiten zu bestimmen.
Kann sich Knochenmark selbst regenerieren?
Das Knochenmark, d. h. die Stammzellen, hat die Fähigkeit, sich ständig zu erneuern.
Wie viele Tage dauert es, bis ein Knochenmarksergebnis vorliegt?
Knochenmark ist im Becken (Beckenknochen) des menschlichen Körpers am reichlichsten vorhanden. Das für die Transplantation benötigte Knochenmark wird dem Spender unter Vollnarkose und in einer sterilen Umgebung entnommen. Der Spender kann nach 24 Stunden Beobachtung wieder entlassen werden. Zur Entnahme des Marks werden spezielle Nadeln verwendet. Diese Nadeln ermöglichen die Entnahme des Marks mit einer dichten Konsistenz.
Ist die Knochenmarkentnahme schmerzhaft?
Die Knochenmarkentnahme wird unter Vollnarkose und in einer sterilen Umgebung durchgeführt. Zur Entnahme des Knochenmarks werden spezielle Nadeln verwendet. Mit diesen Nadeln kann das Knochenmark mit einer dichten Konsistenz entnommen werden. Der Spender spürt keine Schmerzen.
Ist Knochenmarkkrebs Leukämie?
Leukämie ist gemeinhin als Knochenmark- oder Blutkrebs bekannt.
*Der Inhalt dieser Seite dient nur zu Informationszwecken. Bitte konsultieren Sie Ihren Arzt für Diagnose und Behandlung.
Contact
- 3111 West Allegheny Avenue Pennsylvania 19132
-
1-982-782-5297
1-982-125-6378 - support@consultio.com

